
김승업 서울대학교 의과대학 졸업 일본 교토( 京都) 대학 대학원 의학박사 미국 펜실베니아대학 신경내과 부교수, 교수 역임 독일 하이델베르크대학 , 일본 도쿄(東京)대학, 오사카(大阪)대학 초빙교수 역임 현재 캐나다 브리티시 컬럼비아대학 신경내과 교수 330 여 편의 저서, 논문 , 초록 출간
조직배양 
 조직배양
조직배양

책 머리에 조직배양은 20 세기 초에 예일대학의 해리슨 교수가 울챙이 척 수조직을 응고된 개구리 림프액 속에서 발육시키고 신경섬유가 성장하는 것을 관찰함으로써 시작이 된 생물학의 연구기술이다. 따라서 조직배양은 20 세기에 시작된 새로운 학문의 하나이며 20 세기와 함께 발달해 온 연구기술이라 할 수가 있다. 다세포계로 서 이루어진 생물체 안에서 그 구성성분인 세포의 성질을 알고자 할 때에, 세포 간의 상호작용, 혹은 각 조직과 세포를 조절하는 제어메커니즘이 방해를 하여 세포가 가전 성질을 이해하기가 곤 란하다. 이에 반하여 조직배양은 세포와 그를 둘러싼 배양액이란 제한된 환경으로 이루어전 단순한 실험모델이기 때문에 세포의 기본적인 성질을 조사하고 분석하는 것이 가능하다. 지난 30 년 동안에 조직배양 기술의 진보는 눈부신 바 있었으며, 세포발생, 세포분화, 세포중식 등의 세포생물학과 분자생물학의 각 분야에 서 없어서는 안 되는 극히 중요한 연구방법이 되어 오늘에 이르 렀다. 해의의 여러 나라에서는 조직배양이 극히 보편적이며 일반화된 연구기술이어서 이를 소개하는 다수의 책자가 나와 있다. 이에 비하여 우리나라에서는 아직도 조직배양에 대한 책이 나와 있지 않아서 처음으로 조직배양을 시작하고자 하는 생명과학계 대학 및 대학원의 학생, 연구기관의 기술원과 연구원들이 조직배양에 대한 정보부족으로 크게 곤란을 당하고 있음을 알 수가 있다. 이 책은 그러한 공백을 채우고 조직배양의 이론과 실제기술에 대한
이해를 촉진시키고자 마련된 입문서이다. 제 1 부에서는 조직배양을 시작함에 있어서 기초지식이 되는 실 험실 설비, 배양기구, 배양액에 대하여 소개하였고, 제 2 부에서는 실제로 조직배양을 함에 있어서의 기초기술을 차례로 기술하였으 며 갖가지 배양기술의 특칭과 장단점을 개괄하였다. 제 3 부에서는 독성검사법, 세포염색법, 오토라디오그라피, 면역염색법 그리고 전자현미경 등의 배양세포를 종합적으로 검색함에 있어서 필요한 연구방법을 소개하였다. 이 책이 우리나라에서의 조직배양, 나아가서는 세포생물학과 분 자생물학의 발전에 조그마한 도움이라도 될 수가 있다면 더없이 다행이라 생각된다. 30 여년 전 나의 대학원 시절과 그에 이어서 펠로우 시철에 조직배양을 지도해 주신 일본 교토대학 오카모토 미치오岡本道雄 총장과 미국 콜롬비아대학 마가렛 머레이 Marga ret Murray 교수, 두 분에게 감사를 드린다. 또한 이 책 이 세상에 나오도록 도와주신 대우재단 이사장 이석희 은사님 그 리고 서울의대 박찬웅 교수께 감사드리며, 이 책을 아내 명화와 두 아들 용호와 태호에게 바친다. 1994. 2 김승업
조직배양
차례책 머리에 5제 1 부 조직배양의 기초지식 11제 2 부 기초배양 기술 63제 3 부 특수실험법 153참고문헌 191용어해설 193찾아보기 199자세한 차례 제 1 부 조직배양의 기초지식 제 1 장 서론 13 조직배양의 의의 13 / 조직배양의 역사 14 제 2 장 실험실 선비와 기구 19 멸균시설 20 / 증류수 장치 (이온교환 컬럼) 23 / 원심분리기 23 / 인큐베이 터 25 / 무균벤치 26 / 현미경 27 제 3 장 배양기구 29 제 4 장 기구세척과 멸균 34 세척 34 / 멸균 35 제 5 장 배양액 38 천연배양액 39 / 염류용액 39 / 합성배양액 42 / 무균검사 46 / 항생물 질 46 제 6 장 배양법의 분류 57 정치배양법 57 1 회전배양법 59 / 선회배양법 59 / 부유배양법 60
제 2 부 기초배양기술 제 7 장 일반배양 기술 65 무균조작 65 / 배양액 교환 66 / 계대배양 67 / 콜로니 형성법 68 / 증식곡 선 73 / 세포수 계산법 75 / 세포동결보존법 78 / 세포운반 80 제 8 장 초대배양법 기본기술 81 조직소편배양법 82 / 단리세포배양법 84 제 9 장 초대배양법국픕屋조직 87 계배 섬유아세포 초대배양 88 / 계배 근육세포 초대배양 91 / 계배 간세포 초 대배양 93 / 계배 뇌척수세포 초대배양 94 I 계배 척수후근신경절 초대배양 97 / 마우스 태아 뇌신경세포 배양법 99 I □ I-¥스 태아 신장세포 배양법 99 I 성숙 랫트 간세포 배양법 101 제 1 07c1- 초대배양법-사람조직 105 사람 임파구 배양 105 / 사람피부 섭유아세포 초대배양 107 / 사람 뇌하수체 세포 초대배양 109 / 사람 암세포의 초대배양 113 제 11 장 수립세포계 117 대표적인 세포주 이름과 그 특징 ' 117 / 테라토카시노마 주세포와 그 배양 124 제 1 潟} 세포분리법 128 트립신 128 / 프로나아제 129 / 콜라게나제 129 / 디스파제 130 / 파파인 130 / 금속제거제 131 / 기계적 세포분리 131 제 1~ 세포기질과 부착인자 133 콜라겐 134 / 라미닌 137 / 파이브로넥틴 137 / 비트로넥틴 138 / 젤라틴 139 / 폴리라이신 139 제 147 ol- 무혈청 배양액의 개발 140 제 1~ 세포융합과 집종세포 145 제 1~ 모노클론 항체와 하이브리도마 제작법 148
제 3 부 특수실험법 제 17 장 독성검사법 155 독성검사법-크리스탈 바이올렛 검사법 155 / MIT 검사법 158 제 1~ 집균감염 검사법 160 티오글리콜레이트 용액 160 / 마이코풀라스마 검출법 160 제 1~ 염색체 표본 작성법 162 제 2 ()78 세포염색법 165 김사염색법 165 / 헤마독실린 염색법 166 / 메틸그린-파이로닌 염색법 167 / 생체염색 168 제 21 장 면역세포화학 169 형광항체 면역염색법 170 / 효소항체 면역염색법 173 제 2W 오토라디오그라피와 방서성물질 측정법 180 오토라디오그라피 180 / 신틸레이션 카운터법 182 제 2~ 전자현미경 184 투과전자현미경 185 / 주사전자현미경 188
 제 1 부
제 1 부
제 1 장 서론 1.1 조직배양의 의의 조직배양 혹은 세포배양 기술은, 생물체의 일부인 조직편 혹은 세포를 분리하여 이들을 단순화한 시스템 속에서 유지하는 기술 이다. 생명의 최소단위인 세포를 다면적으로 연구하고 분석할 수 가 있으므로, 면역학, 유전학, 세포생리학과 같은 생물학의 각 분야에서 크게 이용되어 오늘에 이르렀다. 다세포계로서 이루어 진 생물체 안에서 그 조직구성 성분인 세포의 생리적 혹은 생화 학적인 성질을 연구하고자 할 때에, 세포 간에 존재하는 복잡한 상호작용 혹은 제어 메커니즘이 이들 사이에 있기 때문에 그 본 래의 성질을 분석할 수가 없다. 조직배양은 세포와 그를 둘러싸 는 배양액이란 제한된 환경으로 이루어전 단순한 실험모델이기 때문에 세포가 가전 기본적인 성질을 조사하고 분석하는 것이 가 능하다. 그리고 생물체의 기본적인 제어 메커니즘을 배양액 속에 존재하는 성장인자 혹은 억제인자라 인식하고 이를 분석할 수가 있다. 이렇게 조직배양은 세포의 분자생물학, 세포발생, 세포분 화, 세포증식 등의 생물학의 중요한 분야에서 가장 중요한 연구 기술이 되었다. 다세포계로서 이루어전 생물체 안에서 이들 세포들은 가지각색 의 생 리 활성물질 b i oac ti ve subs t ance 을 생산하고, 또한 세포들은 이둘 물질과 반응함으로써 생물체로서의 항상성 homeos t as i s 을 보존하고 의부에서 침입해 오는 해독에 대항하는 시스템을 가지 고 있다. 생물체로부터 이러한 생리활성물질을 분리하고, 이들
개체의 건강유지, 질병치료에 이용하려는 것이 의학과 생물학의 새로운 연구방향이 되었다. 다시 말하면, 의약품으로서의 생리활 성물질을 배양된 세포에서 대량으로 분리할 수가 있다는 가능성 울 가지게 되었다. 과거에는 생물체 유래의 생리활성물질을 분리 하려면 화학합성이 가능한 일부를 제의하고는 혈액, 오줌, 조직, 기관에서 정제하는 것이 보통이었다. 그러나 원료를 대량으로 신 속하게 구하는 데는 큰 곤란이 있었다. 조직배양 기술이 발달함 에 따라서 사람이나 다른 동물의 세포를 대량으로 배양하고 이들 세포 혹은 세포배양액으로부터 활성물질을 분리하는 기술이 발전 하게 되었다. 최근에 와서 세포배양법을 사용하여 인터페론, 사 이토카인, 모노클론 항체, 바이러스 백신을 대량으로 생산하고 있다. 위에서 말한 바와 같이 조칙배양은 생물체의 구성성분의 기본 이 되는 세포의 기본성질을 조사하고 연구함에 있어서 가장 유용 한 실험모델이 되었다. 근래에 와서는 분자생물학과 유전공학의 발전과 더불어, 생물체 유지에 가장 중요한 생리활성물질의 분리 와 확정 그리고 이들 물질의 유효성을 조직배양에서 검색하고 연 구하게 되었다. 이같이 조직배양은 의학과 생물학의 분야에서 없 어서는 안 되는 극히 중요한 연구기술로서 그 자리가 굳건하게 확립되었다. 1.2 조직배양의 역사 의학과 생물학 연구에서는 동물실험이 필요불가결한 연구방법 이다. 실험동물을 써서 병의 원인이라 의심되는 세균, 바이러스, 독성물질을 접종하고 실험적으로 질병을 만들어내고 그 경과를 자세히 관찰한다. 이러한 실험동물에서 실험적인 치료법, 예컨대 새로운 수술법이나 신약을 사용할 수가 있다. 그러나 동물에서
보는 생물현상은 너무나 복잡하여 그 분석이 곤란하다. 이러한 문제를 바이패스하고 단순한 실험계를 만들려는 노력에서 나온 것이 조직배양법이다. 조직 (세 포) 배 양은 20 세 기 초기 에 해 리 슨 Harr i son 과 카렐 Car rel 이 동물조직이나 동물세포를 체의에서 단순한 여건을 가진 조 건 아래 시험관이나 페트리딧슈에서 길러보자는 의도에서 시작된 생 명 과학life s ci ence 의 실험 방법 이 다. 해리슨은 1907 년에 미국 예일대학의 동물학 교수로 있을 때에 조칙배양을 최초로 시작한 사람이다. 그는 올챙이의 척수조직을 작은 조각으로 잘라내고 이를 응고된 개구리 임파액 속에서 4 일 동안 길러서 척수신경세포에서 신경섬유가 새로 성장해 나오는 것을 관찰 기록하였다(그림 1-1). 그리하여 오늘날 해리슨은 조 직배양의 아버지라 불린다. 이것은 그가 단순명쾌한 논리로써 반 복 재현할 수 있는 실험방법을 발명하였기 때문이다. 해리슨의
 그111림011... 5 01 0관43 1 찰-1 한一一국올 해챙리이슨 x의척 수 스 케조치직 소편1111배.。 2. 31 양7 4 일에` `\.신0 5경 섭유의 、\성 .、1 0`장 m을 m 차례로
그111림011... 5 01 0관43 1 찰-1 한一一국올 해챙리이슨 x의척 수 스 케조치직 소편1111배.。 2. 31 양7 4 일에` `\.신0 5경 섭유의 、\성 .、1 0`장 m을 m 차례로
이 획기적인 논문이 발표된 뒤로 세계 각국의 학자들이 계속 노 력하여 조직배양의 실험법이 확립되었다. 해리슨의 제자인 버로우 Burrow 가 응고임파액 대신에 응고혈 장p lasma clo t을 사용하여 전보가 있었고, 바로우와 카렐이 협 력하여 조직추출액ti ssue ex t rac t이 배양세포의 생존이나 성장에 크게 도움이 된다는 것을 밝힌 바 있다. 그 후 이 두 가지 조건 을 겸하여 사용하게 되었는데, 혈장p lasma 에 계배조직 추출액 chic k embryo ex t rac t을 반씩 섞 어 서 조직 배 양하는 것 이 가장 보편적인 방법이 되었으며 1960 년 후반까지 이 방법이 사용되었 다. 동물조칙의 소편을 커버글라스 위에 응고혈장으로 고정하고 이 것을 특수하게 만든 슬라이드글라스 위에 놓고 배양하는 방법은 해리슨에 의해서 고안되었는데, 이 우아하고 단순한 방법은 아칙 도 여러 연구실에서 사용되고 있다. 조직배양을 시작함에 있어서 과거의 학자들이 곤란하게 생각한 것이 세균감염이었다. 세균감염을 막기 위해서 수술실에서 의과 의사가 수술을 하듯이 배양실과 배양기구의 잡균을 죽이고 조직 배양을 할 사람은 손을 소독하고 수술옷에 장갑을 끼고서야 배양 실에 들어가서 비로소 조직배양을 시작한 것이다. 1912 년에 노벨 상을 받은 카렐은 무균조작의 방법을 확립하여 계배 섬유아세포 chic k embry o fi broblas t를 34 년간 계속 배양한 성과를 보였고, 카렐의 이 완전무결한 무균방법 이 후진 학자들의 표준규격 방법 이 되었다. 카렐은 원래가 의과의사로서 혈관봉합이나 수혈의 연 구로 노벨상을 받았는데, 그의 의과의사로서의 무균조작 기술이 이렇게 조직배양 발전에도 크게 도움이 되었다. 그러나 무균방법 은 완전하기는 하나 너무 시간이 오래 걸리고 번잡스러워서 마치 큰 병원의 수술실과 같은 인상을 주어 많은 사람들이 조직배양을 시작하지도 않고 이를 멀리하였으며, 조칙배양이 마치 마술을 쓰 는 듯한 인상을 가졌던 것도 사실이다.
앞서 말한 바와 같이 카렐과 그의 제자들의 업적 중에서 가장 중요한 것이 계배 섬유아세포의 장시일에 걸친 계대배양이다. 카 렐은 섬유아세포가 계속 분열하여 30 년 이상 유지할 수 있는 실 험성적을 토대로 하여 〈시험관 속에서 영원한 생명의 유지〉가 가 능하다고 생각하였다. 그러나 최근에 와서는 이러한 극단적이고 낙관적인 학설은 부정되고 있다. 예컨대 미국의 헤이풀릭 Ha y fli ck 에 의하면 인간태아 섬유아세포는 50 대에서 60 대 가량 계대 배양한 뒤 사멸한다고 보고하였다. 이러한 헤이플릭의 〈세포의 유한분열 능력〉은 노화 a gi n g연구에서 가장 큰 문제가 되고 있 다. 〈왜 세포마다 서로 다른 분열능력을 가지고 있는가〉라는 의 문이 인간의 노화연구에서 연구모델이 되어 많은 학자들이 세포 생물학과 분자생물학의 관점에서 연구를 계속하고 · 있다. 카렐 이 후로 루이스 Lew i s, 맥 시모우 Max i mow, 레 비 Lev i, 스 , 트랜지웨이 S t ran g ewa y, 얼 Earle 과 같은 학자들이 조직배양의 방법을 확립하였다. 루이스 부처는 세포의 생존과 성장의 기본요 소가 무엇인가를 배양세포에서 연구하였는데, 이렇게 배양세포의 • 최 소 영 양요구에 대 한 연구는 뒤 에 파커 Parker, 모전 Mor g an, 웨이모스 Wa ym ou th, 이글 Ea g le 과 같은 학자들에 의해서 계속되 었고 아미노산, 비타민, 필수영류를 함유하고 있는 합성배양액의 처방이 많이 나오게 되었다. 케임브리지대학의 스트랜지웨이 S t ran g ewa y와 펠 Fell 은 1930 년대 에 기 관배 양 or g an cu lt ure 의 방 법을 대성하였는데, 이 방법은 태생학 embr y olo gy에 큰 공헌을 하였다. 조직배양이 대성하고 많은 진보를 가져온 것은 제 2 차 세계대전 이 끝나고 페니실린이나 스트렙토마이신 등의 항생물질 an ti b i o tic s 이 보급되어 무균조작이 간단하게 되면서부터라 해도 과언 이 아니다. 식 물조직 배 양p lan t tiss ue cul t ur 타본 앞서 말한 동물조직 의 배 양과는 별도로 발전이 되었고, 이 두 계통의 배양법 사이에는 전
혀 의견교환이 없었는데, 1920 년대에 모리알 Mo lli ard, 콧트 Kott e, 로빈스 Robb i ns 와 갇은 학자들에 의해서 식물뿌리를 수 주일간 시험관 안에서 유지한 것이 그 시초라 하겠다. 그 뒤에 화이트 Wh it e 와 고데 레 Gau th ere t가 식 물조직 을 위 한 배 양액 을 고 안한 뒤로 크게 발전한 바 있다. 최근에는 농업생산, 품종개량, 유전공학에 관련되어 이 분야에 많은 전보가 있게 되었다. 존스-홉킨스대학의 가이 Ge y가 1950 년 초에 수술에서 얻어낸 인간의 암조직 세포를 써서 계대 주세포인 힐라 Hela 세포를 분리 한 뒤로 조직배양이 암연구 cancer research 에 많이 사용되게 되 었다. 힐라세포는 자궁암 조직에서 분리된 암세포인데, 환자의 첫 이름자를 따서 명명하였고 암 치료약의 개발뿐만 아니라 바이 러스의 생산, 분리, 항체분석 등에서 널리 사용되고 있다. 최근 에는 힐라세포 이의에 수천 가지의 암 세포주, 정상 세포주가 분 리되어 의학, 생물학, 유전공학 분야에서 널리 사용되고 있다.
제 2 장 실험실 설비와 기구 제 2 차 세계대전 이전, 항생물질이 나오기 전에는 조직배양실험 실이 무균조작을 하기 위해서 마치 큰 병원의 중앙수술실과 같은 규모와 준비가 되어 있었다. 최근에는 공기여과 장치filt ered air 롤 써서 이러한 장황한 실험실이 필요하지 않다. 공기여과 장치 가 있는 무균실 시설이 비용관계로 곤란한 경우에는 무균(클린) 벤치 혹은 무균공기 상류벤치 lam i nar flow hood 가 있으면 문제 는 해결된다. 여기에서는 작은 연구실 하나를 개조하여 조직배양을 시작하는 경우를 상상하고 그 준비를 고려하여 보겠다. 장경 6m 인 정방형 의 연구실이라 가정한다. 조직배양에는 배양준비와 무균조직 배 양의 두 가지 임무가 있게 되므로, 첫째로 수도와 배수구가 있는 곳을 중심으로 하여 방의 반을 배양준비 구역으로 하고 나머지 반을 무균조직 배양구역으로 정한다. 배양준비에 최소한으로 필요한 기구로서 고압증기 멸균장치 au t oclave 와 건 열 멸 균기 dry heat oven, 그리 고 증류수 장치 wate r dis t i lling un it가 있댜 증류수 장치는 이온교환 컬럼 deio n iz i n g column 으로 대신할 수 있는데, 이것이 비용으로 보 나 생산량으로 보나 더욱 효율적이다. 무균조직 배양구역에는 앞서 말한 무균(클린)벤치와 정온가스 인큐베이터i ncuba t or 를 두고, 이 밖에 배양세포를 관찰 기록할 현미경 m ic rosco p e 이 필요하댜 실험실의 사방 벽에는 배양을 위 한 유리기구나 플리스틱 기구를 저장할 캐비넷이나 선반이 설치 되어야 한다. 이 실험실의 설계는 다음과 같다(그림 2-1).
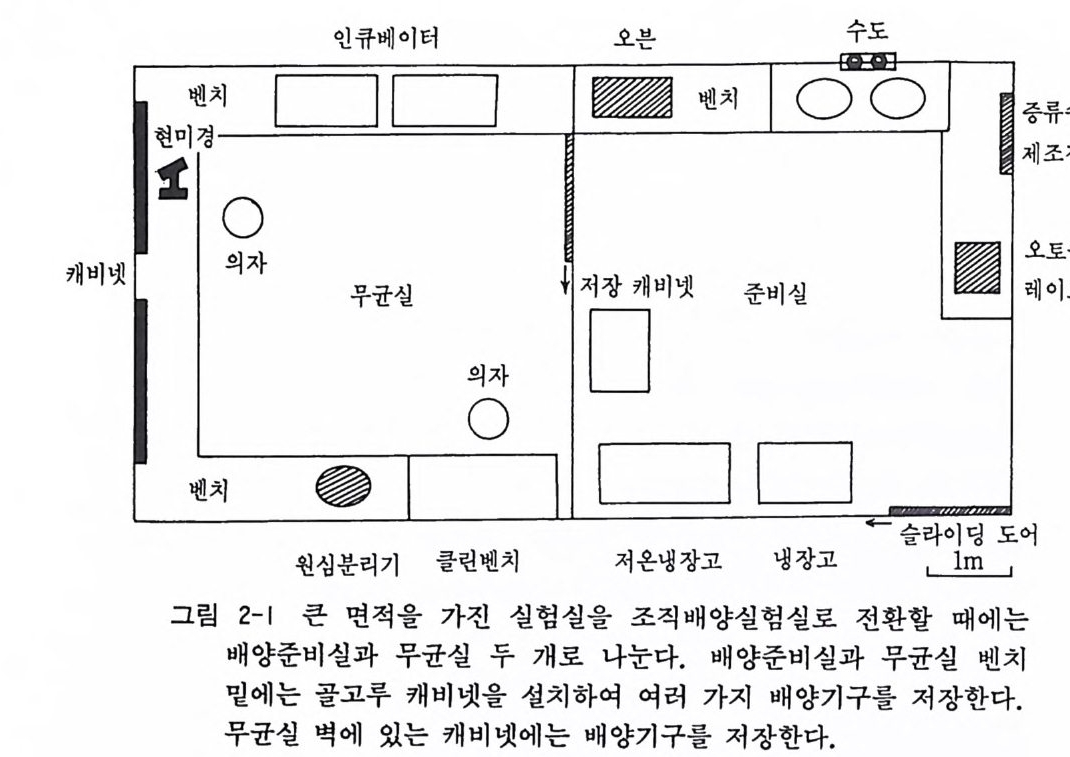 인큐베이터 오븐 수도
인큐베이터 오븐 수도
저자가 미국 펜실바니아대학에서 설계한 조직배양실험실은 6X 10m 의 장방형 방이었는데, 이 방울 앞서 말한 바와 같이 두 부 분으로 구분하여 배양준비실과 무균조직배양실로 나누었다. 그 실제 설계는 그림과 같다(그림 2-2). 앞서 말한 바와 갇이 조직배양실험실은 두 개의 부분으로 구분 하여 배양준비 구역과 무균조직 배양구역으로 나누어지게 되는 데, 그 설비를 하나씩 따로 설명하기로 한다. 2.1 멸균시설 조직배양실험실에서 중요한 것이 배양기구와 배양액을 준비하 논 데 사용되는 멸균시설이다. 여기에는 건열멸균기(오븐)(그립
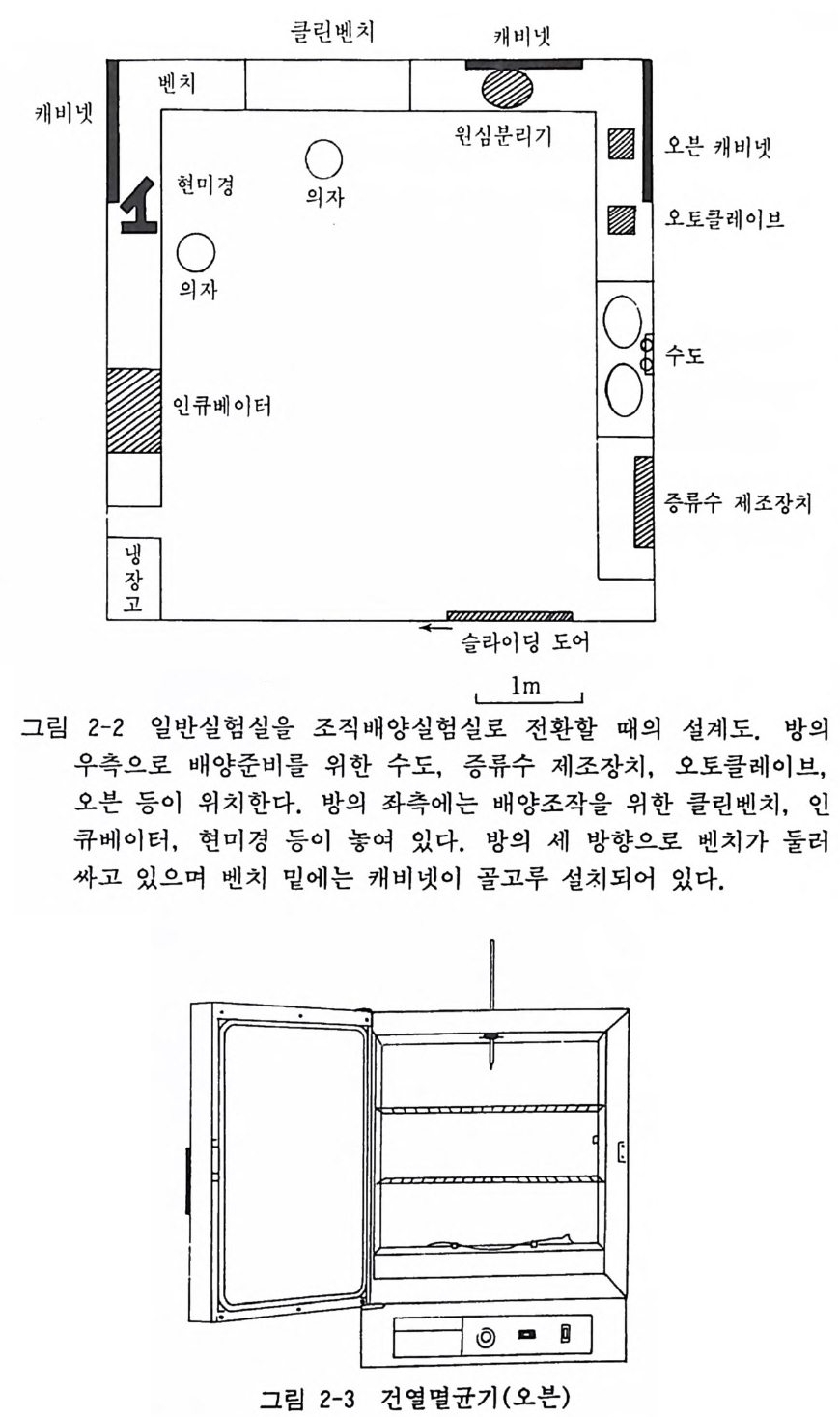 쿨린벤치 캐비넷
쿨린벤치 캐비넷
2-3), 고압증기멸균기 (오토클레이브) (그림 2 - 4) 가 있으며, 셋째로 소량의 배양액 혹은 열에 약한 시약을 멸균하기 위한 여과멸균기 가 필요하다. 최근에는 여과멸균기로서 간편한 디스포사블 (1 회 용)의 여과필터가 나와 있어 편리하게 되어 있다(그립 2-5). 미
 그림 2-4 고압층기멸균기(오토클레이브)
그림 2-4 고압층기멸균기(오토클레이브)
국의 밀리포어 M illip ore 나 날진 Nal g ene 에서 여러 가지 크기의 것을 시판하고 있다. 2.2 증류수 장치 (이온교환 컬럼) 조직배 양액을 만드는 물의 순도가 극히 중요하다. 극히 미 량의 금속에 의해서도 세포배양에 차질이 있게 되므로 고순도의 물이 필요하다. 과거 유리중류수 장치로 세 번 증류한 탈이온수를 사 용하였는데, 최근에는 여과방식 이온교환 컬럼으로 고순도의 물 을 얻을 수 있게 되었다. 우리 연구실에서는 밀리포어의 밀리큐 M illi-Q 이온교환 컬럼을 사용하고 있다(그립 2-6).
 그림 2-6 이온교환 컬럼에 의한 증류수 제조장치
그림 2-6 이온교환 컬럼에 의한 증류수 제조장치
2.3 원심분리기 세포배양액에서 세포를 분리하기 위해 500-2,000 회전(rp m) 의 탁상저 속원심 분리 기 tab le-to p cen trifug e 가 필요하다 (그림 2-7) .
 그림 2-7 탁상원심분리기 그림 2-8 중성능원심분리기
그림 2-7 탁상원심분리기 그림 2-8 중성능원심분리기
g2는조3:r 데\a직O,·Od O배고i er 원np양 이 tm : 을런 c까 튜e n지어때하t r 브 에i는f:올u 는 ~g라 a횟 \t 7 1i「수臣 o 0n다,가0에 尸0 0중:-증의2스성0가해로 ,능o 하\o종원게o\심r류 p\ m가 분1되 의-리 면다 구 7 고론배\7성속: 1세능 원원이회포있심심 사를으 분분좋에 면리분리은 서 ,리기법 좋 하가생다 d최e 게 (산n필고s그 i 요로되림시ty 하다(그림 2-9).
 그림 2-9 고속원심분리 기
그림 2-9 고속원심분리 기
2.4 인큐베이터 변온동물인 개구리나 올챙이의 세포를 배양하기 위해서는 필요 하지 않으나 항온동물의 세포를 기르기 위해서는 인큐베이터 (항 온기)가 필요하다. 밀폐된 실험계에서라면 보통 인큐베이터를 36-3 7° C 의 온도에서 사용할 수 있으나 페트리딧슈p e t r i d i sh 나 풀라스크fl ask 와 같은 개방계를 쓰게 되면 이산화탄소 인큐베이 터가 절대적으로 필요하다. 이러한 이산화탄소 인큐베이터의 가 스농도는 보통 이산화탄소를 5-10% 를 유지하고, 인큐베이터 바 닥에 물을 넣어서 습도를 100% 로 유지한다(그림 2-10, 2-11).
 그림 2-10 싱글도어 이산화탄소 (CO2) 인큐베이터
그림 2-10 싱글도어 이산화탄소 (CO2) 인큐베이터
2.5 무균벤치 이것은 보통 스테인리스 스틸로 만들어진 폭 1-2m, 깊이 lm, 높이 2m 정도의 상자 같은 실험대로서 천장이나 후방 부분에 있 는 공기여과 장치를 통하여 무균공기가 그 내부에 들어오게 되어 있다. 캐비닛 안에는 가스라인과 진공라인이 들어 있어서 실험의 편리를 도모한다. 실험하는 사람은 캐비넷 앞에 앉아 두 손을 캐 비넷 안에 넣고 실험을 한다(그림 2-12, 2-13). 한국에서도 최근 에 국산품이 제조되고 있는데 성능이 대단히 좋다. 한국이나 일 본에서는 이를 클린벤치라 부르기도 한다.
 그림 2-12 탁상형 클린벤치
그림 2-12 탁상형 클린벤치
2.6 현미경 조직을 배양하기 위해서는 특수한 조칙 부분을 보존하고 불필 요한 조직 부분을 제거하여야 한다. 이때 꼭 필요한 기구로서 절 제용 혹은 해부용 실체현미경 s t ereo m ic rosco p e 이 있어야 한다. 현미경과 라이트(광원)가 세트되는 수가 많다. 대안렌즈가 줌 zoom 이 되어 있어서 0.7 에서 3.0 사이의 몇 단계 배율을 선택 하게 되며, 대안렌즈가 10 배이면 전체배율이 7 에서 30 배가 된다 (그림 2-14).
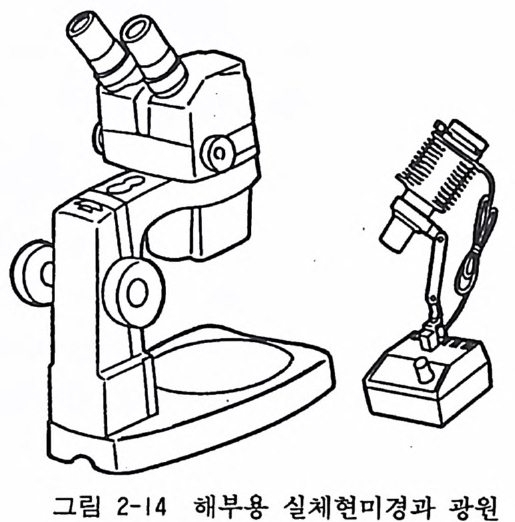 그림 2-14 해부용 실체현미경과 광원
그림 2-14 해부용 실체현미경과 광원
살아 있는 배양세포의 형태를 매일 관찰하며, 나아가서는 배양 세포의 증식발육의 상태를 관찰하기 위해 위상차도립현미경 inv ert ed ph ase contr a st m i ~rosco p e 이 필수적이다. 일반적으로 대물렌즈 4 배, 10 배, 20 배의 콤비네이션이 많이 쓰인다. 일반적 인 명 시 야현미 경 brig h t fiel d m ic rosco p합프로는 배 양세 포를 관찰 할 수 없으므로 반드시 위상차현미경이라야 한다. 또한 관찰의 기록을 하기 위해 현미경 사진촬영 장치 혹은 비디오카메라가 필
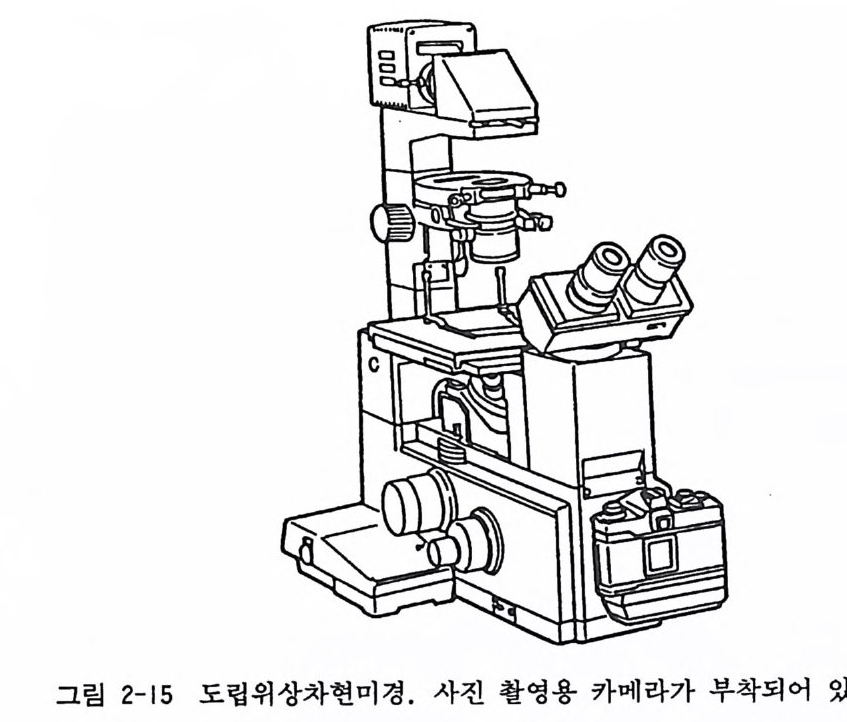 그립 2-15 도립위상차현미경. 사진 촬영용 카메라가 부착되어 있다.
그립 2-15 도립위상차현미경. 사진 촬영용 카메라가 부착되어 있다.
요있N i하짜; ~게이n 스과된 Z다e같 i( s은s그, 림회 라2사이-1가5츠) . L 고e 성it z능, 의울 림조퍼직스배 O양l 용y m p현 us미, 경그을리 시고판 하니고콘
제 3 장 배양기구 저자가 조직배양을 배우기 시작한 1960 년에는 조직배양에 쓰는 기구가 모두 유리로 되어 있었으며, 보통유리로는 안 되고 미국 에서나 유럽에서 수입하는 파이렉스 P y rex 라야 한다는 불문율이 있었다. 내가 대학원 공부를 하던 교토대학 시절에는 일본제품이 신통치 않아 미국제만을 쓰던 때가 있었다. 그러나 유리를 재사 용하려면 그것을 특수한 세제로 닦은 다음에 멸균하는 번잡하고 시간이 걸리는 조작이 필요해 최근에 와서는 많은 연구실에서 될 수 있는 대로 한 번만 사용하는 풀라스틱 배양기구를 쓰는 경향 이 있다. 조직배양에서 사용하는 유리기구로서는 각종 배양용기인 크기 가 다른 페트리 딧슈p e t r i dis h , 풀라스크fl ask, 시 험 관, 배 양액 병, 파이펫pip e t, 원심튜브 등이 있다. 조직배양에서 또한 중요 한 것이 커버글라스 cover g lass 이다. 세포를 그 위에서 배양한 다음 여러 가지 조직염색이나 전자현미경 관찰을 하려면 특수한 커버글라스가 필요하다. 1970 년에 둘어서면서 플라스틱 제품이 완전히 유리제품을 대체 하게 되었는데, 페트리딧슈나 플라스크에는 특수한 재료를 써서 배양세포의 접착성이 높아지게 가공되어 매우 편리하다. 그 밖에 도 파이펫, 원심튜브가 모두 한 번만 사용하는 풀라스틱으로 무 균화되어 있어서 편리하고 인건비를 철약하는 이점이 있다. 최근 에는 챔버가 여러 개 있는 96 혈, 24 혈, 12 혈, 6 혈의 멀티웰 챔버 mult iwe ll chamber 가 나와 있어 세 포클로닝 clonin g , 독성 검 사 등에 그 위력을 · 보이고 있다. 조직배양에서 사용되는 각종 풀라
스크, 페트리딧슈, 멀티웰 시험관, 원심튜브 등은 그림 3-1 에서 그림 3-5 까지에서 설명하였다. 그 밖에 조직배양에 필요한 기구로서는 실리콘 고무로 된 병마
 그림 3-1 각종 사이츠의 에렌마이어 플라스크
그림 3-1 각종 사이츠의 에렌마이어 플라스크
 그림 3-3 각종 사이즈 (35mm, 60mm, 100mm) 의 페트리딧슈
그림 3-3 각종 사이즈 (35mm, 60mm, 100mm) 의 페트리딧슈
개, 러버풀리스맨 rubber po lic e man, 가스버너g as burner, 파이 펫에이드pip e t aid 등이 있으며 가위, 핀셋, 수술메스 등 조직분 리 를 위 한 수술기 구가 중요하다 (그림 3-6, 3-7, 3-8) .
 그림 3-6 분젠 가스버너
그림 3-6 분젠 가스버너
 ,,;,
,,;,
제 4 장 기구세척과 멸균 4.1 세척 앞서 말한 바와 같이 최근의 조직배양 추세로는 풀라스틱 기구 의 사용으로 세척멸균의 문제가 많이 없어졌으나 배양액의 저장 울 위한 유리병, 세포를 육성시킬 커버글라스 등은 반드시 세제 로 씻은 다음 멸균해야 한다. 세제로는 알칼리성과 중성세제가 있는데, 저자의 30 년 넘는 경 험으로 보아서는 중성세제인 세븐엑스 Seven X 가 가장 효과가 있 다고 본다. 유리병, 기타 유리기구를 세븐엑스에 하롯밤 담가 두 었다가 수돗물로 세 번 가량 씻어내고 다시 증류수(탈이온수)로 두 번 씻은 다음 건조시키면 된다. 알카리 세제 (라보크린, 헤모 졸 엑스트란 등)는 세척력은 강력하나 기구표면에서 떨어지지 않 아서 몇 번씩 온수로 씻어내야 한다. 이에 비해서 세븐엑스, 라 이폰 F, 비스타 등의 중성세제는 세척력은 떨어지나, 씻어내기가 쉽다. 강한 산울 써서 세척할 수도 있는데, 다소 위험이 수반되므로 조심하여야 한다. 가장 보편적인 것으로 50% 황산이 있고, 그 밖에 황산과 영산을 섞어서 쓰는 실험실도 있다. 크롬산이 들어 있는 세척액이 시판되어 있어서 이것을 써도 된다. 커버글라스는 반드시 산에 처리할 필요가 있다. 산에 하룻밤 담근 다음 수돗물 세 번, 증류수 두 번의 세척을 거쳐서 건조시킨다. 최근에는 초 음파세척기를 써서 유리기구를 세척할 수 있다. 세제가 들어 있 는 온수 속에서 10 분 가량 초음파를 걸면 유리기구나 커버슬립이
깨끗이 씻어진다. 현재 미국, 캐나다, 일본 등 각국에서 가장 흔히 쓰이는 세제 는 세븐엑스인데 플로우 Flow 사가 판매하고 있다. 세븐엑스의 사 용법은 다음 두 가지가 있어서 그 예를 든다. • 단시간 세척 1) 세븐엑스 원액을 100 배로 수돗물에 타서 스데인리스스틸 양동이 에 담는다. 기구를 넣고 끓는 직전까지 가열한다. 여기서 불을 끄고 자연히 식게 한다. 2) 세제를 버리고 유리기구를 수돗물로 세 번씩 씻는다. 3) 증류수나 탈이온수로 세 번씩 씻어낸다. 4) 기구를 열풍건조하거나 실온에서 건조시킨다. • 장시간 세척 1) 세븐엑스 원액을 20 배로 수돗물에 타서 스데인리스스틸 양동이 에 담는다. 한 번 수돗물에 씻은 유리기구를 넣고 1-2 일간 방치 한다. 2) 세제는 버리지 않고, 유리기구를 양동이에서 꺼내서 수돗물로 세 번, 증류수로 세 번 씻는 처치를 되풀이한다. 3) 기구를 열풍건조 혹은 실온건조한다. 4) 세제는 다시 쓰되 한 달에 한 번 교환하도록 한다. 4.2 멸균 세포배양액에는 많은 종류의 영양소가 있으므로 이 속에 미생 물이 있으면 이들이 급속히 증식하여 양분을 소모하고 유독물질 울 내어서 배양세포를 죽여버린다. 따라서 멸균방법이 극히 중요 하며, 기구, 배양액, 혈청을 멸균함에 있어 그 방법이 다르게 되 어 있다.
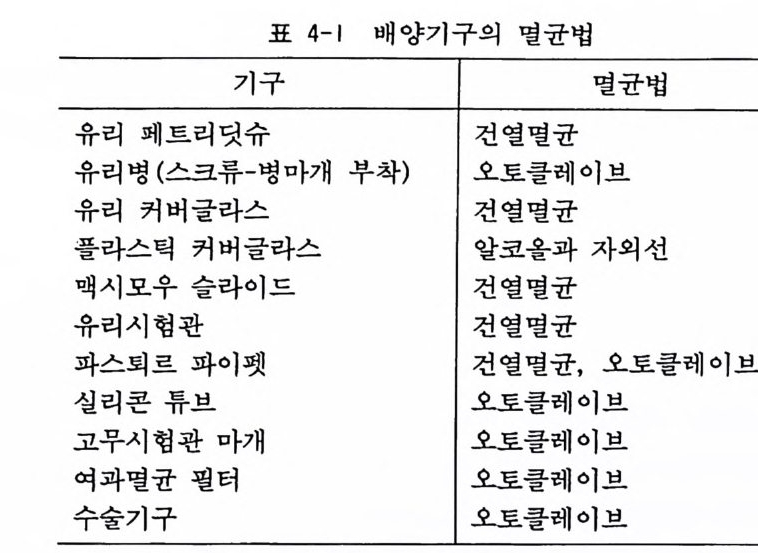 표 4-1 배양기구의 멸균법
표 4-1 배양기구의 멸균법
고압증기멸균법은 고압증기멸균기 (오토클레이브 au t oclave) 를 써 서 2 기압 120 도의 온도에서 15-20 분간을 유지하면 유리기구, 수 술도구 그리고 배양액 중에서 단순한 영류용액 등을 쉽게 멸균할 수 있다. 더 복잡한 배양액, 예컨대 이글용액 Ea g le's MEM 같은 배양액 가운데에는 고압증기 멸균을 할 수 있도록 되어 있는 상 품이 시판되고 있다. 오토클레이브가 찰되었는지를 알기 위해서 오토클레이브 테이프를 유리기구 등에 1-2cm 길이로 잘라서 붙 인다. 120 도에서 15 분간을 중기에 접하면 테이프에 글자가 나와 서 멸균이 되었음을 알린다. 유리병, 유리 페트리딧슈, 파이펫, 커버슬립 등은 오븐에서 전열 멸균을 하는데 , 그 조건은 160 도에서 90 분, 180 도에서 45 분이 다. 밀리포어필터 M illip ore filter 같은 필터를 써서 하는 여과멸균 법은 열에 불완전한 영양분, 예컨대 글루타민산, 포도당, 그 밖 에도 호르몬, 성장인자 등을 멸균하는 데 사용된다. 일반적으로 필터의 구멍크기가 0.22 미크론이나 0.45 미크론의 것을 사용한다 (그립 2-5 참고). 그 밖의 멸균방법으로는 수술기구인 가위, 메스 등을 95% 알
코올에 담근 다음 가스버너에서 불꽃멸균을 한다든가 풀라스틱기 구를 에틸렌다이옥사이드로 가스멸균하는 방법이 있다. 시판되는 풀라스틱 기구는 감마선으로 멸균되어 있는데, 이 감마선 멸균법 은 값비싼 기계가 필요하므로 일반 연구실에서는 적당하지 않다. 유리기구나 미량의 배양액, 시약 등은 자의선 아래서 20 분 가량 조사시키는 수도 있으나, 자의선 멸균은 실패하는 수가 있어 주 의가 필요하다. 여러 가지 멸균법에 대한 장점과 단점을 간략히 정리하면 표 4-2 와 갇다.
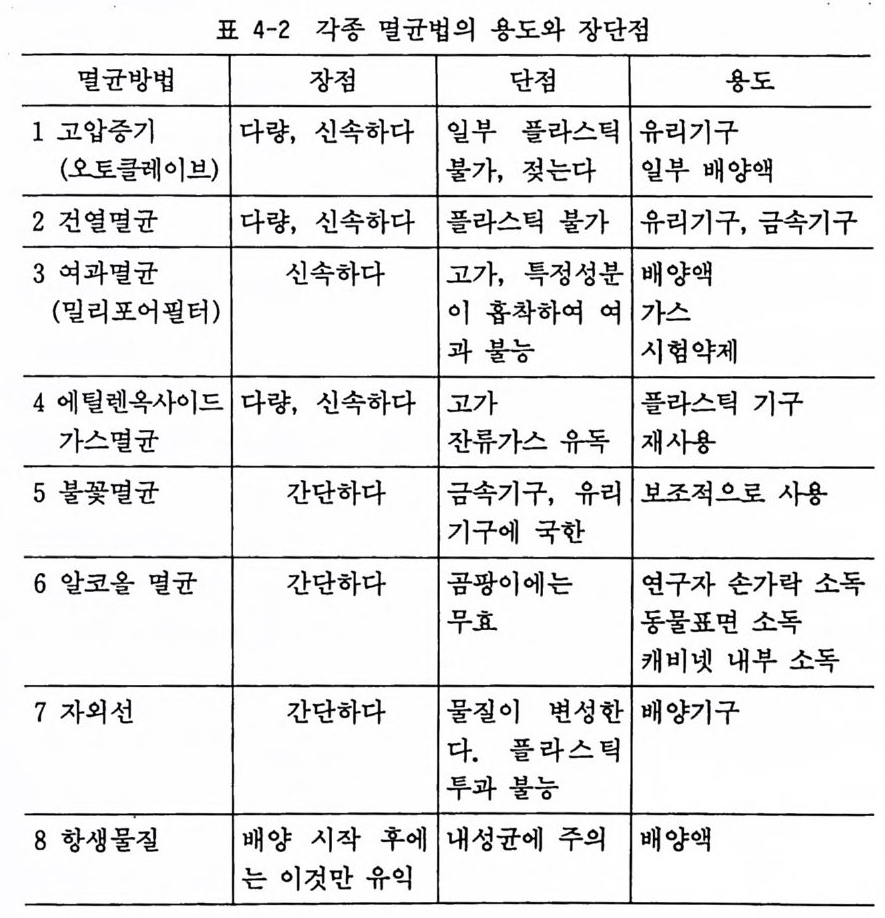 표 4-2 각종 멸균법의 용도와 장단접
표 4-2 각종 멸균법의 용도와 장단접
제 5 장 배양액 배양액은 조직배양에서 가장 중요한 요소가 된다. 이상적인 배 양액은 일정량의 이미 알려진 화학물질을 섞어서 만든 인공합성 배양액이겠으나, 이것은 아직 실현되지 못하고 있고, 혈장 pla sma, 혈청 serum, 조칙추출액ti ssue ex t rac t이 배양에서 필요 불가결한 요소가 되어 있다. 배양세포의 증식과 생존에 필요한 인자의 해명이 아직도 불충분하여 인공의 배양액에, 앞서 말한 혈청과 감은 천연물질을 첨가하여야 한다. 최근에는 무혈청 배양 액의 개발이 많이 전전되어서 주세포나 하이브리도마 세포를 위 한 무혈청 인공합성 배양액이 각 회사에서 시판되고 있으며 초대 배양에서도 단기간이면 무혈청 배양액을 사용할 수가 있다(1 4 장 참고). 배양목적, 배양세포의 종류에 알맞는 여러 가지 인공배양액이 시판되고 있는데, 여기에 일부분의 혈청을 가하면 배양세포의 충 분한 생존과 증식을 볼 수 있다. 배양액에 사용되는 증류수는 과거에는 세 번씩 유리기구에서 증류한 물을 사용하였는데, 현재로는 이온교환 컬럼을 통과시킨 탈이온수로 충분하며, 일반으로 시판되는 액체배양액은 모두 이 온교환 컬럼으로 얻어전 물을 쓰고 있다. 배양세포의 생존, 중식 에 문제가 있는 경우 제일 먼저 물의 순도를 검사하도록 할 것이 다.
5.1 천연배양액 여기에 속하는 것으로는 혈청 serum, 혈장p lasma, 조직추출액 tiss ue extr a ct, 락트알부민 가수분해 물 lac t album i n hy d rolys ate , 효모추출물y eas t extr a ct, 세균 펩 돈 bac t o p e pt one, 스킴 밀크 sk im mi lk 등이 있으며, 그 밖에도 접착인자로서 콜라겐 colla g en, 파이브로넥틴fi bronec ti n, 라미닌 lam i n i n 등이 있다. 혈청이 배양액에서는 가장 중요한 천연배양액 na t ural media 부분이 되겠는데, 보편적으로 쓰이는 것이 우태아 혈청f e t al bovin e serum 과 마혈 청 horse serum 이 다. 그 밖에 성 인 혈 청 human serum, 태 반혈 청 human pla centa l cord serum 등이 사용 될 수가 있다. 5.2 염류용액 배양액에 있어서 이온의 공급, p H 의 조정, 삼투압의 조철, 세 포세척, 각종 시약의 용액 등에 사용하기 위하여 각종 영류용액 balanced salt solu ti on 이 사용되게 되었다. 이들의 대표적인 것 은 다음과 같다(표 5-1). 일반적으로 10 배 농축액을 만들어서 사 용시에 무균수로 희석하여 쓰게 된다. 아래에 가장 보편적으로 사용되는 영류용액을 소개한다. 5.2.1 얼 Earle 용액과 핸크스 Hanks 용액 〈재료와 기구〉 1) 1 리터 유리 비커 1 2) 200ml 유리 비커 3 3) 중류수
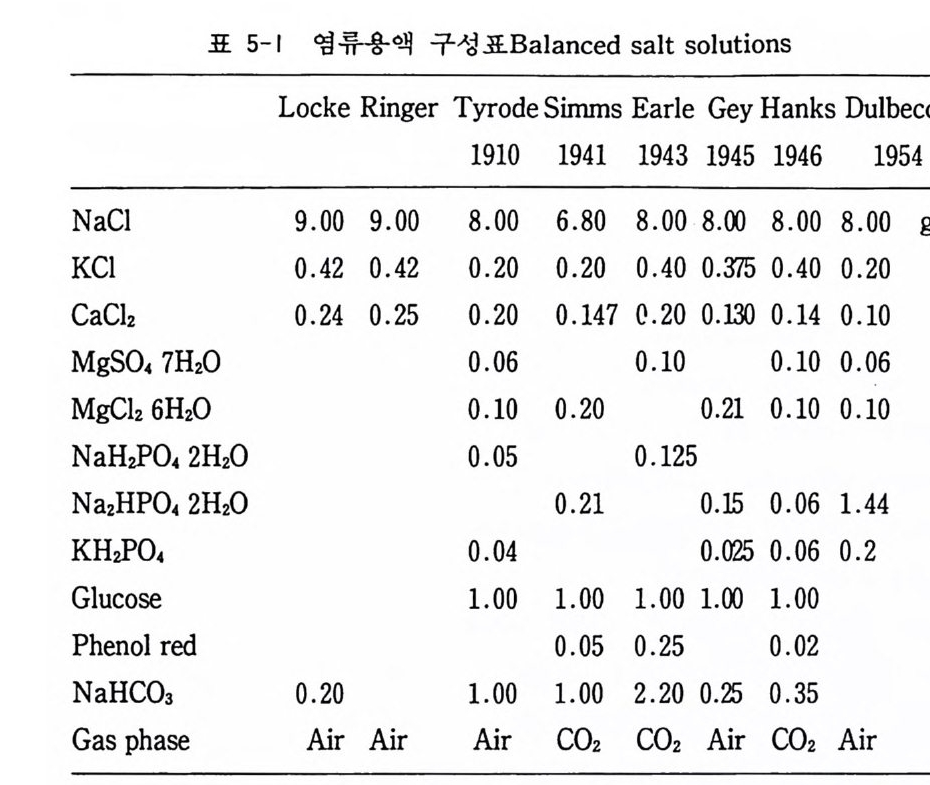 표 5-1 영 류용액 구성 표 Balanced salt s oluti on s
표 5-1 영 류용액 구성 표 Balanced salt s oluti on s
4) 500ml 유리 병 2 〈처방〉 Earle BSS Hanks BSS (1) NaCl 6.8g /l 8. Og/ 1 KCI 0.4 0 0.40 NaH2P04 0.125 0.06 KHf 0 4 。 0.06 포도당 1.0 1.0 (2) Mg S O, 0.1 0.1 (3) CaClz 0.2 0.14 (4) NaHC03 2.20 0.35
〈방법〉 1) 증류수(탈이온수) 750ml 을 1 리터 비커에 넣어 처방 (1) 을 차례로 녹인다. 처방 (2) 와 (3) 을 작은 비커에 넣어서 100ml 증류수에 녹인다. (1) 이 녹아 있는 비커에 (2) 와 (3) 의 용액 울 천천히 가해서 합친다. 여기에 증류수를 가해서 1 리터를 정확히 만들고, 500ml 유리병에 나누어 넣고 고압멸균한다. 2) 멸균된 염류용액 500ml 에 0.2% 페놀레드 멸균액 2 . 5ml 를 가해서 p H 표식을 한다. 3) (4) 는 따로 준비하되 7.5% 중나트륨탄산액 (NaHC03) 을 여 과멸균한다. 염류용액에 7.5% 중탄산나트륨액 (NaHC03) 을 첨가한다. 얼액에서는 14.5ml /50 0ml, 핸크스액에서는 2.35 m l/ 500ml 를 첨 가한다. 5.2.2 칼슘-마그네슘 제거 인산염 완충용액 Calc i um-Ma gn e siu m free Phosph ate buff er ed Sali ne , CMF-PBS 〈재료와 기구〉 1) 1 리터 유리 비커 1 2) 증류수 3) 500ml 유리 병 2 〈처방〉 NaCl 8.0g /1 KCl 0.2 Na2HPO,. 1.1 5 KH2PO,. 0.2 〈방법〉 1) 1 리터 유리 비커에 증류수 800ml 을 넣고 위의 처방울 하나
씩 차례로 녹인다. 증류수를 더 가해서 1 리터를 만든 다음 500ml 유리병에 갈라넣고 고압멸균한다. 페놀레드나 중조액 은 필요치 않다. 이 CMF-PBS 는 세포를 씻어낼 때 혹은 트 립신을 녹여서 조직분리할 때 흔히 쓰인다. 2) 멸균된 CMF ― PBS 는 4 도 냉장고에 저장한다. 5.2.3 중탄산나트륨(중조) 용액 중탄산나트륨 15 g을 200ml 의 증류수에 녹인 다음 필터로 여과 멸균을 한다. 4 도 냉 장고에 보존한다. 5.2.4 페놀레드 용액 페놀레드p henol red l g을 O.lN NaOH 40ml 에 녹인 다음 증 류수를 가해서 500ml 을 만든다. 이를 필터여과 멸균한다. 보통 4 도 냉장고에 보존하되, 실온에서 보존할 때에는 클로로포름 2 ml 를 첨가한다. 5.3 합성배양액 이것은 인공배양액의 기초가 되는 것으로서 그 처방은 영류액 울 중심으로 하여 여기에 비타민, 아미노산, 중금속, 당류(주로 포도당을 사용한다), 핵산영기 그 밖의 대사 중간물질을 영양성분 으로서 포함하고 있다. 1950 년대부터 여러 곳에서 합성배양액 syn t h e ti c med i um 의 처 방이 발표되 었는데 , 그 중에서 많이 쓰이 는 것으로 다음과 갇은 것이 있다(표 5-2).
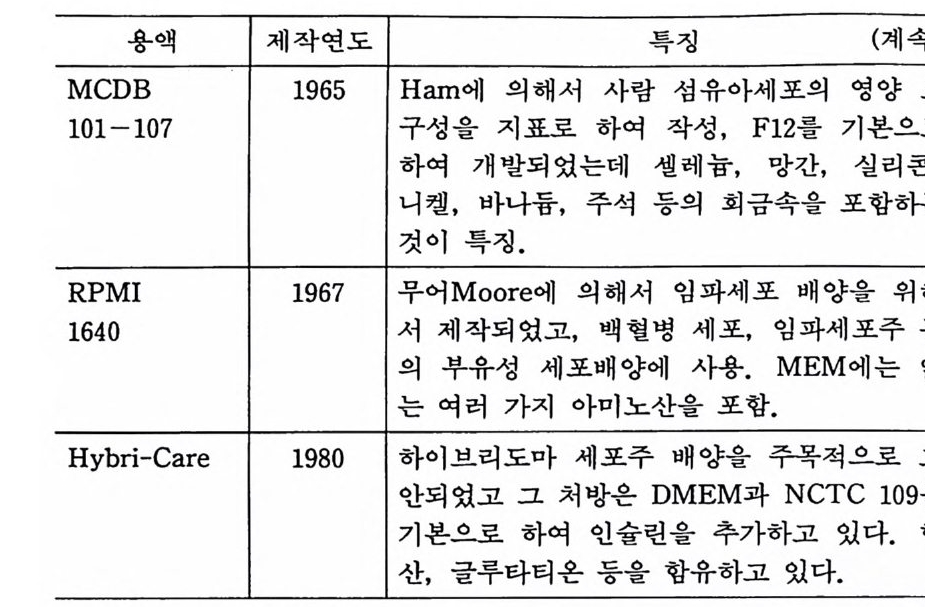 용액 제작연도 특징 (계속)
용액 제작연도 특징 (계속)
위에서 설명한 각종 합성배양액의 특칭을 열거하면 다음과 같 다. CD 199 배 양액 : 1950 년 모전 Mor g an 에 의 해서 발표된 합성 배 양 액으로서 계태 근육조직의 생존일수를 지표로 하고 아미노산, 비 타민, 콜레스테롤 그 밖에 핵산염기 등 여러 가지 영양물질을 추 가하여서 영양분이 풍부한 배양액이다. 동물세포 배양에 적합하 며 백신제조 등의 대량배양이나 조직기관 배양에 많이 쓰인다(표 5-3). ® 이글 BME 배양액 : 1955 년 이글 Ea g le 에 의해서 포유동물 세 포배양에 적합하도록 발표된 배양액으로 합성배양액 중에서 가장 간단한 처방울 갖고 있다. 아미노산과 비타민의 적합농도를 포함 하고 있으며 사람 이배체세포, 사람 섬유아세포 배양에 사용된다 (표 5-4). ® 이글 MEM 배양액 : 1955 년 이글 Ea g le 에 의해서 발표된 이 래 가장 널리 사용되는 합성배양액이다. 배양액 중의 아미노산은
세포 내 유리아미노산의 농도와 극히 가까운 농도를 갖도록 고안 되어 있다. BME 와 비교하여 글루타민 이의의 아미노산은 두 배 (아르기닌은 6 배, 히스티딘은 4 배)이며 비타민도 농도를 높이고 있 다. 적당한 농도의 혈청을 첨가하면 대다수의 세포배양이 가능하 다(표 5-5). ® 그 밖의 MEM 수정 합성배양액 : 이글의 MEM 을 기초로 하 여 각종 수정처방의 MEM 이 발표되었는데, 알파 MEM 은 스탠 너스 S t anners 가 마우스와 행스터의 잡종세포 연구를 위하여 만 들었으며 아미노산 8 종, 비타민 4 종 그리고 피루빈산을 첨가하여 만들었다. 달백코 Dulbecco MEM 은 최근에 많이 사용되는 배양 액으로서 아미노산이 2 배 비타민이 4 배 들어 있다. 조클릭J ok li k MEM 은 NaCl 양이 감소되어 있으며 글루코스가 2 배로 되어 있 다. 부유배 양용 MEM 은 부유배 양에 맞도록 MEM 에 비하여 인 산나트륨이 10 배로 되어 있다(표 5-6). @ NCTC 135 배양액 : 1964 년에 에반스 Evans 에 의해서 발표되 었고 혈청이나 단백질을 첨가하지 않은 조건 하에서 포유동물 세 포를 장기간 배양하도록 고안되었다. NCTC 109 배양액은 NCTC 135 배양액에 시스데인이 첨가되어 있다(표 5-7). @ CMRL 1066 배양액 : 1957 년 파커 Parker 에 의해서 발표된 배 양액 으로서 캐 나다 토론토의 Connaug h t Medic a l Research Labora t or i es 의 약자가 CMRL 이 다. 199 배 양액 을 기초로 하여 서 그 처방이 극히 복잡하다(표 5-8). (J) L-15 배양액 : 1963 년 레이보비츠 Le i bov it z 에 의해서 발표된 배양액으로서 탄산가스가 없는 인큐베이터에서 사용할 수 있고 pH 조정이 가능하도록 유리 염기성아미노산 (L- 아르기닌)을 사용 하고 중탄산나트륨이 제거되어 있다. 글루코스 대신에 D- 갈락토 스가 들어 있다. 아미노산 양이 많고 정상세포와 암세포가 모두 이 배양액에서 잘 발육한다(표 5-9).
@ RPMI 1640 배양액 : 1967 년 무어 Moore 에 의해서 정상인간 혈액세포 배양을 위하여 작성되었고 현재 백혈구, 임파세포, 골 수종세포 등의 배양액으로 많이 사용되고 있다. RPMI 는 Rose-well Park Memoria l Ins tit u t e 의 약자이 다 (표 5-10) . 5.4 무균검사 사용하는 배양액이 무균이 아니면 모든 배양실험이 한꺼번에 전멸하게 되므로 가장 신중을 요하는 것이 무균검사이다. 가장 간단하고 편리한 무균검사법은 사용 전에 배양액을 37 도 인큐베 이터에 며칠 두어서, 배양액이 탁하게 되면 세균이 들어간 것이 므로 이 룰 버 리는 것 이 다. 티오글리코레 이트thy o g l y cola t e 배 양 액에 시험배양액을 소량 첨가하고 37 도 인큐베이터에서 며칠 두 면서 무균검사를 할 수도 있다. 시험액이 탁하게 되면 감영을 의 미한다 (18 장 참고). 5.5 항생물질 조직배양을 시작하여 세포를 기르기 시작하면서부터는 무균조 작이 항생물질의 사용에 의존하게 된다(표 5.1 1 ). 가장 일반적인 항생물질로서 페니실린-스트렙토마이신이 lOOU/ml 과 lOOµg /m l 의 농도로 사용된다. 배양액 교환이 자주 있는 경우에는(예컨대 일주일에 두 번) 페니실린-스트렙토마이신이 신뢰되나 교환이 일 주일에 한 번이라면 그 효과가 장기 지속성인 겐타마이신(최종농 도 25µ g /ml) 을 사용하는 것이 바람직하다. 그 밖에도 카나마이 신, 테트라사이클린, 에리스로마이신을 사용할 수도 있다. 곰팡이나 효모를 위하여 환기존이나 마이코스타틴을 사용하는
 m /(Lg) 0.00 5 03 0.0 03.00 170.0 0 0.005. 7613 030 0. 0.050 00.30 00.300 )/Lg m( aH)'skn( ,08 .000 . 00041 . 0402. 0000053. .547 .0 60
m /(Lg) 0.00 5 03 0.0 03.00 170.0 0 0.005. 7613 030 0. 0.050 00.30 00.300 )/Lg m( aH)'skn( ,08 .000 . 00041 . 0402. 0000053. .547 .0 60
 /L) (gm a(Hnsk) '8,.000 040 00.4 0 01. 0 020.0 035. .7 5406.0
/L) (gm a(Hnsk) '8,.000 040 00.4 0 01. 0 020.0 035. .7 5406.0
 /gL) (m (Hank') s.00,00 804 0.00 0. 14 . 02000 5.03 .457 6.00
/gL) (m (Hank') s.00,00 804 0.00 0. 14 . 02000 5.03 .457 6.00
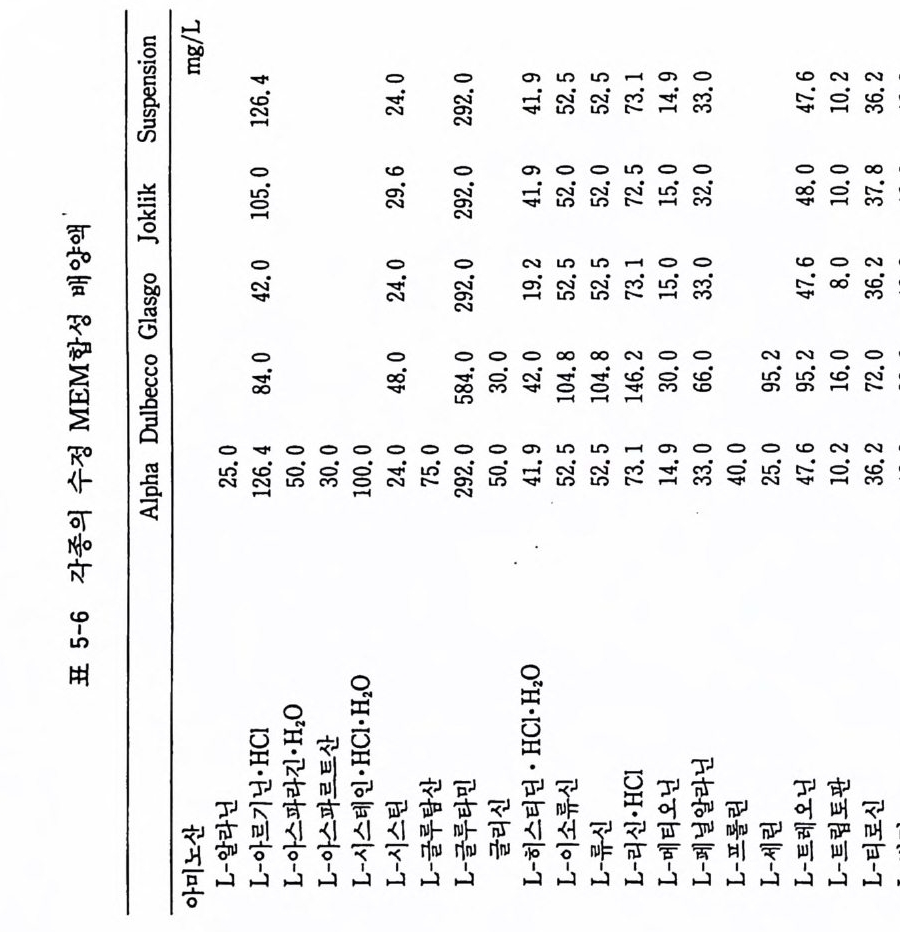
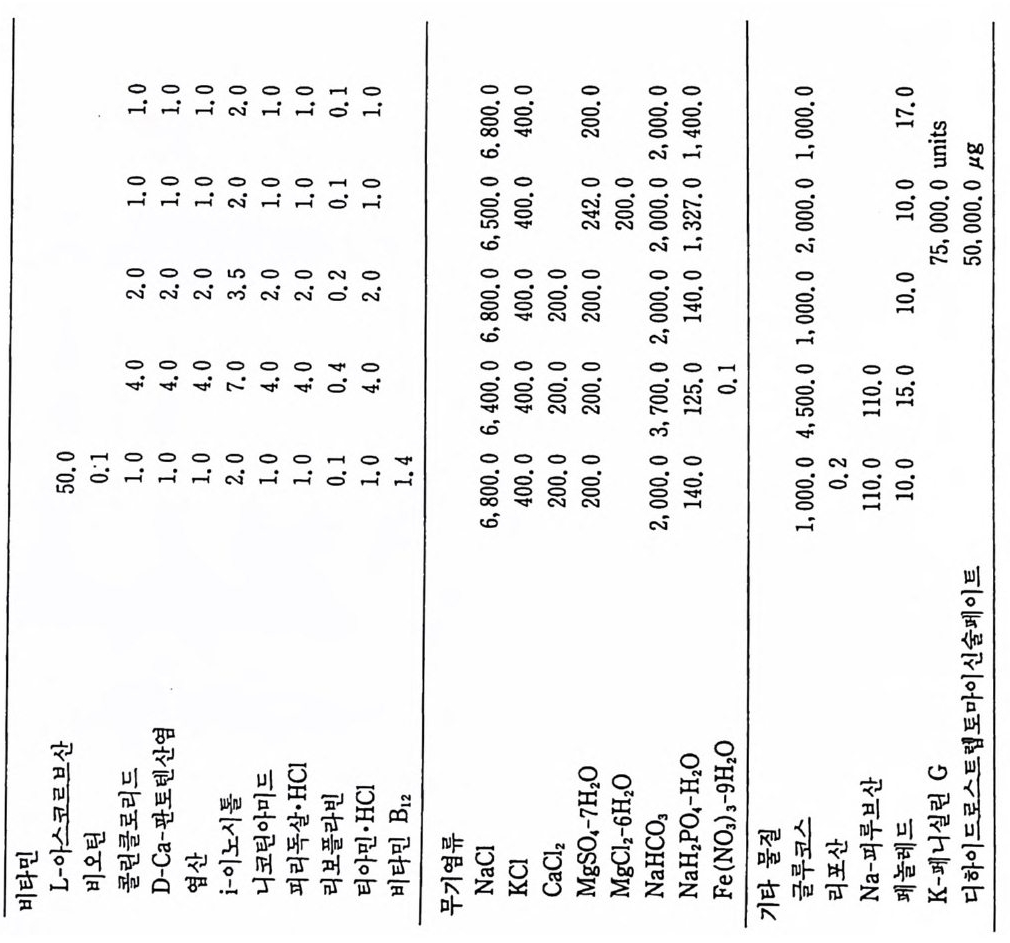
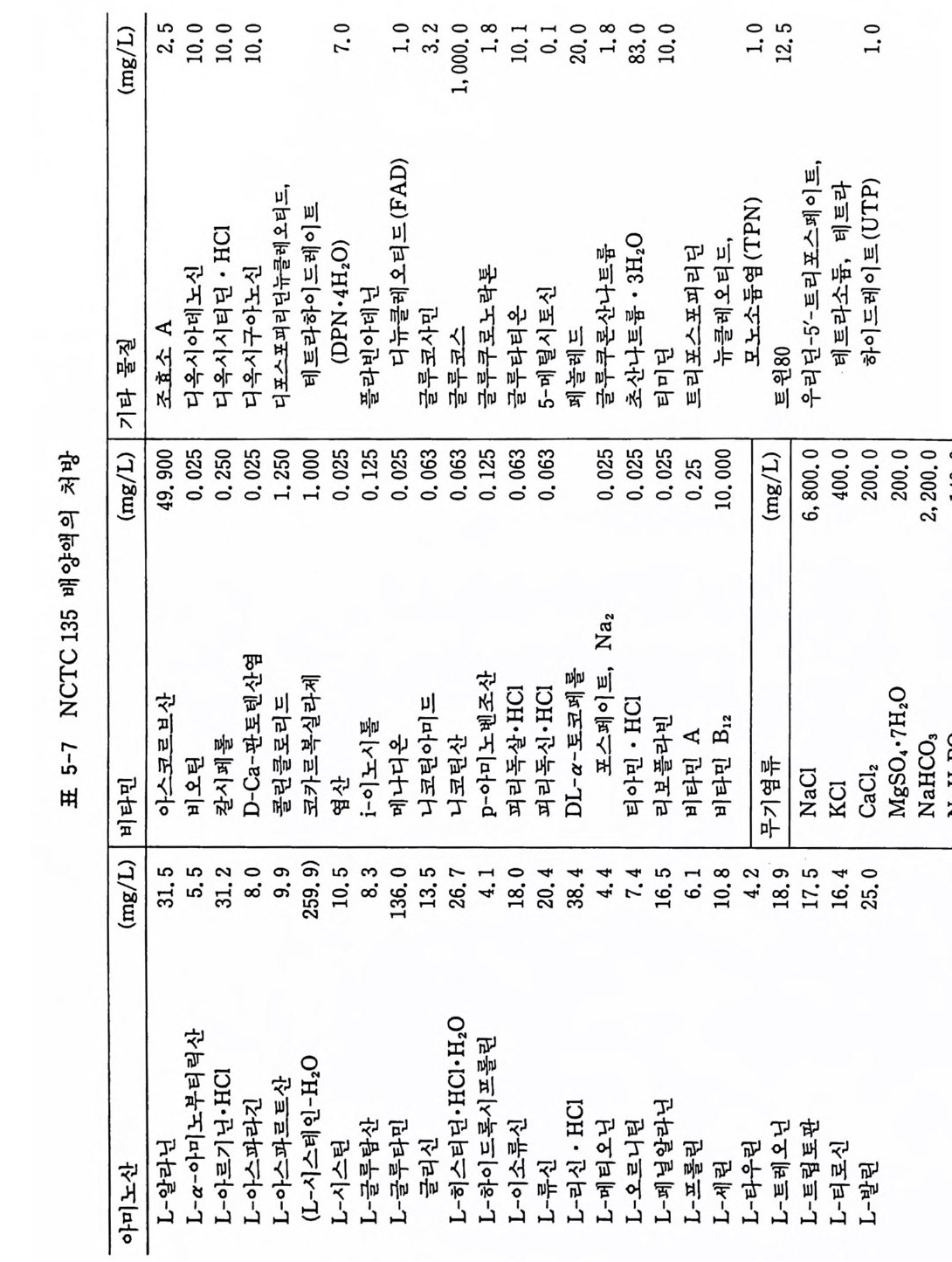
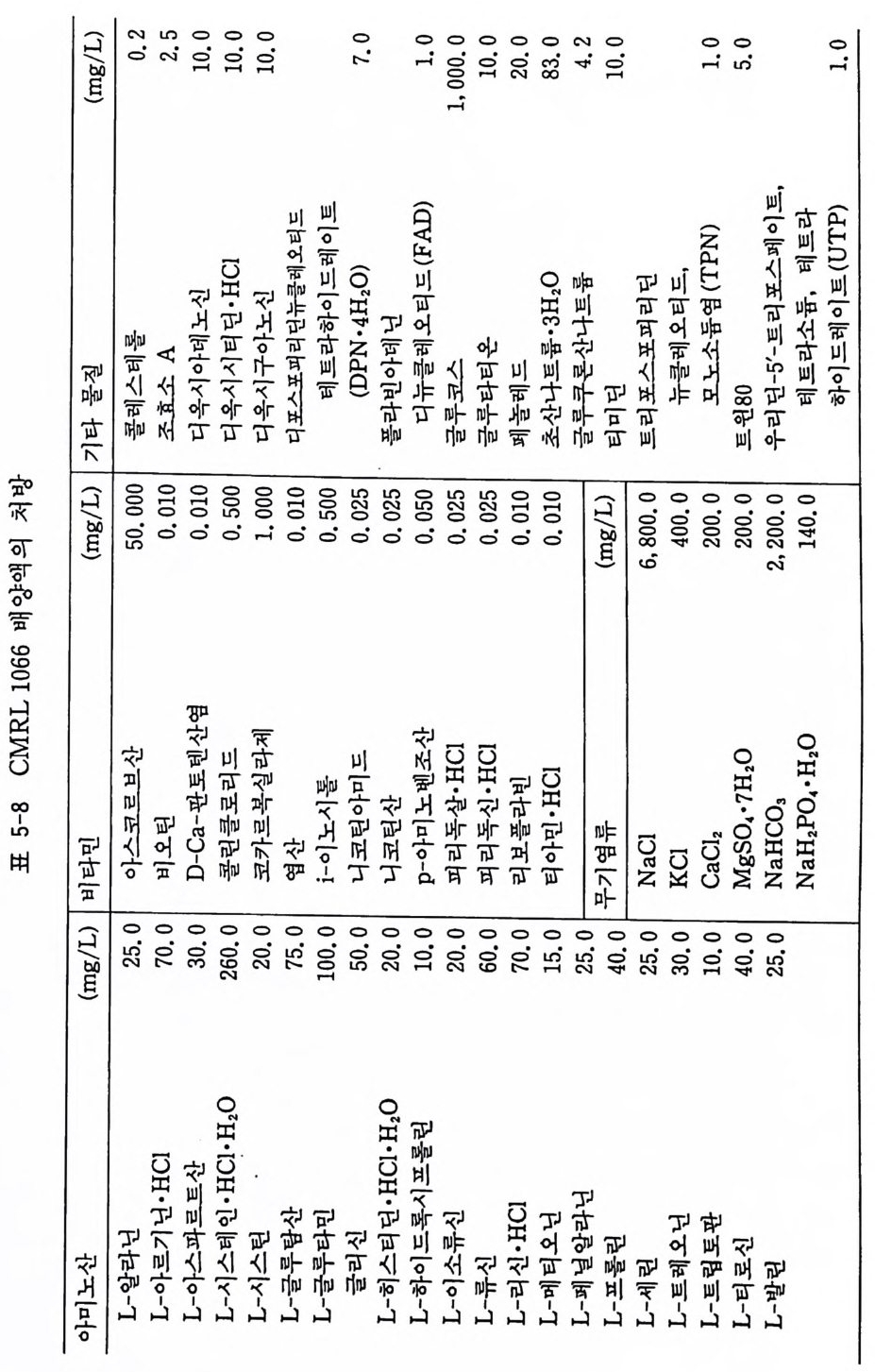 ) mg(/L 2 。• .25 0.1 0 01.0 .10 0 .0 70 . 10 0001 , . 0 1.0.02 0 . 38 0.4 20 1.0 0.1 . 50. 1 0
) mg(/L 2 。• .25 0.1 0 01.0 .10 0 .0 70 . 10 0001 , . 0 1.0.02 0 . 38 0.4 20 1.0 0.1 . 50. 1 0

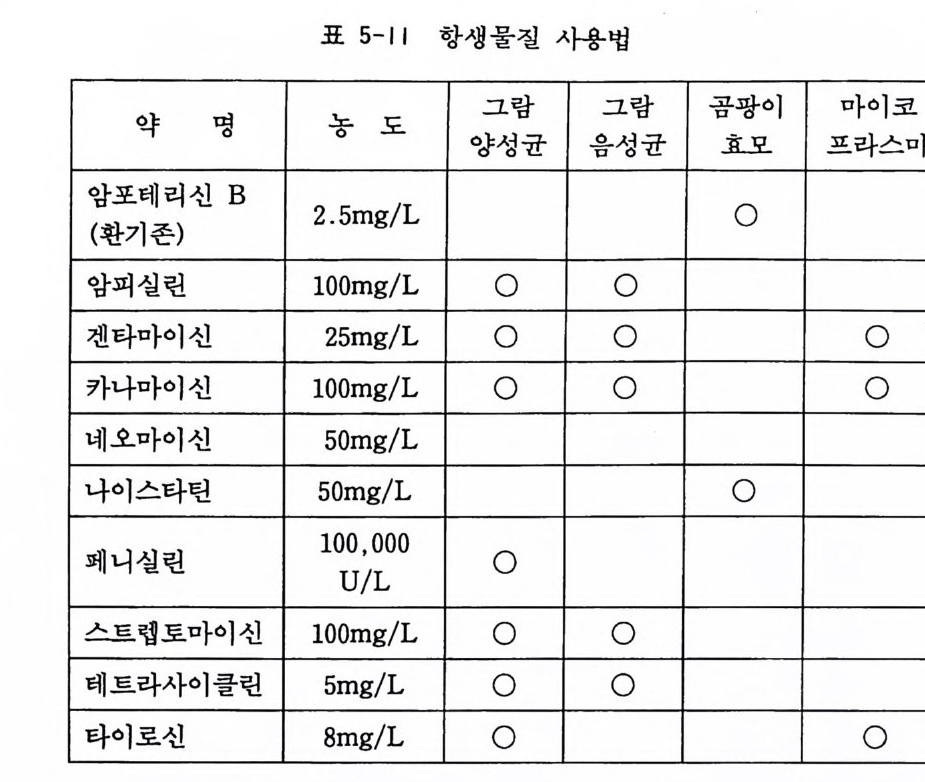 표 5-11 항생물질 사용법
표 5-11 항생물질 사용법
데, 여기서 조심할 것은 동물에 따라서나 조직에 따라서 환기존 의 독성으로 사멸하는 수가 있다는 점이다. 수술실에서 분리하여 온 인간조직이나 도살장에서 사온 소, 돼 지조직을 사용하는 경우 형기성 세균이 감염되어 있어서 세포분 리와 조직배양에는 성공하였으나 2, 3 일 뒤에 세균감염으로 실험 을 포기하게 되는 수가 있다. 이러한 경우에는 날리딕식산 na li dix i c a ci d 을 50µ g /ml 의 최종농도로 사용하거나, 설퍼메톡사졸 sul fa me th oxazole 을 lOµ g /ml 의 농도로 배 양액 에 첨 가하여 사용 하면 잡균의 감영을 방지할 수 있다. 가장 이상적인 항생물질은 광범위 약제 broad s p ec t rum 이어야 하며, 동시에 배양세포에 대 하여 무독이어야 한다.
제 6 장 배양법의 분류 일반적으로 조직배양이라고 하는 경우, 배양세포를 풀라스틱 배양 페트리딧슈나 배양 풀라스크에 넣어서 이것을 이산화탄소 인큐베이터에서 장기간 유지하는 것으로 이해하게 되는데, 이것 은 조직 배 양법 의 한 방법 에 불과하며 정 치 배 양법 sta t i on ary cul t ure 이라 한다. 배양법에는 여러 가지 콤비네이션이 있는데, 여기에서는 그 대략을 정치배양, 회전배양, 선회배양 그리고 부 유배양으로 구분하여 설명하기로 한다. 6.1 정치배양법 세포를 페트리딧슈, T- 풀라스크, 그리고 멀티웰 챔버에 나누 어 넣고 배양액을 첨가한 뒤에 인큐베이터에 넣어서 배양하는 것 울 의미하는데, 페트리딧슈나 멀티웰이 모두 밀폐할 수 없는 개 방성인 용기이므로 이산화탄소를 5% 나 10% 로, 그리고 습도를 포화상태로 유지하여야 한다. 이를 위해서 자동조절기가 있는 이 산화탄소 인큐베이터가 시판되고 있다. 이산화탄소의 농도는 배양액에 들어 있는 중탄산나트륨의 농도 와 서로 평형을 이루면서 안정된 p H 를 유지하는 것이므로, 배양 액의 중탄산나트륨 농도에 따라서 이산화탄소를 5% 나 10% 로 조 절하게 된다. 정치배양에는 앞서 말한 개방계 정치배양 이외에도 폐쇄계 정 치배양이 있다. 아 경우에는 일반 인큐베이터를 사용할 수가 있
다. 풀라스크나 시험관 안에 세포를 가하고 병마개로 밀폐를 하 면 폐쇄계 배양이 된다. 병마개로 밀폐하기 전에 소량의 이산화 탄소를 풀라스크나 시험관에 불어넣어서 배양성과를 개선시킨다 는 보고도 있다. 정치배양에서 사용되는 배양기구 중에서는 여러 조직배양 학자들이 고안한 폐쇄계 배양기구가 있다. 맥시모우 Maxim ow, 로즈 Rose, 사이 크스-무어 Sy k es-Moore, 리톤 Le ig h ton 등의 여러 가지 기구가 판매되고 있다(그림 6-1).
 區
區
이 밖에도 개방계인 페트리딧슈를 데시케이터 dess ic a t or 에 넣 은 다음 데시케이터를 밀폐하여 일반 인큐베이터에 정치하는 방 법을 쓸 수도 있다. 이렇게 함으로써 비용이 싸게 드는 간편한 배양시설을 할 수가 있다. 배양액의 증발을 방지하기 위하여 데 시케이터 바닥에 중류수롤 넣어야 한다. 이 경우 곰팡이나 잡균 이 번식하는 것을 방지하기 위하여 소독비누(수술실에서 사용하는 종류)를 1% 의 농도로 첨가한다. 6.2 회전배양법 회전배양 roller drum cul t ur 타는 세포를 시험관이나 배양병에 넣은 다음 이것을 회전드럼 속에 넣어 이 드럼이 1 분 5 회전의 저 속에서 1 분 50 회전의 고속회전을 하도록 한다. 이렇게 함으로써 세포는 액체와 가스에 차례로 노출되고 중식을 빨리 하게 된다. 유전공학이나 백신 제조 등 제약회사에서는 대량으로 세포배양을 하기 위하여 이 회전배양을 쓰는 수가 있는데, 이러한 경우 500 ml 크기의 병을 사용한다. 6.3 선회배양법 회전배양법에서는 배양병을 수직으로 회전시키는 데 비해 선회 배 양법 rota t i on cul t ure 에 서 는 엘 렌 마 이 어 플라스크 Ehlenrne y er fl ask 를 수평으로 선회시키는 방법을 사용한다. 일반적으로 30 ml 의 엘렌마이어플라스크에 5-7ml 의 세포부유액을 넣고 1 분에 60-80 회전을 시키면 풀라스크 바닥의 중심부에 세포들이 덩어리 룰 만드는데 , 이를 재웅집 rea ggr e g a t e 배 양법 이 라 하기도 한다. 이 방법은 암 연구나 신경조직 배양에서 자주 쓰인다. 악성화한
세포나 암세포를 선회배양하면 정상세포에 비하여 커다란 응집덩 어리를 만드는 것을 볼 수 있다. 배양 풀라스크롤 선회하기 위해 서 특수한 셰이커gy ra t or y shaker 가 필요하다. 6.4 부유배양법 스핀어 병 s pi nner bo tt le 에 대 량의 세포를 배 양하는 것 이 부유 배 양법 sus p ens i on cul t ure 의 가장 일반적 인 방법 인 데 , 이 를 위 해 서는 마그네트(자석)가 들어 있는 스핀어 병이나 회전을 시키게 하는 특수한 스터러 s ti rrer 등이 필요하여 비용이 많이 드는 결점 이 있다(그립 6-2).
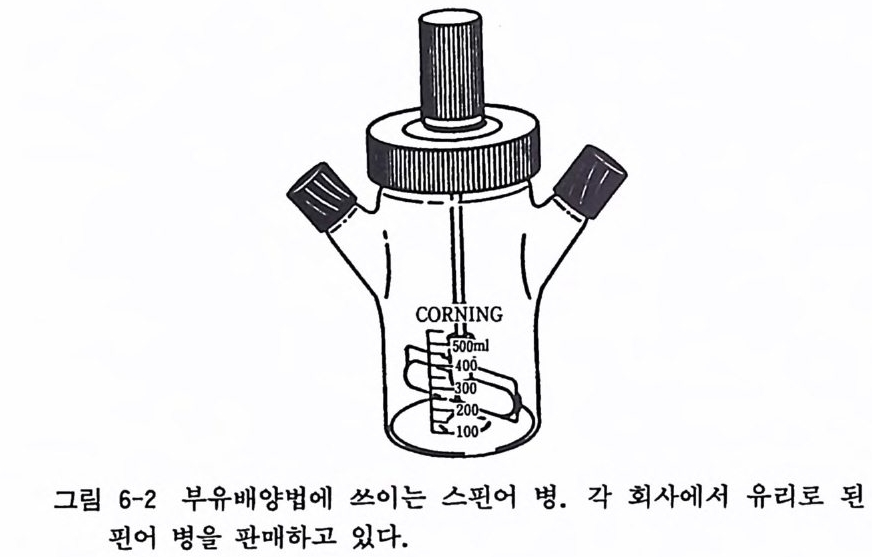 그림 6-2 부유배양법에 쓰이는 스핀어 병. 각 회사에서 유리로 된 스
그림 6-2 부유배양법에 쓰이는 스핀어 병. 각 회사에서 유리로 된 스
우리 연구실에서는 이것을 간략하고 염가로 하기 위해 500ml 의 보통 배양액 병에 200-250ml 의 세포부유액을 가한 다음 병 바닥에 2cm 크기 의 스터 링 마그네트 s ti rr i n g ma gn e t를 넣고 스
터러를 1 분에 30-60 회전시킴으로써 배양을 하고 있다. 대량의 배양을 하기 위해서 최근에 와서 여러 가지 방법이 고 안되고 있는데 , 그 중의 하나로서 마이크로캐 리 어 m ic rocarr i er 법 이 있다. 이것은 풀라스틱이나 그 밖의 유기물질로 구형 캐리어 롤 만들어 그 표면에 세포를 부착시켜 부유배양법으로 세포증식 을 하게 한다. 그 장점은 국한된 공간에서 넓은 증식면적을 갖게 하여 대량의 세포를 배양하는 데 있다.
 제 2 부
제 2 부
제 7 장 일반배양 기술 7.1 무균조작 조직배양에서는 미생물의 오영이 없는 무균적 상태에서 장기간 세포를 유지하여야 한다. 조직배양에서 사용되는 배양액에는 영 양가가 높은 여러 가지 화학물질이나 생물물질이 들어 있으므로 세균에게도 역시 적합한 영양액이 된다. 또한 각종 세포가 갖가 지 바이러스의 숙주가 되기도 한다. 이들 미생물은 증식도가 극히 높은 까닭에 조직배양에서는 무 균조작이 가장 중요한 조건이 된다. 공기 중의 먼지, 물방울, 실 험대, 벤치 그리고 실험하는 사람의 손가락 등 여러 곳에 미생물 이 존재하므로 세균이 실험조직 재료에 떨어져서 같이 붙어오지 않도록 실험실에서는 사람들의 출입을 가능한 한도에서 제한할 필요가 있다. 큰 소리로 이야기한다든가, 기침을 하는 것도 삼가 한다. 벤치나 실험대 위는 실험을 시작하기 전에 70% 알코올이 나 크레졸액으로 분무기를 써서 소독하도록 한다. 실험시작 전에 소독비누액이나 0.3% 히비텐액으로 손을 소독하도록 한다. 실험 시에는 마스크롤 하고 사람들이 주위에서 너무 움직이지 않도록 주의하여야 한다. 배양액이 들어 있는 병, 배양 풀라스크, 파스퇴르파이펫은 사 용시 화염소독하도록 하며 핀셋, 가위 기타 수술기구는 95% 알 코올에 참시 담그었다가 화염소독한다. 실험이 끝난 뒤에 사용이 끝난 파이펫, 배양병 등을 무균벤치에서 제거하고 무균벤치 안은 70% 알코올이나 크레졸액으로 소독해 둔다.
일반적으로 실험이 끝난 뒤에는 실험실 천장이나 무균벤치 안 에 설치된 자의선 살균등을 켜서 다음날까지 두는 것이 보통이나 요즈음은 인체에 대한 안전관리를 위해서 자의선 살균등의 사용 울 금지하는 수가 있다. 예컨대 1980 년 이래 미국의 국립의학 연 구소 NIH 에서는 자의선 살균등 사용이 금지되고 있다. 7.2 배양액 교환 세포를 배양하고 있는 배양액 교환f eed i n g을 시작하기 전에 풀 라스크나 페트리딧슈에 이상이 없는가 검사한다. 잡균이 들어가 서 배양액이 뿌영게 되었거나 노랗게 되어 있으면 다른 배양에 번지지 않도록 이룰 먼저 버리고 배양액 교환을 시작한다• 〈방법〉 1) T 폴라스크의 경우에는 마개를 연 다음 풀라스크 입을 가스 버너 불꽃에 노출하고 화염소독한다. 2) 플라스크를 세워서 배양액을 세포가 자라지 않는 쪽으로 기 울인다. 3) 파스되르파이펫(흔히 전공흡입 장치에 접속한다)으로 배양액 을 제거한다. 4) 새 배양액을 세포가 자라지 않는 표면을 향하여 첨가한다. 이때 파이펫에이드를 사용하면 정확한 양의 세포액을 쉽게 첨가할 수 있다. 5) 풀라스크 입을 화영소독하고 병마개를 한다• 6) 파이펫이 다른 곳에 닿은 듯하면 죽시 이것을 버리고 새 파 이펫을 사용한다. 7) 다른 종류의 세포를 취급할 때에는 흡입용이나 도입용으로 새 파이펫을 사용한다.
8) 일반적으로 묵은 배양액은 조금 남겨서 80% 정도만 버린 다. 이것은 묵은 배양액이 조건배양액이 되어 세포증식이나 생존에 유익하다고 생각되기 때문이다. 페트리딧슈에 배양한 경우에는 화염소독을 못하게 되나 그 액의 교환요령이 풀라 스크와 마찬가지이다. 7.3 계대배양 세포가 증식하여 배양 풀라스크나 딧슈 안에서 빈틈 없이 빽빽 하게 세포충이 밀집하게 되면 이룰 희석해서 새로운 플라스크에 옮기게 된다. 이를 계대배양 subcu lt ure, p assa g e 이라 한다. 세포 가 증식하고 있는 배양기로부터 고르게 세포부유액을 만들어서 새 배양기로 옮기게 되는데, 트립신 처리를 하거나 러버풀리스맨 rubber p o li ceman 을 써서 기 계 적 으로 세 포를 긁어 내는 수가 있 다. 하이브리도마인 경우에는 간단한 파이펫팅으로 풀라스크 바 닥에 부착한 세포를 분리시켜서 단리세포 부유액이 될 수 있다. 〈 방 법 〉 1) 동결된 트립신 스톡울 온수에서 녹인다. 2) 묵은 배양액을 파이펫으로 흡인하여 버린다. 3) 칼슘, 마그네슘 제거 PBS(CMF - PBS) 로 풀라스크를 한 번 씻는다. 4) 트립신 희석액(보통 PBS 에 0.1% 로 희석한다)을 풀라스크에 넣고 마개를 하여 인큐베이터에서 10 분간 정치한다. 5) 플라스크의 측벽을 서너 번 때려서 세포충이 풀라스크 바닥 에서 미끄러져 분리되게 한다. 여기에 혈청첨가 배양액을 가 하고 원심튜브에 옮긴다. 6) 파이펫으로 몇 번씩 상하로 흡입한다. 이때 세포가 분리되
는데, 거품이 안 나도록 조심한다. 거품이 나면 세포표면에 상처가 나서 세포가 죽는다. 7) 원심 (800-1,OOOr p m/ 분) 5 분간 8) 상청액을 버리고 여기에 새 배양액 5ml 을 가한다. 9) 혈구계산판으로 세포수를 계산한다. 10) 적당한 세포밀도로 희석하고 새 풀라스크에 도입한다. 11) 풀라스크를 인큐베이터에 옮긴다. 이때 너무 움칙이면 세 포가 플라스크 중앙에 모이게 된다. 12) 현미경에 의한 검사는 30 분 뒤에 행한다. 7.4 콜로니 형성법 동물 정상조직이나 악성 암조직의 초대배양을 하면 그 세포들 은 균일한 세포집단이 아니기 때문에 그 사이에서 분리된 단일세 포를 멀티웰이나 페트리딧슈에 심어서 단일세포의 자손으로만 구 성 된 클론 clone 을 만드는 것 을 콜로니 형 성 법 colony for mati on 이라한다. 콜로니 형성법은 단일세포의 자손으로 구성된 콜로니를 순수하 게 분리하여 유전적으로 균일한 세포집단을 얻는다. 세포에 대한 약품이나 방사선을 조사하기 위하여 콜로니 형성효율을 본다. 돌 연변이 mu t a ti on 를 일으킨 변이클론을 분리하여 유전학 연구 등 여러 가지 응용을 할 수가 있다. 콜로니 형성에는 여러 가지 방 법이 가능하기 때문에 그 몇 가지를 여기서 소개한다. 7.4.1 제한회석법 D il u ti on pla ti ng 이 방법은 클로닝에서 가장 많이 쓰이는 방법이다.
〈재료〉 1) 증식이 빠른 주세포나 초대배양 1X10 가 세포 2) 0 .1% 트립 신 /EDTA/PBS 3) 이글 MEM/10% 우태아 혈청 4) 파이펫, 풀라스틱 시험관, 96 혈 멀티웰 〈방법〉 1) 주세포 배양액을 버리고 PBS 5ml 로 세포를 씻는다. 2) 트립신 /EDTA/PBS 를 가하고 37 도에서 10 분간 인큐베이터 에서 정치한다. 3) 트립신액을 제거한 뒤 5ml 의 10% 우태아 혈청을 포함한 배양액을 첨가한 후 파이펫팅을 하여 세포를 부유시킨다• 4) 혈구계산판으로 세포수를 계산한다. 5) 세포수를 106/ml 로 희석한 뒤 계속하여서 10 배씩 희석을 하여 100/ml 까지 내 려 간다. 6) 96 혈에 세포부유액 0.1ml( 평균하여 10 개 정도 세포가 들어 있 음)을 가하고 37 도에서 배양을 시작한다. 7) 2-3 일 뒤 도립현미경 밀에서 각 웰에 들어 있는 세포를 계 산하여 세포 하나가 들어 있는 웰울 표식해 둔다. 8) 10-14 일 뒤에 표식된 웰 중에서 세포집단(콜로니)이 되어 있는 웰울 찾아낸다. 9) 파이펫팅으로 세포를 부유시키고 35mm 페트리딧슈에 옮겨 서 배양을 시작한다. 이렇게 하여 세포집단을 증식시킨다. 7.4.2 클로닝 실 린 더 법 Clonin g cy lind er 클로닝실린더는 유리, 사기, 스데인리스로 되어 있으며 시판 되고 있다(그립 7-1).
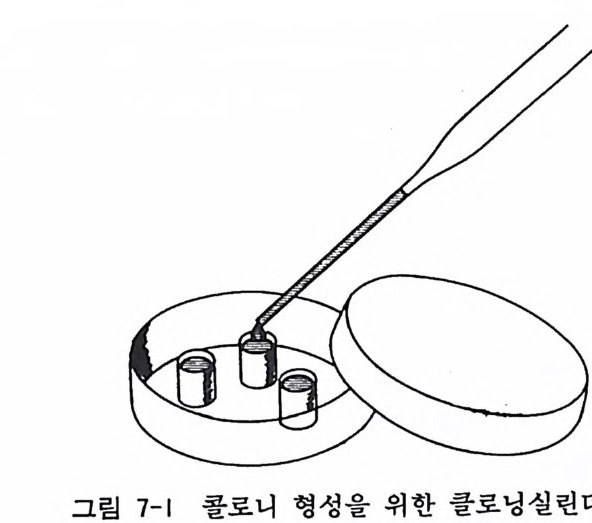 그림 7-1 콜로니 형성을 위한 클로닝실린더법
그림 7-1 콜로니 형성을 위한 클로닝실린더법
〈재료〉 7.4.1 과 같으나 그 이외의 것으로 1) 유리 클로닝실린더 (직경 10mm, 높이 8mm) 2) 60mm 페트리 딧슈 〈방법〉 1) 7.4.1 의 (1) 에서 (3) 까지 같음. 2) 5ml 의 배양액을 60mm 페트리딧슈에 첨가하고 미리 인큐베 이터에서 보온한다. 3) 세포수를 혈구계산판으로 계산한 뒤 106/ml 로 세포수를 희 석하고 계속하여 103/ml 까지 내려간다. 세포는 시험관에 넣 는다. 4) (2) 에서 준비한 페트리딧슈 6 개에 103/ml 세포부유액 0.1 ml 를 첨가하고 37 도에서 배양을 시작한다. 각 페트리딧슈에 100 개 정도의 세포가 들어 있다. 5) 10-14 일 뒤에는 도립현미경 밀에서 세포집단으로 된 콜로니 를 관찰한다.
6) 분리하고자 하는 콜로니가 있으면 마카펜으로 딧슈 밀에 표 식을 한다. 페트리딧슈에서 배양액을 버리고 콜로니 위에 실 리콘그리스(미리 오토클레이브로 멸균해 둔다)를 바른 클로닝 실린더를 세우고 그 안에 트립신 /EDTA/PBS 를 파이펫으로 가한다(그립 7-1). 7) 5 분간 인큐베이터에서 보온한 뒤, 파이펫팅으로 실린더 안 의 세포를 부유시키고 35mm 페트리딧슈에 옮겨서 배양을 시작한다. 7.4.3 유리조각법 앞의 두 가지 방법에 비하여, 세포의 관찰이 쉽고 다수의 클론 울 한 번에 얻을 수 있는 장점이 있다(그림 7-2).
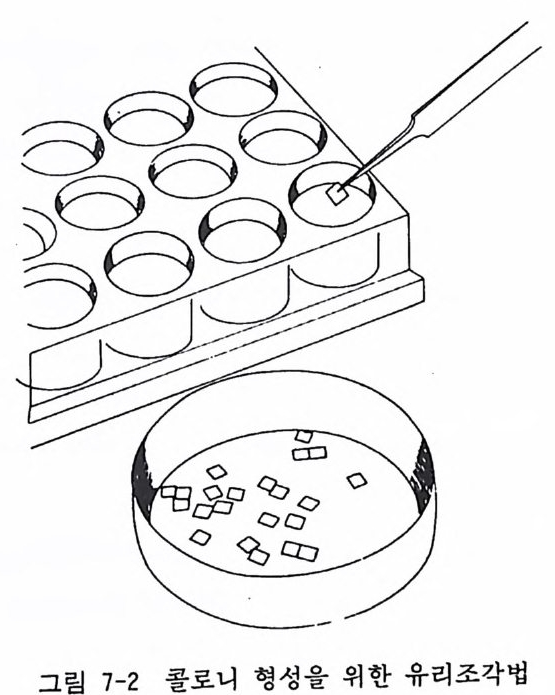 그립 7-2 콜로니 형성을 위한 유리조각법
그립 7-2 콜로니 형성을 위한 유리조각법
〈재료〉 7.4.1 과 같으나 그 이의의 것으로 1) 유리 커버슬립 2) 1mm 와 0.5mm 직경의 네트를 가전 체 2 개 3) 24 혈 멀티웰 〈방법〉 1) 유리 커버슬립 10 개 정도를 1-2mrn3 정도 크기로 조각을 낸다. 1mm 직경의 체로 걷론 다음에 다시 0.5mm 직경의 체로 걸러서 체 위에 남은 유리조각g lass ch ips 을 모은다. 이렇게 두 가지 체를 사용하여 0.5-lmm 직경 사이의 유리 조각을 골라낸다. 2) 50% 영산수 속에 1 시간 정치한 다음 수돗물에서 2 시간 씻 어낸다. 다음에 증류수로 네 번 씻어낸다. 3) 오본에서 건열멸균한다. 4) 6 개의 60mm 페트리딧슈 바닥에 위의 유리조각을 골고루 깐다. 50-100 개 가량의 유리조각이 들어 간다. 5) 유리조각이 떠내려가지 않게 조용히 4ml 의 배양액을 페트 리딧슈에 첨가한다. 6) 7.4.1 에서 하듯 세포부유액을 준비한다. 7) 2X103/ 딧슈 혹은 4X103/ 딧슈 정도로 세포를 각 페트리딧 슈에 분주한다. 8) 2 시간 뒤에 도립현미경 밀에서 세포 하나만 부착한 유리조 각을 찾아내어 시계수선 핀셋으로 24 혈 멀티웰에 옮긴다(그 립 7-2). 9) 5-10 일 뒤에는 다수의 세포가 자라서 유리조각 위를 덮는 다. 트립신액으로 세포를 분리하여 35mm 페트리딧슈에서 세포증식을 시킨다.
7.5 증식곡선 세포배양을 계속하고 있으면 세포들이 증식을 하여 배양기가 가득 차게 되므로 계대배양을 한다. 일정한 시간마다 그 세포수 롤 측정 하면 증식곡선gr ow th curve 을 그릴 수가 있다. 중식곡선 은 지 연기 la g pe rio d , I, 대수증식기 lo g a rithtnic grow th pe ri od , II, 정지기 s t a ti ona ry pe rio d , III, 사멸기 dea th ph ase, IV 등의 네 기간으로 구분될 수가 있다(그립 7-3). 증식곡선은 세포의 종
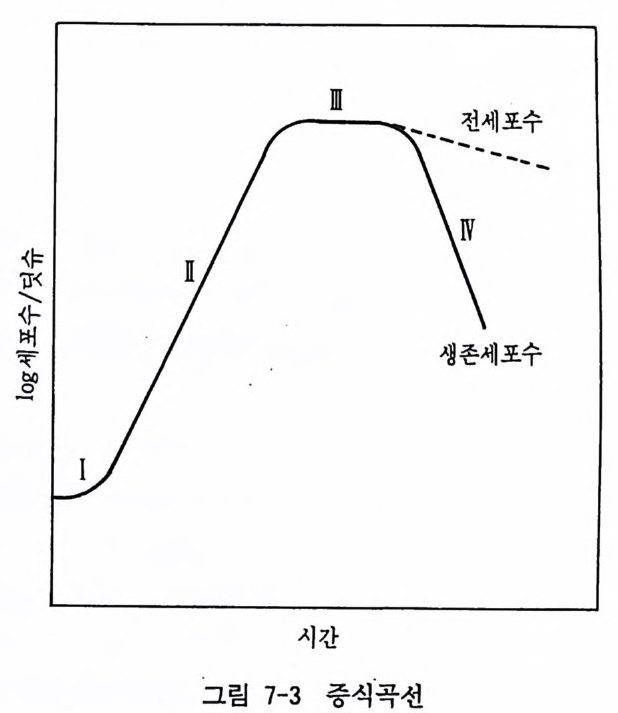 따
따
류와 배양조건에 따라서 변동이 크다. 정지기의 세포를 트립신 처리하고 희석한 뒤에 배양을 계속하면, 지연-대수증식-정지의 증식기간이 되풀이된다. 이것을 중식 사이클gr o wth c y cle 이라 한다. 세포의 대사기능은 증식의 진행과 더불어 점차로 저하하게
된다. 여기서는 힐라 HeLa 세포를 실험모델로 해서 증식곡선을 실제로 찾아보기로 한다. 〈재료〉 1) HeLa 세포 2 X l06 2) 트립 신 /EDTA/PBS 액 이글 MEM 액 +10% 마혈청 0.4% 트리판불루액 -PBS 액 3) 파이펫 35mm 플라스틱 페트리딧슈 혈구계산판 〈방법〉 1) 풀라스크에 들어 있는 묵은 배양액을 버리고 PBS 5ml 로 세포를 씻은 뒤 이를 버린다. 2) 트립 신 /EDTA/PBS 액 5ml 롤 플라스크에 첨 가하고 37 도에 서 5 분간 정치한다. 3) 10ml 파이펫과 파이펫에이드를 사용하여 세포를 홉인하고 내보내는 과정을 열 번 정도 계속함으로써 세포를 분리한다. 10% 마혈청이 들어 있는 배양액 5ml 를 첨가한 뒤 세포부유 액을 시험관에 옮기고 1,000r p m 으로 5 분간 원심분리를 한 다. 4) 미리 12 개의 35mm 칙경 페트리딧슈에 마혈청 포함 배양액 1.8ml 씩을 주입하고 인큐베이터에서 보온한다. 5) 시험관의 가라앉은 세포에 5ml 의 마혈청 포함 배양액을 가 하고 그 속의 세포수를 혈구계산판을 써서 계산한다. 6) 세포수를 1X106/ml 로 희석하고 0.2ml 를 (4) 에서 준비한 페트리딧슈에 0.2ml 씩 주입한다. 37 도에서 배양을 한다.
7) 24 시간 뒤에 3 개의 페트리딧슈에서 세포를 분리하고 트립 신 /EDTA/PBS 액으로 처리한 뒤, 트리판블루 염색을 하고 전세포수와 생존세포수를 계산한다. 8) (7) 의 과정을 24 시간마다 네 번 되풀이한다. 9) 수표의 가로축에 배양시간, 세로축에 전세포수와 생존세포 수를 표시한다. 그러면 그립 7 一 3 과 같은 증식곡선을 얻을 수 가 있다. 10) 증식속도는 배 가시 간 doub li n g ti m~ 로 표시 한다. 배가시간= lo(gt _ Nto—) lIoogg N2o t와 1:o : 세포수를 계산한 시간 N : t시간의 세포수 N 。 : &시간의 세포수 11) 포화밀도 sa t ura ti on dens ity는 증식이 정지된 정지기의 세 포수를 페트리딧슈의 바닥면적으로 나눈 수이다• 7.6 세 포수 계 산법 Cell count 세포배양에 있어서 도입p la ti ng 세포수나 세포증식도 측정 등 세포수를 계산하는 것이 배양법의 기초기술의 하나가 된다. 일반 적으로 혈구계산판 hemoc yt ome t er 울 사용하여 세포수를 계산하 는데 , 이 에 더 하여 트리 판블루 염 색tryp an blue s t a i n 을 하여 살 아 있는 세포를 구별하는 방법을 병용하기도 한다. 부착성 세포의 경우에는 트립신 처리를 하여 세포를 단리분산 시켜 사용한다. 그러나 부유세포인 경우에는 파이펫팅을 함으로 써 세포분리가 가능하다. 요즘에는 자동식 세포수측정기 Coul t er
coun t er 가 있으나 고가이고 세 포 의 생사 를 구별할 수가 없어서 혈구계산판이 가장 편리하다. 트리판블루는 죽은 세포를 파랗게 염색하나, 살아 있는 세 포 는 염색치 못하므로 트리판블루에 염색 이 안 되는 세포수를 혈구계산판에서 계산하면 살아 있는 세포수 롤 알 수가 있다. 이를 색소배제법이라 한다. 혈구계산판은 두 개의 챔버로 되어 있고 한 쳄버는 아홉 개의 1.0mm 떡 소구역으로 나누어져 있다. 그 위에 커버글라스가 덮 어져 있고, 글라스와 계산판 사이가 0 . 1mm 의 공간이 되어 있으 므로 한 소구역의 용적은 0 . lmm3 가 된다. 여기에 10,000 배를 하면 1ml 안의 세포수를 계산할 수 있다(그림 7- 4 ).
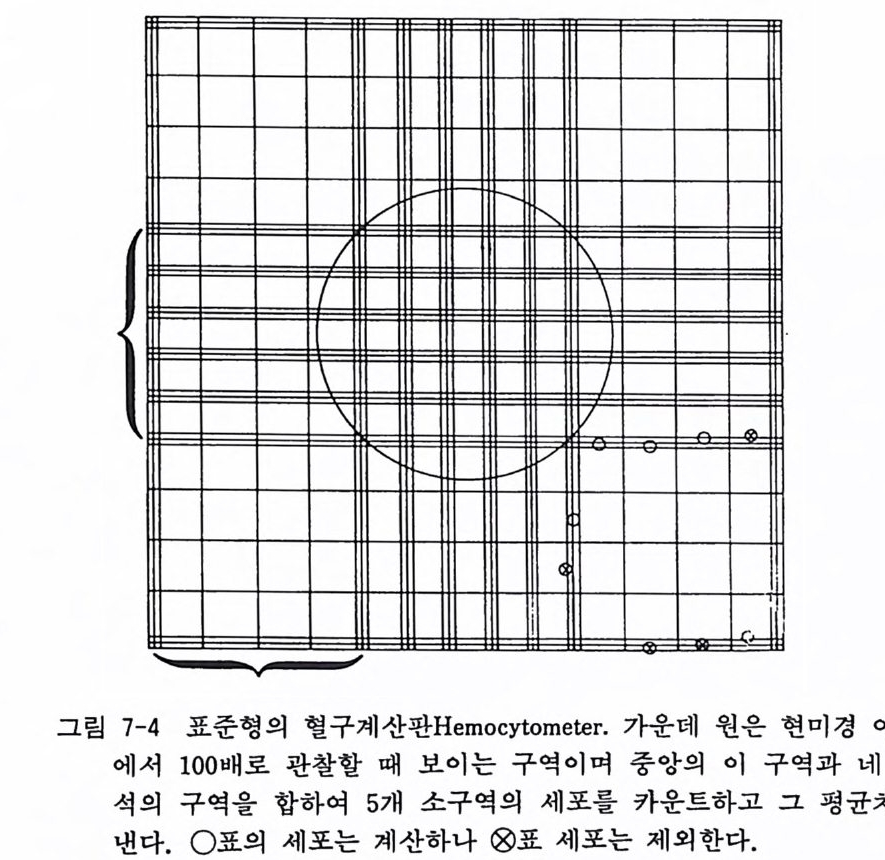 曰\’:_":“:广 1
曰\’:_":“:广 1
혈구계산판 계산에는 다음과 같은 오차가 있으므로 주의하는 것이 좋다 : (1) 고르지 못한 세포분포, (2) 덩어리로 되어 있는 세포를 계산, (3) 경계선상의 세포수를 두 번씩 계산, (4) 오차가 없는 측정을 위하여 최소한 세 번 카운트를 할 것. 〈 재 료 〉 1) 혈구계산판과 커버글라스 2) 파스퇴르파이펫 3) 영류용액 (핸크스나 얼 영류용액) 4) 0.4% 트리판블루(영류용액에 희석) 스톡액 5) 시험관 (12X75mm) 6) 카운터 7) 현미경 8) 세포부유액 〈 방 법 〉 1) 트리판블루액 0 . 2ml 를 염류용액 0 . 8ml 에 희석. 2) 혈구계산판 위에 커버글라스를 울려놓는다. 3) 시험관에 세포부유액 0.5ml 와 트리판블루액 0.5ml 를 섞는 다. 4) 파이펫으로 세포부유액, 트리판블루액을 섞은 다음 혈구계 산판의 두 챔버를 채운다. 5) 현미경에서 100 배 배율로서 10 배 대안렌즈와 10 배 대물렌즈 를 써서 가운데 1 개 구역과 구석의 4 개 소구역 (lmm2) 을 카 운트하고 5 로 나눈다. 먼저 전세포수를 카운트하고 그 다음 에 트리판블루에 염색된 죽은 세포를 카운트한다. 이때 그립 에 있듯이 소구역 하변과 우측변 선 위에 올라 있는 세포는 제의한다(그립 7-4). 6) 세포수를 계산한다.
소구역 평균치 X10,000-lml 의 세포수 1ml 의 세포수 X2X 배양액 총수-배양세포 총수 7) 계산울 되풀이하여 재현율 오차가 15% 이내로 한다. 7.7 세포동결보존법 배양세포를 계대유지함에 있어 여러 가지 문제점을 갖게 되는 데, 그 중 몇 가지를 열거하면 (1) 주세포가 계대배양중에 그 형 상, 성질이 변화한다. (2) 계대배양중 마이코플라스마 등의 감염 이 있다. (3) 유한증식성 세포주에서는 계대배양을 오랫동안 계 속하지 못한다. • 이러한 문제점을 해결해 주는 것이 세포동결보존법 cell free z- i n g이다. 세포배양중에 일정량의 세포를 앰플에 분주하여 동결보 존하고 필요시에 하나씩 꺼내 실험에 사용한다. 이에 따라 매주 마다 계대배양하는 시간과 노력을 절약할 수가 있다. 세포의 동결, 융해 후의 생존율은 동결시의 냉각속도, 보존온 도, 융해시 융해속도, 동결보호제의 종류와 농도 등의 여러 가지 조건이 고려되어야 한다. 다음과 같은 조건이 가장 이상적이라 생각된다. 동결속도 (1 분에 1 도씩 하강), 동결보존 온도 (-180 도), 급속융해 (1 분 이내), 동결보호제 사용 (5% DMSO 나 10% 글리세 린). 〈재료〉 1) 10% 우태아 혈청 +90% 이글 MEM 액 2) 디 메 틸설폭사이드 d i me thy lsul fo x i de, DMSO 3) 파이펫과 시험관 4) 세 포동결 튜브 c ry o t ube 5) 초저온 냉장고(섭씨 -80 도)
6) 액체질소 저장탱크 7) 세포부유액 〈방법〉 1) 증식중에 있는 세포를 분리하여 세포수 계산에 따라 2X 106/ml 의 세포부유액 을 만든다. 2ml 를 준비한다. 2) DMSO 를 온수에서 녹이고 증식배양액이 15% 가 되도록 혼 합한다. 3) 세 포부유액 (2ml) 과 15% DMSO 액 (2ml) 을 동량 혼합하고 이룰 세포동결 튜브에 1ml 씩 분주하여 4 개의 튜브롤 만든 다. 4) 세포동결 듀브 위에 마카펜으로 세포명, 날짜, 연구자 이름 을 표기한다. 5) 스티로폼 상자 속에 세포동결 튜브를 넣고 이를 -80 도 초 저온 냉장고에 하룻밤 보존한다. 6) 동결되어 있는 세포동결 튜브를 액체질소 저장탱크 속에 옮 긴다(그림 7-5).
 그림 7-5 세포동결 바이 알을 보존하는 액체질소 탱크 외부와 내부
그림 7-5 세포동결 바이 알을 보존하는 액체질소 탱크 외부와 내부
7) 동결보존된 세포를 융해하고 재배양하는 경우 세포동결 튜 브를 45 -5 0 도 가량의 온수에 넣어서 1 분 안에 녹도록 한다. 알코올을 적신 탈지면으로 세포동결 튜브 표면을 소독하고 듀브 내부의 세포부유액을 원심관에 옮기고 여기에 혈청첨가 배양액 10ml 를 첨가하여 1 , 200r p m 으로 5 분간 원심분리한 다 . 이것을 다시 한번 되풀이하고 T 플라스크나 페트리딧슈 에서 세포배양을 시작한다. 7.8 세포운반 배양세포를 다른 대학이나 연구소 연구실에 양도하거나 받아 오는 수가 많은데, 이런 경우 다음과 같은 처리를 한다. 1) 위에서 기술된 대로 세포를 동결한 다음 드라이아이스가 둘 어 있는 스티로폼 용기에 넣어서 밀봉한 다음 자동차, 비행 기로 목적지까지 운반한다. 목적지에 도착하면 죽시 해동하 고 배양을 시작한다. 2) 살아 있는 세포를 보내는 경우에는 T 플라스크에 세포를 배 양하고 운반이동 직전에 풀라스크 가득히 배양액(항생물질과 HEPES 완충액을 첨가)을 채우고 밀봉한다• 운반중에는 대기 온도가 된다. 목적지에 닿으면 풀라스크 입구를 알코올로 소 독하고 새 배양액을 넣은 다음 인큐베이터에서 정치배양한 다.
제 8 장 초대배양법 기본기술 배양기술이 발달되면서 여러 가지 조직,세포의 배양이 가능하 게 되었다. 그러나 한 가지 기술로서 모든 조직, 세포의 배양이 일률적으로 가능하지도 않고 각 조직에 따라서 그에 적합한 배양 법이 고안되고 개선되고 있다. 과거에는 동물태아의 조직은 배양하기 쉽고 성숙동물의 조직은 배양이 어렵다고 생각되어 왔으나 최근에 와서 기술의 개선으로 특수한 기능을 가전 간이나 신장 그리고 장조칙까지도 배양이 가 능하게 되었다. 아직도 불가능한 것이 있다면 그것은 성숙동물에 서 분리된 뇌신경세포라 하겠다. 그러나 필자의 연구실에서 최근 에 분리배양에 성공한 바 있어서 이제는 노력과 시간에 따라서 성숙동물의 중추신경계 신경세포도 배양이 가능하게 될 것으로 확신한다. 암조직은 정상조직에 비하여 배양이 쉬울 것이라 생각되나 실 제로는 이것이 대단히 어려워서 암조직 배양에 적합한 기술이 필 요하다. 정상조직에서 분리된 세포가 계대배양되는 경우에 이것 이 무한히 증식하는 것이 아니고 인간태아 폐 섬유아세포에서 보 더라도 50 세대 정도에서 사멸하게 된다. 쥐나 행스터 태아세포에 서는 이보다 더 짧아서 20 세대 전후의 계대에서 끊어지게 마련이 다. 이같이 배양세포에는 생물시계 b i olo gi cal clock 가 있어서 유 한증식한다는 현상이 최근의 노화연구 a gi n g research 의 중십문제 가 되어서 여러 나라에서 연구과제가 되고 있다. 여기에서는 조 직 또는 세포배양의 가장 초보적인 초대배양 기술에 대하여 서술 한다.
초대 배 양법 prim ary cul t ure 에는 두 가지 기본방법 이 있는데 그 것은 조직소편 ex p lan t 배양법과 단리세포 d i sso ci a ti on 배양법이 다. 8.1 조직소편배양법 이 방법은 극히 간편하고 손쉽게 조직배양을 시작할 수 있는 장점과 또한 극히 제한된 소량의 조직으로도 시작할 수 있는 장 점이 있다. 조칙을 소편으로 자를 때에는 예리한 수술칼 Sca p el 이나 안과용 가위를 사용하여 조직편을 예리하게 만들 것이며 조 직소편 속으로 가스나 영양물질이 충분히 침투할 수 있도록 그 크기가 lmm3 정도로 한다(그립 8-1 , 8-2). 한편 조칙편이 너무 작으면 그 속에 포함되는 세포수가 너무 적어서 발육이 안 되는 수가 있으니 조심하여야 한다• 약 10 년 전까지는 응고혈장p la sma clo t을 써서 조직소편을 커버슬립이나 페트리딧슈 바닥에 부착하도록 하였는데 최근에는 좋은 혈장의 입수가 힘들어서 사 용되지 않는다. 최근에 흔히 쓰이는 방법으로 샌드위치 sandw ic h 법과 엣칭
 그림 8-1 안과용 수술가위로 조직을 자른다.
그림 8-1 안과용 수술가위로 조직을 자른다.
 그림 8-2 수술칼 2 개를 써서 조직을 예리하게 자른다.
그림 8-2 수술칼 2 개를 써서 조직을 예리하게 자른다.
e t ch i n g법 등이 있는데 여 기 에 서 이 두 가지 를 소개 한다(그림 8-3 과 8-4). 샌드위치법은 조직소편을 35mm 페트리딧슈 바닥에 위치하게 하고 그 위에 22X22mm 유리 커버슬립을 올려놓는다. 커버슬립 의 압력으로 조직소편이 유리되는 것을 방지하게 된다. 딧슈에 2 ml 의 배양액을 주입하고 배양을 시작한다(그림 8-3).
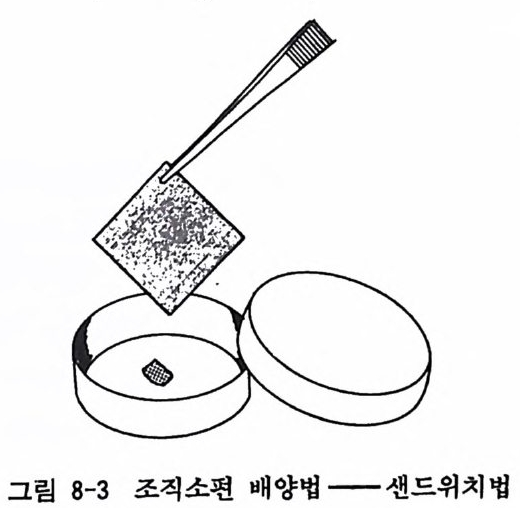 그림 8-3 조직소편 배양법 -샌드위치법
그림 8-3 조직소편 배양법 -샌드위치법
엣칭법은 35mm 페트리딧슈 바닥에 3-4 개의 X 를 수술칼울 써 서 그어넣는다. 조직소편을 X 위에 올려놓고 약간의 압력을 가 하면 딧슈 상처 위에 소편이 부착하게 된다. 30 분 가량 기다린 뒤에 2ml 의 배양액을 가하고 배양을 시작한다(그림 8-4).
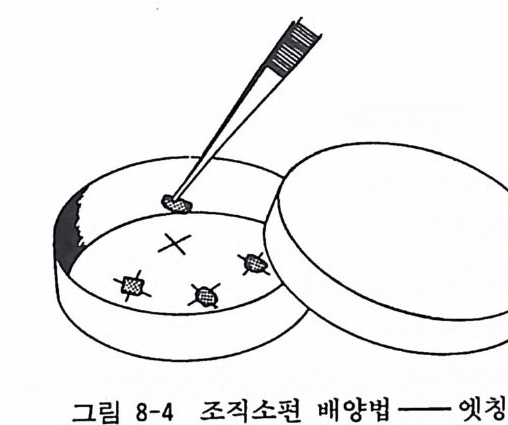 그림 8-4 조직소편 배양법-엣칭법
그림 8-4 조직소편 배양법-엣칭법
일반적으로 2-3 일 내로 세포가 조직편 주위에서 이동해 나오는 것이 보이나 예의적으로 한두 주일이 걸리는 수도 있다. 8.2 단리세포배양법 조직의 종류에 따라서는 효소에 의한 처리가 필요치 않고 기계 적인 처리만으로 세포를 분리할 수가 있는데 비장 s p leen 이나 흉 선thy mus 이 그 예가 되겠다. 효소를 쓰는 경우에는 트립신 try p s in , 프로나아제 pro nase, 파파인p apa i n 혹은 콜라게 나제 collag e nase 등의 효소를 하나 선택 해서 사용한다. 효소액 속에 서 소화가 된 조직은 염류용액이나 효소억제액을 써서 효소를 씻 어내고 파이펫팅을 되풀이하여 단독세포로 분리한다• 세포 덩어
리가 아직도 남아 있는 경우에는 20-100 미크론 구멍크기를 가전 나일론메시 mesh 를 써서 걸러낸다. 나일론메시를 구하기 힘든 경 우에는 여성의 나일론 양말을 찰라내어서 오토클레이브 멸균을 하여 사용토록 한다. 조직이나 세포 잔재가 많이 있는 경우에는 일분에 500rpm (50g ) 정도의 원심침전을 시키고 씻어낼 수가 있 다. 세포단리법에는 세 가지 주의가 필요한데 그것은 다음과 같 다. (1) 조직을 소편으로 조그마하게 자르는데 이것은 조직표면 의 효소에 닿는 부분을 많게 하기 위한 것이다. 너무 조그마하게 조직을 자르면 세포들이 파괴되고 너무 크면 효소작용이 낮아져 서 세포분리가 곤란하다. 따라서 lmm3 정도 혹은 그보다 약간 큰 정도가 이상적이다. (2) 연구목적에 이상적인 효소와 그 사용 농도를 결정하여야 한다. 참고문헌에 사용농도가 지시되어 있으 므로 이것을 참고로 하여 조직과 사용목적에 따라서 경험적으로 결정하도록 할 것이다. (3) 효소액 속에서의 인큐베이션 시간이 역시 중요하다. 너무 오래 효소액에서 소화되면 조칙과 세포가 파괴되고, 너무 짧은 시간이면 조직에서 세포가 분리되지 아니한 다. 일반적으로 0. 25% 트립신에서는 20 분에서 30 분인데, 이것도 트립신의 종류와 제조자에 따라서 품질이 천차만별로 다르기 때 문에 경험적으로 자기가 결정하여야 한다. 일반적으로 트립신을 사용하여 조칙에서 세포를 단리하는 경우에 사용하는 방법은 다 음과 같다. 1) 적당한 크기의 조직을 유리 페트리딧슈나 맥시모우 슬라이 드에 옮기고 그 속에서 예리한 안과수술용 가위나 수술칼 두 개를 써서 lmm3 정도 크기로 잘라낸다(그립 8-1, 8-2). 2) 조그맣게 자론 조직편을 50ml 원십튜브나 100ml 배양액 병 에 옮기고 전자에는 20ml, 후자에는 30ml 의 염류용액이나 PBS 를 추가한다. 조직편을 옮기는 것은 10ml 의 파이펫을 사용한다.
3) 원심튜브 병을 37 도 온도를 유지하고 있는 수조 wa t er bath 에 옮겨서 5 분 정도 보온한다. 4) 조직 위 에 있는 상청 액 su p erna t an t을 버 리 고 10-20ml 의 0.2 5 % 트립신액을 추가하여 37 도 수조에서 25 분에서 30 분간 보온한다• 수조는 적당한 속도로 진동할 수 있는 셰이킹 수 조가 있으면 이상적이다. 5) 수조에서 원심튜브 병을 꺼내, 표면액을 버린다. 조직편이 끈끈하게 되어서 액을 버릴 수가 없는 경우에는 0.5% DNA 가수분해효소 (DNase , 시그마)를 4-5 방울 첨가하고 2-3 분 기 다리면 된다. 조직이 끈끈하게 되는 것은 파괴된 세포에서 DNA 가 분리되어서 서로 엉키기 때문이다. 6) 혈청을 포함한 배양액 10ml 를 추가하고 10ml 파이펫으로 20 번 가량 위아래로 파이펫팅을 한다. 이 기계적인 조작으로 세포가 조직에서 분리된다. 이때에 거품이 나올 정도로 강하 게 파이펫팅을 하면 세포표면이 상해서 사멸하므로 조심스럽 게 파이펫팅을 해야 한다. 7) 2-3 분 기다려서 세포덩어리가 가라앉는 것을 기다리고 표면 액을 다론 50ml 원심튜브에 옮건다. 남아 있는 세포덩어리 에 10ml 의 배양액을 새로 가하여 파이펫팅을 계속하고 세포 분리를 한다. 8) 분리된 세포를 포함한 표면액을 모아서 8 분 동안 800r p m 으 로 저속원심을 한다. 표면액을 버리고 가라앉은 세포에 신선 한 배양액을 가하고 저속원심을 한다. 이 조작을 한 번 더 되풀이하고 마지막으로 세포부유액을 커버슬립이나 페트리딧 슈에 추가해서 배양을 시작한다.
제 9 장 초대배양법-동물조직 초대배양은 생물체에서 직접 찰라낸 세포, 조직, 기관에서 시 작이 된 배양을 의미하여 일정기간 배양한 뒤에 계대배양s ub cu lt ure 할 때까지를 의미한다. 일반적으로 초대배양은 계배, 랫 트, 마우스, 행스터, 토끼 등의 실험동물 조직을 사용하여 시작 한다. 소나 돼지 같은 가축의 조직이 필요한 경우에는 도살장에 가서 조직을 얻게 마련인데 이때에는 되도록이면 무균상태에서 조직을 잘라내도록 노력하여야 한다. 이러한 경우에는 멸균된 비 커나 특수한 유리용기(그립 9-1) 에 염류용액이나 PBS 을 반 정도 채 우고 그 속에 페 니 실 린 (1, OOOU/ml ) , 스트렙 토마이 신 (lmg /m l )
 그림 9 기 수술실에서 수술재료를 가지고 을 때에 사용하는 유리용기.
그림 9 기 수술실에서 수술재료를 가지고 을 때에 사용하는 유리용기.
그리고 환기존 (25µ g /ml) 의 세 가지 항생물질을 포함시킨 다음 그 속에 동물조직을 넣도록 해야 한다. 랫트나 마우스 같은 실험 동물의 경우에는 에데르마취나 그 밖의 적당한 마취제를 써서 마 취시킨 다음 의과적으로 조칙을 잘라낸다. 랫트와 마우스의 경우 에는 한 손으로 목 뒤를 막대기로 누르고 다른 손으로 꼬리를 강 하게 잡아끌어서 희생시킬 수도 있다. 9.1 계 배 섬 유아세 포 Ch ic k embry o fibr oblasts 초대 배 양 〈재료〉 1) 70% 알코올 2) 이글 MEM( 합성배양액) 3) 마혈청 4) 칼슘, 마그네 슘 제 거 PBS (CMF-PBS) 5) 0 . 25% 트립 신 액 혹은 0 . 05% 콜라게 나제 collag e nase 6) 2mg /m l DNase 효소액 7) 해부용 현미경과 조명 8) 수술기구 -100mm 가위 (직선과 곡선) 2 개 시계수선용 핀셋 (No. 4) 2 개 수술용 칼 2 개 9) 시험관, 페트리딧슈, 원심튜브 10) 혈구계산판 11) 스위넥스 Sw i nnex 필터에 100 미크론 나일론메시를 장치 12) 부화 10-12 일 된 계란 〈방법〉 1) 계란의 둔한 쪽을 위로 하여 그곳을 알코올로 소독한다. 2) 계란 상부에 구멍을 내어 원형으로 계란껍질을 벗긴다.
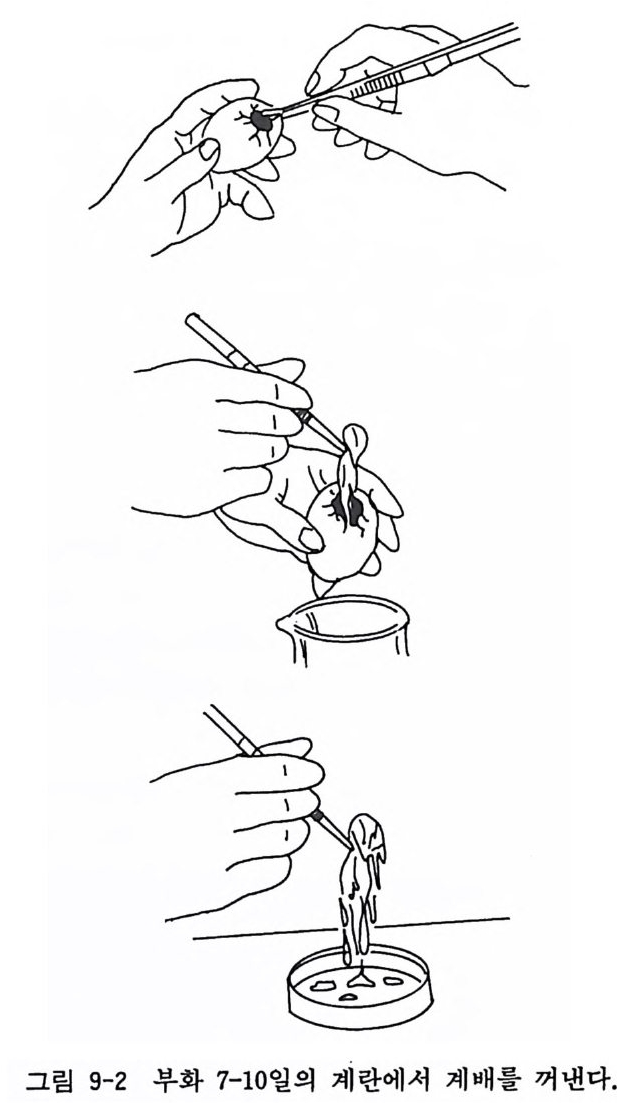 그림 9-2 부화 7-10 일의 계란에서 계배를 꺼낸다.
그림 9-2 부화 7-10 일의 계란에서 계배를 꺼낸다.
3) 계배를 꺼내되 목을 신중하게 걷어내어서 CMF-PBS 가 둘 어 있는 100mm 페트리딧슈에 옮긴다(그립 9-2). 4) 계배 머리, 사지, 내장을 찰라내고 나머지 몸부분을 CMF- PBS 로 씻어낸다. 5) 다른 100mm 페트리딧슈에 씻어낸 피부조직을 옮기고 수술 용 칼 2 개로 조직을 섬세하게 자른다 .
6) 조그맣게 자론 조직편을 시험관에 옮기고 조직편이 바닥에 가라앉기를 기다린다. 7) PBS 를 제 거 하고 0 . 25% 트립 신액 10ml 를 가하고 37 도 인 큐베이터에서 15 분간 정치한다. 트립신은 보통 2.5% 스톡액 으로 시판되고 있으므로 이것을 1 : 10 으로 CMF-PBS 로 희 석하여 사용한다. 8) 트립 신액 을 제 거 하고 CMF-PBS 10ml 를 가한 뒤 파스퇴 르 파이펫으로 20 번 상하로 조용하게 파이펫팅을 한다. 이때 트 립 신액 에 20µg /m l 농도의 DNas 탸다요액 을 가하면 세포분리 가 쉽게 된다. 9) 상청액을 걷어서 같은 양의 10% 마혈청 첨가 MEM 배양 액이 들어 있는 새 원심튜브에 옮긴다. 10) 새 트립신 용액을 남아 있는 조직편에 넣고 효소작용을 다 시 한다 (37 도에서 15 분간). 두 번의 트립신 소화액을 합하여 이를 1,000r p m 으로 8 분간 원심분리한다. 11) 상청액을 버리고 가라앉은 세포에 10% 마혈청 첨가 MEM 배양액 20ml 를 가하고 파이펫팅을 하여 세포부유액을 만든다. 100 미크론 나이론메시가 둘은 스위넥스 필터로 세포 를 걸러서 세포덩어리를 제거할 수도 있다. 12) 페트리딧슈나 커버글라스 위에 세포를 뿌린다. 커버글라스 롤 쓰는 경우에는 12mm 직경의 No. 1 두께가 가장 편리하 다. 이것을 산으로 세척한 뒤, 건열멸균을 하고 lOµ g /ml 농 도의 폴리 라이 신p ol y l y s i ne 에 20 분간 정 치 한 뒤 에 60mm 페 트리딧슈에 8 개를 정돈되게 위치시킨다. 한 방울의 세포부유 액을 커버글라스 위에 뿌리고 하롯밤을 지내고 다음날 3ml 의 배양액으로 페트리딧슈 전체를 덮는다. 13) 배양액의 조성은 다음과 같다. 이글 MEM : 89 마혈청 : 10
2mg /m l 겐타마이신액 : l 9.2 계 배 근육세 포 Ch i ck embryo my o blasts 초대 배 양 재료와 계배분리는 계배 섬유아세포 배양과 같다. 그림 9-3 에서는 근육세포 배양 2 일 뒤, 그리고 그림 9-4 에서는 이주일 뒤의 근육관 형성을 보이고 있다. 〈 방법 〉 1) 계배 다리 부분에서 근육을 잘라내고 PBS 가 담긴 다른 페 트리딧슈로 옮긴다. 2) 수술용 칼 2 개로 근육조직을 섬세하게 자른다. 3) 조직편을 시험관에 옮기고 조직편이 바닥에 가라앉기를 기 다린다. 4) PBS 를 제거하고 0. 25 % 트립신액 10ml 를 첨가한 뒤 37 도
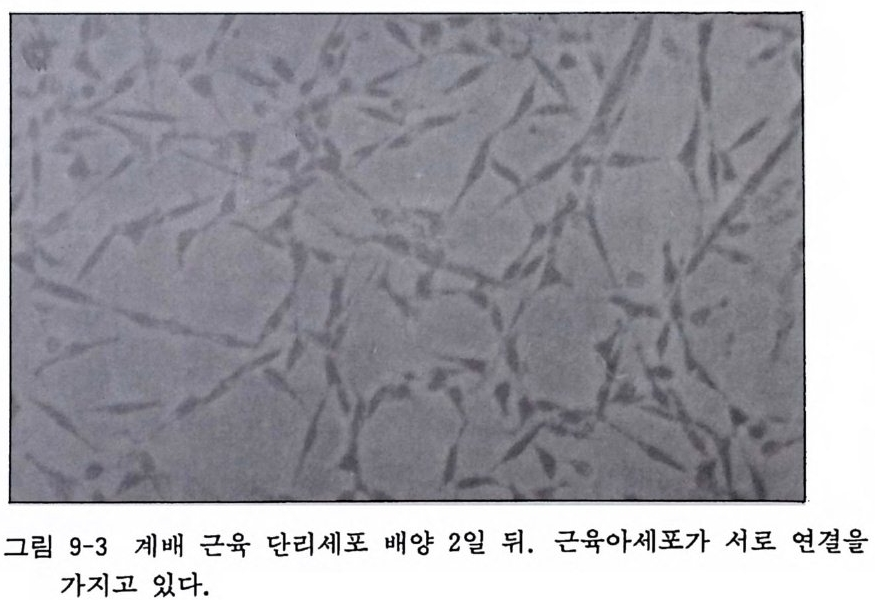 그림 9-3 계배 근육 단리세포 배양 2 일 뒤. 근육아세포가 서로 연결을
그림 9-3 계배 근육 단리세포 배양 2 일 뒤. 근육아세포가 서로 연결을
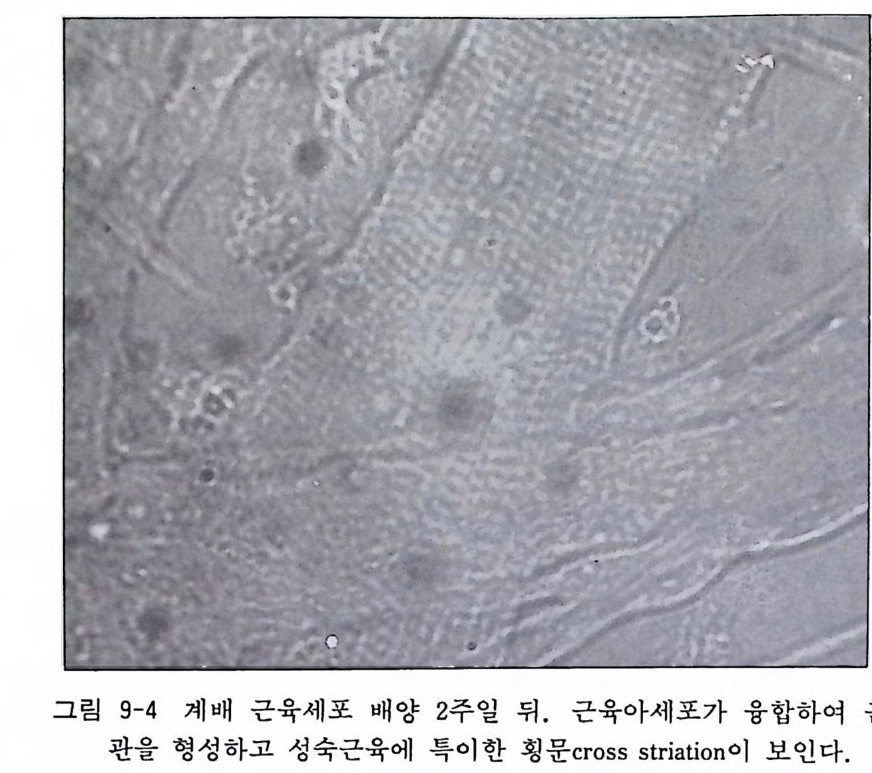 그림 9-4 계배 근육세포 배양 2 주일 뒤. 근육아세포가 융합하여 근육
그림 9-4 계배 근육세포 배양 2 주일 뒤. 근육아세포가 융합하여 근육
인큐베이터에서 15 분간 정치한다. 5) 트립신액울 제거하고 PBS 10ml 를 가한 뒤 파스퇴르파이펫 으로 20 번 파이펫팅을 한다. 조직편이 가라앉기를 기다린다. 6) 상청액을 걷어서 동량의 10% 마혈청 첨가 MEM 용액이 들어 있는 새 원심튜브에 옮긴다. 7) 새 트립신 용액을 남아 있는 조직편에 넣고 효소작용을 37 도 인큐베이터에서 15 분간 다시 하게 한다. 두 번의 트립신 소화액을 합한 뒤 30ml 주사기에 100 미크론 나일론메시를 넣은 스위니 여과필터를 붙인 뒤 큰 세포덩어리를 걸러낸다. 구멍직경 100 미크론의 나일론메시를 사지 못하는 경우에는 여성용 나일론 스타킹을 적당한 크기로 잘라서 봉지형태를 만든다. 이를 오토쿨레이브 멸균한다.
8) 원심분리기에서 1,000r p m 으로 8 분간 원심분리하고 가라앉 은 세포를 10ml 의 10% 마혈청 첨가 MEM 배양액에 부유시 키고 세포수 계산울 한다. 9) 세포부유액 10ml 를 100mm 직경 페트리딧슈에 정치시킨다. 세포수는 2X105/ml 로 희석한다. 한 시간동안 37 도 인큐베 이터에 정치시킨 뒤 위에 떠있는 액을 걷어내고 다시 10ml 룰 가하여 페트리딧슈 바닥을 씻어낸다. 이들 세포부유액을 합친 뒤 1,000rp m 속도로 8 분간 원심분리한다. 10) 가라앉은 세포를 10% 마혈청 첨가 MEM 배양액에 재부 유시키고 2X105/ml 농도로서 젤라틴 코팅이 되어 있는 60 mm 페트리딧슈나 12mm 직경 커버글라스에 세포를 뿌린다. 그립 9-3 과 9-4 에서 근육세포 배양의 실제를 보이고 있다. 젤 라틴 코팅을 위해서 2% 젤라틴을 증류수에 만들어서 오토클 레이브 멸균을 한다• 충분량의 젤라틴액으로 페트리딧슈나 커버글라스의 표면을 덮고 10 분 뒤에 여분의 것을 홉인하고 무균벤치 속에서 건조시킨다. 9.3 계 배 간세 포 Ch ic k embry o hep a to c y tes 초대 배 양 재료와 계배분리는 계배 섬유아세포 배양과 같다. 〈 방법 〉 1) 계 배 에서 간장을 분리 하고 CMF-PBS 가 담긴 100mm 페트 리딧슈에 옮긴다. 2) 수술칼 2 개로 간을 소편으로 자른다. 3) 조칙편을 시험관으로 옮긴다. 4) PBS 를 제 거 하고 0 . 25% 콜라게나제 (MEM 에 희석 ) 3ml 를 첨가한 뒤 37 도 인큐베이터에서 30 분간 정치한다.
5) 파이펫으로 10-20 번 조용히 파이펫링한 뒤 조칙편이 가라앉 는 것을 기다려서 상청액을 걷어내어 새 원심튜브에 옮긴다. 6) 새 PBS 3ml 를 조직편에 첨가하고 파이펫팅을 20-30 번 하 여 조직편이 남지 않을 정도로 세포분리를 한다. 7) 세포부유액을 합쳐서 1 , 000r p m 으로 8 분간 원심분리한다. 가라앉은 세포를 두 번 MEM 으로 세척한다. 이때 800rpm 으로 6 분간의 원심분리를 사용한다. 8) 가라앉은 세포를 10% 마혈청 첨가 MEM 배양액에 재부유 시 키 되 1 X 107/ml 의 세포밀도로 조정 한다. 9) 35mm 나 60mm 페트리딧슈에 플레이팅을 하고 인큐베이터 에서 37°C 로 배양하고, 24 시간 뒤에 배양액을 교환한다. 9.4 계 배 뇌 척 수세 포 Ch ic k embry o brain - sp ina l cord 초대 배양 재료와 계배분리는 앞부분 계배 섬유아세포 배양 참고. 그립 9-5 와 9-6 에서 계배 척수신경세포 배양 삼주일 뒤의 형태 롤보여준다. 〈방법〉 1) 계배에서 뇌를 분리한다. 머리 부분의 피부를 벗기면 얇은 두개골이 나오는데, 이를 핀셋으로 걷어내면 뇌가 나온다. 뇌롤 PBS 를 포함한 100mm 페트리딧슈에 옮기고 2 개의 시 계수선용 핀셋을 사용하여 뇌막을 제거한다. 뇌막을 그대로 두면 배양중 섬유아세포가 많이 자라나서 신경세포 성장에 지장이 있다. 2) 계배에서 척수를 분리함에 가장 간단한 방법은 먼저 계배의 배부를 위로 향하게 한 뒤 머리와 목의 경계를 절단한다. 그
 rg1 i ¢ ”·
rg1 i ¢ ”·
다음에 2 개의 핀셋을 써서 꼬리 부분에서부터 척수를 교대로 압축하면서 머리 쪽으로 밀어울린다. 이것은 마치 치약 튜브 에서 치약을 짜내는 동작과 비슷하다. 목 부분에서부터 척수 가 치약같이 나오게 된다. 계배의 요수 lumbar cord 나 천수 sacral cord 부분에는 글리코겐체g l y co g en bod y가 있으므로 사용하지 않는다. 3) 수술칼 2 개로 뇌나 척수를 소편으로 자르고 이룰 시험관에 PBS 와 같이 옮긴다. 4) PBS 를 제거하고 0.25% 트립신과 20µg /m l DNase 가 들은 효소액 10ml 를 첨가하고 37 도 인큐베이터에서 30 분간 정치 한다. 5) 트립신액을 제거하고 20µg / ml DNase 를 포함한 PBS 5ml 를 가한 뒤 20-30 번 파이펫팅을 한다. 조칙편이 가라앉은 뒤 상청액을 10% 마혈청 첨가 MEM 이 들어 있는 새 원심분리 튜브에 옮긴다. 6) 10% 마혈청을 포함한 MEM 5ml 를 남은 조직편에 가한 뒤 재차 20-30 번의 파이펫팅을 한다. 상청액을 먼첫번 상청액과 합한 뒤 1,000r p m 으로 8 분간 원심분리한다. 7) 가라앉은 세포를 10% 마혈청 첨가 MEM 배양액 5ml 에 부 유시킨 뒤 두 번 더 세척, 원심분리를 되풀이한다. 8) 가라앉은 세포를 배양액에 재부유시킨 뒤 혈구계산판으로 세포수 계산을 하고 1Xl06/ml 로 희석한다. 세포부유액은 폴리라이신 코팅된 12mm 커버글라스에 뿌리고 하룻동안 37 도 인큐베이터에 정치시킨다. 9) 다음날 10% 마혈 청 포함 MEM 배 양액 3ml 를 추가한다. 배양액 교환은 매 5 일마다 혹은 매주 한 번 하도록 한다. 10% 마혈청 포함 MEM 배양액의 조성은 다음과 같이 한 다. 이글 MEM : 88
마혈청 : 10 50% 글루코스액 : 1 2m g /ml 겐타마이신액 : 1 9.5 계 배 척 수후근 신 경 절 Chic k embry o dorsal root ga n- glion 초대배양 재료와 계배분리는 앞부분 계배 섬유아세포 배양 참고. 〈 방법 〉 1) 계 배 를 분리 하고 10ml 의 핸크스 BSS 가 들어 있는 100mm 페트리딧슈에 넣는다 . 계배의 등을 아래로 하여 전부를 노출 시킨다. 여기서부터 입체해부현미경을 사용한다. 가위로 머 리를 절단하고 가슴과 배 부분을 가위로 절개한 뒤 그 속에 들어 있는 장기 (심장, 간, 위장, 기타)를 깨끗이 둘어내어 버 린다. 2) 계배 중앙부에 척수가 보이는데, 요수 부분 lumbar cord 에 서는 후근신경절을 척수 양측으로 볼 수가 있다. 요수와 천 수 부분 sacral cord 에서 10 개에서 12 개의 신경절을 분리할 수가 있다. 3) 분리된 신경질을 두 개씩 콜라겐을 바른 커버글라스에 올려 놓고 한 방울의 배양액을 주고 커버글라스를 멕시모우 쳄버 Maxim ow Chambe 라 페트리딧슈에 위치시키면 조직편(엑 스프란트) 배양이 시작된다. 4) 신경철을 계배 3-4 마리에서 모아 30 개 정도가 되면 이를 사 용하여 단리 세포배양을 시작할 수 있다. 5) 신경절을 핸크스 BSS 와 같이 시험관으로 옮긴다. BSS 를 제거한 뒤 0.25% 트립신액 10ml 롤 가하고 37 도 인큐베이터
에서 30 분간 정치한다. 6) 트립신을 제거하고 20µg /r nl 농도의 DNase 효소액이 들어 있는 PBS 5ml 를 가한 뒤 파스퇴르파이펫으로 20 번 상하로 조용히 파이펫팅을 한다. 7) 상청액을 걷어서 동량의 10% 마혈청 첨가 MEM 배양액이 들어 있는 새 시험관에 옮긴다. 8) 새 트립신 용액을 남아 있는 조직편에 넣고 효소작용을 다 시 한다 (37 도에서 15 분간). 두 번의 트립신 처리세포액을 합 하고 이를 1,000r p m 으로 8 분간 원심분리한다 . 9) 상청 액 을 버 리고 가라앉은 세포에 10% 마혈청 과 lOOng /m l NGF 첨가 MEM 배양액 3ml 를 가하고 파이펫팅을 조용히 하여 세포부유액을 만든다. 10) 커버글라스(폴리라이신 코팅) 위에 한 방울의 세포부유액 (106 세포 /ml) (5-10X104 세포/커버글라스 세포밀도)을 올려 노눙' -T 다. 하룻밤 지난 다음날 3ml 의 배양액으로 덮는다. 배양액 조성은 다음과 같다. 마혈청 : 10 50% 글루코스액 : 1 2mg /m l 겐타마이 신액 : 1 lOµg /m l NGF( 신경성장인자) : 1 이글 MEM : 87 9.6 마우스 태아 뇌신경세포 Mouse brain 배양법 앞서 기술한 계배 섬유아세포 배양, 계배 뇌척수세포 배양과 같은 기술법을 사용한다. 먼저 태아를 14-18 일 임신된 마우스로 부터 분리하는 방법을 여기서 기술한다.
〈 재료 〉 1) 에데르와 에데르 병 2) 70% 알코올 3) 핸크스 BSS( 영류용액) 4) 입체해부용 현미경과 조명 5) 수술기 구 -10mm 가위 (직 선과 곡선) 2 개 시계수선용 핀셋 (No. 4) 2 개 수술용 칼 2 개 6) 시험관 , 페트리딧슈, 원심튜브 7) 14-18 일 임신 쥐 (마우스) 〈 방법 〉 1) 임신 마우스를 에데르 병에 넣고 마취시킨다. 2) 70% 알코올로 온몸(특히 가슴, 그리고 배)을 적신다. 3) 마우스의 등을 아래로 하여 눕힌다. 피부를 핀셋으로 잡아 올리면서 배 부분을 가위로 절개한다. 4) 근육을 조금씩 절개하는데, 장기를 자르지 않도록 조심한다. 5) 자궁을 핀셋으로 들어울리고 경관부와 난관부를 가위로 자 른다. 조심스럽게 자궁을 핸크스 BSS 가 들어 있는 100mm 페트리딧슈로 옮긴다. 6) 자궁근육을 철개하고 태아를 끄집어낸다. 일반적으로 6-12 마리의 태아를 얻을 수가 있다. 7) 필요한 뇌 부분을 태아에서 찰라내고 계배 세포배양에서 설 명한 대로 초대배양을 시작한다. 랫트의 경우에도 갇은 요령 으로 배양을 시작한다. 9.7 마우스 태아 신장세포 Mouse kid n ey 배양법 14-18 일 된 마우스 태아의 신경계, 근육, 폐, 심장, 부신, 소
장, 간 그리고 신장의 조직배양을 하려면 가장 간단하고 용이한 방법이 lmm3 정도의 조그만 조직편을 만들어서 풀라스틱 페트 리딧슈 바닥에 정치하고, 조직편을 커버글라스로 가볍게 압박하 고 이 위에 배양액을 첨가하는 것이다. 일주일에서 열흘이 자나 면 조직편에서 많은 세포가 유출돼 나온다. 여기에서는 조직에서 단리한 세포를 배양하는 단리 세포배양에 대하여 기술한다. 태아 를 임신한 마우스로부터 분리하는 방법은 9.6 에서 기술한 대로 한다. 〈방법〉 1) 마우스 태아에서 신장을 분리하고 CMF-PBS 가 담긴 100 mm 페트리딧슈에 옮긴다. 2) 수술칼 2 개를 교차하면서 신장을 소편으로 잘라낸다. 3) 조직편을 시험관에 옮긴다. 4) 여분의 CMF-PBS 를 제 거 하고 CMF-PBS 에 희 석 한 0 . 25% 트립신과 20µg /m l DNase 액에서 37 도 30 분간 정치한다. 5) 튜브 바닥에 있는 조직편을 둔 채 트립신액을 걷어서 버린 다. 6) 10% 마혈청을 포함한 이글 MEM 액을 3ml 정도 튜브에 첨 가하고 10-20 번 조용히 파이펫팅을 한다. 조직편이 가라앉는 것을 기다려서 상청액을 걷어서 새 원심튜브에 옮긴다. 7) 남은 조직편에 배양액 2ml 롤 첨가하고 위의 조작을 되풀이 한다. 8) 세포부유액을 합쳐서 1,000r p m 으로 8 분간 원심분리한다. 가라앉은 세포를 두 번 MEM 으로 세척한다• 9) 가라앉은 세포를 10% 마혈청과 20µg /m l 겐타마이신을 첨 가한 MEM 배양액 3ml 에 부유시키고 lX106/ml 의 세포밀도 가 되도록 조철한다. 10) 35mm 혹은 60mm 페트리딧슈에 플레이팅하고 이산화탄소
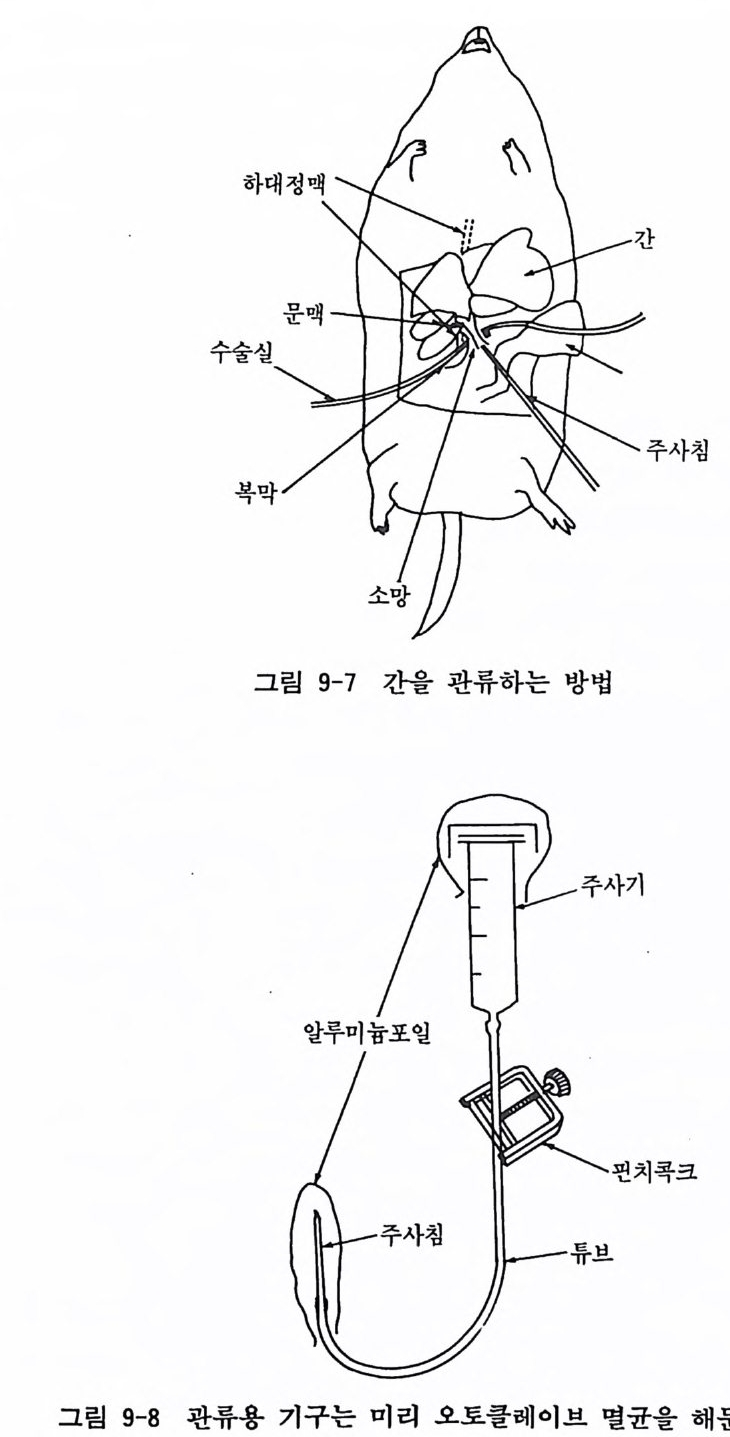
인큐베이터에서 배양을 시작한다. 24 시간 뒤에 배양액을 교 환한다. 장기 배양시에는 일주일에 두 번 액교환을 한다. 9.8 성숙 랫트 간세 포 Ra t live r 배 양법 간은 대사의 조정, 효소의 유도, 호르몬에 대한 응답 등 갖가 지 특이한 생리기능을 가지고 있는 기관으로 그 기능의 대부분이 간 실질세포p arench ym al cells 에 의 해 서 전행 된다. 이 러 한 간기 능을 보촌한 간 실질세포를 배양하는 것은 중요한 배양기술이라 생각이 된다. 여기서는 성숙 랫트의 간을 관류효소법에 의해서 분리하고 배양하는 방법을 설명한다. 〈재료 〉 1) 성숙 랫트(체중 150-200g ) 2) 이글 MEM+10% 우태아 혈청 0 . 05% 콜라게 나제 /MEM 3) 각종 파이펫, 풀라스틱, 페트리딧슈 4) 수술기구 관류용 기구(그립 9-8 참고) 〈방법〉 1) 랫트를 마취하고 배를 위로 하여 눕힌다. 배 부분을 70% 알코올로 소독한 뒤 에 무균적으로 개복을 한다. 2) 그림 9-7 과 갇이 간을 뒤집고 위와 장을 심장을 향해서 밀 어올리면, 간으로 가는 문맥p o rt al ve i n 이 보인다. 문맥 주 위의 소망부를 일부 열고 그곳을 동해서 수술실을 삽입한다. 3) 그립 9-8 과 같이 설치한 주사기에 PBS 20ml 를 넣고 실리 콘튜브, 주사침까지 PBS 가 도달한 다음 핀치콕크를 참근
 수술실
수술실
다. 주 사침을 문맥에 삽입한 다음 수 술 실로 강하게 매어서 주사침을 고정시킨다(그림 9-7).
 !'rr4 ., rIe)~ •• •c··E` 'o e’ ~/ , )
!'rr4 ., rIe)~ •• •c··E` 'o e’ ~/ , )
4) 핀치콕크를 열어서 서서히 PBS 를 주입하면 간이 노랗게 되면서 팽창해진다. 이때에 간 상부에 보이는 복부대정맥을 가위로 절단하여 주사액이 흘러나가게 한다. 약 5 분간 걸려 서 PBS 를 주입하는데 그 속도는 주사기의 높이를 조정하여 서 조절한다、 5) PBS 가 없어질 시간에 콜라게나제액 20ml 를 주사기에 추가 하여서 약 5 분간에 걸쳐서 주입한다. 6) 관류가 끝나면 간조직을 잘라내어 100mm 페트리딧슈에 놓 고 PBS 를 10ml 추가한댜 핀셋 2 개로 간의 피막을 제거하 면 간조칙이 연화해서 끈끈하게 되어 있다. 7) 10ml 파이펫으로 서서히 파이펫팅을 하면서 세포분리를 한 다. 세포부유액을 원심듀브에 모은다. 다시 PBS 10ml 를 추 가하고 파이펫팅을 계속한다. 8) 세포부유액을 300 rp m 으로 5 분간 원심분리하고 상청액을 버 린다. 이러한 과정을 서너 번 계속한다. 9) 가라앉은 세포를 10ml 의 혈청을 포함한 배양액에 부유시키 고, 트리판블루액으로 염색하여 생존세포수를 계측한다. 생 존율은 80-90% 정도가 된다. 10) 2X105/ml 의 간세포 부유액을 30ml 만들어서 60mm 페트 리딧슈 5 개에 5ml 씩 분주하고 배양을 시작한다. 11) 간 실질세포는 크기 때문에 300r p m 으로 5 분간의 저속원심 분리로 가라앉는 데 비하여 그 밖의 세포는 상청액에 남아서 제거된다. 간 실질세포의 기능은 알부민 생산, 티로신 아미 노트란스페 라제 tyros in e ami no tr a nsfe r ase 효소활성 등으로 이러한 기능을 가진 채 일주일 이상 배양할 수가 있다. 그림 9-9 는 관류법으로 분리한 간세포를 하루 배양한 것이고 그림 9-10 는 4 일간 배양한 뒤에 위상차현미경으로 찍은 사전이다.
제 10 장 초대 배 양법 -사람조직 사람의 조직을 초대배양에 사용하는 경우에는 일반적으로 병원 에서 나오는 수술환자의 조직을 쓰는 것을 의미하는데, 이때에는 반드시 대학이나 병원의 윤리위원회에 실험목적과 절차 그리고 실험방법을 상세하게 기술하여 신청서를 내고 그 허가를 받은 다 음에 배양을 시작하여야 한다. 이때에 가능하면 환자의 동의서를 얻는 것이 좋다. 미국에서는 최근에 백혈병 환자에서 채취한 골 수종세포를 환자의 동의 없이 사용하였다고 환자가 거액의 손해 배상을 청구한 예가 있다. 수술재료를 사용하는 경우 되도록이면 무균적으로 조직을 취득하도록 노력하여야 한다. 10.1 사람 임파구 Human lym ph oid cells 배양 사람의 혈액은 쉽게 구할 수가 있어서 사람의 염색체 해석 등 의 연구에 쓰인다. 혈액에서 임파구를 분리하고 그것을 파이토해 마글루티 닌 (PHA) 과 콘카나발린 A (ConA) 감은 분열촉진분자mit o g en 와 함께 배양함으로써 임파구가 활성화하여 커다란 핵을 가 진 임 파구 l ymp ho i d cell 가 되 면서 증식분열을 계속한다. 임 파계 는 흉선을 통해서 성숙한 뒤 세포성 면역(종양반응, 이식면역, 지 연성 과민면역 동)을 전담하는 T 세포와 체액성 면역을 전담하는 B 세포의 두 가지로 대별한다.
〈재료〉 1) 주사기와 주사침 2) 50ml 원심튜브 각종파이펫 혈구계산판 3) 임 파구 분리 액 -Fic o ll-Hy pa q u e (Pharmaci a) RPMI 1640 배 양액 우태아 혈청 헤파린액 〈방법〉 1) 20ml 주사기에 헤파린액 0.3ml 를 넣은 뒤 환자 팔에서 혈 액 10ml 롤 채 혈한다. 주사침 을 바꾸어 끼고서 RPMI 10ml 를 흡인한다. 2) 50ml 원심튜브에 Fic o ll-Paq u e 15ml 를 가한 뒤 그 위에 혈액 -RPMI 1640 혼합액 20ml 를 천천히 올려서 충을 만든 다. 3) 저속원심기에서 튜브를 1,600r p m 으로 15 분간 원심분리한 다. 4) F ic oll-Pa que 와 혈액 두 충 사이에 임파구가 모이는데 이 층을 다른 원심듀브에 모우고 RPMI 10ml 를 가한 뒤 1,600 r p m 으로 8 분간 원심분리한다. 가라앉은 세포에 RPMI 10ml 를 가하고 1,600r p m 으로 5 분간 원심분리한다. 가라앉은 세 포에 20% 우태아 혈청을 포함한 RPMI 1640 배양액(이 밖 에 lOOU/ml 페니실린과 lOOµg /m l 스트렙토마이신을 포함) 3ml 정도를 가하여 2Xl06/ml 로 조정한다. 96 혈 멀티웰에 임파 구를 분주하기 전에 혈구계산판을 사용해서 세포수 계산을 한다. 5) 임파구 활성화를 보기 위해서 H3- 티미딘 취득실험을 한다.
이를 위해서는 96 혈 마이크로 테스트 폴레이트의 가로 한 줄 울 쓴다. 1-4 웰에 PHA-M 액 (lOOµg /m l 농도), 5-8 웰에 ConA 액 (lOOµg /m l 농도) 그리고 마지막 9-12 웰에 RPMI 액 0.1ml 를 가한 뒤에 각 웰에 2X106ml 농도의 임파구 0.1ml 를가한다. 6) 3 일간 인큐베이터에서 배양한 뒤에 H3- 티미딘액 (lOµg C i/ ml) 을 0.02ml 씩 첨가하고 16-18 시간 배양을 계속한다. 다음 날, 세 포 하베스터 Cell harves t er 를 써서 세 포를 글라스파이 버필터 위에 수확한다. 필터를 건조시킨 뒤 필터를 한 장씩 액체 신틸레이션 병에 넣고 톨루엔 신틸레이션액을 1ml 첨 가하고 신틸레이션 카운터에서 방사능을 측정한다. 각 네 개 웰의 카운트를 평균화하고 콘트롤의 평균치를 보고서 증식 인덱스 s ti mula ti on i ndex 를 계산한다. 10.2 사람피 부 섬 유아세 포 Human skin fibr oblasts 초대배양 사람의 섬유아세포는 증식성의 세포집단으로 비교적 간단하게 배양할 수 있다. 미생물학, 바이러스학, 유전학, 생화학 등의 여 러 분야에서 광범하게 사용되고 있다. 사람태 아 폐 장 유래 의 이 배 성 섬 유아세 포fet al human dip lo id fi broblas t는 그 분열 횟수가 한정되어서 50 회에서 55 회라는 사 실을 알게 되었고 성인피부 섬유아세포 배양에서도 이 사실이 확 인되었다. 이러한 배양세포의 유한증식성은 종양세포의 무한증식 성에 대조가 되어서 암연구나 노화연구에서 중요한 연구과제가 되어 있다. 〈재료〉 1) 사람 피부(상박팔의 안쪽)
2) 35mm 풀라스틱 페트리딧슈 60mm 플라스틱 페트리딧슈 10ml 원십듀브 각종파이펫 3) 이글 MEM 우태아혈청 겐타마이신/암포테리신 B 〈방법〉 1) 상박팔의 안쪽을 70% 에틸알코올로 소독을 하고 예리한 가 위로 lmm3 의 피부를 잘라내고 이것을 35mm 플라스틱 페트 리딧슈에 옮긴다. 2) 10% 우태아 혈청과 20µg /m l 겐타마이신, 2.5µg /m l 암포 데리신 B 를 포함한 이글 MEM( 배양액)의 소량을 피부편 위 에 떨어뜨린다. 예리한 수술칼 2 개를 교차시키는 돗 사용하 여 피부편을 5-10 개 정도로 자른다. 3) 피부소편을 가볍게 압박할 정도로 유리 커버글라스 (22X22 mm) 를 올려놓는다. (8.1 샌드위치법 참조) 우태아 혈청과 겐 타마이신이 든 배양액을 1ml 정도 첨가하고 페트리딧슈를 인큐베이터로 옮기고 정치배양한다. 배양액을 일주일에 두 번 교환하고 세포가 조직편에서 유출해 나오는 것을 기다린 다. 세포집단이 페트리딧슈 전면을 덮으면 이때에 계대배양 울 한다. 4) 배양액을 버리고 0.02% EDTA-PBS 로 딧슈를 한 번 씻고 0.05% 트립신과 0.0 2 % EDTA 가 들어 있는 PBS 를 넣어서 10 분간 정치하면, 세포가 딧슈에서 벗겨져 나온다. 부유세포 롤 10ml 원심듀브에 넣어서 배양액으로 한 번 씻어낸 다음 앞서 말한 배양액 10ml 를 가하고 세포부유액을 만든다. 세 포수를 계산한 뒤 60mm 풀라스틱 페트리딧슈에 5ml 씩 분주
하고 배양을 계속한다. 주 두 번 배양액 교환을 하되 그때마 다 1 : 4 정도로 페트리딧슈 수를 늘리고 계대배양을 한다. 그립 10-1 은 초대배양한 사람피부 섬유아세포를 사주일 동안 배양한 예를 보이고 있다. 연구계획에서 단일종의 섬유아세포를 쓰는 경우에는 이미 주 세포가 되어 있는 IMR-90 이나 WI-38 주세포를 쓰도록 하 는 것 이 좋다. 이 들은 Americ a n Ty pe Cultu r e Collec ti on 으 로부터 한국의 대리점을 통하여 값싸게 구할 수가 있다.
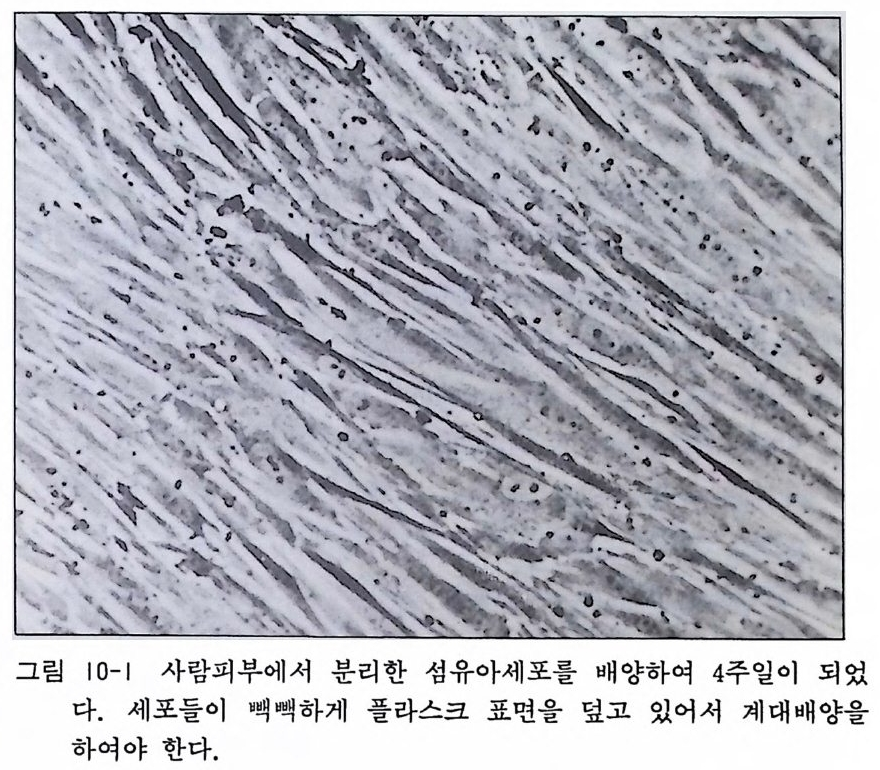 그림 |0-1 사람피부에서 분리한 섬유아세포를 배양하여 4 주일이 되었
그림 |0-1 사람피부에서 분리한 섬유아세포를 배양하여 4 주일이 되었
10.3 사람 뇌 하수체 세 포 Human pitui t ar y cells 초대 배 양 뇌하수체는 성장호르몬, 프로락틴, 부신피질호르몬 ACTH 등
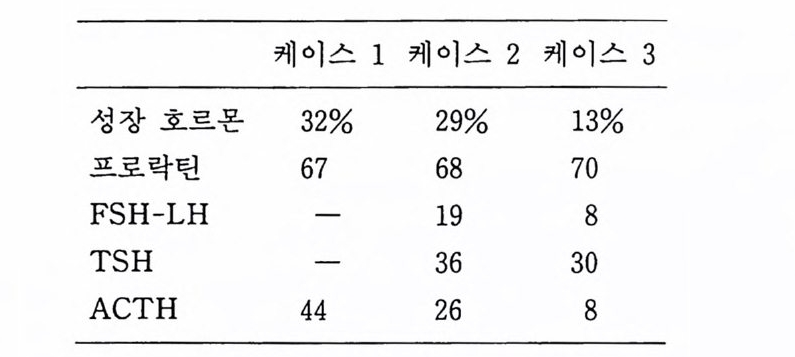
생체의 항상성 유지에 중요한 역할을 하는 호르몬을 생산하고 혈 중으로 분비하고 있다. 이러한 호르몬 생산과 분비의 조절을 연 구함에 있어 뇌하수체의 조직배양은 유력한 모델이 된다. 우리는 수년 전 죽은 지 10 시간 이내 사람의 병리해부시 분리한 뇌하수 체 전영의 조칙배양을 하여 여러 가지 호르몬의 분비를 확인한 바 있다. 여기에 그 방법을 기술한다. 〈재료〉 1) 뇌하수체 조직을 병리해부실에서 가져올 때에 PBS 나 BSS 에 카나마이 신 50µ g /ml 이 나 겐타마이 신 20µ g /ml 이 들어 있 는용기를쓴다. 2) 각종 파이펫 50ml 원심듀브 100mm 유리 페트리딧슈 60mm 풀라스틱 페트리딧슈 40ml 오크릿지 원심튜브 3) CMF-PBS 이글 MEM 우태아 혈청 0.2% 콜라게나제 파콜 Percoll 액 (Pharmaci a) 핸크스 BSS 10 배액 〈방법〉 1) 병리해부에서 얻은 뇌하수체는 카나마이신을 포함한 PBS 가 소량 들은 100mm 유리 페트리딧슈에 옮기고 수술칼 2 개 롤 교차시키는 상태로 작게 찰라낸다. 압박하지 않고 예리하 게 조직을 자른다. 2) 조직편을 원심튜브에 옮긴다.
3) 여분의 CMF-PBS 를 버리고 이글 MEM 에 희석한 0.2% 콜라게나제액 3ml 를 첨가한 뒤 튜브롤 인큐베이터에 옮기고 37 도에서 3 시간 정치한다. 15 분에 한 번씩 튜브를 혼든다. 4) 3 시간 뒤 튜브 바닥에 있는 조직편을 둔 채 콜라게나제액을 걷어서 버린다. 5) 10% 마혈청을 포함한 이글 MEM 액을 5ml 튜브에 첨가하 고 20 번 이상 파이펫팅을 한다• 조직편이 가라앉는 것을 기 다려서 상청액을 걷어서 새 원심듀브에 옮긴다. 6) 배양액 3ml 를 남아 있는 조직편에 첨가하고 파이펫팅을 20 번 이상하여 세포분리를 한다. 이 조작을 한 번 더 되풀이한 다. 7) 세포부유액을 합쳐서 1,000r p m 으로 8 분간 원심분리한다. 가라앉은 세포를 iom 1 핸크스 BSS 에 부유한다. 8) 40ml 오크릿지 원심튜브에 파콜액 9ml, 핸크스 BSS 10 배 액 1ml 를 가하고 여기에 핸크스 BSS 10ml 과 위의 세포부유 액 10ml, 모두 합하여 30ml 의 용액 을 혼합한다. 9) 고속원심분리기에서 15,000r p m 으로 25 분간 원심분리를 한 다. 듀브에 5 층의 농도구배 densit y gr ad i en t가 보인다. 위 에 서부터 1 층은 두명한 핸크스 BSS, 2 층은 죽은 세포와 세포 잔재가 모인 우유색 총, 3 층은 반투명한 세포를 포함한 충이 고, 4 층은 한 줄로 보이는 적혈구 충, 5 층은 바닥이며 세포 가 없는 충이다. 1, 2 층을 버리고 3 층을 튜브에 모은 뒤 (약 15ml 정도) 여기에 30ml 의 핸크스 BSS 를 넣어서 희석하고 1,500r p m 으로 10 분간 원심분리한다. 10) 상청액을 버리고 가라앉은 세포에 10% 우태아 혈청을 포함 한 배양액 3ml 를 가하고 1,000r p m 으로 8 분간 원심분리한 다. 11) 가라앉은 세포에 10% 우태아 혈청, 20µg /m l 겐타마이신, 2.5µg /m l 암포테리신 B 를 포함한 배양액을 8ml 가하고 파이
펫팅을 한 뒤 60mm 패트리딧슈 2 개에 분주한다. 폴리라이 신을 코팅한 12mm 유리나 풀라스틱 커버슬립에 세포를 풀 레이트하면 세포화학 염색이나 전자현미경 검색에 편리하다. 배양액은 일주일에 두 번 교환한다. 저자의 연구실에서는 배 양 20 일에서 45 일 사이에, 커버슬립에 배양한 세포를 호르몬 면역 화학염색을 하여 각 세포형을 동정i den tifi ca ti on 하였는 데 결과는 다음과 같다.
 케이스 1 케이스 2 케이스 3
케이스 1 케이스 2 케이스 3
배양 뇌하수체 세포의 면역화학 염색과 전자현미경 결과는 그 림 10-2 와 10-3 에서 볼 수 있다.
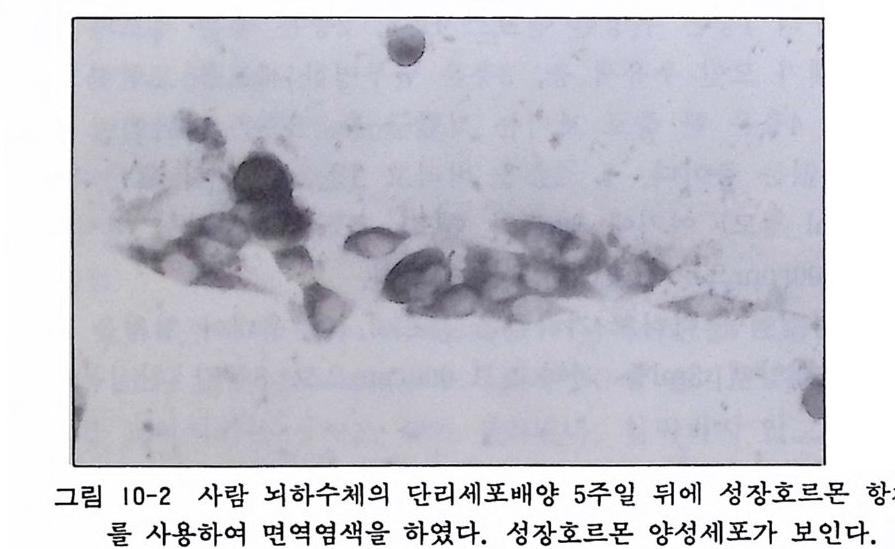 그림 10-2 사람 뇌하수체의 단리세포배양 5 주일 뒤에 성장호르몬 항체
그림 10-2 사람 뇌하수체의 단리세포배양 5 주일 뒤에 성장호르몬 항체
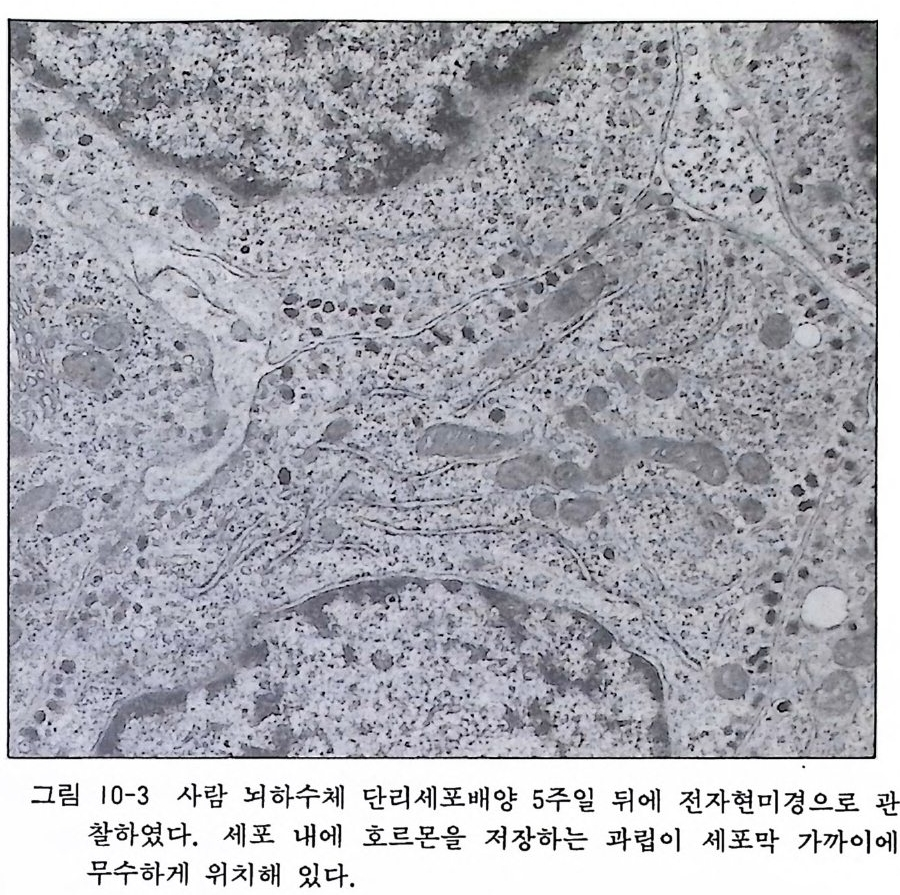 그림 10-3 사람 뇌하수체 단리세포배양 5 주일 뒤에 전자현미경으로 관
그림 10-3 사람 뇌하수체 단리세포배양 5 주일 뒤에 전자현미경으로 관
10.4 사람 암세포의 초대배양 의학연구에서 실험동물을 사용하는 것은, 사람을 생체 레벨에 서 실험할 수가 없기 때문이나, 약품의 독성 스크리닝, 방사선 감수성, 종양면역성 등의 연구를 하는 경우 마지막에 가서는 사 람의 조직이나 세포에서 실험하여야 하므로 사람 유래의 세포가 중요한 의미를 갖게 된다. 또한 사람의 세포를 사용해서 하는 연 구는 다론 실험동물 세포를 사용하는 경우와 달리 그 실험결과를 사람의 병의 전단과 치료에 응용할 수 있는 커다란 이점이 있다.
사람 종양(암)세포 배양은 미국에서도 500 종 이상의 배양 주세포 가 등록되어 있으며 그 수가 장래에 증가할 것이 기대된다. 우리 나라에서도 서울의대 박재감 박사가 사람 대장암에서 분리한 주 세포를 ATCC 에 등록하고 있는 것을 볼 수가 있다. 사람 종양 세포 유래의 주세포를 사용하여 연구하는 경우 두 가지 연구방향 울 생각할 수가 있다. 하나는 비교적 분화된 종양 주세포를 정상 세포의 모델로 간주하고 종양세포의 기능을 정밀하게 연구함으로 써 그 종양세포의 근간이 되었던 정상세포의 분화기능을 알고자 하는 것이다. 다른 하나는 종양세포라는 접에서 종양의 특징, 악 성화의 기전 그리고 치료법의 검색, 화학약품의 스크리닝, 종양 면역 등의 연구에 응용하는 것이다. 지금까지 각종 종양의 배양과 주세포화에 성공한 예가 많기는 하나 아직도 배양하지 못하는 종양이 남아 있어서 초대배양의 기 술, 배양액의 조성, 배양기구의 개선 등 개량되어야 할 것이 많 이 남아 있다. 이곳에서는 사람 간암세포 초대배양을 예로 들어서 그 배양기 술을 간략히 적는다. 〈재료〉 l) 종양조직편 : 수술실에서 수술재료를 가져오되, PBS 나 BSS 에 카나마이신 50µ g /ml 이나 겐타마이신 20µg /m l 들어 있는 용기를 쓴다. 2) 각종 파이펫 50ml 원심튜브 100mm 유리 페트리딧슈 60mm 풀라스틱 페트리딧슈 35mm 풀라스틱 페트리딧슈 조직 체 (tiss ue sie v e, 시그마) 40 과 80 메시 스크린 (시그마)
러버폴리스맨 3) CMF-PBS 달백코 MEM 우태아 혈청 겐타마이신 〈 방법 〉 1) 100mm 유리 페트리 딧슈에 CMF-PBS 5ml 를 넣고 여 기 에 조직편을 넣는다. 핀셋과 수술칼을 사용하여 지방조직, 결체 조직을 잘라내고 또한 네크로틱한 조직도 잘라낸다. 2) 조직편을 3X 3 X3mm3 정도로 찰라내고, 파이펫팅을 하여 조직편을 씻는다 3) 2 개의 수술칼을 교차시키는 상태로 조칙편을 되는 대로 작 게 찰라낸다. 압박하지 않고 예리하게 조직울 자르는 것이 그 요령이다. 4) 100mm 유리 페트리딧슈에 CMF-PBS 10ml 를 넣고 그 위 에 스데인리스 스틸 스크린을 설치한 조칙체 (tiss ue sie v e, 시 그마)를 놓는다. 먼저 40 메시 스크린 (0 . 38mm 구멍크기), 그 뗄에 80 메시 느린 (0.2mm 구멍크기)을 써서 느맣게 자 른 조직편을 갈아 내린다. 이때 주사기의 피스톤을 써서 조 직을 간다 (12-1 을 참고할 것). 5) 50ml 원심튜브에 CMF-PBS 와 기계적으로 분리된 세포를 모아서 1,200r p m 으로 8 분간 원심분리를 한다. 6) 가라앉은 세포를 달백코 MEM 에 부유시키고 다시 1,2 0 0 r p m 으로 8 분간 원심분리를 한다. 7) 가라앉은 세포를 20ml 배양액 (10% 우태아 혈청과 겐타마이 신을 포함한 달백코 MEM) 에 부유시킨 뒤 5 개의 60mm 페트 리딧슈(미리 폴리라이신 코팅을 해둔다)에 4ml 씩 분주한다. 8) 배양개시 3-4 일 동안 이산화탄소 인큐베이터에서 정치한다.
9) 일주일에서 열흘 지나서 상피상 세포가 증식하게 되면 일주 일에 두 번 배양액을 교환한다. 열흘이 지나면 섬유아세포가 우월해지는데, 암세포는 모자이크처럼 자라나는 데 비해서 섬유아세포는 방추형태로 넓게 퍼져나오므로, 그 형태구별이 간단하다. 현미경을 보면서 섬유아세포를 러버폴리스맨으로 긁어내어서 암세포 콜로니를 남긴다. 10) 콜로니를 분리하면 암세포의 순수배양이 가능하다. 11) 조직배양 현미경 아래서 콜로니 colon y를 선택하고 페트리 딧슈 믿을 마카펜으로 표식을 한다. 배양액을 버리고 콜로니 가 있는 부분을 가운데로 하고 실리콘그리스를 바론 유리 실 린더 (직경 10mm, 높이 8mm) 를 세운다. 0.05% 트립산과 0 . 02% EDTA 가 들어 있는 CMF-PBS 를 0 . 3ml 실 린더 안 에 주입하고, 5-10 분 뒤에 분리되는 세포를 모아서 35mm 페트리딧슈에서 배양한다. 배양액은 앞서 말한 10% 우태아 혈청을 포함한 달백코 MEM 이다(배양을 계속하면 암세포가 증식하여 순수배양이 가능하게 된다).
제 11 장 수립세포계 앞서 기술하였듯이 생체에서 분리한 초대배양 세포의 대부분이 계 대 배 양 도중에 증식 이 중단되는데 (유한증식 fini t e grow th) , 이 둘 정상세포에 유전학적인 조작을 하면 무한히 증식하게 할 수 있 어 서 , 이 룰 수립 세 포계 esta b li sh ed cell li ne 라 하며 , 이 들 세 포 는 무한증식 inf i ni t e g rowth의 능력 을 가지 게 된다. 수립 세포계 중에서 그 성질이 형태학, 생화학, 유전학적으로 명백하게 연구 되어 있는 것을 세포주 cell s t ra i n 라 부른다. 수립세포계는 안정 된 증식능력을 가지고 있으며, 계대배양을 쉽게 할 수 있어서 대 량배양에 있어서도 문제가 없다. 그러나 수립세포계 세포들은 염 색체가 이수성을 가지고 있어서 연구목적에 따라서 주의해서 사 용하여야 한다. 11 .1 대표적인 세포주 이름과 그 특징 아래에 대표적인 세포주의 특칭과 그 형상을 열거한다. 이들 세 포주는 Flow, GIBCO, MA bio p ro ducts 등의 배 양기 구, 배 양 액 을 판매 하는 회 사에 서 나 Americ a n Ty pe Cultu re Collecti on (비영리 연구소)에서 구입할 수가 있다. 이때에 플라스크에 살아 있는 세포나 바이알에 동결되어 있는 세포의 두 가지 방법으로 살 수가 있다. 이 연구소의 주소, 전화번호, 팩시밀리번호는 다 음과 같다. Ameri ca n Typ e Cultu r e Collecti on
12301 Parklawn Dr ive Rockvil le , Maryl a nd 20852 U.S .A . 전화 : (301) 231-5585 FAX : (301) 231-58261 l) 세포명 : L929 유래 : C3H 마우스 형상 : 섬유아세포 창시 자 : Sta n fo r d, K. (J. Nat. Cancer Inst. 9, 229, 1948) 특징 : L 세포에서 분리된 클론으로서 세포유전학, 영양학, 대사, 효소학 등에서 많이 사용된다. 유전적 안정성 이 없음이 결점 (그림 11-1) .
 그림 | 1-1 L-929 마우스 섬유아세포
그림 | 1-1 L-929 마우스 섬유아세포
2) 세포명 : 3T3 Swi ss albin o 유래 : 스위스 알비노 마우스태 아 형상 : 섬유아세포
창시자 : Todaro, G.& Green, H.(J . Cell Biol . 17, 299, 1963) 특징 : 최초로 분리된 3T3 섬유아세포로서 형질전환t rans for mati on 연구, 바이 러스감염 연구에 사용된다(그림 11-2) .
 그림 11-2 스위스 알비노 3T3 섬유아세포
그림 11-2 스위스 알비노 3T3 섬유아세포
3) 세포명 : Vero 유래 : 원숭이 신장 형상 : 상피세포 창시 자 : Yasumura, Y.& Kawakit a, Y. (Arch, Gen. Vi ru s 27, 379, 1969) 특징 : 바이러스감영 연구, 백신연구 등에서 많이 사용된다 (그림 11-3). 4) 세포명 : P3-NS1/l-Ag 4 -1 유래 : 마우스 골수종 형상 : 임 파구세포
 .•'• .
.•'• .
창 시 자 : Kohler, G. & Mi lste in , C. (Eur. J. Immun. 6, 292, 1976) . 특징 : MOPC-21 골수종 세포주에서 분리된 주세포로서 모 노클론 항체 생산, 하이브리도마 작성에 사용된다(그 림 11-4).
 ••.•• •• ,. :, ,- \ : .. 型. .:r. .. 틀 : -스. .. ?. . .;.. ‘.一 ;• ,•.. :t•. .•:. . ~• ~: r.• .•.‘.;~ · ? ••:••s ) .•.b . ..- ! .. ’. ‘_, ·o :`. ;•’'- •'. t ··.•`, ‘-: . . 4 ' ? · ‘.•노; ~ _ .f , ·. ‘ , ;( • .· . .. • .`. ••.“.-:J • .-•` •. ,. ~`` ' ` » . • 뺀. .-.•.•
••.•• •• ,. :, ,- \ : .. 型. .:r. .. 틀 : -스. .. ?. . .;.. ‘.一 ;• ,•.. :t•. .•:. . ~• ~: r.• .•.‘.;~ · ? ••:••s ) .•.b . ..- ! .. ’. ‘_, ·o :`. ;•’'- •'. t ··.•`, ‘-: . . 4 ' ? · ‘.•노; ~ _ .f , ·. ‘ , ;( • .· . .. • .`. ••.“.-:J • .-•` •. ,. ~`` ' ` » . • 뺀. .-.•.•
5) 세포명 : WI-3 8 유래 : 사람태아 폐장 형상 : 섬유아세포 창시 자 : Hay flick , L. (Exp . Cell Res. 37, 614, 1965) 특징 : 정상 이배체세포로서 50 세대 정도의 계대배양이 가능 하며 노화연구에서 많이 쓰인다. 배가시간은 24 시간 이며 다수의 바이러스 종류의 감영이 가능하다(그림 11-5) .
 그림 | 1-5 WI-38 사람 섭유아세포
그림 | 1-5 WI-38 사람 섭유아세포
6) 세포명 : L-132 유래 : 사람태아 폐장 형상 : 섬유아세포 창시 자 : Davis , E. (Fed. Proc. 19, 386, 1960) 특징 : 엔테로바이러스 en t erov i rus 분리 등에 사용한다(그립 11-6) . 7) 세포명 : BeWo 유래 : 사람 융모막암 형상 : 상피세포 창시 자 : Pati llo, R. & Gey, G. (Cancer Res, 28, 1231, 1968) 특징 : 최초로 분리된 사람 내분비세포계로서 HCG, 에스트 라다이올, 프로게스테론 등 각종 태반 호르몬을 분비 한다 (그림 11-7) .
 그림 | 1-6 L-132 사람 섬유아세포
그림 | 1-6 L-132 사람 섬유아세포
8) 세포명 : HeLa 유래 : 사람 자궁암 형상 : 상피세포 창시 자 : Gey, G. (J. Exp . Med. 97, 695, 1953) 특징 : 사람 암세포주로서 최초로 분리되었다. 증식성이 높 고 감영바이러스 종류가 많아서 널리 사용되고 있다 (그립 11-8).
 그림 11-8 HeLa 사람 자궁암 유래 세포
그림 11-8 HeLa 사람 자궁암 유래 세포
9) 세포명 : Neuro 2a 유래 : 마우스 신경아세포종 형상:다극 형 세포 창시 자 : Klebe, R. & Ruddle, F. (J. Cell Bi ol . 43, 69A, 1969) 특징 : 자연발생한 신경아세포종인 C-1300 를 마우스에서 분 리하고 조직배양에서 클론 배양하였다. 신경과학에서 많이 쓰이고 있다(그림 11-9).
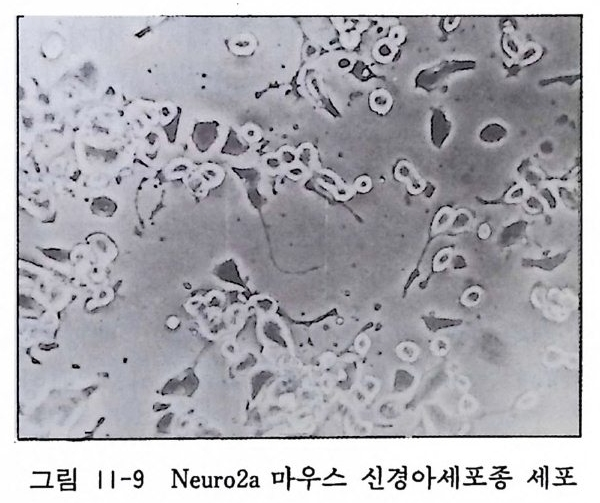 .. 'i.\ ^A` ··、 -` / ‘·.`( - .、》會 r. /.. 4 I 길 · . .
.. 'i.\ ^A` ··、 -` / ‘·.`( - .、》會 r. /.. 4 I 길 · . .
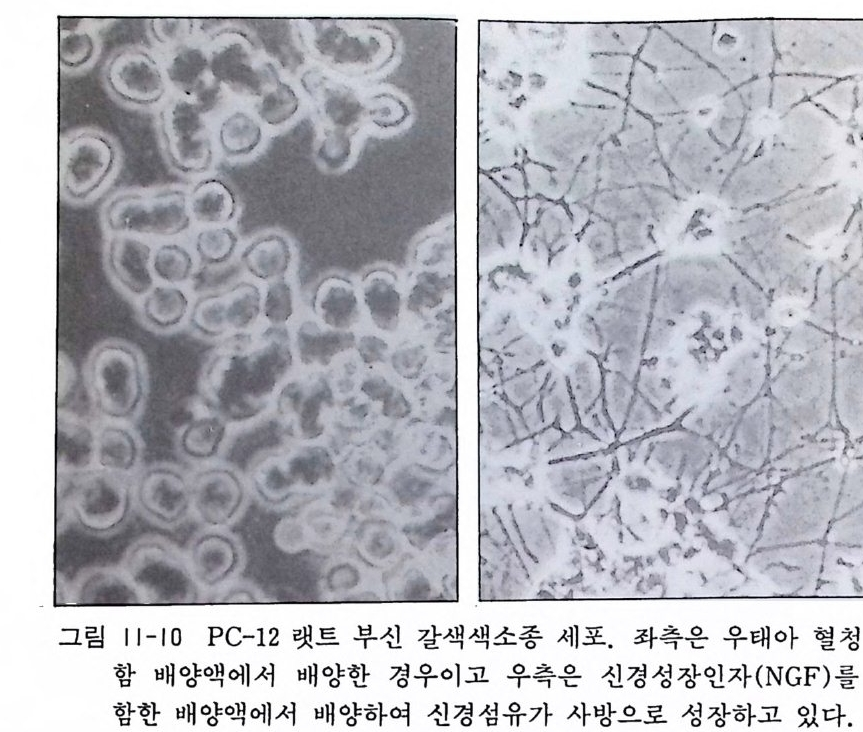 그림 I 1-10 PC-12 랫트 부신 갈색색소종 세포. 좌측은 우태아 혈청 포
그림 I 1-10 PC-12 랫트 부신 갈색색소종 세포. 좌측은 우태아 혈청 포
10) 세포명 : PC-12 유래 : 랫트 부신갈색색소종 형상 : 원형세포 창시 자 : Ti sc hler, G. & Green, L. (Proc.Nat. A cad.Sci. 73, 2424, 1976) . 특징 : NGF( 신경성장인자)로 인해서 신경세포로 분화하며 카테콜아민 신경전달물질을 분비한다(그림 11-10). 11.2 데라토카시노마 주세포와 그 배양 주세포의 배양에는 그 주세포에 적합한 배양액과 가스농도가 있는데, 아래에 그 예로서 테라토카시노마의 배양과 그 특징을 열거한다. 데라토카시노마t era t ocarc i noma( 악성 기형종)는 사람이나 마우
스 생식기관에 발생하는 악성 종양이다. 이 종양의 근간세포는 배 아성 암종세 포 embr y onal carci no ma cell 라 불리 우는 미 분화 세포이다. 이 EC 세포는 무한중식성과 종양형성 능력을 가진 악 성 암세포인데 여러 가지 종류의 세포로 분화할 수 있는 다분화 능력을 가전 점에서 초기배에서 보는 미분화 세포와 극히 닮은 성질을 가전다. EC 세포는 대량 배양할 수가 있고 배양조건을 바 꿈으로서 초기 배아발생처럼 여러 가지 방향으로 분화시킬 수가 있다는 특칭이 있다. EC 세포의 세포주 중에는 분화능력이 저하 되어서 보통의 배양조건 아래서는 분화하지 않고, 레티논산 re ti noic a ci d 이나 디메칠 설폭시미드 d i me thy l sulfo x im i de , DMSO 같은 화학물질에 의해서 비교적 짧은 기간 동안에 분화를 유도할 수가 있다. 〈 재료 〉 1) P19 세포주 : Americ a n Ty pe Cult ur e Collec ti on 에서 살 수 가있다. 2) Reti no ic a ci d( 시그마) 10-4M 농도로 에틸 알코올에 녹이고 이주일 안에 사용한다. Di bu ty ry l cy c lic AMP (시 그마) 10-4M 농도로 PBS 에 녹이 고 여과멸균한 뒤 4 도에서 보존한다. Isobuty ryl meth yl xanth ine (시 그마) 10-2M 농도로 PBS 에 녹이고 여과멸균한 뒤 4 도에서 보존한다. 3) 각종 파이펫, 풀라스틱 페트리딧슈 〈방법〉 1) P19 세포는 0.1% 첼라틴을 바론 플라스틱 딧슈에서 배양 하며 매일 배양액을 교환한다. 배양액은 10% 우태아 혈청을 포함한 달백코 MEM 액이다. 계대배양은 3 일에 한 번씩 트 립신에 의해서 한다(그립 11-11).
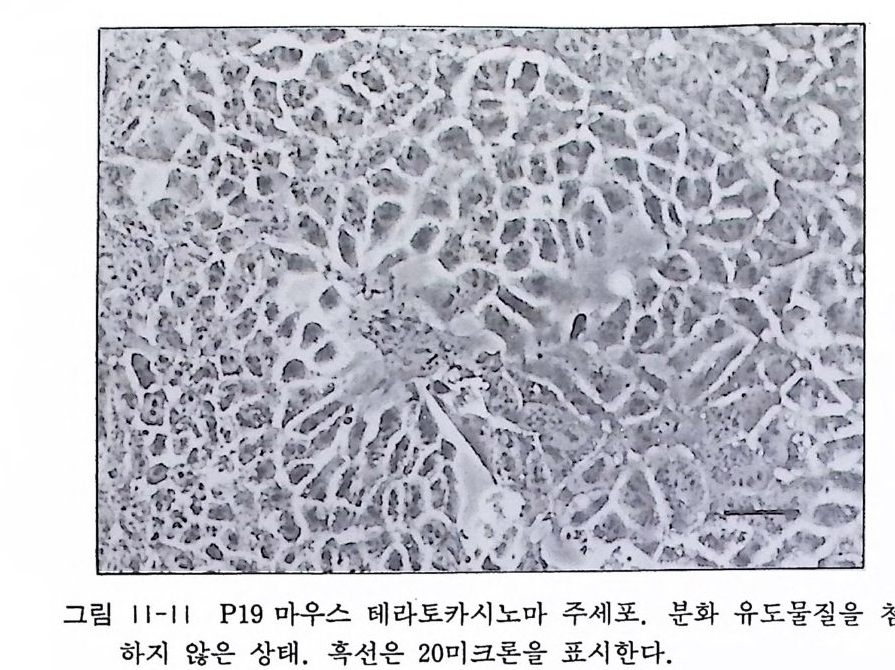 ..
..
2) 계대배양은 배양액을 버린 뒤 0.02% EDTA 를 포함한 CMF - PBS 로 한 번 씻은 뒤, 0.0 5 % 트립신과 0. 02 % EDTA 를 포함한 CMF-PBS 를 약간 가해서 37 도 인큐베이 터에서 5 분간 보온한다. 트립신 -EDTA-PBS 액을 조심스럽 게 빨아서 버린 뒤, 신선한 배양액 4ml 정도를 가하고 파이 펫팅을 하여 세포를 분리한다. 60mm 직경 플라스틱 딧슈에 5X105 농도의 세포를 분주한다. 3) Pl9 세포를 5X105 세포농도로 풀라스틱 딧슈에 분주하고 10% 우태아 혈청을 포함한 달백코 MEM 배양액에 5Xl0 一 7M 레 티 논산, 10-4M DBcAMP, 10-4M IBMX 중 한 가지 를 첨 가한다. 배양액은 2 일에 한 번씩 교환하는데, 일주일 뒤에는 Pl9 세포가 모두 내배영 세포로 분화된다. 레티논산에서 배 양한 세포는 신경세포로 분화한다. 4) 계대배양할 때에 젤라틴을 바론 딧슈 대신에 박테리아용 딧
 ...
...
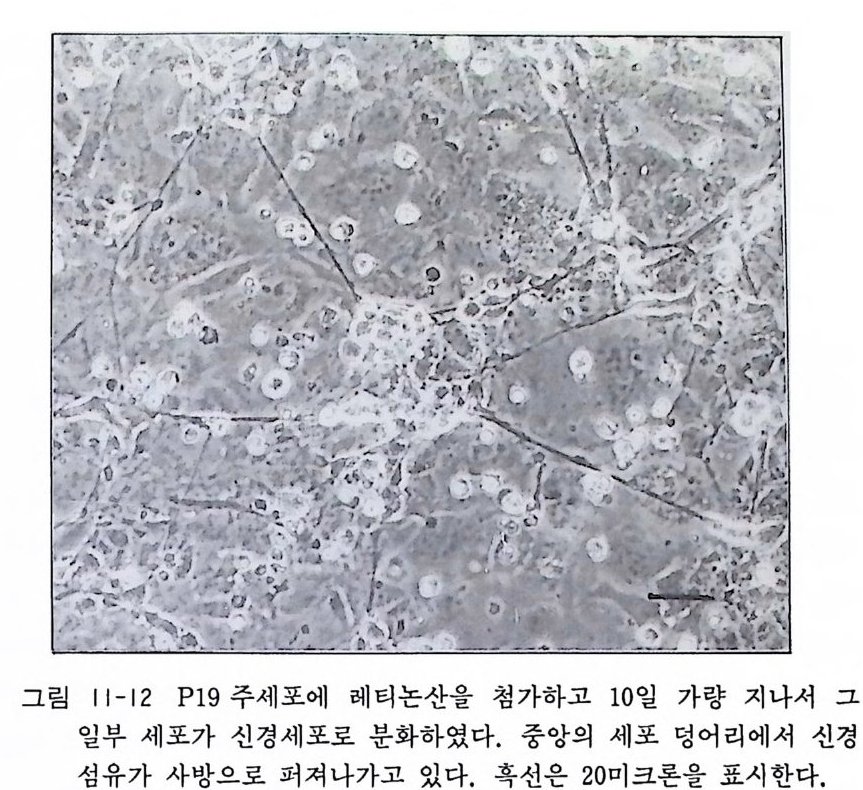
슈에 세 포를 분주하면 세 포가 20-30 개 가량 들어 있는 세포 크럼프(덩어리)를 만든다. 이 세포덩어리는 마우스 정상 배발생에 있어서 수정 후 4-5 일 에 해당되는 배아가 된다(그립 11-11, 11-12) .
제 12 장 세포분리법 조직을 구성하는 세포군과, 유리-풀라스틱 페트리딧슈나 플라 스크 표면에서 자라는 세포는 콜라겐, 뮤코프로테인 등에 의해서 상호 간에 혹은 딧슈 표면에 단단히 부착하고 있으며 이러한 부 착성은 칼슘과 마그네슘에 의해서 좌우되고 있다. 그러므로 이들 세포집단을 하나씩 따로 분리하려면 여러 가지 단백질분해효소와 칼슘과 마그네슘을 제거하는 금속제거제 chela t or 를 동시에 사용 하여야 한다. 단백질분해효소에는 여러 종류가 있는데 트립신 try p s in , 프로나아제 pro nase, 콜라게 나제 collag e nase, 디 스파제 dis p a se, 파파인p a p a i n, 판크레아틴, 에스테라제가 여기에 속한 다. 12.1 트립신 과거에는 소나 돼지 췌장의 아세톤 분말을 사용하여 조직을 분 해하였는데, 이러한 제품은 트립신 1 : 250 이라 불리웠고 여기에 는 트립신 외에도 키모트립신 chy mo tryp s i n 과 엘라스타제 elas t ase 를 포함하고 있어서 조직분해에 특히 효과가 있었다. 따라서 결정화한 순수 트립신은 이러한 비정제 트립신 1 : 250 에 비해서 효과가 낮게 마련이다. 장시간에 걸친 트립신 처리는 세포를 상 하게 하므로 알맞은 시간이 중요하다. 트립신 처리 뒤에는 트립 신 억 제 제 tryps in i nh i b it or 를 쓰는 것 이 중요하다. 트립 신 처 리 직후에 혈청이나 혈청이 들어 있는 배양액으로 트립신 활성을 억
제하는 것은, 혈청 속에 천연 억제작용이 있기 때문이다. 최근에 는 각 회사가 2.5% 트립신을 무균화하여 판매하고 있으므로 이 것을 CMF-PBS 나 CMF-BSS 에 10 배로 희 석 해서 조직 분해 , 세 포단리에 사용한다. 플라스크나 딧슈에 부착한 세포를 분리하고 자 할 때에는 0.1% 에서 0.05% 농도를 CMF-PBS 에 녹여서 사 용한다. 트립신에 의한 세포장해가 커지면 조직이 풀과 같이 점착성이 증가하여 세포분리가 불가능하므로 이러한 경우에는 DNase 를 25-lOOµ g /ml 의 최종농도로 트립신액에 첨가하면 세포분리가 용 이하다. 이것은 트립신이 세포독성을 보여서 죽은 세포에서 DNA 가 분리되어 이것이 점착성을 증가시키기 때문이다. 12.2 프로나아제 프로나아제는 토양방선균인 S t rep to my ces gris eus 에서 분리한 단 백질분해효소이며 학자에 따라서는 트립신보다 독성이 낮다고 그 사용을 권하는 수가 있다. 역시 CMF-PBS 에 0.25% 나 0.1% 농 도로 녹여서 여과살균하여 사용한다. 12.3 콜라게나제 결체조직을 많이 포함한 종양조직이나 간, 폐 등의 조직에서 단리세포를 얻고자 할 때에는 콜라게나제가 효력이 있다. 트립신 과 달리 세포독성이 낮고 3 시간 넘는 처리에도 세포가 상처를 입 지 않아서 많은 학자가 추천하고 있다• 우리들은 1978 년에 세계 에서 처음으로 성숙한 사람의 신경세포를 죽은 지 10 시간이 되는 사람의 신경조직에서 분리하고 두 달 넘게 배양을 하였는데, 이
것은 트립신을 쓰지 않고 콜라게나제를 사용하였기 때문이다. 워 싱턴 Wo rt h i n gt on Chem i cal 이나 시그마에서 판매하고 있는 콜라 게나제는 정제되어 있지 않아서 트립신, 키모트립신 등을 소량 포함하고 있어 오히려 조직분해에 효과적이다. 박테리아에서 분 리한 콜라게나제는 혈청에 의해서 억제되지 않기 때문에 콜라게 나제는 생리적인 조건하에 혈청포함 배양액에 0.1-0.25% 농도로 쓸 수가 있다. 이것은 100-250 단위 /ml 의 농도가 된다. 콜라게나 제 억제를 하려면 세 번 이상 배양액에서 씻어내면 된다. 12.4 디스파제 Bacil lu s 균에서 분리한 중성 단백질분해효소로서 혈청이나 칼 슘을 포함한 배양액 속에서도 효력이 있어서 트립신과 달리 세포 에 대한 독성이 적고 세포분산에 적합하다. 1,000 단위 /ml 의 농 도로 사용할 수 있다. 일본의 고도주정에서 디스파제라 해서 발 매하고 시그마에서는 프로데아제 Pro t ease 라 해서 판매하고 있다. 12.5 파파인 파파야 과일에서 분리되는 식물성 단백질분해효소로서, 이것 역시 트립신에 비교하여 독성이 적어서 트립신을 대신하는 세포 단리에 적합한 효소이다. 파파인을 활성화하려면 아미노산인 시 스데인 c y s t e i ne 이 존재하여야 하며 파파인 8-10 단위 /ml 의 농도로 이글 MEM 이나 핸크스 BSS 에 녹이고 여기에 시스데인을 4mg / ml 의 농도로 첨가한 뒤 여과멸균하여 사용한다. 우리들은 다른 방법으로는 대단히 곤란하던 성숙한 사람의 망 막 신경세포의 분리배양을 파파인을 사용함으로써 성공시켰으므
로 그 사용을 추천한다. 워싱턴회사에서는 무균화하여 조직배양 용으로 제품화한 파파인을 판매하고 있다. 12.6 금속제거제 금속제 거 제 chela t or 인 EDTA (dia m i no eth a ne tet r a aceti c acid sodiu m salt) 는 금속인 칼슘이 나 마그네 슘울 배 양환경 에 서 제 거 함으로써 세포분리를 돕는다. EDTA 는 일반적으로 칼슘-마그네 슘제 거 PBS (CMF-PBS) 에 2% 용액 으로 스톡울 만들고 사용시 에 100 배로 희석하여 0.02% 용액으로 사용한다. EDTA 는 트립신 과 함께 쓰는 것이 보통이다. 12.7 기계적 세포분리 그림 12-1 에서 보는 바와 같이 스테인리스 스틸 메시를 조직체
 그림 12-1 조직의 기계적 분리에 사용되는 스테인리스 스틸 각종 메시
그림 12-1 조직의 기계적 분리에 사용되는 스테인리스 스틸 각종 메시
S i eve 로 만들어서, 아주 작게 자른 조직편을 그 위에 올려놓고 주사기 피스돈이나 유리봉으로 갈아 내리는 기계적 세포분리 mechanic a l iso lati on 가 있 다. 메 시 사 이 즈 는 40 (0 . 38mm) , 50 (0 . 28mm) , 60 (0 . 23mm) , 80 (0 .19mm) , 100 (0 .14mm) , 150(0.lOmm), 200(0.074mm) 이 있으며 여러 가지 메시의 콤비네 이션으로 조직을 작게 분리할 수 있다. 암조직 배양의 경우에는 40 과 100 메시를 차례로 사용하면 된다. 최근에는 20, 40, 100, 150 미크론 구멍크기의 나일론 메시를 적당한 크기로 잘라내어 봉 지형으로 만든 다음 여기에서 세포를 기계적으로 분리하기도 한 다. 배양세포를 페트리딧슈나 풀라스크에서 분리하여 계대배양을 한다든가, 생화학적인 혹은 약리 독성학적인 실험을 위하여 신속 하게 세포를 분리하고자 할 때에는 러버풀리스맨 rubber po li ce- man 이나 스크레이퍼 scra p er 를 사용하여 문자 그대로 막처럼 퍼 져 있는 세포집단을 긁어낼 수가 있다. 각 조직배양기구 회사에 서 여러 가지 모양의 스크레이퍼를 판매하고 있어서 편리하다.
제 13 장 세포기질과 부착인자 일반적으로 세포주 세포는 부유배양을 할 수 있는 데 비해 초 대배양 세포들은 표면을 가전 곳에서 성장을 잘하게 마련이다. 이 때문에 플라스크, 페트리딧슈, 커버글라스를 사용하는데, 이 때 이러한 배양기구 표면을 가공하여 세포가 잘 부착하도록 하는 것이 중요하다. 시판되고 있는 풀라스틱 풀라스크, 페트리딧슈에 는 가공이 되어 세포가 부착하기 쉽게 되어 있는데, 제작회사들 이 기업비밀이라 하여 그 정체를 말하지 않아 어떤 가공을 하고 있는지 확실하지는 않다. 세포는 다른 세포와 그 표면에 있는 분자를 통해서 접촉을 하 고 여러 가지 접합형식을 가지게 된다. 그 예로서 ga p jun c tion , tigh t jun cti on , syn ap tic jun cti on 등이 있다. 세 포가 세 포외 환 경 과 만나게 되 면 그 곳에 는 세 포의 기 질 ex t racellular ma t r ix이 있다. 이 세포의기질은 초기발생에 특히 중요한 역할을 갖게 되 는데 세포와 세포의기질의 상호작용을 통해서 조직구축ti ssue arch i- t ec t ure 이 나 형 태 발생 mor p hog enes i s 이 성 취 되는 것 이 다. 1980 년 대에 세포외기질의 대요가 알려지게 되었는데 세포의기질의 중요 한 것으로는 콜라겐 colla g en 과 라미닌 lam i n i n, 파이브로넥틴 fibr onecti n 등의 당단백 질g l y co p ro t e i ns 이 있다. 이 러 한 세 포의 기질은 각종 세포들에 의해서 생산되고 세포 밖으로 분비되어 축 적 이 된다. 이 밖에 도 콘드로넥 틴 chondronec ti n, 트롬보스폰딘 thro mbospo ndin 등의 세 포의 기 질이 있으나 그 구조나 상태 가 분명하지 않다.
13.1 콜라겐 콜라겐은 섬유아세포가 만드는 단백질로서 세 개의 줄이 나선 형으로 서로 꼬여 섬유형 혹은 시트형으로 되어 있어서 세포 밖 에서 축적이 된다. 섬유성으로 구성된 콜라겐은 세포 밖에 있으 면서 조칙구성의 근간이 된다. 콜라겐은 부착기능을 가지고 있어 서 이것이 세포성장, 분화, 형태변화에 크게 영향을 준다. 13.1. 1 콜라겐 I(I 형 콜라겐) 피부, 뼈, 근육 그밖의 결체 조직에 많이 있고 조칙배양에서 가장 많이 쓰이는 세포기질이다. 근육세포, 신경세포, 간세포, 심장세포, 췌장세포 등 여러 조칙과 세포에 적절한 기질이다. 조 칙배양에서 쓰이는 콜라겐 1 은 랫트 꼬리에서 분리하여 0.1% 빙 초산액에 녹여서 사용한다. 13.1. 2 콜라겐 IV(IV 형 콜라겐) 모든 조직의 기 저 막 Basemen t membrane 의 중요한 구성 성분인 단백질이며 세포외기질에 물리적인 안정성을 갖도록 하는 것이 콜라겐 IV 라 생각되고 있다. 피부각질세포, 간세포, 혈관내피 세포, 암세포에서 콜라겐 IV 와의 집착성이 높다. 콜라겐 IV 의 생 물적 역할은 아직도 분명치 않은 점이 많다. 마우스 육종 Eng el breth -H olm-Swarm Sarcoma 에서 분리 되는 제품이 Flow, GIBCO, Sig ma 등의 회사에서 판매되고 있다. 〈방법〉 1) 콜라겐 IV 분말을 0.25% 초산수용액에 녹인다 2) 배양 페트리딧슈나 커버글라스 표면을 콜라겐 IV 액 5-lOµg /
cm 떡 농도로 덮고 실온에서 3 시간, 4 도에서 하룻밤 방치한 다. 3) 여분의 콜라겐을 제거하고 실온에서 건조시킨다. 4) 콜라겐액의 무균화가 안 된 경우에는 건조시킨 뒤 70% 에 틸알코올에 담가서 살균하고 다시 건조시 킨다. 13.1. 3 콜라겐 I 분리 법 콜라겐 l 은 쥐 (랫트) 꼬리에서 분리한다. 그 분리법은 다음과 같다. 〈 재료 〉 1) 성장 쥐 꼬리 2) 70% 알코올 3) 0 .1% 빙초산액 (오토클레 이브로 무균화한다. ) 4) 가위 , 연골도, 핀셋 5) 시험관, 원심분리 튜브, 페트리딧슈 〈 방법 〉 1) 쥐꼬리를 비누로 간단히 씻는다. 2) 70% 알코올에서 5 분간 소독한다. 이 후부터 무균조작이 된 다. 3) 꼬리를 150mm 페트리딧슈에 놓은 다음 연골도를 써서 꼬 리 끝에서부터 1cm 간격으로 피부를 철개한다. 윗방향으로 꼬리 끝을 끌어올리면 은빛으로 된 콜라겐 섬유가 갇이 따라 올라온다. 이를 절단하여 다른 집시에 들어 있는 0.1% 빙초 산액에 담근다. 4) 계속하여 꼬리를 절단하고 콜라겐 섬유를 모은다. 5) 한 마리의 꼬리에서 나온 콜라겐 (10 g 정도)을 100ml 빙초산
액이 든 병에 옮긴 다음 냉장실 (4 도)에서 마그네틱스터러를 써서 24 시간 동안 돌린다. 6) 원심분리 튜브에 걸쭉하고 점도가 높은 액을 넣어 2,000 r p m 으로 20 분간 원십분리한다. 7) 상청액을 다른 병에 옮기고 4 도에서 저장한다. 약 4 개월 가 량 유용하다. 13.1. 4 콜라겐 코팅 (건조) 콜라겐 코팅은 두 가지 방법으로 만들 수 있다. 하나는 콜라겐 원액을 10 배로 무균증류수에 희석하고 접시나 커버글라스에 올려 놓고 여분을 빨아올린다. 이것을 하루나 이틀 실온에서 건조시킨 다. 이를 건조 콜라겐이라 한다. 이 건조 콜라겐 위에 세포부유 액을 울려놓으면 세포배양이 시작된다. 13.1.5 콜라겐 코팅 (습성) 두번째 방법은 다음과 같이 하는데, 이를 습성 콜라겐 코팅 Wet collag e n coa ti n g이 라 한다. 〈방법〉 1) 콜라겐 원액을 커버글라스나 페트리딧슈 표면을 덮을 수 있 도록 코팅을 한다. 2) 다른 페트리딧슈 뚜껑에 여과지(필터페이퍼)를 부착데이프 로 부착시키고 그 여과지에 1-2ml 의 암모니아수를 적시고 콜라겐이 도포된 커버글라스나 페트리딧슈를 덮는다. 3) 실온에서 10 분간 정치한 뒤 암모니아 노출을 중지하고 콜라 겐 도포 딧슈나 커버글라스를 무균증류수로 5 분씩 세 번 씻 는다.
4) 콜라겐 도포가 끝난 페트리딧슈나 커버글라스 위에 부유세 포나 이식편을 울려놓고 배양액을 가하면 배양이 시작된다. 13.2 라미닌 모든 조직 의 기 저 막 basemen t membrane 에 특이 하게 존재 하는 분자량 900,000 의 당단백질이다. 타이프 IV 콜라겐, 헤파린유산 과 결합하여 기저막을 구성하고 있다. 조직배양에서는 상피세포, 간세포 등에서 접착작용이 있고, 신경세포의 성장촉진 작용도 가 지고 있다. 라미닌은 암세포의 전이능력과 관련이 있으며 전이성이 높은 악성 암세포는 라미닌 리셉터를 다량 가지고 있다. Flow, GIBCO, Sig ma 등의 회사에서 무균화된 제품을 살 수가 있다. 〈방법〉 1) 라미닌을 lOµ g /ml 의 농도로 무균증류수에 녹인다. 2) 페트리딧슈 (35mm) 하나에 0.5ml 의 라미닌울 분주하고 실 온에서 1 시간 방치하고 건조시킨다. 3) 커버글라스도 위의 요령으로 라미닌을 바르고 건조시킨다. 냉장고에 저장하면 한 달 가량 사용할 수 있다 .• 13.3 파이브로넥틴 파이브로넥틴은 악성화 세포 등에서 분비되는 당단백질로, 분 자량 250,000 의 폴리펩티드 이양체이다. 세포집착에 큰 역할을 하므로 정상세포 배양에 사용된다. 일반적으로 정상인의 혈장에 서 분리되는데 조직배양에서는 섬유아세포, 간세포, 신경세포 등
의 접착을 가져온다. 생체 안에서는 세포접착, 세포이동, 식작용 의 촉진을 가져오며 조직 손상부에서 그 수복을 돕는 것으로 알 려져 있다. 파이브로넥틴은 시판되고 있어 Flow, GIBCO 등의 회사에서 살 수 있다. 파이브로넥틴은 2-5µ g/cm2 로 세포배양 기 구의 표면을 덮으면 유효하다. 〈방법〉 1) 파이브로넥틴(시판의 것은 이미 무균화되어 있음)을 lOµg /m I 의 농도로 무균증류수에 녹인다. 2) 페트리딧슈 (35mm) 하나에 0.5ml 의 파이브로넥틴액을 분주 하고 36 도에서 말린다. 3) 무균 증류수로 두 번 씻은 다음 다시 말린다. 4) 파이브로넥틴 도포 딧슈는 실온에서 한 달 가량 저장할 수 있다. 커버글라스는 위의 요령으로 하며, 비슷한 방법으로 건조시킨다. 13.4 비트로넥틴 사람 플라스마와 혈청의 당단백질인 비트로넥틴은 분자량이 75 , 000 이며 각종 세포가 부착, 이동, 신장, 증식의 각 작용을 하 도록 돕는다. 파이브로넥틴과 유사한 작용을 가지고 있으나 화학 적으로 이 두 가지 분자는 완전히 독립되어 있다. 최근까지 혈청 신장인자 serum spr e adin g fac t or 라 불리웠으며 헤파란 글라이코사미노글리칸g l y cosam i no g l y can, 트롬빈-안티 트롬빈 III 콤플렉스 등에 부착하는 성질이 있다.
13.5 젤라틴 젤라틴은 콜라겐을 변성처리하여 수용성으로 만든 단백질로서 조직배양 용기의 표면에 바르면 근육세포, 혈관, 내피세포, 데라 토카시노마 세포배양에 좋은 결과를 가진다. 소나 돼지 피부에서 분리한 젤라틴이 쓰이는데 보통 l_2% 수용액을 만들어서 오토클 레 이브하여서 무균화한다. 〈 방법 〉 1) 냉장고에 저장된 2% 첼라틴액을 온수에서 37 도까지 가열해 서 녹인다. 2) 배양 페트리딧슈나 커버글라스를 가볍게 덮어서 실온에서 30 분 방치한다• 3) 여분의 젤라틴을 제거하고 실온에서 건조시킨다. 13.6 폴리라이신 양성 전하를 가진 아미노산 폴리머인 폴리라이신이 최근에 많 이 사용되어 풀라스틱이나 유리 풀라스크, 페트리딧슈, 멀티웰, 커버글라스를 코팅하여 사용한다. 폴리 라이 신p ol y -D-l y s i ne bromi de sa lt(분자량 30,000-70,000, 시그마에서 시판)을 lm g/ml 의 농도로 증류수에 용해시킨 뒤 밀 리포어 필터로 무균화한다. 사용 직전에 무균증류수로 100 배로 희석하고 페트리딧슈, 커버글라스 등에 충분량 가하고 20 분간 정 치한다. 폴리라이신액을 완전히 제거하고 한 번 무균증류수로 씻 은 뒤에 실온에서 말린다. 폴리라이신액은 두 번 더 쓸 수 있다. 폴리라이신코팅을한페트리딧슈나폴라스크는이주일간유효하다.
제 14 장 무혈청 배양액의 개발 조직배양법이 시작된 초기에는 세포의 생존과 증식에 필수적인 배양액 성분으로서 영류용액 balanced salt soluti on , 배태추출액 embry o extr ac t, 혈장p lasma, 혈 청 serum 등의 세 포환경 성 분을 그대로 사용하였으나 이러한 자연배양액의 아미노산, 비타민, 당 분, 금속성분의 화학분석이 알려지게 되자 필수영양 성분을 포함 한 합성배양액 s ynth e tic med i um 이 개발되었다. 합성배양액 199 이 나 이 글 MEM (Eagl e 's mi ni m u m essenti al mediu m ) 등이 그 대 표적인 예가 되겠다. 그러나 조직배양 조건 하에서 세포가 생장 하고 증식하려면 이러한 단순한 합성배양액 만으로는 부족하고 일반적으로 마혈청, 우태혈청 등의 동물혈청이 소량이나마 반드 시 첨가되어야 한다. 혈청이 조직배양액에서 가지는 기능은 다음과 갇다. 1) 성분이 알려지지 아니한 영양성분의 공급 2) 영 양성분, 금속성분의 운반자 carr i er 역 할 3) 세포구조에 이용되는 고분자의 직접공급 4) 여러 가지 성분의 완충작용 bu ff er ing 5) 대 사산물의 해독작용 de t ox ic a ti on 6) 단백질분해효소 등의 증식저해 물질을 중화 7) 세포정착 인자의 공급 위에서 성분이 알려지지 않은 영양성분의 공급이라 함은 세포 성장에 필수적인 성장인자gr o wth fa c t or 가 혈청 속에 포함되어 있음을 의미하는데, 그 성장인자가 무엇인가를 확인하고 그 구조
와 기능을 결정하는 것이 현재 세포생물학과 분자생물학의 가장 시급한 과제가 되고 있다. 1976 년에 사토 Sa t o 의 연구실에서 쥐 의 뇌하수체 종양 주세포 GH3 를 배양함에 있어서, 혈청농도를 최소한으로 하고 그 대신 여러 가지 호르몬과 성장인자를 추가하 는 방법으로 배양을 계속한 결과 갑상선자국호르몬방출호르몬 (TRH), 소마토메딘 C, 트란스페린, 부갑상선호르몬 (PTH), 트 리아이오드타이로닌(감상선호르몬)의 다섯 가지 호르몬의 배합으 로 무혈청 배양액을 개발하고 장기간 쥐의 뇌하수체 종양 주세포 룰 배양하였다. 우리 교실에서는 소마토메딘 C 가 인슐린과 그 약 리작용이 비슷하며 수용체를 같이하는 인슐린 유사 성장인자 Insuli n like grow t h fac to r I 이 라는 점 에 유의 하여 그 순수 분리 가 극히 곤란한 소마토메딘 C 대신에 인슐린을 사용하여 신경세 포 배양을 위한 무혈청 배양액을 개발하였다. 이 연구에서 우리 가 분명히 한 것은 10-20µg /m l 농도의 인슐린을 F12, 이글 MEM 같은 인공배양액에 첨가하면 신경세포를 비롯하여 각종 섬유아세포, 암세포 등이 일주일이나 이주일의 단기간 동안은 생 존할 수가 있다는 사실이다. 우리 교실에서 고안한 무혈청 배양 액은 인슐린, 트란스페린, 하이드로코티존, 트리아이오도타이로 닌(갑상선호르몬)과 회금속인 세레늄을 포함하고 있다. 이렇게 무 혈청 배양액에서 각종 세포가 생존하고 증식할 수가 있다는 것은 〈모든 세포배양에서 적절한 영양성분, 호르몬, 세포 성장인자의 배합으로 무혈청 배양이 가능하다〉는 것이다. 이렇게 무혈청 배 양법의 개발은 지금까지 가지고 있던 호르몬의 개념을 크게 확대 시키는 것이 되었다. 호르몬의 정의는 〈특정 내분비 기관에서 합 성되어서 혈류를 통하여 다른 특정 조칙이나 기관에 작용하는 물 질〉인데, 앞서 말한 세포 성장인자도 호르몬이나 마찬가지로 세 포기능을 제어 조절하는 작용을 하기 때문에 그 기능은 호르몬과 다를 것이 없다. 무혈청 배양액을 개발하려면 먼저 기초배양액울 무엇으로 하는
가를 결정한다. 가장 흔히 쓰이는 것으로는 달백코 MEM 과 F12 가 섞 인 DME/F12 가 있고 그 밖에 이스코베 Iscove's MEM, MCDB 105, MCDB 110, MCDB 151, MCDB 153, MCDB 201, MCDB 302, NCTC 135, L15 등 각종 합성배양액이 있다. 기초배 양액에 혈청을 첨가하여 세포배양울 하고, 점차적으로 혈청의 함
 표 14-1 세포 성장인자
표 14-1 세포 성장인자
유량을 감소시켜서 세포발육이 정지되는 점을 찾는다. 이때에 기 초배양액에 각종 영양성분과 세포 성장인자를 첨가하여 세포발육 이 다시 시작하면 각 성분의 성장 유효농도를 측정한다. 세포 성장인자 : 각종 세포 성장인자의 기능과 작용양식에 대하 여는 아직 분명치 않은 점이 많으나, 대부분의 배양세포에서 하 나 또는 그 이상의 성장인자가 필수적이다. 예컨대 쥐태아 척수 후근 신경세포배양에서는 10-lOOng /m l 농도의 신경 성장인자 nerve grow t h fa c t or 의 첨가가 필수적이며 이것이 결핍되면 신 경세포가 단시간 안에 죽는다. 현재 사용되고 있는 각종 세포 성 장인자의 이름과 유효농도 그리고 유효조직 세포에 대하여는 표 14-1 을 참고하기 바란다. 호르몬 : 호르몬이 각종 세포에 주는 영향은 아직 분명치 않은 점이 많으므로, 그 종류와 농도의 선택은 실험적으로 결정하는
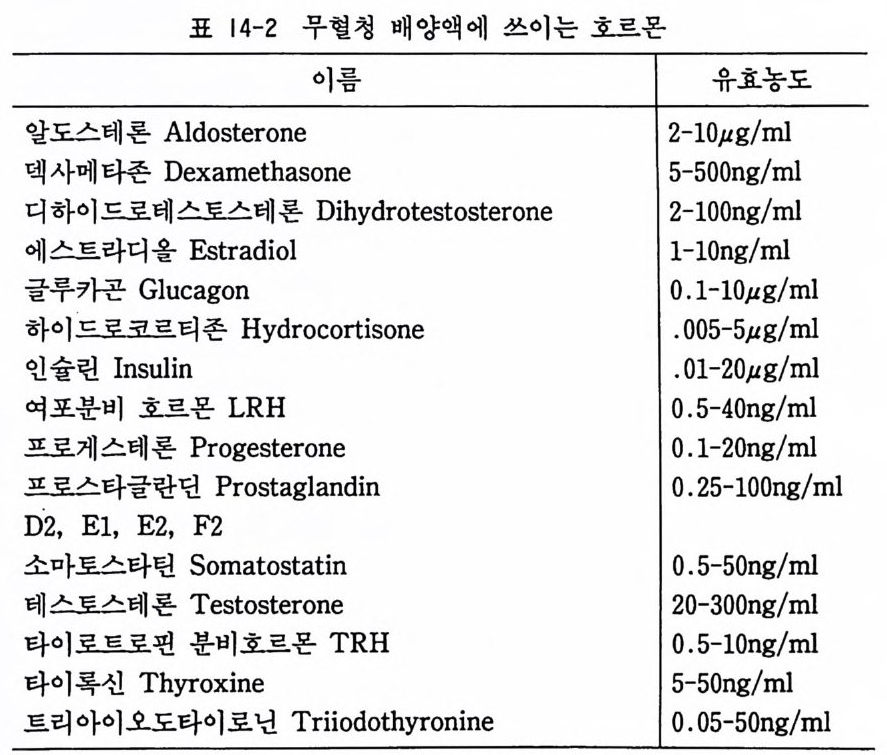 표 |4-2 무혈청 배양액에 쓰이는 호르몬
표 |4-2 무혈청 배양액에 쓰이는 호르몬
수밖에 없다. 인슐린은 필수적이며 이것이 없으면 세포발육이 없 다. 그 농도가 생리적 혈중농도의 1,000 배로 사용되는 이유는 인 슐린이 37 도의 온도에서 극히 불안정하며 기초배양액 중의 시스 테인에 의해서 급속히 분해되기 때문이다. 스데로이드 호르몬은 각종 세포의 증식과 분화를 촉진하는 것으로 알려져 있으며, 갑 상선 호르몬 역시 세포분화와 성장에 효과가 있다고 보고되고 있 다. 무혈청 배양액에 쓰아는 호르몬의 리스트는 표 14-2 를 참고 하기 바란다. 기질과 세포 접착인자 : 대부분의 배양세포들은 풀라스크나 딧 슈 표면에 접착한 뒤에 증식을 시작한다. 기질로서 가장 흔히 쓰 이는 것이 폴리라이신이고, 콜라겐과 젤라틴도 역시 잘 쓰이는
 표 14-3 기질과 접착인자
표 14-3 기질과 접착인자
기질이다. 접착인자는 일반적으로 배양액 속에 포함된 혈청에 의 해서 공급되고 있으므로, 무혈청 배양의 경우에는 의부에서 이를 공급하여야 한다. 집착인자로는 파이브로넥틴과 라미닌이 무혈청 배양액에 첨가되는 수가 많다. 기질과 접착인지는- 표 14-3 에 표 시하였다.
제 15 장 세포융합과 잡종세포 생체 내에서나 배양조건 하에서나 세포는 서로 경계를 가지고 있어서 세포가 서로 접촉을 가졌을 경우 서로 융합하는 수가 없 다. 그러나 세포에 특수한 처리를 하여 두 개 이상의 세포가 경 계면이 없는 하나의 세포막 안에 둘러싸인 융합체를 만들어내는 경 우 이 를 세 포융합 cell fu s i on 이 라 한다. 형 성 된 융합세포가 더 나아가서 핵의 융합을 가져올 수가 있는데, 이 경우 유전적 조성 이 다른 핵이 융합하여 두 가지 다론 세포의 유전자의 발현이 있 울 수 있다. 이 를 잡종세포 h yb ri d cell 라 한다. 이러한 세포융합을 일으키는 것으로는 폴리에틸렌글리콜 p ol y e t h y lene- g l y col 을 써 서 화학적 으로 융합시 키는 방법 , 바이 러스를 써서 생물학적으로 융합시키는 방법, 그리고 강력한 전장 elec t ro p hores i s 을 써 서 물리 적 으로 융합시 키 는 방법 이 있다. 후 자는 전장융합법 elec t ro p ora ti on 이라 하며 이를 위한 기구 (electr o po rato r ) 가 시 판되고 있다. 세포융합을 시킨 뒤에 잡종세포를 선택적으로 찾아내는 것을 잡종형 성 법 h y br i d i za ti on 이 라 하며 , 최근에 이를 사용하여 체 세 포유전학 soma tic cell g ene tic s 이 크게 진보한 바 있다. 이 선택법에서 흔히 쓰이는 것이 하이포잔틴 구아닌 포스포라 이보즈 트랜스페라제 HGPRT 결손세포주와 티미딘키나제 TK 결 손세포주를 쓰는 방법이다. 그 배양액 속에 뉴클레오티드의 신생 합성 을 방지 하는 아미놉데 린 am i no pter i ne, 그리고 뉴클레오티드 의 전구체인 티미딘t h ymi d i ne 과 하이포잔틴 h yp oxan thi ne 을 포 함한 HAT 액을 선택배양액으로 사용한다. 이 조건하에서는 잡
제 2 부 기초배양 기술 145
종세포만이 살아 남게 된다. 〈재료〉 1) 10% 우태아 혈청 +90% 이글 합성배양액 2) HAT 100 배액 (하이포잔틴 5X10-3M, 아미놉테린 5X10-4M, 티미딘 lX10-3M) 3) 50% PEG( 분자량 1,000 의 폴리에틸렌글리콜 10 g을 50ml 병에 넣어서 고압증기 멸균하고, 식은 다음에 합성배양액 20ml 를 가 해서 혼합한다.) 4) 파이펫 시험관, 원심듀브, 페트리딧슈, 멀티웰 5) 스톱워치 6) H~PRT 결손세 포주 (2 X l06/ml ) TK 결손세포주 (2 X 105/ml ) 이 경우 TK 결손세포주 대신 증식하지 않는 정상세포로 대치 할수 있다. 〈방법〉 1) 두 세포군을 혼합하여 1,200 rp m 으로 5 분간 원심분리한다. 2) 상청액을 버리고 PEG 액 0.5ml 를 넣어서 세포를 부유시킨 다. 3) PEG 를 가한 1 분 뒤에 배양액을 10ml 파이펫으로 천천히 파이펫팅을 하고 1,200 rp m 으로 5 분간 원심분리한다. 4) 배양액 (혈청 없음)으로 세 번 세척한다(상청액을 버리고 배양 액을 넣어서 여러 번 파이펫팅을 하는 조작을 세 번 계속한다). 여기서 PEG 가 제거된다. 5) 세포수를 계산하고 혈청첨가 배양액에 희석한 다음 페트리 딧슈나 멀티웰에 도입p la ti n g한다. 6) 하루 뒤에 HAT 배양액 (우태아 혈청 배양액에 HAT 100 배 액을 1% 로 첨가)으로 액교환을 한다.
7) 일주일에서 이주일 사이에 콜로니가 발생하면 이를 분리 배 양한다. 8) 단충세포를 사용하는 경우에는 두 종류 세포를 60mm 페트 리딧슈에 고밀도로 가득하게 배 양하고 다음날 배 양액을 버 린 뒤 PEG 액을 첨가한다. 여기서 딧슈를 혼들어 액이 혼합되 도록 한다. 인큐베이터에 딧슈를 정치하고 2 분에서 5 분 뒤에 PEG 액을 제거한다. 배양액(무혈청)으로 세 번 세척을 하고 마지막에 혈청첨가 배양액을 가한다.
제 16 장 모노클론 항체와 하이브리도마 제작법 1975 년에 쾰러 Koller 와 밀스틴M il s t e i n 은 세포융합 기술을 사 용하여 양 적혈구 표면항원에 대한 특수항체를 계속하여 생산하 는 B 세포 하이브리도마 h y br i doma 를 만드는 데 성공하였다. 이 들은 이 획기적인 배양기술을 발전시킨 업적으로 1986 년도 노벨 상을 수상한 바 있다. 여기에서는 마우스세포-마우스세포 융합에 의한 하이브리도마 제작법을 설명한다(그림 16-1 참고). 〈재료〉 1) 성숙 BALB/C 마우스 4 마리 2) BALB/C 마우스 유래 의 골수종 m y eloma 주세포 P3-NS1/ 1-A g 4- l( ll 장 수립 세포계 참고) 3) BALB/C 마우스 흉선 유래 세포 4) lmg /m l 농도의 항원(단백질이나 당단백질)과 같은 양의 완 전 프로인트아주반트 Com p le t Freund ad j uvan t의 혼합액 5) 배 양액 10% 우태 아 혈청 포함 RPM! 1640 액 HAT 배양액 (RPMI 1640+10% 우태아 혈청에 하이포잔틴 lX 10-•M, 아미 놉데 린 4 x 10-1M, 티 미 딘 1. 6 X 10-5M 을 포함) 6) 50% 폴리에틸렌글리콜액 PEG 1500 30 g을 병에 가하고 오토클레이브 멸균을 한다. 냉각하기 전에 RPMI 액 30ml 를 가하고 찰 녹도록 혼든다. 7) 페록시다제 표식이 된 산양 항마우스 lg 항체 8) 주사기 각종파이펫
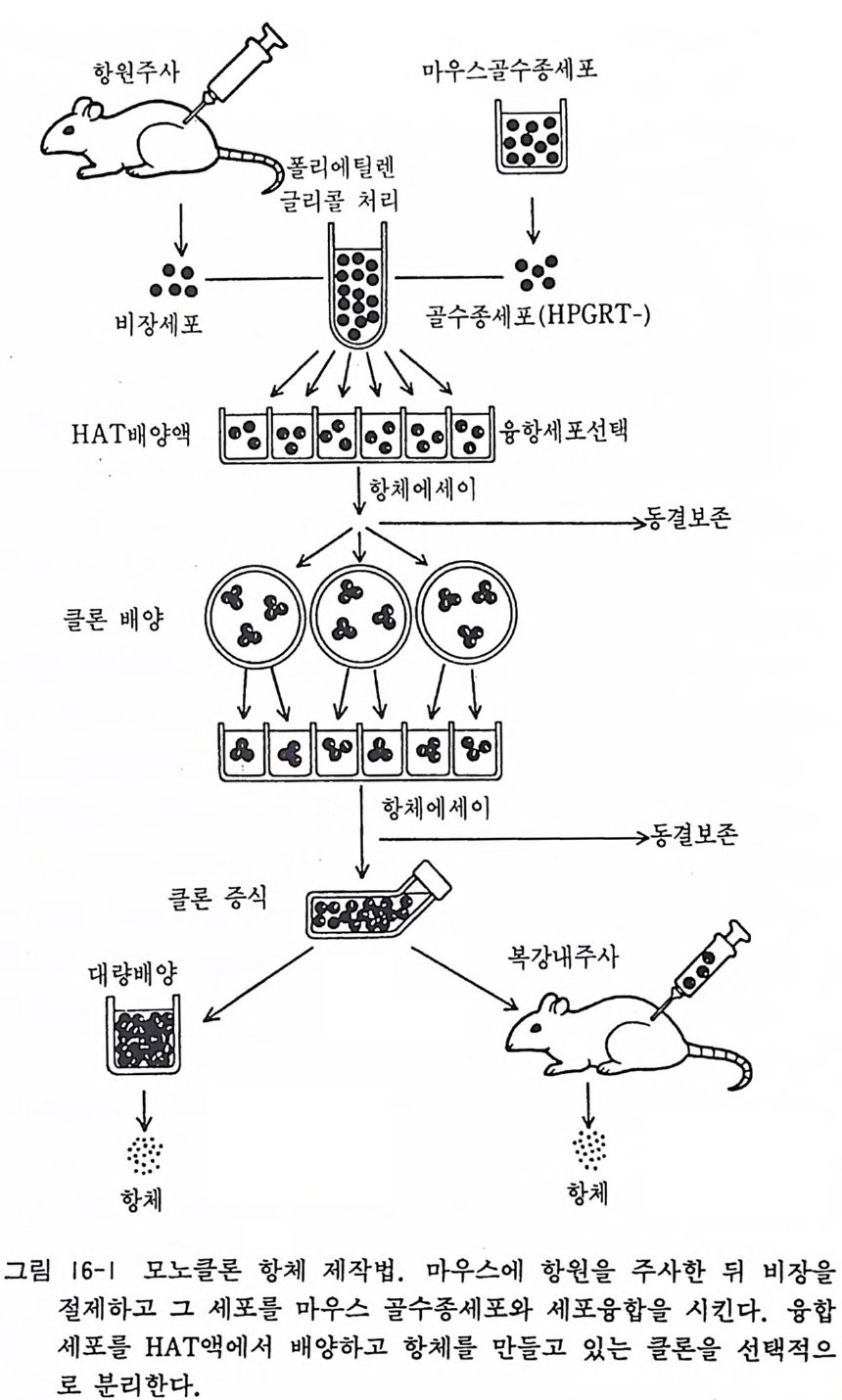 마우스곱수종세포
마우스곱수종세포
각종 원심튜브 96 혈 멀티웰 플레이트 24 혈 멀티웰 폴레이트 풀라스틱 페트리딧슈 ELISA 비색기 〈방법〉 1) 항원-아주반트 혼합액 0.2ml 를 2 마리의 BALB/C 마우스 복강 내에 주사한다. 이주일 뒤에 혼합액 0.1ml 를 정맥 안 으로 주사한다. 3 일 뒤에 마우스의 비장을 분리하고 5ml 의 RPMI 액이 들은 페트리딧슈로 옮긴다. 2) 비장을 안과용 가위로 미소하게 찰라서 단리세포를 분리한 다. 3) 비장세포를 씻은 다음 RPMI 1640 액에 부유시키고 세포수 룰 계산한다. 4) 따로 10cm 페트리딧슈에서 P3-NS1 골수종세포를 배양하 던 것을 분리하여 RPMI 1640 액에 부유시키고 세포수를 계 산한다. 5) P3-NS1 세포 1x101 부유액과 비장세포 lX108 부유액을 50ml 원심듀브에 넣고 800rp m 으로 10 분간 원심침전시킨다. 이 때 50% PEG, RPMI 1640, 10% 우태 아 혈청 포함 RPMI 1640 액을 37 도에서 정 치 한다. 6) 세포를 포함한 듀브는 상청액롤 버리고 37 도 워터베스 속에 세운다. 7) 파이펫 첨단으로 세포를 혼합시키면서 50% PEG 액 1ml 를 서서히 첨가한다. 다음에 RPMI 1640 2ml 를 2 분간에 걸쳐 한 방울씩 떨어트린다. 계속하여 RPMI 1640 액 7ml 를 2 분 간에 걸쳐 서서히 첨가한다. 8) 실온에서 800r p m 으로 10 분간 원십침전시킨다. 상청액을 버
리고 l0% 우태 아 혈청 포함 RPMI 1640 액 10ml 을 가하고 가볍게 섞는다. 9) 96 혈 멀티웰에 0.1ml 씩 세포부유액을 주입하고 인큐베이터 에서 배양을 시작한다. 10) 배양개시 다음날 0.1ml 의 HAT 배양액을 각 웰에 추가한 다. 배양 개시 2,3,5,8,11 일 뒤에 각 웰의 배양액 0.1ml 를 제거하고 신선한 HAT 배양액 0.1ml 를 추가한다. 그 뒤로 는 3-4 일에 한 번씩 HAT 배양액으로 배양액 교환을 한다. 11) 이주일에서 사주일 가량되면 웰 속에 콜로니 형성을 볼 수 가 있다. 12) 96 혈 멀티웰에 O.l m g /m l 항원액을 0.04ml 씩 첨가하고 실 온에서 1 시간 정치한다. 항원이 웰 표면에 결합한다. 각 웰 을 ELISA 완충액 (PBS+0.1% 소혈청 알부민)으로 세 번 씻 는다. 13) 하이브리도마 콜로니의 배양액 0.02ml 씩을 분리하여 항원 결합 멀티웰에 각각 주입하고 실온에서 1 시간 정치한다. 14) ELISA 액으로 세 번 씻은 다음 페록시다제 표식 항마우스 lg 희 석 액 (ELISA 액 으로 100 배 희 석 ) 0 . 02ml 를 첨 가하고 실온 에서 1 시간 정치한다. 15) ELISA 액으로 세 번 씻은 다음 페록시다제 발색반응을 시 킨다. 16) ELISA 비 색기 에서 OD 450 으로 비 색 측정 한다. 17) ELISA 측정에서 높은 면역반웅을 보인 웰에서 세포를 분 리하여 클로닝을 한다. 18) BALB/C 마우스 2 마리에서 흉선세포를 분리하고 다른 페 트리 딧슈에서 배 양을 하여 피 더 세포fe eder cell 를 만들어 둔 다. 피더세포는 RPMI 1640 액으로 두 번 씻은 다음 1x101/ ml 의 농도로 HAT 배양액에 부유시키고 96 혈 멀티웰에 0.1 ml 씩 분주한다.
19) 원하는 웰에서 히이브리도마 세포를 파이펫팅으로 분리하 고 1,000-3,000 세포 /ml 정도로 HAT 배양액에 희석한다. 이것을 10cm 페트리딧슈에 넣고 도립현미경 밀에서 세포를 하나씩 마니퓨레이터(유리 마이크로파이펫을 가열해서 아주 가 늘게 하고 그 끝을 약간의 각도로 꾸부린다. 이 파이펫에 튜브를 접속하여 입으로 흡인할 수 있게 한다. 미리 오토클레이브 멸균 해 둔다)를 사용하여서 분리하고 피더세포가 들어 있는 웰에 넣는다. 하나의 웰에서 30 개 정도의 단리세포를 분리하도록 한다• 20) 클로닝 5 일 뒤에 0.1ml 의 HAT 액을 추가하고, 12 일 뒤에 배양액 반을 교환한다. 그 뒤로는 3-4 일에 한 번씩 배양액 교환을 한다. 21) 세포가 증식한 단계에서 콜로니 배양액을 0.2ml 씩 분리하 여 위의 12)-16) 단계에서처럼 ELISA 데스트를 하여 항체 의 특이성을 조사한다. 22) 자기가 원하던 항체를 생산하는 클론임을 확정하고 동시에 항체농도가 높은 클론을 찾아내도록 하여야 한다. 23) 계대배양을 계속하여 96 혈에서 24 혈 멀티웰, 35mm 페트 리딧슈, 60mm 페트리딧슈, 25c 面 플라스크의 차례로 배양 울 하고 하이브리도마 클론을 증식시킨다.
 제 3 부
제 3 부
제 17 장 독성 검사법 17.1 독성검사법-크리스탈 바이올렛 검사법 화학물질이 배양세포에 미치는 영향을 알고자 할 때, 그 물질 이 독성을 보이는 농도를 알아보는 것이 중요하다. 여기에서는 가장 보편적이고 간편한 방법으로 96 혈 멀티웰 마이크로타이터 플레 이 트 mul ti well mi cro ti ter p la t e 와 ELISA 비 색 기 를 사용하는 방법을 기술한다. 섬유아세포의 L 세포에서 DNA 합성 저해제 hy d roxy u rea(HU), RNA 합성 저해제 pro fl av in ( PF), 단백질합 성 저해제 cyc lohexim i de (CH), 세포분열 저해제 colcemi d (CL) , 돌연 변 이 촉진제 N-meth yl- N'-nit ro -N-nit ros og ua nin e (MNNG) 의 독성검사를 하는 방법을 간략하게 기술한다. 〈재료〉 1) L 세포 1Xl06 2) CMF-PBS 0 . 25% 트립 신 /CMF-PBS 10% 마혈청 /MEM 3) Hy d roxy u rea Profl av in Cy c lohexim i de Colcemi d MNNG 4) 0.4 % 크리스탈 바이올렛 수용액
메탄올 5) 96 혈 멀티웰 플레이트 파이펫 시험관 마이크로 파이펫 6) ELISA 비 색 기 mult ipla te reader 〈방법〉 1) 화학물질을 계량하여 데스트하고 싶은 최고농도의 2 배가 되 는 용액을 준비하고 이를 여과필터로 멸균한다. HU : 2mg / ml 수용액을 준비 PF : 200µ g /ml 의 수용액을 만들고 이를 10 배로 희석하여 20 µg/m l 용액을 준비 CH : 200µg /m l 수용액을 만들고 이룰 100 배 희석하여 2µg / ml 용액을 준비 CL : lOµ g /ml 액을 준비한 다음 이룰 50 배 희석하여 0.2µg / ml 용액을 준비 MNNG : 2m g /ml 의 DMSO 액을 준비한 다음 이룰 100 배로 희석하여 20ug /m l 용액을 준비 2) 96 혈 멀티웰 플레이트 제 1 열의 A-H 를 포지티브 콘트롤, 제 12 열의 A-H 를 네거티브 콘트롤로 한다. 가로 A 열 2-11 울 제하고 모든 웰에 0.1ml 의 배양액을 분주한다. 제 2, 3 열 A 와 B 에 HU 2 배액 0.1ml, 제 4, 5 열 A 와 B 에 PF 2 배액 0.1ml, 제 6, 7 열 A 와 B 에 CH 2 배액 0.1ml, 제 8, 9 열 A 와 B 에 CL 2 배 액 0 .1ml, 제 10, 11 열에 MNNG 2 배 액 0 .1ml 롤분주한다. B 열 웰 속의 배양액과 약품을 찰 혼합한 다음 그 0.1ml 를 C 열 웰, C 열 웰에서 0.1ml 를 D 열 웰로 옮긴다. 이러한 희 석 조작을 되풀이하여 H 열까지 간 다음 H 열에서 나오는
0.1ml 를 버린다. 3) L 세포를 5x104/ml 의 비율로 15ml 의 배양액 (10% 마혈청을 포함한 MEM 합성액)에 희석한다. 이들 세포부유액 0.1ml 씩 제 12 열 네거티브 콘트롤을 제의한 모든 웰에 주입한다. 4) 96 혈 멀티웰 플레이트를 이산화탄소 인큐베이터에 정치하고 배양을 계속한다. 5) 3 일간 배양한 뒤, 각 웰울 PBS 로 한 번 씻고 메탄올로 5 분간 고정한다. 0.4% 크리스탈 바이올렛액으로 20 분간 염색 한 뒤 PBS 로 한 번 씻는다. 6) 염색한 표본은 ELISA 비색기에서 OD 590 으로 측정한다. 포지티브 콘트롤 결과를 100%, 네거티브 콘트롤 결과를 0% 로 한 뒤 각 웰의 OD 결과를 %로 표시한다. 가로축에 약품 의 농도를, 세로축에 OD 결과를 표시한 뒤 50% 저해치를 알아본다. 그림 17-1 에 그 결과를 표시하였다. 7) ELISA 비색기가 없는 경우에는 각 웰의 세포증식도의 높 고 낮음을 육안으로 혹은 현미경하에서 조사하여 세포장해도 롤 0 에서 4 로서 표식한다. 0 은 네거티브 콘트롤, 4 는 세포가 모두 사멸하여 웰에서 떨어져 나간 경우, 2 는 세포증식의 콘 트롤의 반 정도의 경우로 한다.
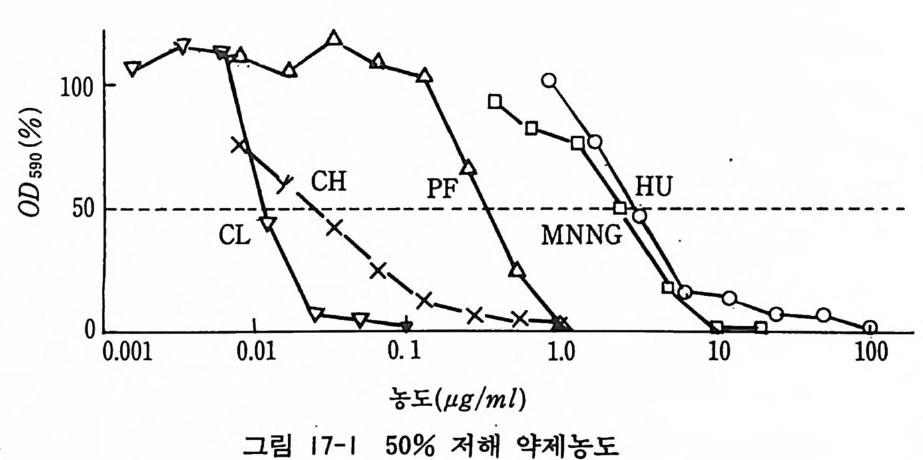 100 ' 7
100 ' 7
17.2 MTT 검사법 최근에는 MTT 검사법이 위에 기술한 크리스탈 바이올렛 검 사법에 대신하여 널리 사용되고 있다. 그 원리는 다음과 같다. MTT (3-(4 , 5-dim e th y lt h i a z ol-2-yl ) -2, 5-dip h eny lt e t r a zoli wn bro- m i de) 는 수용액 속에서는 무색인데 살아 있는 세포의 미토콘드 리아 안의 효소에 의해서 물에 녹지 않는 보라색 색소로 변환한 다. 색소의 강도를 ELISA 비색계에서 측정하여 살아 있는 세포 의 증식, 독성검사 등에 활용할 수가 있다. MTT 는 미국 시그 마에서 살 수가 있다. 〈재료〉 17.1 크리스탈 바이올랫 검사법과 같음.
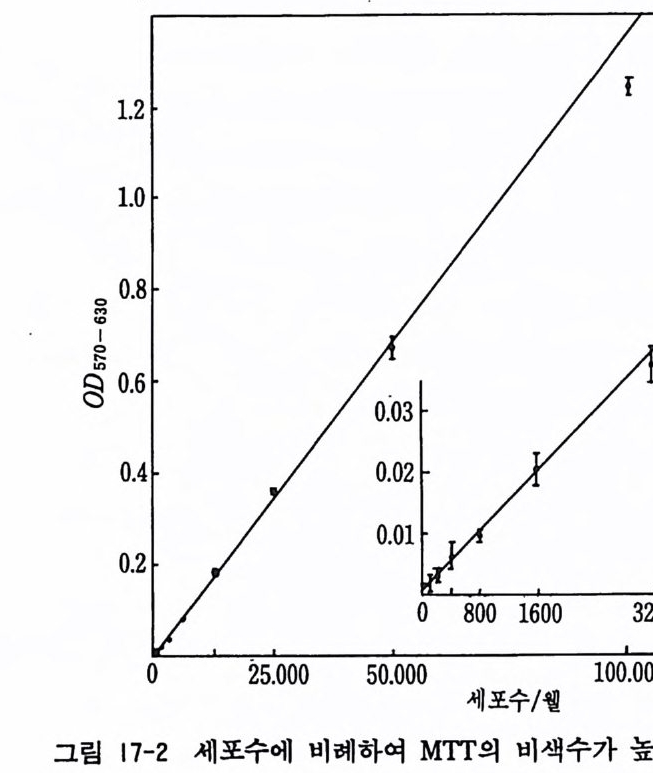 r
r
〈방법〉 1) 17.1 의 방법에서 (3) 에서 (4) 까지 같은 방법으로 L 세포를 배양한다. 2) 0.01ml MTT 액 (PBS 에 5m g /ml 로 스톡을 만든다)을 각 웰에 추가하고 4 시간 동안 37 도 인큐베이터에서 정치배양을 계속 한다. 3) 멀티웰을 인큐베이터에서 꺼내고 각 웰에 0.0 4 N 영산울 녹 인 이소프로필 알코올 0.1ml 를 첨가한다• 4) ELISA 비 색 기 에서 파장 570 nmi료 OD 를 측정한다. 그림 17-2 에서는 L 세포의 세포수에 비례하여 OD 수가 증가하고 있음을 볼 수가 있다.
제 18 장 잡균감염 검사법 18.1 티오글리콜레이트 용액 티오글리콜레 이트 Th y o g l y colla t e( 시그마)는 배 양용액 이나 혈청 의 잡균감염을 검사하기 위하여 쓰인다. 티오글리콜레이트 분말 을 29.5 g /L 만큼 뜨거운 증류수에 녹인 다음, 유리튜브에 4ml 씩 분주하고 120 도에서 15 분간 오토클레이브로 멸균한다. 티오글리 콜레이트 튜브에 검사하고자 하는 용액을 0.4ml 정도 첨가한 뒤 이를 37 도 인큐베이터에 정치한다. 며칠 안에 우유같이 혼탁하게 되면 잡균감염이 있는 것이고, 그대로 두명하게 남아 있으면 무 균임을 증명한다. 18.2 마이코플라스마 검출범 세포배양에서 가장 큰 문제점은 미생물에 의해서 배양세포가 오염되는 것이다. 일반세균이나 곰팡이의 경우에는 세포독성이 심하여 단시간 안에 이를 인식하고 대책을 세울 수가 있으나 마 이코풀라스마 m y co p lasma 오염인 경우에는 세포배양이 저하하는 정도이기 때문에 모르고 지나는 수가 많다. 마이코풀라스마로 인 해서 세포가 감염되면 세포의 대사계에 변화가 오고 바이러스 증 식, 사이토카인이나 모노클론 항체생산의 저하, 염색체의 이상 등의 여러 가지 폐단이 오게 된다. 여기에서는 마이코풀라스마 검색울 위한 DNA 형광염색법을 소개한다.
〈 재료〉 1) Hoechst 33258 색 소 2) PBS 3) 고정액 (메틸알코올려J초산 3 : 1) 4) 형광현미경 〈 방법〉 1) 커버슬립을 PBS 로 씻은 다음 고정액에서 10 분간 실온에서 고정한다. 2) 고정액을 버리고 커버슬립을 건조시킨다. 염색액 속에서 30 분간 실온에서 정치시킨다. 염색액은 다음과 같이 만든다. 스톡액 PBS 100ml 에 Hoechst 33258 5m g을 가하고 병 을 알루미늄 포일로 완전히 덮은 다음 마그네틱 스터러를 써서 30 분간 용해시킨다. 1ml 씩 튜브에 분주하고 일광을 완전히 차단하여 영 하 20 도에서 보존한다. 사용용액 -PBS 100ml 에 Hoechst 33258 스톡액 0 .15ml 롤 녹 여서 이것을 염색액으로 사용한다. 3) 염색액에서 커버슬립을 꺼내어서 증류수에서 세 번 씻은 다 음 글리세린 -PBS 로 슬라이드에 봉입한다. 4) 형광현미경 밀에서 관찰한다. 정상세포에서는 세포핵이 선 명하게 염색이 되어 있는 이의에는 세포질에 아무 염색반응 이 없다. 그러나 마이코플라스마 감영세포에서는 세포질에 먼지같이 미소한 과립 같은 염색반응이 보인다. 1,000 개의 세포를 관찰하고 5 개 이상의 세포에서 세포질 영역에 형광이 보이면 마이코플라스마 양성이라 판정한다.
제 19 장 염색체 표본 작성법 염색체는 유전자를 지니고 있는 세포 소기관으로서 DNA 와 단 백질 그리고 소량의 RNA 를 가지고 있으며 동물의 종류마다 일 정한 수와 형태를 가지고 있다. 이것을 핵형 kar y o typ e 이라 한 다. 악성화한 세포나 독성을 가전 화학물질, 바이러스, 방사선 등에 노출된 세포의 염색체는 그 수나 형태가 변화하게 되고, 정 상세포에서도 장기간 배양되면 변화가 울 수가 있다. 따라서 핵 형을 조사하는 것은 그 세포가 무슨 동물에서 유래되었나, 유전 적 성질의 변화, 세포의 형질과 유전자 사이의 관계 등을 알아보 는 데 중요하다. 사람의 염색체 수가 배양세포의 연구에서 확정되었듯이 염색체 연구는 배양세포를 사용한 이후로 크게 진보한 바 있다. 최근 여 러 가지의 밴딩법 band i ng me th od 이 알려져 염색체의 결정이 쉽 게 되었다. 〈재료〉 1) 대수증식기의 L 세포 2Xl06 2) 콜세 미 드 colcem i d (시 그마) 3) 트립신 /PBS 4) 0.075 M 영산칼륨 5) 메틸알코올 : 빙초산 (3 : 1) 고정액 6) 김사액 7) 파이펫 8) 커버글라스와 슬라이드글라스
〈 방법 〉 1) 배양중에 있는 L 세포 배양에 콜세미드를 O.lµg /m l 농도로 가하고 배양을 계속한다(콜세미드의 농도, 시간은 세포의 종류 와 그 증식속도에 따라서 적당히 결정한다) . 2) 2 시간 배양 후 배양액을 원심튜브에 옮기고, 세포 위에 0.05% 트립신 /PBS 를 가하고 37 도에서 10 분간 인큐베이트 한다. 3) 세포가 딧슈에서 떨어지면 (2) 의 원심튜브에 보관한 배양액 으로 희석하고 다시 원심튜브로 옮긴다. 4) (3) 의 원심튜브를 1,200r p m 으로 5 분간 원심분리한다. 5) 가라앉은 세포에 0.075 M 염산칼륨액 3ml 를 첨가하고, 가 볍게 파이펫팅한 다음 37 도에서 20 분간 인큐베이트한다. 6) 메탄올 : 빙초산 고정액 6ml 를 (5) 의 원심튜브에 가하고 가 볍게 파이펫팅한 다음, 1,200r p m 으로 5 분간 원심분리한다. 7) 가라앉은 세 포에 고정 액 5ml 를 첨 가하고 1, 200 rp m 으로 5 분간 원심분리한다. 이 과정을 한 번 더 되풀이한다. 8) 가라앉은 세포에 1ml 의 고정액을 첨가하고 세포를 부유시 칸다 9) 깨끗한 슬라이드글라스 위에 세포부유액 한 방울을 떨어뜨 리고 건조시킨다. 염색체 수를 계수하는 경우에는 이 단계에 서 김사염색을 한다. 10) 슬라이드글라스를 37 도에서 하롯밤, 80 도에서 3 시간 말린 다. 11) 슬라이드글라스를 꺼내어서 10 도 정도로 냉각된 0.1% 트 립신 /PBS 에 10 초에서 1 분간 인큐베이트한다. 12) 에틸알코올액에 술라이드글라스를 옮겨서 트립신 작용을 정지시킨다. 13) 중류수에서 두 번 씻은 뒤, 김사염색을 하고, 건조시켜서 파마운트 마운팅을 한다.
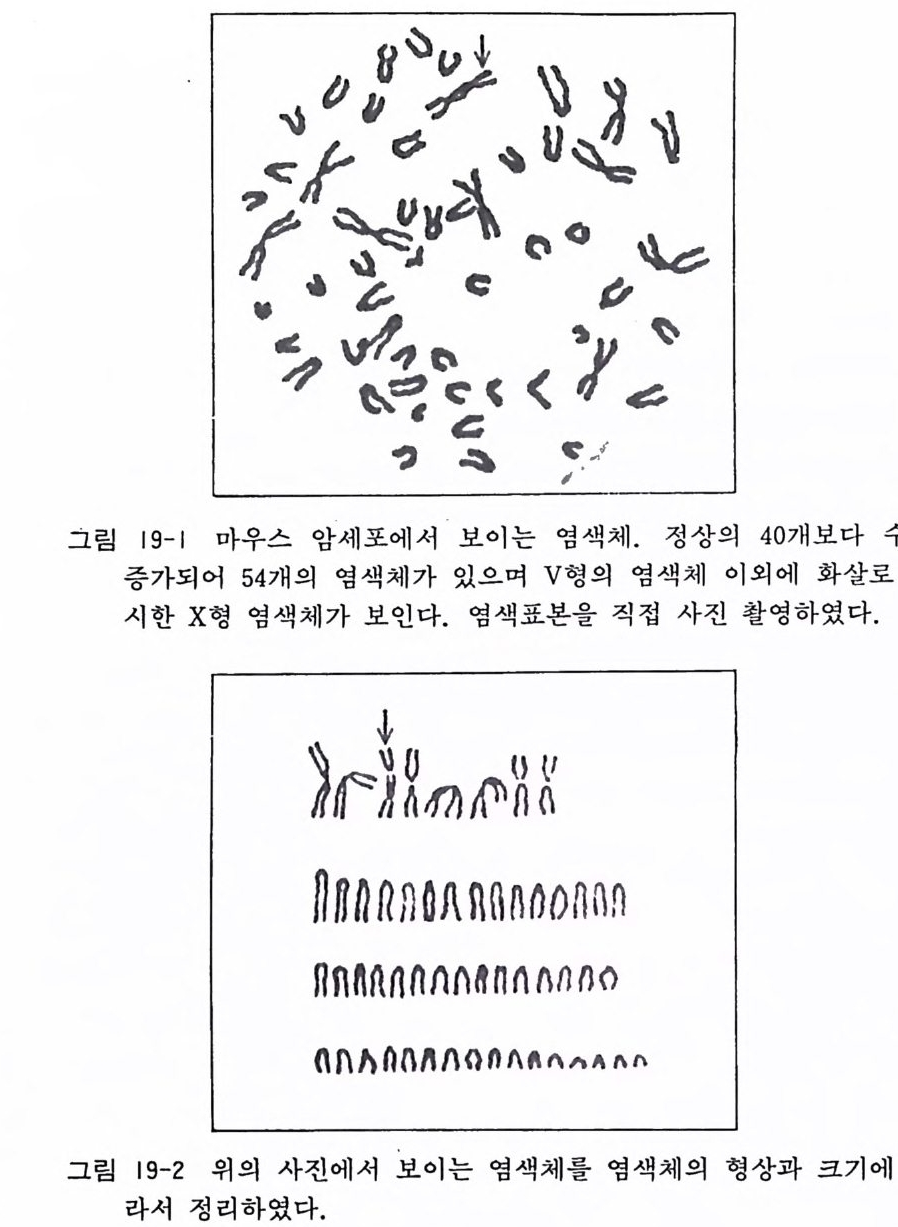 • 2, J'v`e ‘ “'u 1< ,,cJ`v
• 2, J'v`e ‘ “'u 1< ,,cJ`v
14) 현미경하에서 400 배나 1,000 배 배율로 염색체 사전을 찍는 다. 15) 핵형 분석을 하기 위해서 프린트롤 만들고, 염색체를 가위 로 오려내서 플레이트에 차례로 정리한다(그림 19-1 과 19-2).
제 20 장 세포염색법 배양세포는 그 유래하는 조직, 세포의 기능과 영양상태, 그리 고 배양조건에 따라서 그 모양이 달라진다. 따라서 배양세포에 의한 실험을 하게 되면 먼저 그 세포의 형태를 여러 가지 조건 아래서 관찰하고 그 내용을 찰 알아두어야 한다. 여기에서는 가 장 기 초적 인 세 포고정 염 색 법으로서 김 사염 색 Gie r nsa s t a i n 과 해 마톡실린-에오신 염색 Hema t ox yli n-Eos i n s t a i n 에 대해 간략히 기술한다. 그 밖의 염색법으로서 메틸그린-파이로닌 염색법 Meth y lg r ee n-Py ron in s t a i n 과 생 체 염 색 법 를 소개 한다. 20.1 김사염색법 〈 재료 〉 1) 김 사 G i emsa 액 2) 배양세포(커버글라스) 3) PBS 4) 산성 메틸알코올(메틸 알코올 3 : 빙초산 1) 5) 봉임제 (파마운트, 기타) 〈 방법〉 1) 커버글라스(세포가 그 위에 있음)를 PBS 에서 씻는다. 2) 산성 메틸알코올에 30 초 가량 고정한다. 3) 커버글라스를 실온에서 말린다•
4) 김사액 (1 : 10 온수로 희석한다) 속에서 30 분 동안 실온에서 염색한다 5) 증류수로 두 번 씻고 실온에서 완전히 말린다. 6) 봉임제(파마운트)로 슬라이드글라스 위에 봉입한다. 〈결과〉 세포질은 보라색, 호영기성 과립은 푸른색, 호산성 과립은 빨 간색이 된다. 20.2 헤마톡실린 염색법 〈재료〉 1) Harris 헤 마톡실 린 액 2) 배양세포 3) PBS 4) 포르말린fo rma li n 5) 암모니 아수 (1 : 50) 6) 알코올 7) 자일렌 x y lene 8) 봉입제 〈방법〉 1) 커버글라스를 PBS 에서 씻는다. 2) 10% 포르말린에 실온에서 10 분간 고정. 3) PBS 에서 두 번 씻는다. 4) 헤마톡실린액을 커버글라스 위에 분주한다. 실온에서 1 시간 정치한다. 5) 증류수로 씻는다.
6) 암모니아수로 씻는다. 이때 염색이 파랗게 된다. 7) 증류수로 씻은 다음 알코올로 탈수하고 다음에 자일렌에 투 석을 한다. 8) 파마운트로 슬라이드 위에 봉입한다. 〈 결과 〉 핵이 푸른색으로 염색된다. 해마독실린 다음에 5 분 가량 에오 신액 eos i n 에 염색하면 세포체 속이 빨갛게 염색될 수 있다. 20.3 메틸그린-파이로닌 염색법 재료는 20.2 와 같다. 〈 방법〉 1) 커버글라스를 95% 알코올에 고정 (10 분간)한 뒤 증류수에서 씻는다. 2) 메틸그린-파이로닌액으로 10 분간 염색한 뒤 가볍게 증류수 에서 씻는다. 3) 필터페이퍼로 물을 빨아들이고 100% 아세돈으로 급속히 탈 수한다• 4) 아세톤-자일렌 혼합액에서 1 분간 투석을 한 다음 파마운트 슬라이드 위에 봉입한다. 5) 메틸그린-파이로닌액 조성은 다음과 같다. 용액 A : 5% 파이로닌 수용액 17.5ml 2% 메 틸그린 수용액 10 . 0ml 중류수 250.0ml 용액 B : 0 . 2M 초산완충액 (pH 4 . 8) 250ml 사용직전에 A 와 B 를 같은 양으로 섞는다.
〈결과〉 DNA 는 녹색으로, RNA 는 적색으로 염색된다. 20.4 생체염색 세포를 고정하거나 죽이지 않고 색소로 염색하는 것을 생체염 색 v it al s t a i n 이라 한다. 트리판블루t r yp an blue, 리튬카민lit h ium carmi ne 등의 산성 색소, 뉴트럴레드 neu t ral red, 메틸렌불 루 me thy lene blue 등의 염 기 성 색 소, 빅 토 리 아블루 v ict or i a blue, 이소졸엑 트바이 올렛 iso solecht vio l et 등의 중성 색 소를 사 용할 수 있다. 원액으로서 물에 녹인 것을 쓰고 이를 PBS 나 BSS 에 희석해서 사용한다.
제 21 장 면역세포화학 조직 가운데서 여러 가지 다른 종류의 세포가 어떠한 기능을 가지고 있으며 서로 어떠한 상관관계를 갖는가를 검색함에 있어 서 제일 먼저 일어나는 의문은 어떻게 서로 다른 종류의 세포를 인식하고 판정하는가 하는 것이다. 이 문제 때문에 면역학과 그 에 관련된 분야는 오랫동안 그 연구의 전전이 지체된 바 있다. 1970 년대에 들어서서 B 임파구 세포와 T 임파구 세포분별을 염색 법으로 할 수 있게 되었는데 이것은 각 세포 표면에 특이한 항원 에 대해서 특별하게 인식하는 항체를 사용하여서 이루어진 것이 다. 이러한 면역염색법으로 시작하여 지난 20 년 동안에 면역학은 급속한 진보를 가진 바 있으며, 또한 1975 년 쾰러 Koller 와 밀스 틴 M il s t e i n 에 의해서 개발된 모노클론 항체 제작법의 보급으로 면역세포화학i mrnunoc yt ochem i s try의 기술은 크게 발전한 바 있 다. 면역염색법에는 두 가지 기본적 기술이 있는데 항체 an ti bod y 룰 형광색소 혹은 페록시다제p erox i dase 나 알카리포스파타제 alkali ne ph osph ata s e 같은 효소와 결합시켜서 직접 조칙에 있는 항원 an tig en 에 작용시 켜서 관찰을 하는 직 접 법 (그립 21-1) 과 항 원에 작용시키는 항체 (일차항체)는 미표식으로 반응을 시작하고 그 다음 단계에서 그 항체에 대한 항체(이차항체)에 형광색소나 효소표식을 하여 간접적으로 항원을 검출하는 간접법 (그림 21-2) 의 두 가지가 있다. 직접법은 비특이 반응이 적고 간접법에 비하여 특이성이 높으 나 그 감도가 많이 떨어진다. 이에 더하여 일차항체에 일일이 표
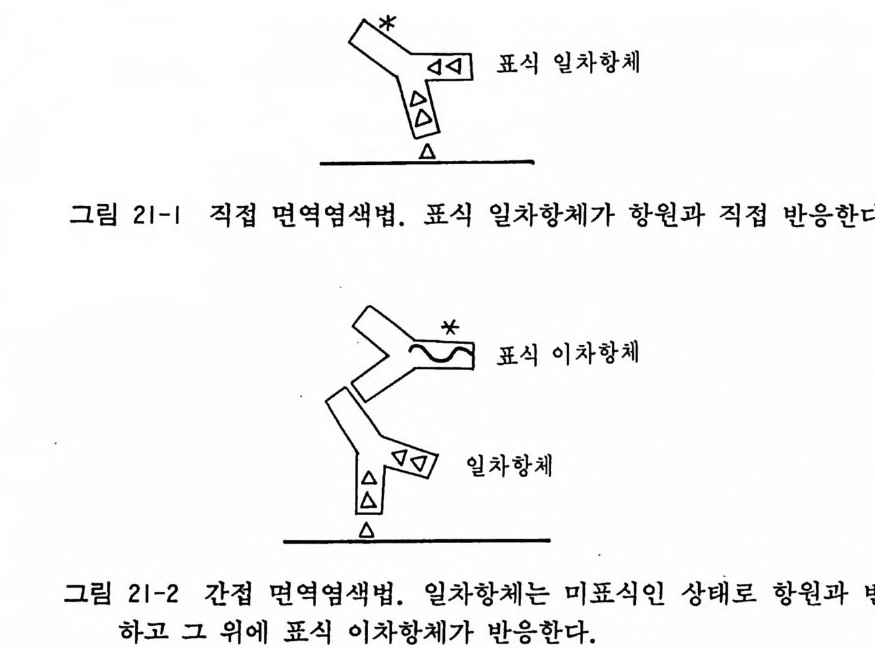 \ 표식일차항체
\ 표식일차항체
식을 결합시키는 번잡한 조작을 자기 연구실에서 하여야 하는 결 점이 있다• 그 반면 간접법은 표식 이차항체가 여러 가지로 제작 되어서 저렴한 가격으로 쉽게 입수할 수 있는 이점이 있다. 최근 에는 PAP 법, ABC 법 등 간접법을 보충한 감도가 높은 기술이 고안되어서 면역염색법이 널리 사용되고 있다. 21.1 형광항체 면역염색법 여기에서는 신생 랫트 대뇌 분산세포 배양을 써서 아스트로-사 이트(성상교세포)의 특이항원인 글리아산성섬유단백질 GFAP, glial fibr ill ar y ac idi c p ro t e i n 의 형 광항체 염 색 의 조작을 소개 한 다. 일차항체의 콘트롤로서 정상 토끼혈청 혹은 NS-1 마우스 골 수종세포 배양액을 희석하여서 사용한다. 형광현미경은 짜이스 Zeis s , 라이츠 Le it z, 울림퍼스 Ol y m p us 그리고 니콘 N i kon 등의
회사에서 시판하고 있다. 형광현미경은 광원으로서 형광을 발생 시키게 하는 자의선 근원인 초고압 수은 램프, 광선 스펙트럼에 서 파장을 선별하는 여과필터, 대물렌즈와 접안렌즈 사이에서 형 광색조의 조정을 하는 흡수필터, 암시야 콘댄서, 현미경 사진촬 영을 위한 카메라와 그 조정장치의 몇 가지 콤비네이션으로 되어 있다. 형광현미경은 광원의 쏘이는 방향에 따라서 투과형과 낙사 형 두 가지가 있는데 최근에는 낙사형이 주류가 되어 있다. 면역 염색 표본을 관찰함에 있어서 형광을 일으키는 광선의 파장을 선 덱하는데 필터의 콤비네이션에 따라서 UV, BV, V, B, G 의 다섯 가지가 있으며 플루오레신(녹색 형광)의 경우에는 B, 로다민 (적색 형광)의 경우에는 G 콤비네이션을 사용한다. 〈 재료 〉 1) 일차항체-토끼 항인간 GFAP 항체 2) 이 차항체 -플루오레 신fl uoresce i n 표식 산양 항토끼 IgG 항 처] 3) 희 석 액 -HHH (핸크스액 -HEPES-horse serum) 핸크스액에 lOmM HEPES 완충액과 1% 마혈청을 첨가하여 서 항체의 희석액으로 사용한다. 4) 마이크로 파이펫 (5-200 짜와 100-1,000µ1) 과 파이펫팁 5) 마이크로 듀브 6) 챔 버 chamber 10cm 페트리딧슈 바닥에 파라필름을 꼭 맞게 깔고, 페트 리딧슈 뚜껑 내면에는 필터페이퍼를 테입으로 붙이고 물로 적셔서 페트리딧슈 내부가 마르지 않도록 한다. 〈방법〉 1) 랫트 대뇌세포 배양 커버슬립을 HHH 액으로 한 번 씻고, 미리 차게 해두었던 메틸알코올 속에서 영하 20 도에서 10 분
간 고정한다(냉장고의 동 결 챔버에서). 2) 고정된 커버슬립을 PBS 로 두 번 씻는다. 3) 커버슬립을 챔버로 옮기고 토끼 항 GFAP 항체 (HHH 나 PBS 로 1 : 100 으로 희석) 를 20-30µ1( 커버 슬 립 크기에 따라서 양 이 다르다) 울려서 1 시간 실온에서 반응시킨다. 4) 커버슬립을 PBS 로 세 번 씻는다. 5) 플루오레 신 표식 산양 항토끼 lgG 항체 (HHH 나 PBS 로 1 : 50 으로 희석) 20-30µ1 을 울려서 1 시간 실온에서 반응시킨다. 6) 커버슬립을 PBS 로 세 번 씻는다. 7) 유리 슬라이드 위에 글리세린 -PBS(9 : l) 혹은 젤바톨로 봉 입한다. 8) 형광현미경 밑에서 검색한다. 신생 랫트 대뇌세포 배양에서 아스트로사이트가 GFAP 항체에 염색된 것을 그림 21 一 3 에서 보였다.
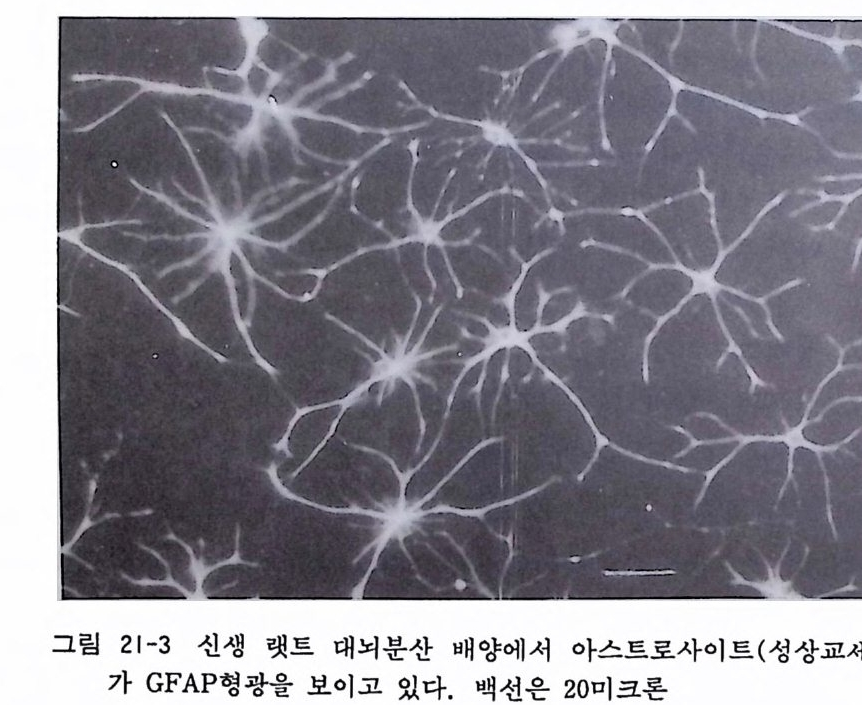 그림 21- 3 신생 랫트 대뇌분산 배양에서 아스트로사이트(성상교세포)
그림 21- 3 신생 랫트 대뇌분산 배양에서 아스트로사이트(성상교세포)
성숙 마우스 척수후근신경절 dorsal root ga ng li o n 세포를 분 리하여 10% 마혈청을 포함한 배양액에서 이주일간 배양한 다음 그 신경세포를 마우스 항신경필라멘트 neuro fil amen t 모노클론 항체를 사용하여 면역염색한 것이 그림 21-4 이다. 그 염색방법은 위에서 설명한 형광항체 염색법과 같다.
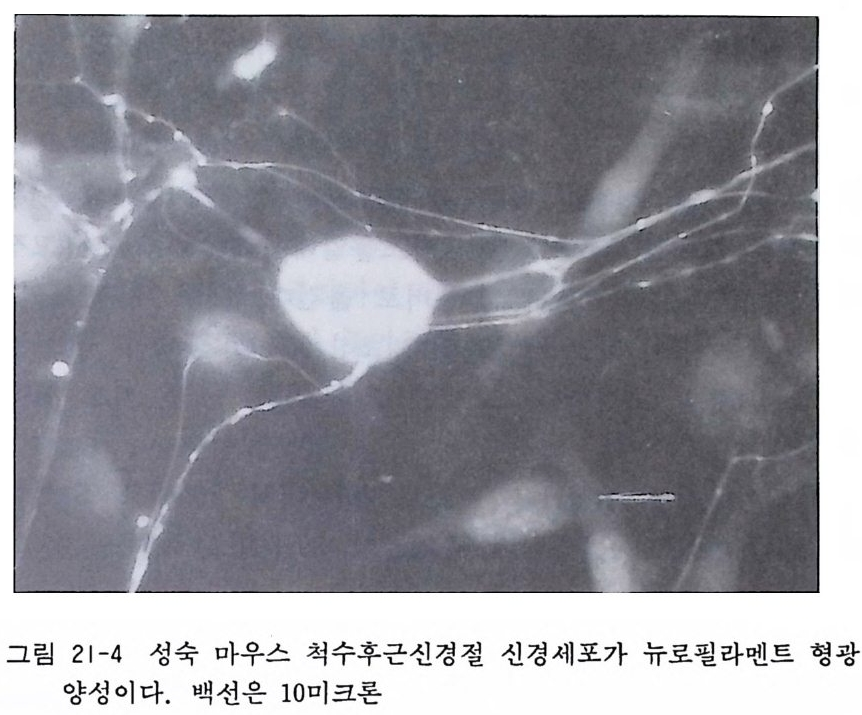 그림 21-4 성숙 마우스 척수후근신경절 신경세포가 뉴로필라멘트 형광
그림 21-4 성숙 마우스 척수후근신경절 신경세포가 뉴로필라멘트 형광
21 .2 효소항체 면역염색법 항원의 세포표면 혹은 세포 내 존재를 증명하려면 효소단백질 을 항체와 결합시켜서 항체의 마커 marker 로서 쓸 수가 있다. 항 원과 항체롤 작용시켜서 그 존재를, 항체를 표식하고 있는 효소 를 가시화시킴으로써 관찰한다는 원리이다. 마커로서 사용되는 효소에는 여러 종류가 있는데, 그 중에서 가장 보편적인 것이 페
록시다제와 알칼리포스파타제이다. 효소항체 면역염색법에는 효 소표식 항체 간접 법 , 효소표식 프로틴 A 법 , PAP 법 (pe roxid a se- anti pe roxid a se) , ABC 법 (avid i n - bio t i n comp le x) 등 네 가지 가 있다. 21 .2. 1 페록시다제 표식항체 간접법 이 간접법의 원리는 그림 21-2 에 설명되어 있다. 〈방법 〉 1) 배양 커버슬립을 꺼내어서 세포표면 항체의 경우에는 살아 있는 그대로, 혹은 4% 파라포름알데히드에서 5 분간 고정한 뒤, PBS 로 두 번 씻고 챔버로 옮긴다. 세포 내 항원인 경 우에는 산성 알코올(알코올 : 빙초산 95 : 5) 중에서 영하 20 도 로 10 분간 고정한다. 고정한 뒤 PBS 로 두 번 씻고 챔버로 옮건다• 2) 일차항체를 HHH 나 PBS 로 20 배에서 100 배로 희석하고 30-100µ1 를 커버슬립에 올려놓고 30-60 분간 실온에서 인큐 베이트한다. 3} 커버슬립을 PBS 로 세 번 씻는다 4) 페록시다제 표식 이차항체(산양 항토끼 혹은 산양 항마우스 I gG)를 PBS 로 40 배에서 100 배 희석하고 커버슬립에 첨가하 여 실온에서 30 분간 반응시킨다. 5) 커버슬립을 PBS 로 세 번 씻는다 6) DAB 액에 과산화수소를 넣어서 그 속에서 커버슬립을 5-10 분간 반응시킨다 (2 1. 2.2 . 참고). 7) 커버슬립을 PBS 로 두 번 씻은 뒤 알코올 탈수, 자일렌 투 철을 하고 파마운트에 봉입한다. 8) 현미경 아래서 검색한다.
21 .2. 2 DAB 용액 DAB 는 시그마에서 살 수가 있다. DAB 용액은 다음과 같이 작성한다. 1) 디 아미 노벤 지 딘 (3, 3-dia m i no benzid i n e tet r a hy d roxy ch lo-rid e ) 5m g을 0 . 05 M 트리 스 완충액 (pH 7 . 6) 10ml 에 녹이 고 필터페이퍼로 여과시킨다. 2) 30% 과산화수소액 0 . 01ml 롤 0 . 6ml 증류수에 희 석 하고, 그 0 . 01ml 를 10ml DAB 액 에 첨 가한다. 3) DAB 액 속에 nic k el ammoniu m sulfa te 30mg 혹은 cobalt chlorid e 40m g을 첨 가한 뒤 에 과산화수소액 을 추가하면 페 록시다제 염색이 증가하여 반응의 색조가 갈색에서 흑색으로 바뀌고 콘드라스트가 높아진다. 21.2.3 ABC 면역염색법 ABC (av id i n - bio t i n pe roxid a se com p lex) 법의 원리는 그림 21-5
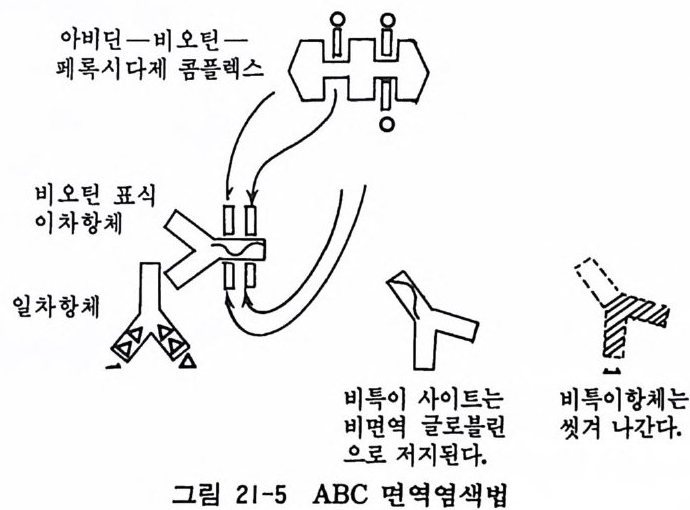 -` `
-` `
에 설명되어 있다 〈방법〉 1) 배양 커버슬립을 4% 파라포름알데히드 중에서 5 분간 실온 에서 고정하거나 산성 알코올 중에서 15 분간 영하 20 도에서 고정한 뒤, PBS 로 두 번 씻고 챔버로 옮긴다. 2) 비면역혈청 (이차항체와 같은 동물)의 40-100 배 희석액 (PBS) 을 커버슬립에 울려놓고 20 분간 실온에서 반응시킨다. 3) 커버슬립에서 비면역 혈청을 씻어내지 않고 가볍게 불로팅 을 하여 버리고, 일차항체 희석액 (100-1000 배, PBS) 을 올려 놓고 실온에서 1-2 시간 반웅시킨다. 경우에 따라서는 24, 48, 72 시간 4 도에서 인큐베이트한다. 4) 커버슬립을 PBS 로 세 번 5 분씩 씻는다• 5) 비오틴 표식 이차항체를 PBS 로 40-100 배 희석하여 커버슬 립에 올려놓고 30 분간 실온에서 반응시킨다. 6) 커버슬립을 PBS 로 세 번 5 분씩 씻는다. 7) 아비딘액과 페록시다제 결합 비오틴액의 혼합액 (벡터 Vec t or 의 ABC 액은 A 액과 B 액을 0 . 04ml 씩 섞어서 이를 PBS 나 트리스 완충액 5ml 에 희석한다)을 커버슬립에 올려놓고 30 분간 실온 에서 반응시킨다. 8) 커버슬립을 PBS 로 세 번 5 분씩 씻는다. 9) DAB 반응을 5-10 분간 한다 (21 . 2 . 2 참고) . 21.2.4 PAP 면역염색법 PAP( perox i dase-an tip erox i dase) 법의 원리는 그림 21-6 에 설명 되어 있다.
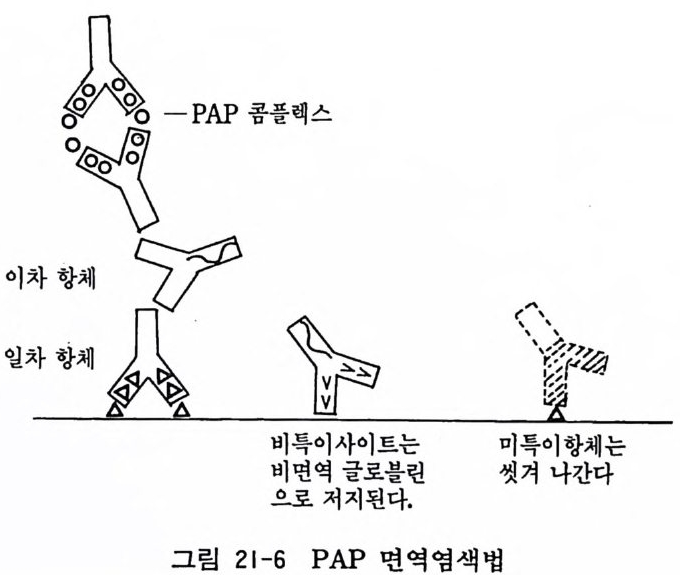 일이차차항항체체 ?n > \ r` ^` ` `` ` f`/ . 〈;;多
일이차차항항체체 ?n > \ r` ^` ` `` ` f`/ . 〈;;多
〈방법〉 1) 배양 커버슬립을 4% 파라포름알데히드 중에서 5 분간 실온 에서 고정하거나 산성 알코올 중에서 15 분간 영하 20 도에서 고정한 뒤, PBS 로 두 번 씻고 챔버로 옮긴다. 2) 비면역혈청 (이차항체와 같은 동물, 일반적으로 산양이나 토끼) 의 40-100 배 희 석 액 (PBS) 을 커 버슬립 에 올려놓고 20 분간 실 온에서 반응시킨다. 3) 커버슬립에서 비면역혈청을 씻어내지 않고 가볍게 블로팅을 해서 버리고, 일차항체 희석액 (100 배 -1,000 배)을 올려 놓고 실온에서 1-2 시간 반응시킨다. 4) 커버슬립을 PBS 로 세 번 5 분씩 씻는다. 5) 미표식 이차항체를 PBS 로 40-100 배 희석하여 커버슬립에 울려놓고 30 분간 실온에서 반응시킨다. 6) 커버슬립을 PBS 로 5 분씩 세 번 씻는다 7) 커버슬립에 PAP 희석액(일차항체가 모노클론 마우스이면 마 우스 PAP, 토끼 이면 토끼 PAP 를 PBS 로 100 배 희석) 을 울려
 -r 며 -. = ..` ..
-r 며 -. = ..` ..
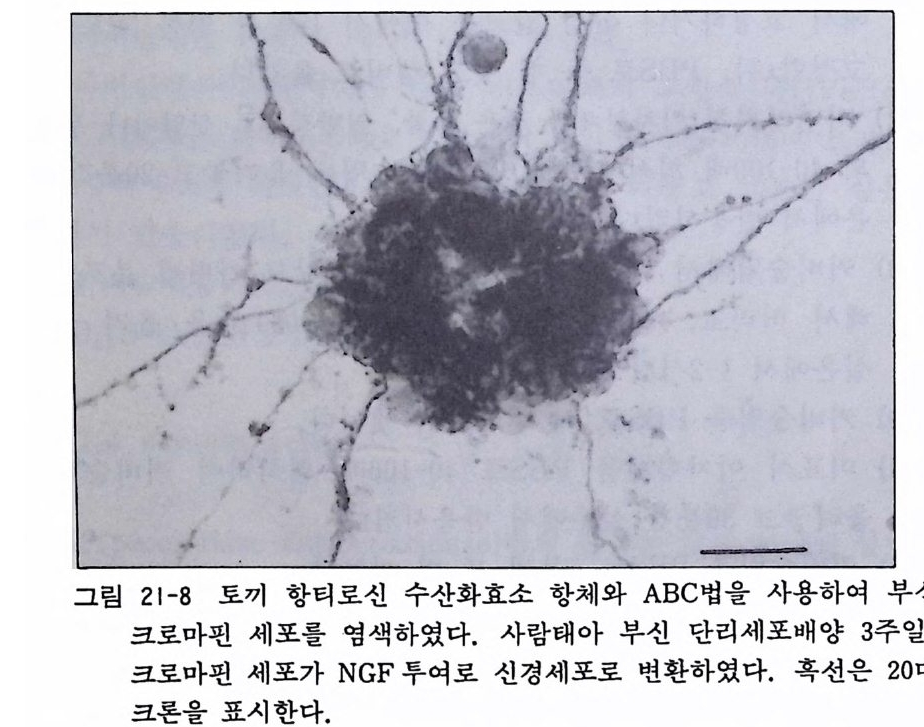 - · . ·•· ., . 느 소 /'
- · . ·•· ., . 느 소 /'
놓고 30 분간 실온에서 반응시킨다. 8) 커버슬립을 PBS 로 세 번 5 분씩 씻는다. 9) DAB 반응을 5-10 분간 한다 (2 1. 2.2 참고). 10) 탈수-두철-파마운트 봉입-현미경 관찰을 한다. 그립 21-7 에서는 계태 척수 신경세포를 모노클론 항아세틸콜린 에스테라제 항체와 PAP 법을 써서 염색하였고 그림 21-8 에서는 사람태아 부신 크로마핀 세포를 토끼 항티로신 수산화 효소 항체 와 ABC 법을 써서 염색하였다.
제 22 장 오토라디오그라피와 방사성물질 측정법 배양세포의 중식능력을 검사하는 데 가장 보편적으로 사용되는 기술은 트리튬표식 티 미 딘triti a t ed thyrni d i ne 을 취 득한 세 포를 신틸레이션 카운터 s ci n till a ti on coun t er 로 그 방사능을 자동적으 로 측정하는 방법 과 오토라디오그라피 au t orad i o grap h y에 의 해서 사전유제 emuls i on 위에 은입자 s il ver gr a i n 로서 검출하는 두 가 지 방법이 있다. 세포가 증식하려면 DNA 를 합성하여야 하는데 이것은 세포주기 cell cy c le 중에서 S 기에만 가능하며 이때에 세 포가 티미딘을 취득하여 DNA 로 변환시키는 것을 이용한 것이 다. 22.1 오토라디오그라피 〈재료〉 1) [H 기티미딘 2) PBS 3) 고정액 -4% 파라포름알데히드 45)) 사사전전유현제상 액-K —oKdaodk a kN TDB-1-92 사전정착액 6) 밀봉상자
〈 방법 〉 1) 배양세포가 자라고. 있는 커버슬립을 [H 기티미딘 (0 . 5µC i/ rnl 최종 농도)이 들어 있는 배양액 속에서 2_12 시간 인큐베이트 한다. 2) 커버슬립을 PBS 속에서 두 번 간단히 씻는다. 3) 커버슬립을 4% 파라포름알데히드액 속에서 5 분 고정한다. 4) 커버슬립을 PBS 속에서 두 번 2 분씩 씻는다 5) 커버슬립을 해마득시린액 속에서 2 분간 염색한다. 6) 커버슬립을 PBS 속에서 두 번 2 분씩 씻는다. 7) 커버슬립을 드라이어를 써서 건조시킨 다음, 유리 슬라이드 위에 파마운트로 정착시킨다. 8) 여 기서부터는 Kodak No. 2 dark red 필터를 사용하고 암 실에서 행한다. 사전유제롤 워터베스 속에서 45 도로 가온해 서 녹이고 그 5ml 롤 물 5ml 를 써서 두 배로 희석한다. 9) 커버슬립이 울라 있는 슬라이드를 한 장씩 사전유제 속에 2 초씩 담그고 수직으로 끌어올린 다음 세워서 건조시킨다. 10-15 분간 건조시 킨다. 10) 슬라이드를 실리카젤 건조제가 들어 있는 밀봉상자에 넣고 데이프를 써서 밀봉한다. 냉장고 속에 4 도의 온도에서 4 일 -7 일간 노출시킨다. 11) 현상은 실온에서 5 분간, 정착은 10 분간, 수선은 15 분간으 로 그 뒤에 충분하게 건조시킨다. 12) 건조시 킨 뒤 90% 알코올, 95% 알코올, 100% 알코올 두 번, 자일렌 두 번을 통하여 탈수와 투석을 한 뒤 파마운트로 매몰한다• 13) 현미경 아래서 관찰한다.
22.2 신틸레이션 카운터법 〈재료〉 1) [H 기티미딘 2) PBS 3) 1% NaNs 4) 0.2N NaOH 5) lN 영산 6) 신틸레이션액 (NEN 의 A q uasol 이나 Amersharn 의 ACSII 등이 시판되어 있다). 〈방법〉 1) 35mm 페트리딧슈 12 장에 세포부유액 (5X104/ml) 을 2ml 씩 주입하고 37 도에서 24 시간 배양한다. 2) 배양액을 버리고 신선한 배양액 1ml 를 주입한다. 세포증식 자극제 혹은 억제제를 0 . 01ml 씩 추가하고 1 시간 배양한다. 3) 각 페트리딧슈에 [H 기티미딘 (0.SµC i/ ml 최종농도)을 가하고 37 도에서 2-12 시간 배양한다. 4) 인큐베이터에서 페트리딧슈를 꺼내고 얼음 양동이 위에서 1% NaNs 액을 0.01ml 추가하여 반응을 정지시킨다. 5) PBS 로 두 번 세포를 씻고, 0.2 N NaOH 액을 0.5ml 주입 하여 세포를 용해시킨다. 6) 5 분 뒤 용해세포액을 플라스틱 시험관에 옮기고, 0.5ml 의 0.2N NaOH 액으로 페트리딧슈를 씻어내어 그 내용을 다시 시험관에 추가한다. 7) lN 염산 0.2ml 로 중화시킨 다음, 50% 트리크롤초산 (TCA) 0.15ml 를 첨가하여 4 도에서 30 분 정치하면 침전이 생건다. 8) 원심침전한 뒤 상청액을 버리고 침전을 5% 트리크롤초산으
로 한 번 씻는다. 9) 침전을 글래스필터 위에 옮기고 5% 트리크롤초산 두 번, 에틸알코올, 아세돈의 차례로 씻어낸다. 10) 글래스필터를 바이알에 넣고 신틸레이션액 1ml 를 첨가한 뒤 카운터에서 방사능을 측정한다.
제 23 장 전자현미경 전자현미경 elec tr on mi cr oscop y 기술은 1960 년 이래 의학과 생물학의 분야가 획기적인 전보를 가져온 이유의 하나가 되거니 와, 그 이전에는 생각하지도 못하던 세포의 미세구조가 세밀하게 하나씩 가시화될 수 있게 하였다. 전자현미경 아래에서 명확하게 보이는 각 세포소기관이 담당하고 있는 생리기능이 무엇인가 하 는 의문에서 시작되어 생화학, 생리학, 분자생물학의 각 분야가 역시 활성화되어서 오늘날의 의생물학의 폭발적인 지식축적의 기 반이 되었다. 전자현미 경 분야에 서 는 투과전 자현 미 경 tra nsmi ss io n electr o n mi cro scop e, 주사전자현미경 scann i ng electr o n m ic rosco p e 울 중 십으로 하여 이에 세포화학, 면역화학, 동결절편 제작법, 원소분 석법 등의 기술을 병용함으로써 새로운 연구분야가 크게 전개되 고 있다. 조직배양 세포를 전자현미경 하에서 관찰하는 것도 이 러한 새로운 전개의 하나가 된다. 배양세포를 위상차현미경 아래서 관찰하고 사진촬영을 하여 세 포형태, 증식상태 등을 기록으로 남길 수 있으나, 이들 세포의 기능과 분화를 파악하려면 광학현미경 관찰만으로는 충분하지 않 고 생화학적 분석, 전기생리학적 분석 그리고 전자현미경에 의한 세포의 미세구조 검색이 중요한 방법이 된다. 초기에 배양세포의 전자현미경 관찰은 페트리딧슈나 풀라스크 에서 증식한 세포를 트립신 처리 혹은 러버풀리스맨으로 긁어내 어서 원심침전한 뒤에 고정, 탈수, 포매의 각 과정을 거쳐서 전 자현미경 재료를 준비하였다. 이러한 방법으로는 효소처리나 기
계적 원인으로 인해서 세포 미세구조에 여러 가지 상처를 주었 다. 최근에 와서는 딧슈나 플라스크 그리고 커버슬립에서 세포를 배양하여 가능한 한 원상태로 고정, 포매하는 기술이 주류가 되 었다. 23.1 투과전자현미경 투과현미경의 기본구조는 광학현미경과 비슷한데 광원으로서 열전자 elec t ron 를 사용하며 이것이 자계형 렌즈(전자코일을 튜브 형으로 제작)를 지나면서 그 괘도가 바뀌어진다. 이 전자가 20-lOOnm 의 두께가 있는 에폭시스페시멘울 투과하여 또 한번 자 계 형 렌즈를 통과하면서 이 미 지 를 결상하게 된다 (그림 23-1) . 투
 그림 23-1 루과전자현미경의 전경
그림 23-1 루과전자현미경의 전경
과현미경에서 관찰된 배양 신경세포의 실례 를 그림 23 - 2 에서 볼 수가 있다 .
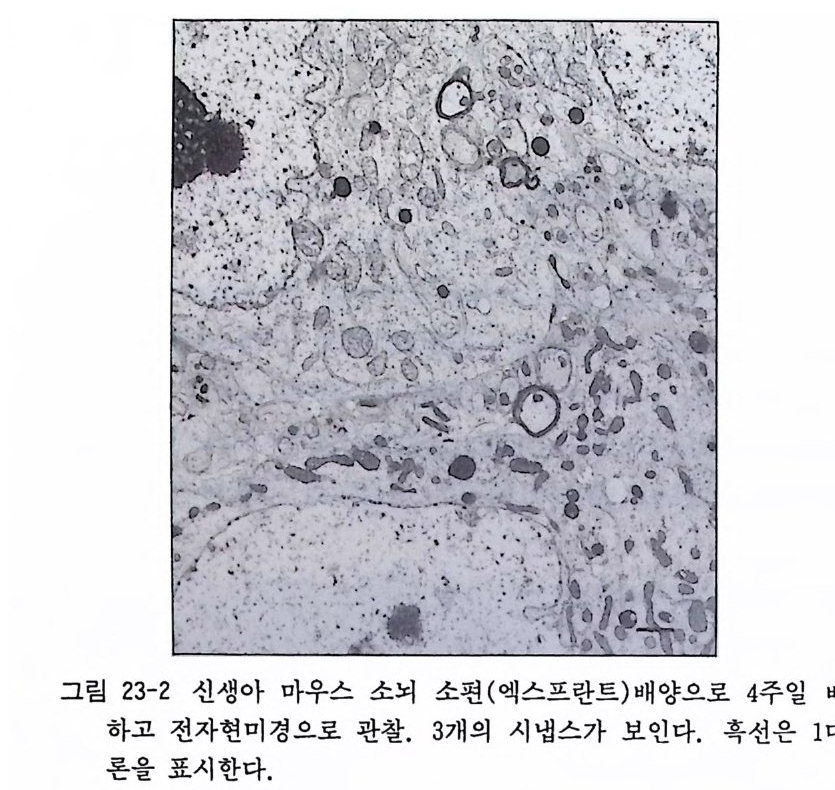 · 도 ( • --• •• · .' •- . •.... ,.I 튼 .. :•• • .•• •: ~ : ~. •: ’. •. . , ,•, ..• ._ . . ..•-- .~ . : · .~,\ ., ., .· .~ '-,- _` ,! '. r` .:.. - •., . ~. `• ~.: •• · .、.• .,·》 ;. ` •`' - ~.,일. ;'• .•l\’
· 도 ( • --• •• · .' •- . •.... ,.I 튼 .. :•• • .•• •: ~ : ~. •: ’. •. . , ,•, ..• ._ . . ..•-- .~ . : · .~,\ ., ., .· .~ '-,- _` ,! '. r` .:.. - •., . ~. `• ~.: •• · .、.• .,·》 ;. ` •`' - ~.,일. ;'• .•l\’
아래 적은 방법에서는, 아크라플라스틱 커버슬립이 에폰과 중 합하지 않는 성질을 이용하여 세포와 커버슬립 경계면이 깨끗하 게 분리되는 경우를 설명하였다. 배양세포를 풀라스틱 페트리 딧 슈나 플라스크에 배양한 경우에는 딧슈나 풀라스크를 원상태로 고정, 탈수를 하고 프로필렌옥사이드 대신에 100% 알코올에서 알코올-에폰 혼합액으로 처리하고 그 다음에 에폰액으로 포매하 도록 한다. 풀라스틱과 에폰수지를 분리하려면 자기가 원하는 장 소 주위를 잘라내고 액체질소 속에 3 분 가량 넣었다가 공기 중에 꺼내면 간단하게 풀라스틱이 벗겨진다. 유리 슬라이드 위에서 배
양한 경우는 에폰포매 뒤에 유리 슬라이드를 핫플레이트 ho t pla te 위에서 150 도의 열로 1 분간 가열하고 유리와 에폭시수지의 열팽창률을 이용하여 순간적으로 분리한다. 〈재료〉 1) 배양세포(아크라플라스틱 커버슬립 위에서 배양) 2) 25% 글루타르알데 히드g lu t araldeh y de 3) 0.15M 카코딜레이트 완충액 cacod y la t e buff er , pH 7.3 4) 2% 오스뮴 oxm i um tet r o xid e 5) 알코올 6) 프로필 렌옥사이 드p ro py lene oxid e 〈방법〉 1) 배양세포(아크라플라스틱 커버슬립 위에서 배양)를 PBS 에서 잠깐 씻는다. 2) 2.5% 글루타르알데히드 (0.15M 카코딜레이트 완충액에 희석 한다)에서 30 분간 실온에서 고정한다. 3) 커버슬립을 PBS 에서 1 분간 씻는다. 4) 2% 오스뮴액에서 30 분간 실온에서 고정한다. 값비싼 오스 뮴울 절약하기 위해 커버글라스 위에 소량의 오스뮴을 산같 이 덮는다. 5) 다시 PBS 에서 1 분간 두 번 씻는다. 6) 70%, 80%, 90%, 95%, 100% 알코올로 차례로 탈수한다. 실온에서 각각 5 분씩 시행한다. 7) 알코올 • 프로필렌옥사이드 (1 : 1) 에 10 분간 정치한다. 8) 프로필렌옥사이드에 10 분간 정치. 9) 프로필렌옥사이드 • 에폰 (1 : 1) 속에서 2 시간 정치하는데, 이 과정까지는 실온에서 한다. 10) 적당한 풀라스틱 용기 바닥에 아크라 커버글라스를 놓고
(배양세포를 위로 향한다) 그 위에 에폰액을 봇는다. 에폰액 처방은 다음과 같다. A 액 : Ep o n 812 62ml DDSA 100ml B 액 : Ep o n 812 100ml MNA 89ml A 액과 B 액을 4 : 6 의 비율로 혼합한 뒤 DMP-30 을 전체양 의 1. 5% 가 되도록 첨가하고 잘 섞이도록 나무 막대로 혼합 한다. 11) 오븐 (59 도)에서 2-3 일간 경화시킨다. 12) 에폰 블록을 현미경 마이크로톰으로 미세 절편으로 만들고 우라닐아세데이트 uran y l ace t a t e 와 구영산연 lead cit ra t e 액으 로 전자염색을 한 다음 현미경 하에서 관찰한다. 23.2 주사전자현미경 물질의 표면에 전자 elec tr on 를 쪼이면 전자는 그 물질의 구성 원자와의 상호작용으로 산란하게 되어 점차로 그 에너지롤 상실 하고 마지막에 가서는 그 물질에 흡수되어 버린다. 이 과정에서 전자 혹은 전자파가 물질표면에서 전공 중으로 방사된다. 이렇게 의부로 방사되는 전자와 전자파가 보이는 반응을 종합하여 이미 지를 만들고 재료형태를 관찰하거나 원소분석을 하는 장치가 주 사전자현미경이다(그립 23.3). 따라서 주사전자현미경은 세포표 면의 형상과 변화를 입체적으로 관찰하기에 적합한 기술이다. 〈재료〉 23.1 과 같음.
 ]_
]_
〈 방법 〉 1) 투과전자현미경에서와 같은 방법으로 고정, 탈수를 한다. 2) 초산아밀에서 15 분간 두 번 실온에서 치환한다. 3) 건조용 넷트박스 내부에 필터페이퍼를 깔고 그 위에 커버슬 립을 놓는다. 임계점 건조장치에 넣어서 건조시킨다. 임계점 (예컨대 이산화탄소에서는 73 기압 31 도)을 경계로 하여 순식간 에 그 위는 기체, 그 아래는 액체로 변환하므로 기상, 액상 양쪽이 존재하지 않기 때문에 표면장력이 없어전다. 따라서 세포표면의 변형이 최소한으로 방지될 수 있다. 4) 건조한 커버슬립을 꺼내 이온 스퍼터i on s pu tt er 에 넣고 금 과 파라듐의 합금으로 코팅 coa ti n g을 한다. 5) 주사현미경 아래서 관찰한다.
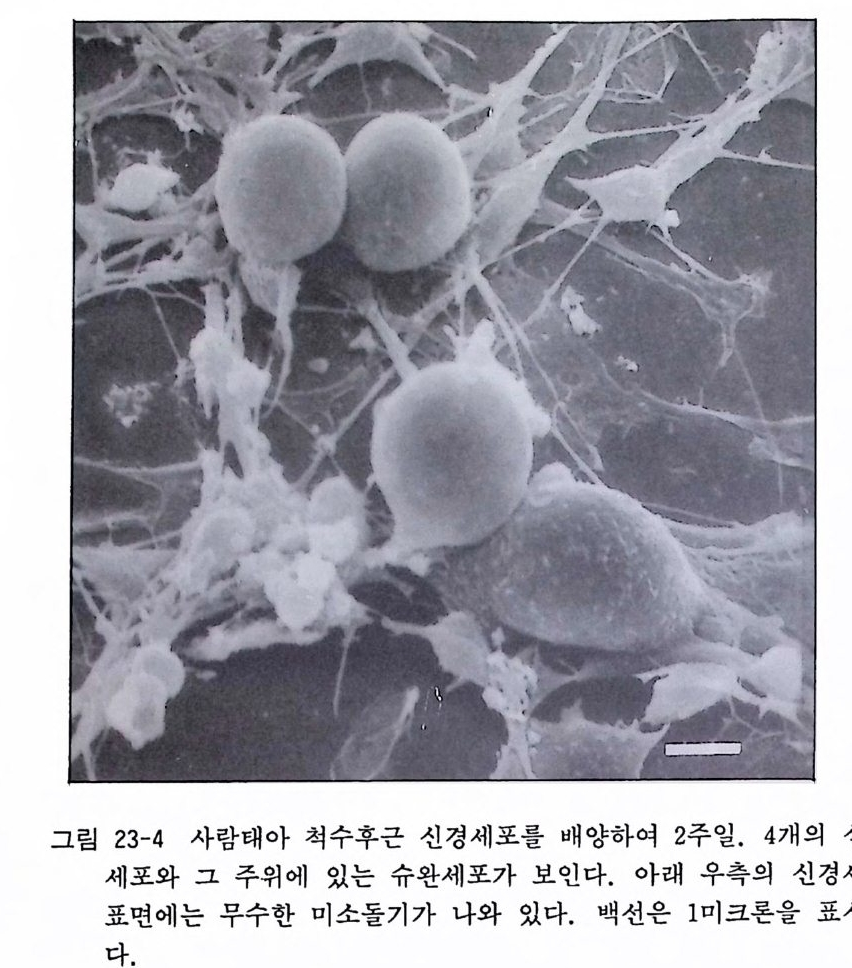 그립 23-4 사람태아 척수후근 신경세포를 배양하여 2 주일. 4 개의 신경
그립 23-4 사람태아 척수후근 신경세포를 배양하여 2 주일. 4 개의 신경
사람태아 척수후근 신경세포의 배양을 주사현미경 아래서 입체 적으로 관찰한 것을 그림 23-4 에서 보이고 있다.
참고문헌 1) Adams R: Cell Cultu r e for Bio c hemi sts , Elsevi er -Nort h Holland, Amste r dam, 1980 . 2) Balls M, Monnic k endam M: Orga n Cultu r e in Bio m edi ca l Resear- ch, Univ e rsity Press, Cambri dg e , 1976 . 3) Fedoroff S, Hert z H (Ed) : Cell, Tis s ue and Orga n Cultu re in Neurobio l og y, Academi c Press, 1977. 4) Fog h J: Human Tumor Cells in vitr o, Plenum, New York, 1975 . 5) Freshney R: Anim al Cell Cultu r e-Practi ca l Ap pro ach, IRL Press, Oxfo rd , 1986 . 6) Freshney R: Cultu r e of Anim a l Cells, Alan Liss , New York, 1987 . 7) Jak oby W, Pasta n I (Ed.) : Meth o ds in Enzym o log y, vol. 58, Cell Cultu r e, Academi c Press, New York, 1973 . 8) Kruse P, Patt er son M: Tis s ue Cultu r e-Meth o ds and Ap plica ti on s, Academi c Press, New York, 1973 . 9) Maramorosch K: Invert eb rate Ti ss ue Cultu re, 'Ac ademi c Press, New York, 1976 . 10) Merchant D, Kahn R, Mu rph y W (Ed.) : Handbook of Cell and Orga n Cultu r e, Burge s s Publi sh i ng , Mi nn eap o li s, 1964 . 11) Parker R: Meth o ds in Ti ss ue Cultu r e, 3rd Ed., Harp er- Row, New York, 1964. 12) Paul J: Cell and Tis s ue Cultu r e, 5th Ed., Church ill-L iv ingston e, Ed inb ergh , 1975 . 13) Rein e rt J, Yeoman M: Plant Cell and Tis s ue Cultu re: A Labora-
tor y Mannual, Sp ri n ge r, Berlin , 1982 . 14) Sato G: Ti ss ue Cultu r e of Nervous Sy s te m , Plenum, New York, 1973. 15) Thomas J: Orga n Cultu r e, Academi c Press, New York, 1970 . 16) Wasley G, May J: Anim al Cell Cultu re Meth o ds, Blackwell, Oxfo rd , 1970 . 17) 日本組織培養學會 : 組織培養技術, 朝倉書店, 東京, 1990. 18) 福井三郞, 杉野幸夫 : 細胞培養技術, 講談社, 東京, 1985 . 19) 金承業, 朝長正德 : 神經組織培養法, 藤田企劃出版, 東京, 1991 .
용어 해설 계 대 배 양 Subcul t ure 세포가 증식 하여 배 양기 바닥에서 밀도가 높아 지면 이들을 희석하여 새 배양기에 옮기게 되는데 이것이 계 대 배 양이 다. 계대 Passa g e 라 하기도 한다. 골수종 M y eloma 세포 골수의 종양에서 유래한 세포로서 모노클론 세 포제작에 사용한다. 기관배양 Or g an cultu r e 기관전체 혹은 그 일부를 조직배양 조건하에 서 보존하고 조직분화를 관찰하고자 하는 배양법. 기 질 Subs t ra t e 배 양세포가 발육할 수 있는 유리나 풀라스틱 딧슈, 플라스크 등의 배양기 표면, 그리고 콜라겐, 젤라틴, 폴리라 이신 등 배양기 표면을 덮은 물질을 총칭하여 말한다. 내배엽 Endoderm 배태의 내부총으로서 뒤에 위장, 간, 폐의 상피층 으로 분화한다. 내분비세포 Endocr i ne cell 호르몬, 성장인자 그밖의 신호물질을 분비 하는 세포로서 그 표적 세포는 이들 물질에 대한 리셉터를 가지고 있다. 내 피 세포 Endo the li al cell 혈관의 내 강을 구성 하는 세포로서 배 태 의 중배영에서 유래한다. 단리 세포배양Di sso ci a t ed cell cultu re 조직을 효소적 처리나 기계적 처리에 의해서 단독세포로 분리한 뒤 이룰 배양하는 기술로 서, 트립신과 콜라게나제에 의한 효소분리법이 가장 많이 사 용된다. 분리 세포배양이라 불리기도 한다. 단충배양 Monola y er cultu r e 세포가 배양기 바닥에 부착하여 증식하 는 경우를 말하며 대다수의 세포배양이 이 형식으로 중식한다. 동결보존 C ry o p reserva ti on 섭씨 영하 100 도 이하에서 세포, 조직,
배태(엠브리오), 종자, 정자 등을 동결하여 저장하는 기술. 모노클론 항체 Monoclonal anti bo dy B 임파세포의 클론이 생산하는 면역항체를 말하는데, 보통 비장유래 B 세포와 골수종세포의 잡종세포에서 생산되는 항체를 의미한다. 무균기 술 Ase ptic tec h niqu e 조직 배 양에서 곰팡이 , 세균, 바아 러스, 마이코플라스마 등의 미생물이 조직배양 속에 들어가지 않도 록 예방하는 기술이다. 무한증식 I nfinit e grow th 초대배양 세포의 계대를 계속하다가 증식을 무한히 할 수 있는 능력을 가지게 된 수립세포계 es t ab li shed cell li ne 를 말한다. 무혈청배양액 Serum free med ium 배양세포에게 영양을 공급하는 배 양액으로서 혈청을 포함하지 않고 그 구성성분이 알려져 있 는 무기염, 비타민, 아미노산, 호르몬, 성장인자로만 되어 있는배양액 배가시간 Doub li ng tim e 배양 세포수가 두 배로 증가하는데 소요되는 시간. 배양액 Me di um 무기영, 아미노산, 비타민 그 밖의 영양분을 포함한 용액으로서 그 속에서 배양세포가 최소한 24 시간 이상 생존 할수가 있다. 배태배양 Emb ry o· cultu r e 배양기 중에서 모체에서 분리된 배태가 정 상으로 발육하게 하는 배양기술. 부유배양 Sus p ens i on cultu r e 세포가 배양기 바닥에 부착하지 않고 부 유한 상태에서 증식하는 경우이며 혈액유래세포, 복수세포 등이 이 상태에서 발육한다. 분열지수 M it o tic ind ex 일정 시간 안에 분열하는 세포수를 전체 세 포수에 대하여 퍼센트로 표시한 지수. 분화Diffe ren ti a ti on 배양세포에서 본래의 유래세포에서 보이는 특이 한 형태와 기능이 그대로 보존되는 현상. 상피 세포E pith e li al cell 본래는 피부상피 에서 유래한 세포를 의 미 하 나 조직배양에서는 다각형 형태에 서로 경계가 분명한 세포 룰말한다. 색소배제Dy e exclusio n 배양세포를 트리판블루나 니그로신으로 염색 하면 살아 있는 세포는 무염색이나 죽은 세포는 파랗게 염색
되므로 배양세포의 생사를 판단할 수 있다. 섬유아세포 F i broblas t 증식능력이 높은 섬유세포의 전구세포. 방추형 spi ndle 이 나 다각형 mul tip olar 의 형 태를 가지 며 접 촉저 지 현 상을보인다. 세포계 Cell li ne 초대배양에서 시작된 세포가 계대배양에 의해서 증 식하고 수대 이상 배양이 가능한 경우. 세포밀도 Po p ula ti on densit y 배양기의 단위면적 안에 있는 세포수. 세포밀도 증식저지 현상 Dens ity dep e ndent grow th inhibi t ion 세포가 증식하여 세포밀도가 높아지면 세포의 증식이 저지된다. 세포배양 Cell cultu r e 분산된 세포를 시험관 속에서i n vit ro 2 4-'-]간 이상 발육시키는 방법. 세포융합 Cell fus io n 두 세포가 융합하여 하나의 세포가 되는 것이 며, 실험적으로는 바이러스, 폴리에틸렌 글리콜, 전기융합에 의해서 융합조작을 한다. 수립주세포 Es t ab li shed cellli ne 초대배양에서 시작된 세포가 무한중 식성을 가진 경우이며 단일세포가 증식하여서 그 자손만으로 구성된 세포계를 수립주세포라 한다. 악성 형질전환 Ma lign an t tra nsfo r mati on 형질전환한 세포가 정상조 직을 무질서하게 침두하는 능력을 갖게 되는 현상. 염류용액 Balanced salt s oltu i o r i 배양액 중에서 나트륨, 칼륨, 칼슘, 마그네슘 등의 무기이온을 공급하고 삼두압과 p H 를 조절하 며 각종 시약의 용매로 사용하는 용액이다. 얼 Earle, 핸크스 Hanks, 가이 Ge y 등 여 러 가지 처 방이 있다. 외배엽 Ec t oderm 배태의 의부충으로 피부상피 조직으로 분화한다. 유전자형 Geno type 세포의 유전형질의 특장. 유한증식 F init e grow th 생물체에서 분리되어서 배양되는 세포는 대 부분이 계대를 계속하면 중도에서 증식이 중지된다. 이배체세포 D ip lo i d 성영색체를 제의한 모든 염색체의 수가 이배수 있으며, 세포가 유래된 원래 동물체의 세포와 형태와 수가 동일한 경우 사람에서는 46, 마우스에서는 36, 랫트에서는 40 이 정상이다. 잡종세포 H yb ri d 두 가지 다른 종류의 세포가 세포융합 기술에 의하 여서 하나의 세포막 안에 들어가서 단일세포가 되는 것.
재응괴 세포배양 Rea ggr e g a t e cultu r e 단리세포를 풀라스크에 넣고 이룰 셰이커 위에서 선회시키면 다수의 세포가 작은 세포덩 어리로 다시 모여들어서 조직과 유사한 형태를 갖는다. 선회 배 양 ro t a ti on cull t ure 이 라 불리 우기 도 한다. 접착인자 A tt achmen t fac to r 배양기 표면에 코팅하여 배양세포의 접 착을 크게 증가시키는 물질로서 폴리라이신, 파이브로넥틴, 라미닌, 콜라겐 등이 있다. 접촉억제 현상 Con t ac t inh ib i t ion 세포가 증식하여 배양기 바닥에 빈 름없이 발육하고 세포가 서로 접촉하게 되면 세포증식이 저 지되는 현상이다. 조직 배 양 T i ssue cultu r e 세포, 조직 혹은 기 관을 시 험 관 속에서 in vit ro 24 시간 이상의 기간동안 보존 혹은 발육시키는 방법을 의 미 하여 세 포배 양 cell cultu r e, 조직 배 양ti ssue cultu r e, 기 관 배양 or gan cultu r e 그리고 식물조직배양p lan t tiss ue cultu re 이 여기에 포함된다. 조직추출액 T i ssue extr a ct 천연배양액에 속하는 물질로서, 계태추출 액이 가장 보편적으로 사용된다. 이 밖에도 근육추출액, 뇌 추출액에서는 특징적인 성장촉진 인자가 발견되었다. 조직추 출액을 배양액의 일부로 첨가하면 세포증식과 분화촉진의 효 과가 있다고 보고되고 있다. 조직 편 배 양 Ex p lan t cultu r e 이 식 편 배 양이 라고도 하며 , lmm3 정도 의 조직편을 콜라겐이나 젤라틴과 갇은 기질 위에 울려놓고 배양하며 조직의 원래형태나 기능을 가능한한 유지하면서 배 양하는 기술. 중배엽 Mesoderm 배태의 가운데 충으로서 내배영과 의배엽 사이에 있으며 결체조직, 연골, 근육, 혈액성분들이 여기에서 유래 된다. 증식곡선 Gro wth curve 세포를 배양하면서 정기적으로 세포수를 계 산하여 이것이 두 배가 되는 시간을 계산한다. 착상효율 Pla ti ng eff icien cy 일정 시간 안에 도입된 세포 가운데 배양 기구 표면에 착상한 수를 퍼센트로 표시한 것. 천연배양액 Na t ural med ium 배양세포가 생존하고 증식함에는 배양액 속에 혈장, 혈청, 조직추출액, 효모추출액, 스킴밀크 등의
천연배양액이 일부분 포함되어야 한다. 천연배양액에서 가장 흔히 쓰이는 것이 혈청이며 이에는 우태아 혈청fet al bov ine serum, 신생우혈청 ca lf serum 그리고 마혈청 horse serum 등 이 있다. 초대배양 P ri ma ry cultu r e 동물조직이나 기관에서 직집적으로 분리된 세포나 조직편을 배양조건하에서 발육시키는 기술. 초대배양 이 성공적으로 계대배양되면 세포계 cell li ne 가 된다. 클로닝 Clon i n g 소수의 단독세포를 페트리딧슈나 멀티웰 플레이트에 뿌려서 단일세포의 자손으로만 된 세포집단을 얻는 기술. 클론 Clone 단일세포가 증식하여서 세포집단을 만드는 것. 클론효율 Clon i ng eff ici e n cy 도입된 단일세포 가운데서 클론을 만드 는 세포수롤 퍼센트로 표시한 것. 탈분화 Ded iffe ren ti a ti on 배양세포에서 본래의 유래세포에서 보는 형 태와 기능이 상실되는 상태로서 분화의 반대. 포화밀도 Sa t ura ti on densit y 특정 배양조건하에서 배양기의 단위면적 안에서 발육할 수 있는 최고 세포수. 표현형 Pheno typ e 배양세포가 표현하는 형태적, 생화학적 그리고 생 리적인 특징. 합성배양액 S ynth e tic med ium 배양세포가 생존하고 증식함에 있어서 최소한으로 필요로 하는 영양분인 무기이온, 아미노산, 비타 민, 핵산염기, 희금속영을 포함하고 있는 배양액으로서 199 배양액, 이글 MEM, 행 F-12 등이 이에 속한다. 핵형 Kar y o typ e 염색체는 유전자를 지니는 실체이며 DNA, 단백질 그리고 소량의 RNA 를 포함하며 동물의 종류마다 고유의 형 태와 수를 가지고 있다. 이를 핵형이라 하는데 악성화한 세 포, 선천성질환 환자의 세포, 바이러스나 방사선에 쪼인 세 포에서는 핵형에 변화가 온다. 형질유도 Induc ti on 자극에 의해서 세포형질 표현이 증가되는 현상이 며, 예컨대 호르몬 자극에 의해서 배양세포에서 효소생산이 증가하는 경우를 말한다. 형질전환 Trans fo rma ti on 바이러스, 방사선, 발암물질 등에 의해서 배양세포가 세포형태와 세포성질이 영구히 변화하는 것.
기 가스멸균 37 가스버너 32 간접법 169 건열멸균기 19, 20, 36 계대배양 67 계배 간세포 배양 93 계배 근육세포 배양 91 계배 뇌척수세포 배양 94 계배 섬유아세포 배양 88 계베 척수후근신경절 배양 97 고압증기 멸균기(오토클레이브) 19, 20, 36 공기여과장치 19 글래스필터 183 금속제거제 131 기계적 세포분리 131 기구세척 34 기질 144 김사염색 165 L 나이론메시 85, 132 노화연구 17, 81 뉴트럴레드 168
C 단리세포배양법 84 대수증식기 73 독성검사법 155 돌연변이 68 디메틸설폭사이드 DMSO 1s 디스파제 130 디아미노벤지딘 DAB 175 DNA 가수분해 효소 DNase 86, 129 DNA 형 광염 색 법 160 己 라미 닌 39, 133, 137 락토알부민 가수분해물 39 러버풀리스맨 32, 67, 132 로즈 Rose 배 양기 58 리톤 Lit ton 배양기 58 리민카민 168 □ 마우스태아 뇌신경세포 배양 98 마우스태아 신장세포 배양 99 마이코풀라스마 160 마이크로캐리어 61
맥시모우 Max i mow 배양기 58 멀티웰 챔버 29 메 틸그린-파이로닌 167 메틸렌블루 168 면역세포화학 169 멸균 34, 35 명시야현미경 27 모노클론 항체 148, 169 무균검사 46 무균공기상류벤치 19 무균벤치 19, 26 무균조작 65 무한증식 117 무혈청배양액 140 닌 바이러스 145 방사능 183 방사성물질 측정법 180 배양액 38 배양액 교환 66 배양액병 29 밴딩법 162 부유배양법 60 부착인자 133 분열촉진분자 105 분자생물학 13 불꽃멸균 37
비디오카메라 27 비장 150 비트로넥틴 138 빅토리아블루 168 人 사람 뇌하수체세포 배양 109 사람 암세포 배양 113 사람 임파구 배양 105 사람피부 섬유아세포 배양 107 사멸기 73 사이 크스-무어 Sy k es-Moore 배 양기 58 사진촬영 장치 27 삼두암 39 샌드위치법 82 생리활성물질 13, 14 생물시계 81 생물학 18 생체염색 168 선회배양법 59 성숙랫트 간세포 배양 101 성 장인자 140, 143 세균 펩톤 39 세레늄 141 세포기질 133 세포동결보존법 78 세포발생 13
세포배양 13 세포분리법 128 세포분화 13 세포수계산 75 세포수측정기 75 세포염색법 165 세포운반 80 세포융합 145, 148 세포 집착인자 144 세포주 117 세포증식 13 셰이커 60 수립세포계 117 수술기구 32 스크레이퍼 132 스킴밀크 39 스터링 마그네트 60 스데인리스 스틸 스크린 115 스핀어 병 60 시험관 29 식물조직배양 17 신경 성장인자 143 신틸레 이션 카운터 182 실체현미경 27 。 아미놉테린 145 아크라플라스틱 186
알코올 65 암연구 18 암종세포 124 에오신 eosin 액 167 ABC 면역염색 175 엘라스타제 128 ELISA 비색기 151, 156, 159 엘렌마이어플라스크 59 L 세포 162 MTT 검사법 158 엣칭법 82 여과멸균기 20, 36 영류용액 39 염색체 표본 162 오토라디오그라피 180 원심분리기 23 원심듀브 29 위상차도립현미경 27 유리조각법 71 유전공학 18 유한증식 117 의학 18 이소졸엑트바이올렛 168 이온 39 이온교환 컬럼 19, 23 이온스퍼터 189 인산염 완충용액 41 인슐린 141 인슐린유사 성장인자 141 인큐베이터 19, 25
그 자외선멸균 37 자의선 살균등 66 잡균감영 160 잡종세포 145 재응집 배양법 59 전자 188 전자파 188 전자현미경 184 전장융합법 145 정지기 73 정치배양법 57 제한희석법 68 젤라틴 139 조직배양 13 조직배양의 역사 14 조직소편배양법 82 조직체 131 조직추출액 16, 38, 39 주사전자현미 경 184, 188 중성세제 34 중탄산나트륨 42 증류수 장치 19 중식곡선 73 증식사이클 73 지연기 73 직접법 169
* 천연배양액 39 체세포유전학 145 초대배양법 87 초음파 34 =7 커버글라스 29 콘드로넥틴 133 콘카나발린 A 105 콜라게나제 84, 129 콜라겐 39, 133, 134 콜라겐 I 134, 135 콜라겐 W 134 콜라겐 코팅 136 콜로니 형성법 68 콜로니 형성효율 68 콜세미드 162 크레졸 65 크리스탈바이올렛 155 클로닝실린더 69 클론 68, 152 키모트립신 128
E 데라토카시노마 124 두과전자현미 경 184, 185 트란스페린 141 트롬보스폰딘 133 트리아이오도타이로닌(감상선호르몬) 141 트리판블루 168 트리판블루 염색 75 트립신 84, 128 트립신 억제제 128 특수항체 148 티미딘 145 티오글리콜레이트 160 파이브로넥틴 39, 133, 137 파이토헤마글루티닌 105 파이펫 29 파이펫에이드 3.2 파파인 84, 130 PAP 면역염색법 176 페놀레드 42 페록시다제 표식 항체 174 페트리딧슈 29 포화밀도 75 폴리라이신 139 폴리에틸렌글리콜 145 프로나아제 84, 129 풀라스크 29
군 하이드로코티존 141 하이브리도마 148 하이포잔틴 14'.i 합성배양액 42 HAT 액 145 항상성 13 항생물질 46 항체농도 152 핵형 162 헤마독실린염색법 166 현미경 19, 27 혈구계산판 75 혈장 16, 38, 39 혈청 38, 39 형광염색법 170 형광현미경 170 회전배양법 59 효모추출액 39 히비텐살균액 65
김승업 193 奭 생, 경기고 疾因 검정고시로 서울의대 입학 1960 서울대학교 의과대학 졸업 1965 일본 교토대학 대학원에서 의학박사 수여 1966-1969 미국 컬럼비아대학 머레이교수 연구실로 유학 1972-1983 미국 펜실바니아대학 신경내과 부교수와 교수 역임 독일 하이델베르크대학, 일본 도쿄대학, 오사카대학 초빙교수 역임 1983- 현재 캐나다 브리티시 컬럼비아대학 신경내과 교수 330 여 편의 저서, 논문, 초록 출간 조직배양 대우학술총서·자연과학 93 1 판 1 쇄 찍음 1994 년 4 월 20 일 1 판 1 쇄 펴냄 -1994 년 4 월 30 일 지은이 김승업 펴낸이 朴孟浩 펴낸곳 (주)民音社 출판등록 1991 . 12. 20. 제 16-490 호 135-120 서울특별시 강남구 신사동 506 강남출판문화센터 였누 대표전화 515-2000 팩시밀리 515-2007 값 8,00~ 십 © 김승업, 1994 자연과학 생물학 KDC/472.028 Pr int e d in Seoul, Korea ISBN 89-374-3593-4 94470 ISBN 89-374-3000-2 (세트) ~4 ~ ;. ;1
대우학술총서 (자 연과학 ) 1 소립자와 게이지 상호작용 김진의 47 생체에너지 주충노 2 동력학특론 이병호 48 리이만 가하학 박을룡 3 질소고정 송승달 49 군표현론 박승안 4 상전이와 임계현상 김두칠 50 비선형 편미분 방정식론 하 기식 5 촉매작용 진종식 51 생체막 김형만 6 외스바우어 분광학 옥항남 52 수리분류학 고철환 7 극 미량원소의 영양 숭정자 53 찰스 다윈 정 용재 ` 8 수소화붕소와 유기붕소 54 금속부식 박용수 화합물 윤능민 55 양자광학 이 상수 9 항생물질의 전합성 강석구 56 효소반응 속도론 서정현 10 국소적 형태의 Ati ya h-sin g er 57 화성암 성인론 이민성 지표이론 지동표 58 확률론 구자홍 11 Mucop ol y sacchar i des 의 59 분자 분광학 소현수 12 생천화체학물 리및학 생 홍물승리수학 박준우 6610 곤벡충터신속경 이 론생 리양학재 현부 경생 13 프로스타글라 딘 합성 김성각 62 에너지띠 이론 모혜정 14 천연물화학연 구법 우원식 63 수학 기초론 김상문 15 지방영양 김숙희 64 신경과학 김 숭 업· 박찬웅 16 결정화유리 김병호 65 BCH 부호와 Reed- 17 고분자에 의한 화학반응 조의환 So lomon 부호 아만영 18 과학혁명 김영식 66 양자 전기역학 김영덕 19 한국지질론 장기홍 67 군환론 박재걸 20 정보이론 한영열 68 대수기하학 조영현 21 원자핵반응론 정운혁 69 양자장이론 이재형 22 파괴역학 김상철 70 해양오염과 생태계 심재형 23 분자궤도 이론 이익춘 71 비기체 연소합성 ( SHS ) 여철현 24 반응속도론 정경훈 72 크로마토그래피 이대운 25 미분위상수학 이현구 73 곤충의 사회행동 추종길 26 자기공명방법 조성호 74 동위원소 지질학 김규한 27 플라스마 물리학과 핵융합 최덕인 75 X 선 결정학 김양 28 천문관측과 분석 이시우 77 통계역학 조순탁 29 석탄에너지변환기술 김상돈 78 고분자의 구조와 형태학 이석현 30 해양미고생물학 백광호 79 LC 에 의한 광학 이성질체의 31 편미분방정식론 김종식 분리 현명호 32 대통일 이론 소광섭 80 신경전달물질 서유헌 33 금속전자계의 다체이론 김덕주 81 발생과 유전자 발현 이양립 34 액정중합체 진정일 82 스테로이드 화학 김완주김득준 35 복합재료 권숙인 83 다체계론 엄정인 36 단백질 생합성 박인원 84 중핵반응론 김병택 37 한국의 광물종 김수진 85 비가역 열역학 이철수 38 일반상대론 이철훈 86 등각장론 임채호 39 레이저 광산란 분광학 김종진 87 방사선생물학 남상열 40 복소다양체론 김상문 88 석유지질학 이용일 41 역학적 연구방법 김일순 89 베르누이 시행의 통계적 분석 4423 김후핵도리구한에조 물해리석학과 민의동미필분 작용소 9910 신생배도리경선세활·포성김을생성인 리가 학진 강C만-식P 화합물의 44 한국의 고생물 이하영 화학 김용준 · 강익중 45 질량분석학 김명수 92 생물유기화학 서정헌 46 급변론 박대현 93 조직배양 김승업