 (iYp 1o버 J
(iYp 1o버 J  (iYp 1o버 J
(iYp 1o버 J

석탄에너지 변환기술 
 석탄에너지 변환기술
석탄에너지 변환기술
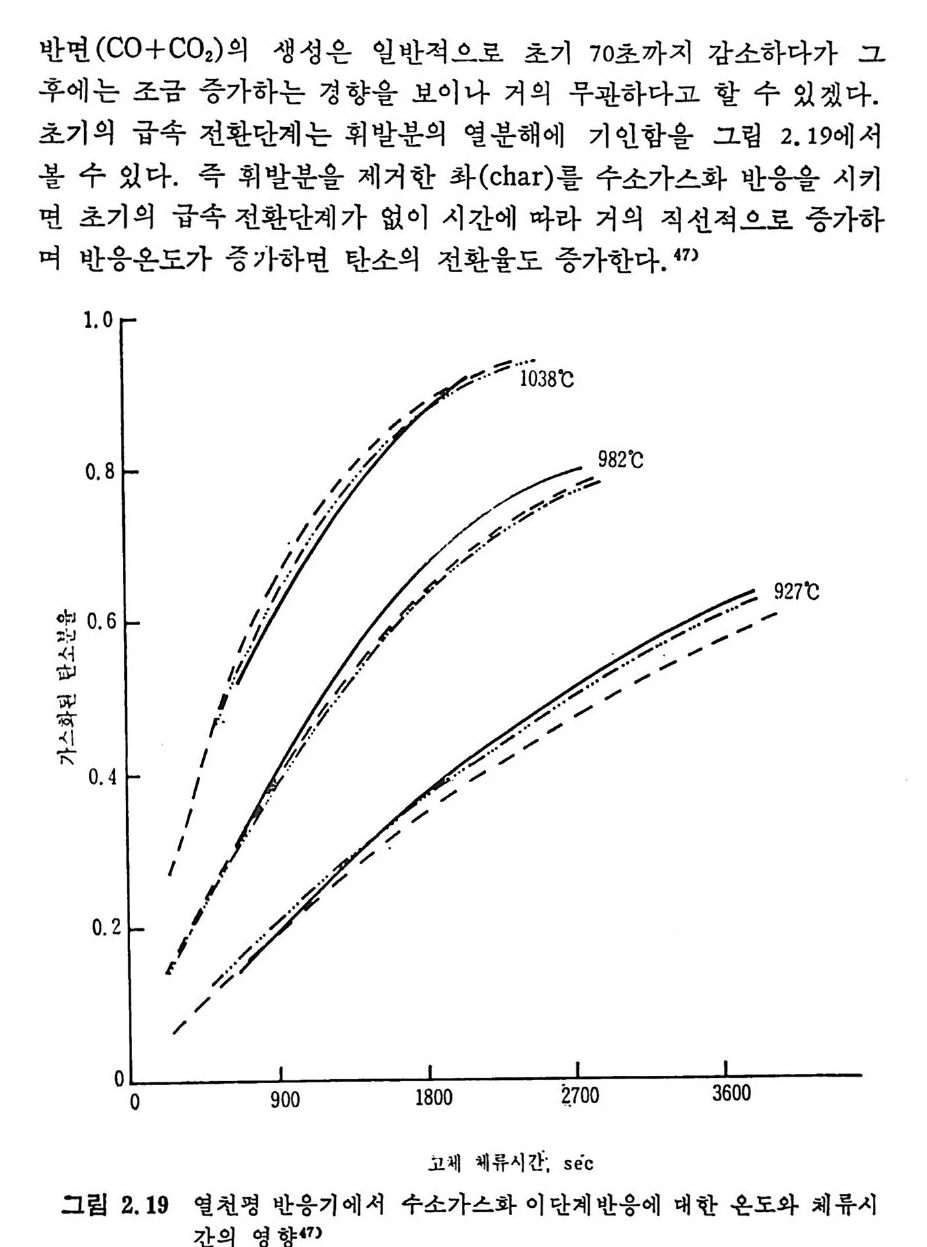
머리말 석탄에너지에 대한 관십은 직접연소분만 아니라 가연성 가스 및 오 일로 변환시킬 수 있는 기술적 방법의 팔요성을 인지하고 1972 년 유 류파동 이후 전세계적으로 석탄에너지 변환기술에 대한 연구가 활발 히 진행되고 있다. 이러한 상황하에서 국내에는 석유의 부촌 자원은 전혀 없고 무연탄 의 가채량은 앞으로 20 년 정도밖에는 사용할 수 없는 것으로 판단되 며 더구나 석탄 채탄도 접접 십부화되어 생산비가 급격히 상승하고 있다. 더우기 국내 무연탄 생산량이 향후 현재 수준인 연 1800 만톤을 크게 상회하지 못할 것으로 예견되므로 석탄의 수요를 해외 수입 유 연탄 및 무연탄에 의촌하여야 할 입장이다. 그러나 석탄은 세계에 비교적 고르게 분포되어 있고 앞으로 약 500 년 이상 사용 가능한 풍부한 자원이므로 원자력 발전의 안정성을 고 려할 때 석탄 활용은 에너지 변환 때의 공해물질을 제거하면 무공해 에너지로서의 고도 활용이 가능하므로 전세계적으로 많은 연구가 이 루어지고 있다 . 그러나 새로이 개발되는 기술은 선전국의 기술보호 정책으로 인하여 첨단기술을 도입하기 힘들고 또한 기술을 도입하여 도 고가의 기술로를 지불하여야 하며 아울러 도입된 기술의 이해를 위하여서도 국내 현실에 맞는 기술축적이 철실히 요구되고 있다. 이 책은 앞으로의 주에너지원으로 사용될 석탄에너지의 전환기술을 위하여 아칙까지 이 분야에 무관십하였던 공학도들에게 석탄에너지의 중요성과 찬숙감을 제공함과 아울러 대학교 고학년과 대학원 과정의 교재 또는 이 분야에 종사하는 연구자들에 게 석 탄에 너 지 변환기 술에 관한 참고 자료로서 집필되었다. 제 1 장에서는 석탄의 물리적 • 화학적 성질, 가열시의 석탄의 특성, 기계적 특성 동을 다루었고, 제 2 장에서는 석탄에너지 변환시의 석탄 의 열분해, 열분해 반응 속도 및 생성물 분포, 석탄의 가스화 반웅들 과 석탄의 액화반응의 원리에 관하여 기술하였으며 제 3 장에서는 석
탄의 칙접연소에 대하여 연소시의 화학적 반응, 연소방법, 연소장치 로서의 격자발화, 유동충 연소로 및 비말동반 연소로를 소개하였다. 또한 발화시의 가열울 및 접화일도, 석탄의 연소현상 및 고정충 • 유 동충 • 분단연소로에서의 연소현상을 해석하였다. 제 4 장에서는 석탄 가스화 공정에 대하여 석탄가스화 반응의 원리, 반응의 열화학, 가스 화 반응의 반응속도식, 촉매의 여할 및 가스화 반응기들의 조업 목 성, 죽 고정충 • 유동충 • 비말동반충 • 0서 체 매체 반응기들과 지하 가 스화 등을 소개하면서 각각 상이접을 열거하였으며 저열량 • 중열량 및 고열량 가스의 제조방법 및 가스의 정제방법 동을 다루었다. 마지막으로 제 5 장에서는 석탄의 액화 공정을 다루어 석탄 조성이 액화에 미치는 영향, 직접액화와 간접액화 방법을 다루고 이의 용매 추출범과 촉매 수소화 액화법을 소개하면서 촉매의 활성도 를 다 루 고 석탄의 성질이 액화에 미치는 영향을 소개하였다. 전체적으로 석탄 에너지 변환기술이 매우 다양하고 석탄의 조성변 화가 십하기 때문에 이에서 발생하는 실험 결과를 이론적으로 정립하 기가 매우 힘든 상황이다. 그러므로 본 학술 개요서가 아칙도 연구개 발이 철실히 요구되고 있는 석탄에너지 변환기술 연구의 활성화에 기 여할 수 있는 계기가 되기 바란다. 마지막으로 본 개요서를 기술할 수 있는 기회를 제공하여 주신 대우재단에 감사드리며 여러 가지로 미흡 한 내용은 독자 여러분들의 충고와 질책으로 앞으로 보완되기를 충십 으로 바란다. 1985 년 가울 김상돈
6
차례 머리말 3 제 1 장 석탄의 생성 및 성질 1.1 서론 II 1.2 물리적 조성 l2 1.3 화학적 조성 I2 1. 3 .1 공업분석 13 1.3.2 원소 분석 I5 1.4 석탄의 등급과 분류 •2 0 1.5 물리적 성질 •23 1. 5. 1 기 공도 및 기 공구조 23 1. 5. 2 석탄의 내부 표면져 27 1.6 석탄 가열시의 특성 -31 1. 7 석탄의 기계적 독성 ·33 참고문헌 36 제 2 장 석탄에너지 변환 2.1 석탄의 열분해 39 2.2 열분해 반응속도 및 생성물 분포 42 2. 2. 1 처 속 열 분해 44 2. 2. 2 급속 열 분해 48 2. 2. 3 순간 연분해 55 2. 3 석 탄의 가스화반응 60 2. 3. 1 카-가스반웅 2. 3. 2 가스화반옹중의 석 탄/좌의 기 공복성 과 이 의 반웅들에 미치는 영향 65
2.3.3 석탄/촤-수소반응 71
2.3.4 급속 가열 수소화 가스반응 75 2.3.5 탄소-이산화탄소반응 80 2.3.6 촤-산소반응 85 2.3.7 석탄/촤-수증기 반응 93 2.4 석탄 액화반응 ―― 97 참고문헌 105 제 3 장 석탄 연소 3.1 서론 ―― 111 3.2 연소의 화학적 반응 ―― 111 3.3 연소방법 ―― 114 3.4 연소장치 ―― 117 3.4.1 격자발화 119 3.4.2 유동층 연소로 124 3.4.3 비말동반 발화계 129 3.5 가열률 및 점화밀도 ―― 135 3.6 석탄의 연소현상 ―― 143 3.7 理想系의 연소분석 ―― 156 참고문헌 191 제 4 장 석탄 가스화 4.1 석탄 가스화의 원리 ―― 197 4.2 열화학 ―― 202 4.3 반응속도 ―― 209 4.4 촉매 ―― 217 4.5 수소화 가스반응 ―― 222 4.6 가스화 반응기 ―― 224 4.6.1 고정층 가스로 227 4.6.2 유동층 가스로 230 4.6.3 비말동반 가스로 2334.6.4 액체 매체 가스로 234
4.6.5 지하 가스화 235 4.7 가스로의 열 공급방법 ―― 237 4.8 저열량 가스 ―― 239 4.9 중열량 가스화 ―― 248 4.10 고열량 가스화 ―― 251 4.11 가스화 반응기 재질 ―― 255 참고문헌 257 제 5 장 석탄 액화 5.1 서론 ―― 261 5.2 석탄의 화학적 조성 ―― 262 5.3 직접 액화 ―― 264 5.3.1 용매 추출공정 265 5.3.2 촉매 수소화공정 270 5.4 열분해 ―― 273 5.5 수소화 또는 액화율 ―― 275 5.6 간접 액화 ―― 276 5.6.1 탄화수소 합성 277 5.7 석탄성질이 엑화에 미치는 영향 ―― 282 5.7.1 석탄의 등급과 조성 282 5.8 용매 추출 ―― 287 5.8.1 용매 추출 반응속도 294 5.9 촉매 수소화 ―― 304 참고문헌 312 색인 ―― 317제 1 장 석 탄의 생 성 및 성 질 1.1 서론 석탄의 생성은 일반적으로 수목의 殘材가 되적되어서 되적충 증가 에 따른 압력하에서 미생물의 작용과 열에 의하여 여러 단계의 접전 적 진화 과정을 거쳐 생성된 것으로 알려쳐 있다. 이러한 전화과정의 일차 산물은 휴믹 (hum i c) 酸이며 이것은 泥炭 (pe at) , 갈탄 (lign it e) , 준역 청 란 (subbit um i no us) , 역 청 란 (bit um i no us) 을 거쳐서 무연탄 (an t hrac it e) 으로 변환되면서 생성되었다. 이러한 변 환 과정에서 탄소와 산소의 함량은 니탄, 갈탄, 역청란, 무연탄으로 변화되면서 석탄의 등급 (rank) 이 증가하여 탄소함량이 각각 60,70, 80, 93% 로 산소함량이 35, 25, 15, 3% 로 중가 및 감소한다 . 석탄의 생성은 크게 두 가지로 나누어 득칭지어치며 첫째는 생화학 저 반응과, 둘째는 유기물질의 열변화에 의한 것으로 대벌된다. 즉 화석 화된 식 물의 찬재 들은 식 물들의 근원에 기 인하게 된다. 식물의 조성은 여러 가지 복잡한 물질을 함유하고 있으나 이 중의 안정한 조성들인 섬유소 (cellulose), 단백 질(p ro t e i n), 밀납 (wax), 수 지 (resin s ) , 테 르펜 (ter pe ns) , 스데 를 (s t eroles) , 후레 보노이 드 (flav o- noid s ), 탄닌(t ann i ns), 리그닌(Iig n in s) 및 알카로이드 (alkalo i ds) 등이 석탄으로 변환되었다. 이러한 성분 중 주요성분인 섬유소나 리그닌 의 구조가 석탄화 (coa lifi ca ti on) 에 의하여 비트리나이트(vitrinit e) 의 조성으로 변환되어서 석탄의 주요성분이 되었다. 또한 섬유소와 갈이
단백질도 매우 빠른 생물 분해 과정을 거쳐서 석탄생성을 이루었다. 그 반면 밀납, 수지, 탄닌, 리그닌, 후라보이드 및 알카로이드 둥은 박테리아의 침두에 저항이 강한 물질이라고 할 수 있으며 호기성 미 생물에 의하여 산화되었다.1) 1.2 물리적 조성 석탄은 근본형성 물질이 다양하여 그 조성 및 구조가 불균일하다. 그러므로 석탄의 조성 및 성질에 대한 연구가 1920 년대부터 시작되었 으나 조직적인 연구결과가 이루어지지 못한 이유는 각 성분의 함량 및 분포가 너 무나 다양하기 때 문이 다. 석탄의 조성을 4 가지로 분류하면 2) 비트레인 (v it ra i n) ; 반짝이는 흑색 두명한 입방체로 구성된 떠를 형성한 것. 크타레인 (clara i n) ; 흑색의 수평줄로 구성된 수정체 광택을 지녔고 석탄을 분쇄하였을 때 광택 표면을 주는 조성. 듀레인 (dura i n) ; 희미한 혹회색 띠를 형성한 물질로 작은 球型의 조직을 가졌고 분쇄시 무광덱의 球로 된 물질. 휴제인(fu sa i n) ; 숯과 같은 물질로서 본질적으로 부드럽고 깨지기 쉬국운제 섬 석유 탄소 암질석의 협 분회말 ” (형In태te 를r n a가ti o전n al물 C질om로m서i t t분ee 류fo되r 어C진oa다l P.e tr o g ra ph y ) 에서 규정한 석탄성분은 마제랄 (macerals) 의 연속으로 구성되어져서 겉모양, 화학적 조성 및 광학적 성질로 특성지어지며 이것은 초기 석 탄 생성시의 수목의 찬재가 남긴 목수성분을 추적하여서 밝힐 수 있 다고 하였다 . 1.3 화학적 조성 석탄은 주로 탄소, 수소와 산소로 구성되었고 바교적 적은 양의 질 소와 유황분울 함유하고 있다. 그 이의의 금속성분의 여러 물질들이 灰分에 포합되어 있는데 유화철, 탄산마그네슘과 칼슘, 영화알카리 및 53 가지 이상의 미량의 원소를 함유하고 있다. 이러한 여러 가지
성 분울 특칭 짓 기 위 하여 화학적 조성 은 공업 분석 (pr oxim ate analys is ) 과 원소분석 (ulti m ate anal y s i s) 을 통하여 서 규정 지 어 진다. 1. 3. 1 공업 분석 (Proxim ate analys is ) 공업분석으로 결정하는 조성은 석탄시료가 함유하고 있는 I) 수분 함량, 2) 휘발분함량, 3) 회분, 죽 모든 가연성 물질의 완전연소 후 에 남은 무기물질과 상기한 성분의 차로써 결정하는 4) 고정탄소함량 죽 %고정탄소 =100 一(%수분+%휘발분+%회분)의 4 가지 성분 함량 윤 조사분석함으로써 결정한다. 공업 분석 의 실험 적 방법 을 Aberneth y 와 Walte r 4J 및 Hatt m an 과 Or t ug li o” 가 포괄적 으로 종합하였 다. a) 수분 석탄 내의 수분함량 분석치를 이해하기 위하여는 자연 상수분, 죽 수분용량 (ca p ac ity mo i s t ure) 과 수용성 수분 (rece i ved mo i s t ure) 을 구분할 필요가 있다. 수분용량이란 상대습도가 100% 일 때 석탄이 함유할 수 있는 수분 량을 말하므로 석탄이 수분을 함유할 수 있는 기공용적을 나타낸다. 그 반면 수용성 수분함량이란 분석하기 위하여 준비된 시료에 함유된 수분량을 말하며 이 양은 시료상태에 따라 床水分批에 비하여 과소가 결 정 된다. 또한 자주 사용되 는 공기 전조 수분함량 (air drie d mois t u re con t en t)이 란 실험실조건 (20°c 土 5°c 및 30~60% 상대습도)에서 석탄 시료의 수분을 평형상태에 유지시켰을 때의 값을 말한다. 미국재료겁사협회 (ASTM-D2013) 의 기준에 따른 세 가지 수분함 량의 결정은 첫번째로 젖은 석탄을 수분손실 없이 분쇄 후 체로 쳐서 일정 크기의 시료를 실온보다 IO~I5°C 높은 온도에서 공기로 건조시 켜 서 증발된 수분을 공기 전조수분 (a i r-dr y mois t u re) 이 라고 한다. 이 공기전조석탄을 다시 분쇄하여서 (250µm 이하) 일정무게 (l g士 O.5m g) 의 시료를 오본 (oven) 에 넣고 104~110°c 에서 공기를 순환시켜서 건 조시 킨다. 이 때 의 무게 감소된 수분을 잔류수분 (res i dual mois t u re ) 이 라한다. 전체 수분은 공기 전조수분과 찬류수분의 합으로 표시된다.
% 전체수분=%x (공 I기O전O_조%수 \분;+건%조 잔수류분수 ) 분 (1. 1) 일반적인 수분함량 결정은 (ASTM D3173 一 73) l g士 o.5m g의 석탄 시료를 (<250µm) 107 土 4°c 의 전공이 나 불활성 기 체 (순수질소)하에 서 1 시간 동안 가열 후 시료의 무게 감소로써 결정한다. b) 휘 발분 (Volati le matt er ) 휘발분은 석탄의 질과 석탄암석의 조성에 따라 넓은 법위의 탄화수 소, CO, C 아 및 화학적으로 결합된 수분함량이 정성 및 정량적으로 변하는 조성이다. 적은 양의 CH4 오} co 가 화학적으로 석탄에 흡수된 것을 제의하면 상기한 성분들은 석탄의 열분해 생성과정에서 형성된 것이다. 휘 발분 (VM) 의 함량은 석 탄의 품위 (rank) 가 감소함에 따라 증가한 다. 그러나 처품위(l ow rank) 석탄에서의 휘발분 함량의 변화는 매우 십하여서 타성분치에 비하여 예측하기 힘든 성분이다. 휘발분함량 결정을 ASTM(D 3175~77) 방법에 따르면 전조한 미분 석탄 l g (<250µm) 을 950 土 20°c 에서 7 분 동안 시료의 산화됨이 없이 가열하여서 그때의 무게 감소로써 휘발분 함량을 결정한다. 국제 표준협 회 (Inte r nati on al Orga niz a ti on for Sta n dardiz a ti on ) 의 방 법에 (IS0-11n) 따르면 상기 석탄시료를 875~1050°C 사이에서 3~ 20 분 동안 가열시의 무게 감소로 정의하였다. 실험결과는 가열률과 시간의 함수이므로 주어전 표준방법을 잘 준 수하여야 한다. 득히 분석중 주의하여야 할 것은 가열 중 시료의 산 화를 방지하여야 하고 350~500°C 에서 발생하는 빠른 휘발분 방출로 인한 도가니 (cru ci ble) 로부터 석탄입자의 손실이 없어야 된다는 것이 다. 고 및 저품위 석탄의 휘발분 함량 분석방법은 실험실에 따라 조 금씩 상이하나, ASTM 방법에서는 고품위 석탄은 공기전조 수분함량 이 10% 이하인 시료를 정량 (l g)하여서 백금도가니에 넣고 잘 밀페된 뚜껑을 씌워서 950°c 土 20°c 가 유지된 로에서 7 분간 가열 후 무게감소 로써 결정하며, 저품위 석탄은 꽁기전조 수분함량이 10% 이상인 시료 를 100°C/m i n 로 600 土 50°c 까지 가열한 후 950 土 20°c 에서 6 분간 더 가열한 후의 무게 감소량으로부터 휘발분 함량을 결정한다.
일반적으로 석탄의 휘발분은 석탄 품위가 감소함에 따라 증가한다. 그러나 저급탄의 경우는 휘발분 함량의 변화가 매우 다양하여서 다론 성분보다 품위 (rank) 에 따른 변화를 예측할 수 없다. 석탄 가열시에 나오는 휘발분은 주로 가열성 기체로서 H2, CO2, CH4 및 다른 탄화수소로써 구성되어 있다. 그러므로 휘발분 함량과 H/C 비와의 관계를 정성적으로 보면 H/C 비가 증가할수록 휘발분 함량이 증가한다. c) 회분함량 석탄 중의 성분 함량을 ASTM(D 3174) 방법에 따라 결정하려면 시 로 1~2 g을 725 土 25°C 하에서 공기와의 완전연소반응 후의 찬류량으 로 결정한다. 분석 중의 유의 사항은 유화철 (pyr it e) 성 분을 많이 함 유한 석탄은 비교적 낮은 온도에서 소각하여서 탄소화 전에 유화철을 분해하여서 회분 중의 유황이 금속탄소 성분으로 유리된 알카리 산화 물과 반응하는 것을 방지하여야 한다. d) 고정 단소 (F i xed carbon) 고정단소란 휘발분이 제거된 석탄을 연소할 때의 무게 감소로 표현 할 수 있다 . 즉 건조-무회분 (dr y and ash-fr ee basis ) 기준의 고정 탄소는 공업분석에 있어서 휘발분 %량을 100 에서 몐 값으로 나타내 어진다. 상기한 바와 같이 고정탄소함량은 100 에서 수분, 회분 및 휘 발분의 차로써 결정한다. 1. 3. 2 원소 분석 (Ultim ate analys is ) 원소 분석은 석탄을 이루고 있는 탄소, 수소, 질소, 유황 및 산소 등을 산화, 분해 및 환원방법을 사용하여 정량적인 분석치를 구하는 것이다. 원소 분석은 또한 수분, 금속성물질 함량 (m i neral matt er conte n t) 및 회분 함량을 결정한다. ASTM(3176~74) 의 정의에 의하면 석탄과 코크스 (coke) 의 원소 분 석은 완전연소시에 나오는 기체 중의 탄소와 수소함량을 결정하고, 유황, 질소 및 회분함량을 결정한 후 산소합량은 100 에서 상기 함량 %의 차로써 결정한다. 표준 원소 분석 방법 에 대 하여 기 술 9-11) 한 바에 의하면 탄소와 수소
함량은 밀페된 계에서 산소와의 완전연소를 825°C(ASTM) 나 1350°C (Briti sh s t andard) 에서 시켜서 이때의 생성 기체의 조성 을 분석하 여 결정한다. 죽 o.2~0.5 g의 석탄시료를 순수한 전조산소로 연소 시 켜 서 생 성 된 CO2 와 H20 를 가열 된 산화동 (cu p r i c oxid e ) 충 을 몽과 시 킨다. 이 배 출가스를 가열 된 lead chromate 와 은망사 (sil v er ga ug e ) 위를 통과시켜서 유황 및 염소 산화물을 제거한 후 흡수충을 몽과시 켜서 홍수물질의 무게 증가로서 정량한다. 질소성분은 석탄의 유기물질 중에 포함된 함량이다. 보통 석탄의 질 소함량 백분율은 1~2% 이나 주로 1~15% 정도이다. K j eldahl 방법에 의한 질소함량 결정은 lg 의 석탄시료를 30ml 의 황산과 8~10ml 의 유 화칼륨(p o t ass i um sulfa te) 혼합물에 촉매로서 수은 혹은 수은영, 코발 트산 또는 pe rchloric acid 를 넣 고 완전히 소화시 킨 후 냉 각된 용액 을 알카리성화하여 생성된 NH3 를 붕산 (bor i c acid ) 혹은 황산용액에 증류시켜서 그로부터 질소함량을 역적정하여서 결정한다. 미량변환 분석 법 은 O. lg 의 석 탄을 3ml 의 황산과 K2 S04 : Hg S04 : Se 촉매 를 32 : 5 : 1 의 혼합물에 30 분간 소화시 킨 후 여 기 에 hy d rog e n sulfi de / sodiu m sulfi de 수용액 을 가하여 NH3 를 발생 시 켜 서 붕산 속에 서 증 기로 증류시켜 결정한다. 유기 및 무기질 유황분의 정량 분석은 유황울 함유하고 있는 시료를 연소시켜서 황산이온 (sul fate i on) 을 생성시킨 후 이를 침전시켜 용적 을 측정하여 결정한다. 간편하고 가장 널리 사용되는 방법은 Eschka 방법 11) 으로 석 탄을 탄산나트륨과 탄산마그네 슘을 1 : 2 로 혼합하여 서 공 기 중에서 800 土 25°C 에서 연소시킨다. 여기서 생성된 황산이온울 산 이나 알카리용액으로 추출하여 황산바뮴 (bar i um sul fat e) 으로 침전시 켜서 결정한다 (ASTM D 3177). 두번째 방법은 bomb 연소방법으로 분석시료를 이산화나트뮴과 갇 이 환원시키든가 산소하에서 2~3MPa 압력하에서 연소시키는 방법 이 다 (ASTM D 3177). 고온연소방법 12) 은 시로를 산화알루미늄 인산철영 (fer ric ph osph ate ) 또는 고령토 (kao li n) 의 촌재하에서, 1250~1350°C 로 산소하에 가열 하여 유황산화물을 표준과산화용액에 흡수시켜 용액의 산성도를 o.05 N 나트륨 붕산영 수용액으로 적정하여 결정한다.
모든 경우에 있어서 유기질 유황분(황산영과 유화철)은 Powell 과 Parr 방법 13) 으로 결정하여서 전체 유황함량과의 차이로써 결정한다. 석탄의 산소함량은 유기질석탄 성분의 다른 원소들의 함량으로부터 그 차이로 결정한다 . 즉 % 산소 =100-(% C+% H+% N+% S) (1. 2) 그러나 이 방법은 탄소, 수소 , 질소 및 유황성분 결정의 실험오차를 내재하게 된다. 직접 산소성분 결정방법은 석탄올 산화 혹은 환원시켜서 결정하는 방법이 개 발 되어져 왔다 . 가장 널리 사용되는 방법은 14-16) 시료를 질 소 존재하에서 1100 ° c 의 고온에서 소각하여 여기서 발생되는 휘발분 을 1100 ° ~1200 ° c 에서 탄소 위를 동과시켜서 나오는 CO 를 측정하는 것이다. 또한 산소성분울 중성자로 활성화시켜서 (16o+n--+16N+ p) /3 또는 r 선의 방사량을 측정하여 산소량을 알고 있는 시료와 비교하여 결정하는 방법 17-18) 도 있다. 이 방법은 비교적 빠르고 정확하다는 장 점이 있으나, 만일 유기산소성분을 측정할 때는 시료의 금속성 물질 울 분석 전에 제거하여야만 한다. 석 탄의 발열 량 (calor ific value) 은 석 탄이 함유하고 있 는 화학적 에 너지로서 석탄의 연료로서의 가치를 결정하는 인자라고 하겠다. 석탄 의 발열량 Q는 시료 1~2 g을 가압 (-25MPa) 하에서 밀페된 열량계 믈 사용하여 이때 발생한 열량으로 결정한다 .8) 직접 측정한발열량치가없을때는석탄의 원소분석치로부터 Dulong 이 제시한 상관식 19) 으로부터 발열량을 추정할 수 있다. Q= 145. 4(% C) +620. 28(% H) —7 7. 5(% 0) +4o. 5(% S) (1. 3) 여기서 Q는 건조된 회분이 없는 석탄의 발열량으로 Btu /lb 또는 ca l/g으로 표시된다. 미국 및 구라파 석탄에 대한 연구결과에서 얻은 Mott 와 Sp o oner 의 식 20) 은 Q= 144. 5(% C)+610(% H)-62. 5(% 0)+4o. 5(% S) (1.4 ) 이며 %성분들은 무게 %를 말하며, 산소함량이 11% 이하일 때 사용 되며 산소함량이 11% 이상인 경우에는 다음 식이 적용된다고 하였다.
Q= l44. 5(% C)+6IO(% H)-(65. 9-0. 31% 0)+4o. 5(% S) ( I . 5) 여러 가지 제시된 식들을 Schu y er 와 Van Krevelen2 3 ) 은 21 종 류의 석 탄을 조사하여 아래와 같은 실험식을 제시하였다 . Q= I408-14. 1VM+12s(%C) +639(%H) 一 43. 9(%0) +ss.s(%S)+20.5(%N) (1.6) 상기한 (1.4 ) (1.5 ) 및 (1. 6) 식을 Er g un21) 은 121 개의 석탄시료로서 시험해 본 결과 (1.4) 및 (1.5) 석이 비교적 (1. 6) 식보다 잘 적용된다 고 주장하였다. 수분을 함유한 석탄울 전조한 석탄 조건으로 치환하려면 식 (1.7) 울 사용하며, % C( 건조 )=lOOX % C/(100— % H20) (1. 7) 건조되고 회분이 없는 (dr y and ash free basis : daf) 기준으로 치환 하려 면 식 (1. 8) 을 사용한다. %C : a f(건조, 무회분) =lOO X %C[ 1 00-(%H20+% 회분)〕 (1. 8) 그러 나 상기 식 을 사용하려 면 시 료의 금속성 분 함량 (mi ne ral matt er con t en t)과 여기서 배출되는 회분과의 관계를 알아야 하나, 만일 관계 를 알지 못하면 회분함량이 10~15% 이하일 때 적철한 근사치 계산 은 분석치를 사용하여 식 (1.9) 을 사용할 수 있다. C=100/(100-(%H20+1. 1% 회분 +0. 1%S 무기 물)〕 (1. 9) 공업분석치를 이용한 발열량 추정식은 1902 년에 Gou t al22) 이 제시한 식이 널리 사용되고 있다. Q= l4, 76o+a(VM) (1. 10) 여기서 a 는 휘발분 (VM) 의 함수이며 그 관계는 아래와 같다.
모a| I 1153 1806 6153 4209 3258 3209 3252 5348 3460
상기식 (1.10) 은 中휘발성 역청란과 고품위 (h ig h rank) 석탄에 잘 적 용된다고 알려져 있다 . 유기질 석탄을 구성하고 있는 다섯 가지 원소 중 질소유기질 및 유 황은 매우 적은 양이다. 질소함량은 많아야 1% 정도이고 유기질 유 황은 간혹 4~5% 까지 함유되어 있으나 평군치는 0. 2~1. 5% 정도이다. 또한 이들과 석탄의 질에는 체계적 함수관계가 없다. 석탄내의 금속 성분 (m i neral matt er con t en t)은 석탄의 다른 구성 성분과의 함수관계 가 없다. 또한 같은 석탄충에서도 금속성분의 함량은 변화가 매우 십 하다. 이 금속성분을 석탄 내에서 물리적 방법으로 분리하는 방법도 없 다. 석 탄의 금속성 분에 관하여 Th i essen24) 과 Ode25) 가 종합하여 보 고하였다. 자세한 회분 분석윤 하지 않은상태에서 금속성분 (M.M. )과 회분과 의 관계는 10) 금속성분 (M. M. ) =I. os( %회분) +o. 55(%S)… (pa rr 방법)(1. 11) 금속성분 (M. M. )=1. 1o( %회분 )+0.1(%S)···(ASTM 방법)(I. 12) 상기 식 (1.11) 및 (1.12) 은 정확도가 요구되지 않는 경우 널리 사 용되고 있다. 구체적인 유황, 탄소 및 영소성분을 측정하였을 때, 금속성분 결정 식 은 Ki ng , Marie s 와 Crossley 26 > (KMC) 식 을 사용한다. 금속성분 (M. M. )=1. 09(% 회분) +o. 5(%SF,s,) +o. 8(%C02) -1. 1 (S03 회분) +S03 석 탄 +o. 5(%Cl) (I.13) 그러나 식 (I.13) 은 많은 분석치가 요구되므로 상기 식을 동계처리하 여서 각 성분을 상관시켜 본 결과 Brown27) 둥은 아래 식으로서 찰 예측할 수 있다고 하였다. 금속성분 (M.M. )=I. 06( %회분 )+o. 53(%S)+o. 74(%C02)-o. 32 (I. 14) 상기 식 (1.13) 및 (I.14) 에서 S 성분은 유기질 S 를 석탄의 일부 물 질로서 취급한 것이다. 석탄 속의 금속성분은 석탄의 변환 반응시 촉매로서의 역할과 석탄 활용시의 공해방지의 자료로서, 또 회분의 페기문제와 고온에서 녹는
회분의 정도축정 둥에 활용되는 중요 자료가 된다. 1.4 석탄의 등급과 분류 석탄의 등급에 따른 분류는 (ASTM D 388~77) 표 1. 1 에 보여주고 있 다. 표에 서 보듯이 등급은 고정 탄소와 발열 량 (calorif ic value) 에 따라 분류되 어 진다. 고등급 (h ig her rank) 석 탄은 전조된 고정 탄소를 근 거로 하며 처동급 탄은 수분이 함유된 상태에서의 발열량을 기준으로 구분한다. 죽 고휘발분 B 역청란 및 그 이하 등급탄은 발열량을 무
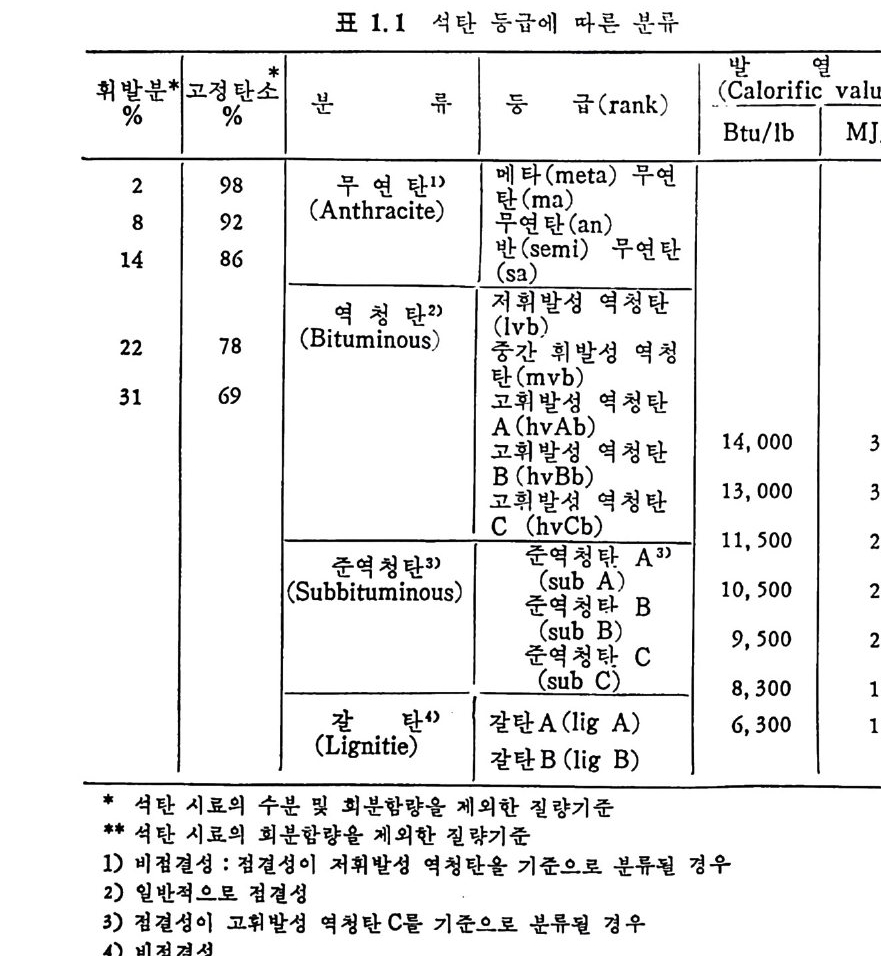 표 I.I 석탄 등급에 따른 분류
표 I.I 석탄 등급에 따른 분류
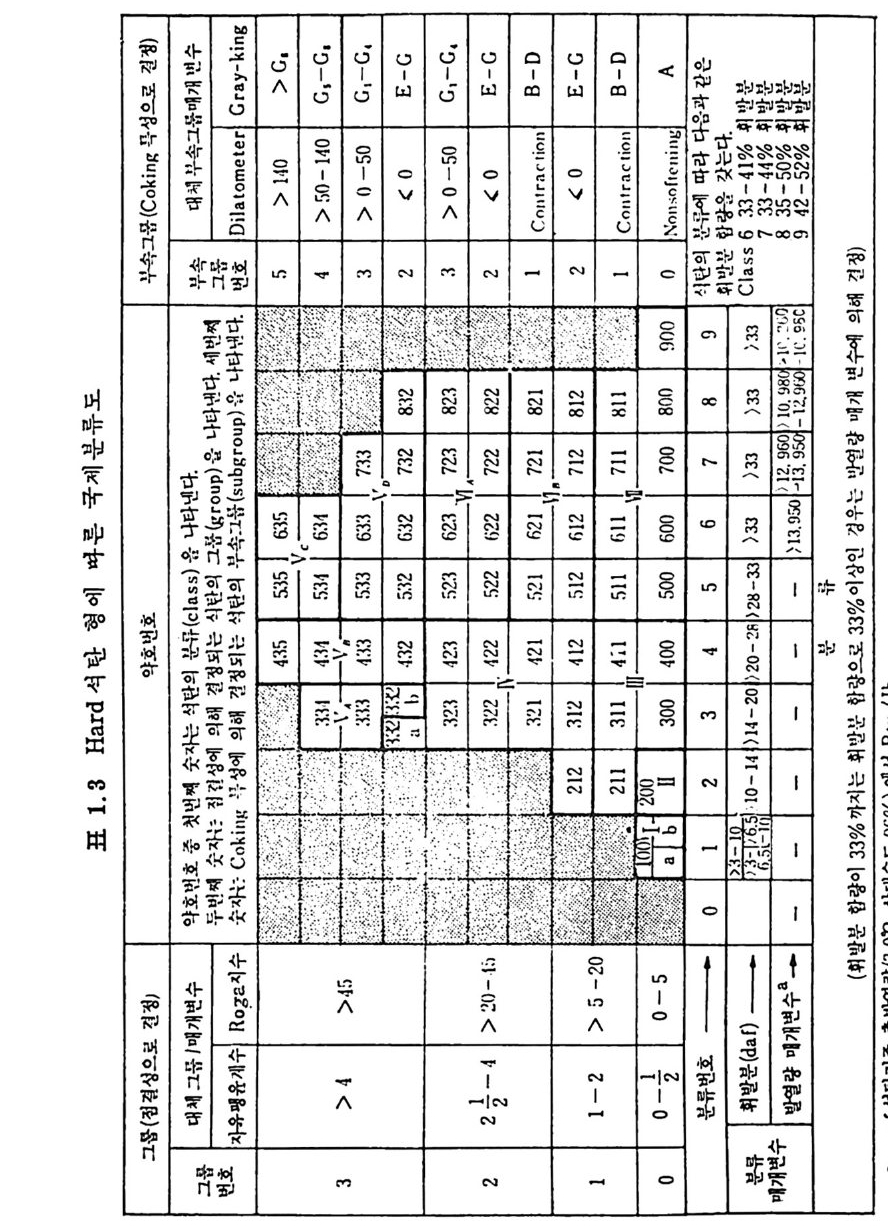
금속성분을 기준으로 하여서 14,oooBt u / b 또는 32.6M J /k g보다 작 울 때이 며 동시에 휘발분은 31% 보다 많아야 한다. 건조, 무금속의 고정 단소 (dr y MM-fr ee FC) 와 수분을 함유한 무금 속상태 의 발열 량 (mois t , MM-fr ee Bt u) 이 ASTM 방법 에 따른 석 탄 등급의 변수이다. 즉 dry, MM -fr ee FC=t o o(FC-o. 15S)/[100-(M+1. osA+o. 55S)J (1. 15) mois t , MM-fr ee Bt u = (Bt u -50S) 100/[1 00-(1 . osA+o. 55S)] (1. 16) FC : 고 정단소. % MM: 금 속 성분, % M : 수분 . % (30 °c, 90~97% 상대 습도에 서 의 수분함량) sA :: 유회 황분 ,분 .% % 영 국 국립 석 탄협 회 (Brit ish Nati on al Coal Board) 의 분류를 표 1. 2 에 보여주고 있다. 표에서 보듯이 휘발분은 건조 무금속 성분치를 근 거로 하였다. 또한 국제규격 (Int e r nati on al Class ifi ca ti on) 은 건조, 무 회분 기준의 휘발분과 수분 무회분 기준의 발열량을 기준으로 하여 ASTM 기 준과 유사하나 군의 분류는 Cakin g 및 Cokin g 성 분에 따라 분류하였다(표 1. 3).
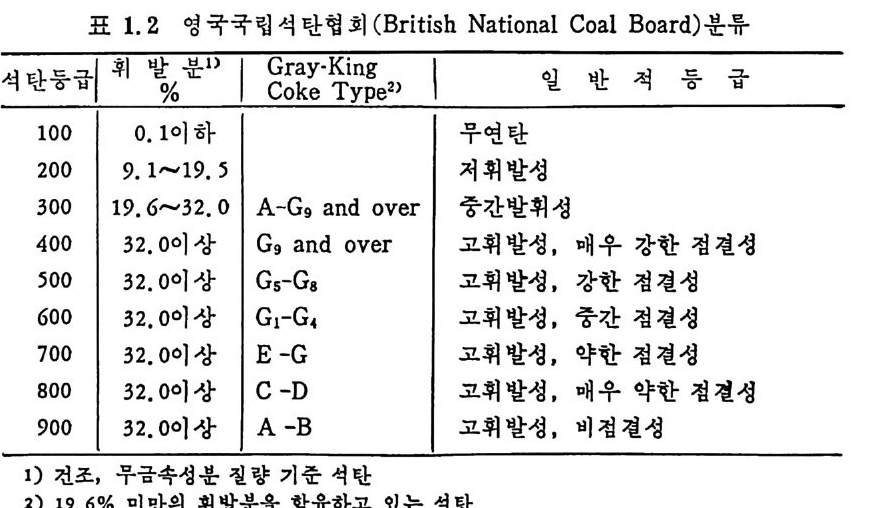 표 1. 2 영 국국립 석 탄협 회 (Briti sh Nati on al Coal Board) 분류
표 1. 2 영 국국립 석 탄협 회 (Briti sh Nati on al Coal Board) 분류
 (그k전속무 로문정으Cgn ) o성부i 쁘부鬪卜째브번무 프세 1 la -keearDGonmr타t ·lt iig다 호y낸번 ,> G 50 14>G,-,G -150> 04 G,, G- 3> 一50() GE-0 ( 2.G 3 CI-0>-5 0 G E-'2 .0 < D -B Ir1 Canunr nit :
(그k전속무 로문정으Cgn ) o성부i 쁘부鬪卜째브번무 프세 1 la -keearDGonmr타t ·lt iig다 호y낸번 ,> G 50 14>G,-,G -150> 04 G,, G- 3> 一50() GE-0 ( 2.G 3 CI-0>-5 0 G E-'2 .0 < D -B Ir1 Canunr nit :
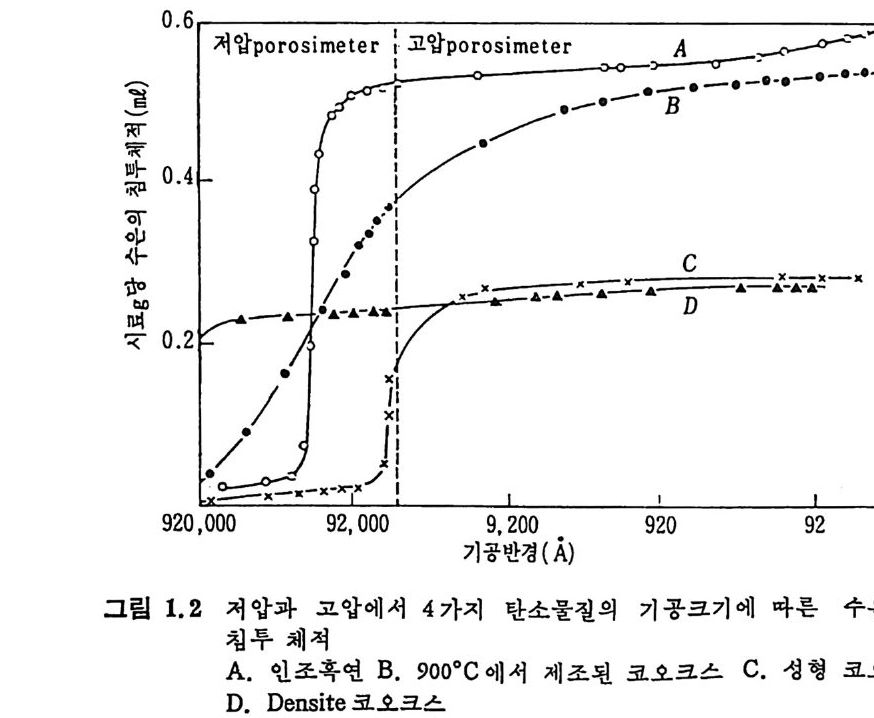
1.5 물리적 성질 석탄의 물리적 성질은 주로 탄소 및 휘발분 함량의 함수로서 표시 되어져 왔다. 죽 석탄의 기공도(p oros ity) 및 표면적은 탄소함량에 따 타 최소치를 보이다가 증가하는 경향을 보인다. 1.5 .1 기공도 및 기공구조 기공을 가진 고체물질의 기공률은 고체물질을 유체 속에 넣고 가압 하여서 기공을 완전히 채운 후 이때 유체양의 변화된 양을 측정하고 기공을 침부하지 못하는 유체에 넣고 이때 변화된 양을 측정하여 결 정한다. 보몽 heliu m 을 사용하여 기 공을 채 워 그때 의 밀도를 구하 고 수은을 사용하여서 기공을 채우지 않은 상태에서 밀도를 구하여 heli um 과 수은밀도의 역 수의 차이 로 기 공을 계 산한다. 28) I-:l.e liu m 의 분자는 크기 가 극히 작으므로 3A 보다 좁은 기 공에도 침 두하여 극히 적은 흡착 열을 가지므로 heliu m 의 밀도를 전밀도(t rue dens ity)로 고려할 수 있겠다. 기공제적은 수은기공 측정기 (H g-p oros i me t er) 로 측정하여 일정한 무게 의 시 료를 유리 dil a to m ete r 에 넣 고 가압하여 서 아 때 의 수온양 의 변화로 측정한다. 죽 기공의 크기를 압력의 함수관계로서 계산하 떤 28) r=-—2p6 cosB (1. 17) 여기서 r : 기공의 반경, p : 압력, 6 : 수은의 표면장력, o : 접촉각이다. 보통 a=480dy n /cm 및 8=140° 륜 사용하며 이 결과를 상기식 (1.17) 에 대입하면 r=75, ooo/p (1. 18) 식 (1.18) 이 되며 여기서 r 은 A 단위이며 P 는 a t m 으로 표시한다. 그립 1.1 에서 보듯이 석탄의 기공률은 탄소함량이 증가함에 따라 감소하여, 탄소함량이 87~89% 인 준역청란에서 기공물은. 1~2% 까지 감소하였다가 탄소함량이 더 증가하는 무연탄에서는 다시 증가한다.
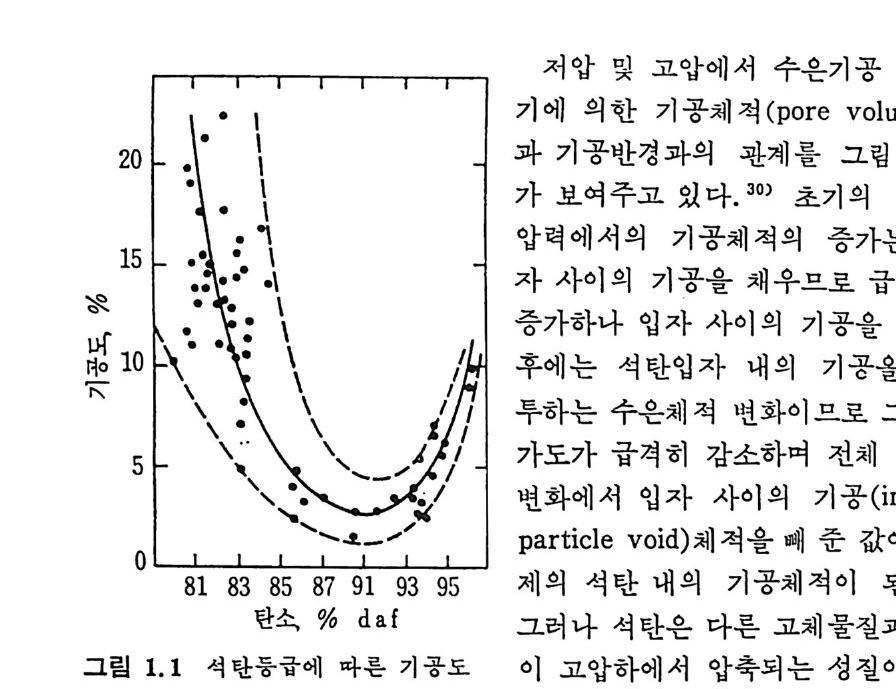 •II\\기 저에 압의 한및 고기 압공에체서 적 (수po 은re기 v공ol u측m정e)
•II\\기 저에 압의 한및 고기 압공에체서 적 (수po 은re기 v공ol u측m정e)
 0.6
0.6
 0.15
0.15
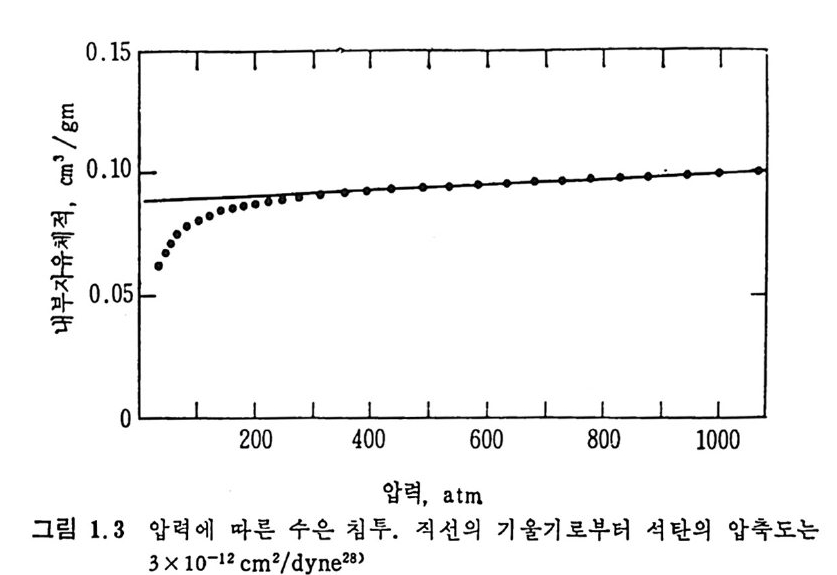
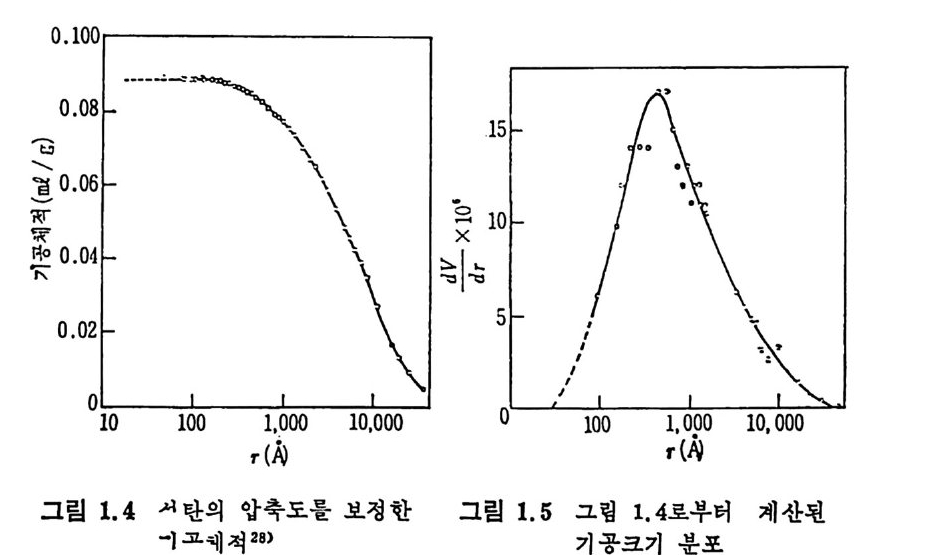
으므로 고압에서의 기공체적 결정치는 기공체적과 압축된 체적의 합 이므로 압축에 의한 기공체적치의 보정이 요구된다. 죽 그림 1.3 에서 보듯이 500atm 이상에서는 기공체적이 직선적으로 증가하며 이 직선 의 기 울기 13 x 10-12cm/dy n e 가 압축률 (com p ress i b ility) 이 된다. 29-30) 이 압축률을 보정한 기공크기의 분포를 그림 1.4 에 보였다. 그림 1. 4 로부터 도출한 기공크기 분포를 그림 1. 5 에 보여주고 있다. 그림
 D.10 0 i . \\\
D.10 0 i . \\\
1. 4 에 서 보면 고압에 서 수은기 석 탄기 공에 침 두된 양은 o. 0885cm3/g 이다. 그리고 그림 1.5 의 분포곡선으로부터 기공 내부 표면적, A 를 계산할 수 있다. 죽 모든 기공의 반경이 r1 과 r2 사이에 존재한다면 내부 기공면적은 A=\::( 움鬪 d (1. 19) 기공이 원통형이라면 A p=스rp도 ( 1. 20) 여기서 Ap , vp ,m 는 각각 기공의 표면적, 체적 및 반경이다. 식 (1.20) 으로부터 내부 기공면적은 1. Im2/ g을 계산 할 수 있다. 또한 전체 기공체적은 (H e 과 H g의 침두 체적 차이) o.13 4 ml / g이다. 이 차이 로부터 석 탄은 큰 기 공 (macro p ore) 과 미 세 기 공 (m i cro p ore) 의 분포를 가침을 알 수 있으며 그 범위는 큰 기공인 경우 40A 이 하인 기공이 5~8A 의 통로를 가지고 있으며 미세기공은 전체 기공 의 50~80% 를 차지한다고 할 수 있 다. 최 근에 카나다 석 탄에 대 한 큰 기공 및 미세 기공체적의 분포를 표 1. 4 에 보여주고 있다 . 3 0)
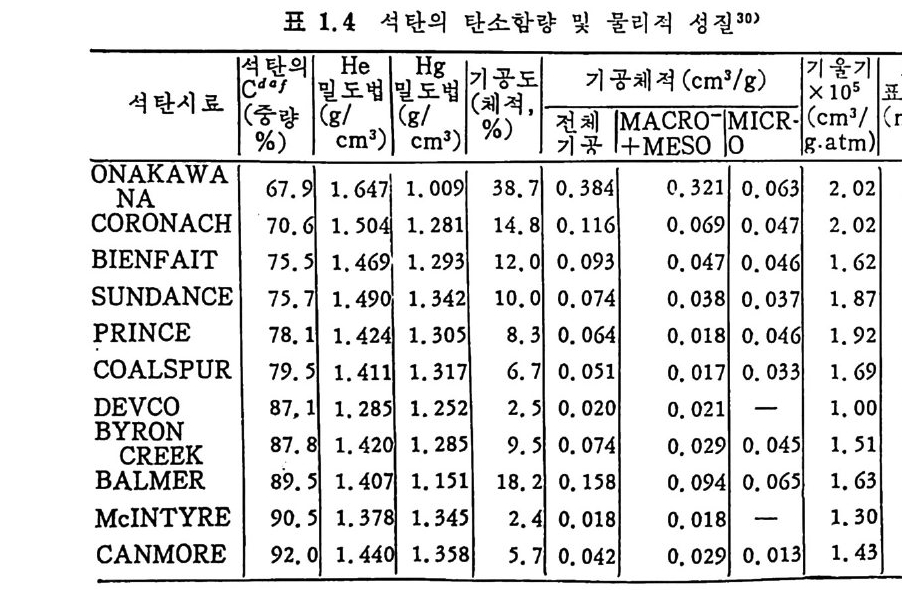 표 1.4 석탄의 탄소함량 및 물리칙 성질 30)
표 1.4 석탄의 탄소함량 및 물리칙 성질 30)
1.5 .2 석탄의 내부 표면적 석탄의 내부 표면적은 기체나 증기를 석탄에 흡착시킨 견과로부터 구하거나 석탄을 액체와 접촉시켰을 때의 영효과로부터 계산할 수 있 다. a) 습영 (heat of wett ing ) 내부 떤적을 측정하는 제일 오래된 방법으로 석탄과 용액간에 화 학적 상호작용이 없으며, 예를 들어서 me t hanol 을 석탄에 침두시키면 석탄의 3~10% 의 체적이 팽창된다. 이때에 에너지가 필요하며 또한 석탄과 액체 상호간의 작용에 의하여 에너지가 발생한다 . 이 습열은 젖은 면적에 비례하여 IOm2 당 약 1cal 를 방출한다 .3 1. 32) 이 상호작용 에너지는 주로 van der Waals 힘과 쌍극자 힘에 의한 것으로 알려쳐 있다. 또한 이 힘은 거리에 따라 급속히 감소하며 이 것은 흡착된 분자의 첫번째 충의 상호작용에 한정됨을 뜻한다. 이것 을 근거로 습열은 전체 표면적을 나타낸다고 할 수 있다. b) 둥온 훈 착법 (iso th ermal adsorpt ion ) 기체나 중기가 각각의 상대압력 (P/ P 0) 때의 흡착된 양울 기체나 증 기가 한충 표면만 홈 착되었다고 가정하여 그때의 흡착된 분자의 표면 적으로부터 석탄 내부의 내부 표면적을 구한다. 일반적으로 찰 알려 전 방법 은 Brunauer-Emmett -T eller 방법 33) 으로서 -v cPp-: = -P f =v:I c국 -Cv— . :zI r -Pp: 400 여기서 P 와 Po 는 액체 질소(의1. 21비) !끝 300 • ••' 점 온도에서 평형압력과 포화압력 ~띤 200• ,, (satu r ati on p ress) 이고 V 는 압력 벼 100 P 에서 흡착된 체적이며, vm 은 。 가스가 단일충 (monola y er) 에 홈착 70 75 80 85 90 단소 %daf 되었을 때의 체적이며 c 는 상수이 다. 그양립으 로1부. 6터 C계O2 산 가된 2표5°면C적 에 과서 석흡 착탄된등 식 (1. 21) 을 사용하여 서 P!Po 와 급과의 관계미) P/V(P 。 -P) 를 도시하면 P/Po 가 0. 05~o. 35 영 역에서 칙선을 얻는다. 이 직선의 기울기 및 절편으로부터 Vm( 단충표면체적)을 계산할 수 있
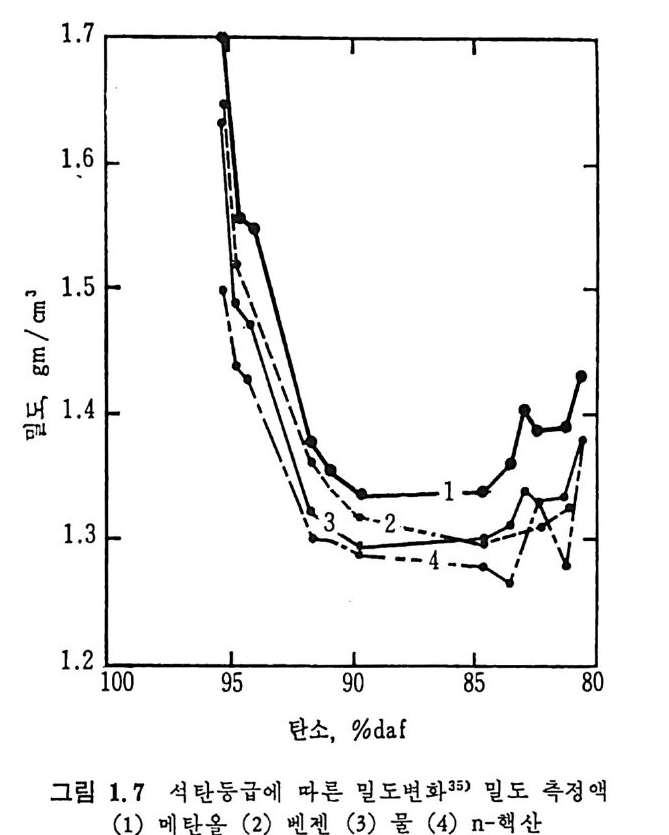
으며 시료의 V 는 N2 분자의 Vm=16.2A2 으로 가정하여 구한다. 그 러나 흡착기체 (N2, CO2) 의 온도의 의존성이 크기 때문에 절대치로서 보다 상대치의 의미를 가진다• 일반적으로 석탄의 내부 표면적은 갇 탄의 경 우 100~2oom2/g 이 며 준역 청 란은 50~100m2/g 이 고 역 청 탄은 10om2/g 이상으로 증가하기 시작하면서 무연탄은 10om2/g 이상이 된다(그립 1. 6). 34) c) 밀도 (densit y) 석탄의 밀도는 구조상의 복잡한 기공과 또한 이의 둥급에 따라 밀 도가 변화하므로 축정하는 방법 에 따라 밀도가 다르다. 벌크밀도 (bulk dens ity)는 평균 입자크기, 크기분포 및 석탄의 충 전밀도로부터 결정하며 석탄의 수송 및 저장 둥에 사용된다. 겉보기밀도 (a pp aren t dens ity)는 보동 액체가 여과되는 양으로 결 정되므로 액체가 얼마나 완전히 기공체적을 침투하는가에 달려 있 다. 철대밀도 (absolu t e dens ity)는 석탄의 여러 변성단계의 순수밀도를 나타낸다. 실제적으로 가장 유용한 밀도는 겉보기밀도로서 비중용기(py cno me t er) 에 서 물, 벤젠 또는 n-hexane 을 사용하여 결정 한다. 완전히 건조된 석탄시료 (1~2 g)를 3mm 보다 작은 입자경을 가전 것을 상기한 액체를 사용하여 충분히 평형을 이룰 수 있는 24 시간 정 도의 시간이 지난 후 일정한 무게를 유지한 후에 결정한다. 그 후 금 속성분치를 보정하여서 아래와 같이 순수 석탄의 밀도를 결정한다. D 보정= D10 회0분D 회D분 실 -험 D(1 실0험0 一(%% 회회분분)) (1. 22) 여기서 D 실험은 석탄시료의 밀도 측정치이고, D 호 1 분은 석탄시료에서 부터 얻은 회분의 밀도이다. D 회분의 값을 얻을 수 없을 때는 보통 2.7~3.o g /cm3 값을 가정하여 사용한다. 그 대표적인 석탄밀도 측정 치를 그림 1.7 에 보여주고 있다 .35) 그립 에서 보듯이 me t hanol 로 축정한 밀도가 다른 것보다 높은 값 올 보인다. 이것은 석탄의 작은 기공에 me t hanol 이 압축되어져 있기 때문이다.
 1.7
1.7
철대 밀도 (absolu t e densit y) 의 결 정 은 기 체 나 증기 흡수법 35-36) 과 유 사한 방법 으로 결정 하며 , 순수 heli um 을 팽 창계 (d il a t ome t er) 유체 로 사용한다. 그 이유는 실제 원자의 직경 (1.78A) 이 제일 작고 석탄에 흡수되지 않기 때문이다. 측정방법은 1mm 보다 작은 석탄시료를 90 ~120°c 에서 기체를 전공 (>10-4 t orr) 하에서 제거한 후 he li um 을 홉 수시켜서 결정하고 금속성분 함량을 보정한다. 그러나 탄소함량이 90% 이상인 석탄의 경우는 물로써 결정한 절대밀도와 별차이가 없 다. 그러므로 매우 정확한 절대밀도치가 필요한 경우에만 he li um 으 로 밀도를 결정할 필요가 있다고 하겠다. 또한 He 이나 H20 로서 결정하는 대략적인 밀도치를 석탄의 수소함 량으로부터 추정 하는 상관식 이 알려 져 있 다. 37-38)
D= (0. 54+0.1 043 %H) (I . 23) 이 식은 석단의 탄소함량이 80% 이상인 것과 산화된 석탄 은 탄소 함량이 73~85% 경우에 한하여 추정할 수 있다. 이때의 밀도는 항상 수분이 포화된 시료를 사용하여 결정하며 금 속성분과 수분함량을 보정하지 않는다. 석탄 덩어리 (bank densit y) 밀도는 석탄 광맥의 밀도로써 일정 지역 의 석탄 매장량을 예측할 때 사용한다. 벌크밀도는 보칭하지 않은 석탄조각의 겉보기밀도를 말하며, 석탄 시료의 크기 분포와 충전 밀도(p ack i ng densit y), 금속성분 그리고 수분함량에 달려 있다. 그러므로 보통 알고 있는 용적의 석탄 무게 를 측정 하여 결정 하며 g/c m3 보다 Kg /N m3 으로 표시 한다. d) 석 탄의 바 열 (sp e c ific heat) , 열 전도도 (the rmal conducti vi t y) 석탄을 가열시, 전열은 석탄의 비연과 열전도도에 달려 있다. 비열 은 석탄의 수분함량에 따라 직선적으로 변하므로, 건조한 석탄의 비 결 은 비열과 수분함량을 도시하여서 수분함량이 없는 (H20=0) 접까지 외삽하여서 결정한다. 석탄의 비열은 탄소함량이 70% 에서 90% 로 증 가할 때 o.30 에서 o.25cal/ g으로 일정하게 감소하다가 95% 에서 급 격 히 감소하여 o. 20 cal/ g 으로 번화한다 (흑연 의 비 열 은 o. 165 ca l/g이 다). 비열 (C,) 은 석탄의 휘발분 함량으로부터 계산할 수 있는 상관식 39) 이 발표되었고 모든 석탄에 적용된다고 주장하였다. Cp = O. 242(1 +o. oos VM) (I. 24) 석 탄의 열전도도는 3. 3 X 10-4~8. 6 X 10-4 cal/sec cm°C 범 위 40,41) 에 서 변화한다. 또높은기공물을가전석탄의 열전도도는 내부 기공면적 울 채우는 기체의 특성에 달려 있다. 죽 -10+12mesh 크기의 44% 의 기공을 가전 석탄을 공기로 채웠을 때는 3.27X10-4 cal/sec cm°C 의 값을 나타내나 수소를사용하였을때는 7 . 03X10-4ca l/ seccm°C 의 값 울 나타낸다 .42) 또한 열전도도는 석탄의 수분함량에 영향을 받는다고 알려져 있다.
1.6 석탄 가열시의 특성 석탄 가열시 석탄의 품위와 동급, 형태에 상관없이 수분과 가스 (CO, CO2, H2, CH4, CxHy , H20, H2S) 및 타르기 체 를 배 출함과 동시 에 char 와 코크스몰 남긴다. 생성된 기체 및 부산물의 조성 및 상대양은 가열 최종온도, 압력 및 석탄의 양에 상관된다. 가열시의 특성에 따 타 크게 코킹 (cokin g ) 및 non-cokin g 석 탄으로 미 국에 서 분류하고 영 국에 서 는 cakin g 및 non-c a kin g 으로 구분한다. 코킹 (cokin g ) 아란 석 탄을 빨리 가열할 때 나타나는 석탄의 독성이며 cak i n g은 천천히 가 열할 때 나타나는 석탄 독성을 의미한다. 점결성 (a gg lomera ti n g)은 휘발분 함량 시험시 석탄을 천천히 가열할 때의 특성을 나타낸다. 그러므로 넓은 의미에서 석탄을 접결성과 비 접 결성 (non ag glo merati ng ) 석 탄으로 대 별한다. 상기 의 성 질과 분류는 보통 실험적으로 결정한다. a) 자유팽 윤 (free . swell ing ) 석탄의 자유팽윤 측정은 시료 l g(― 60mesh) 을 밀퍼]된 s ili ca 도가니 에 넣고 820 土 2°c 에서 2.5 분간 가열하여서 결정한다. 만일 석탄이 이 조건에서 녹지 않으면 응집없이 증류되며 그잔재는 외양이 변화없 이 분말형 태 로 남는다. 이 때 석 탄이 녹지 않으면 non-cokin g 이 라고 부 른다. 만일 석탄이 녹으면 석탄 덩어리는도가니 내에서 괭윤되어지고 다시 다기공의 coke 로 굳어져서 초기 체적보다 증가한다. 즉 팽윤된 체적대 초기 체적의 비를 자유괭윤계수 (Free Swell ing Index) 라고 한 다. 그러나 보통 표준 도가니 형태를 기준으로 하여서 기준 괭윤단면 도의 바닥면과 비교하여서 결정한다(그립 1.8). 도가니에 붙지 않는 분말란을 0 으로 하고 계 수가 2 또는 3 인 경 우를 약한 cakin g 탄으로 부른다. 이 방법은 약 • 중 정도의 cok i n g탄을 분류하기는 쉬우나 강한 CO· k i n g탄에는 부적합하며 석탄의 물리적 성질을 나타내지는 못한다. b) 석탄의 팽창 한 조각이나 작은 구로 만든 석탄시료를 1000°c 까지 가열하여 체 적이 변화한 것을 석탄의 팽창 (d i la ti on) 이라 한다. 이 실험은 고압이
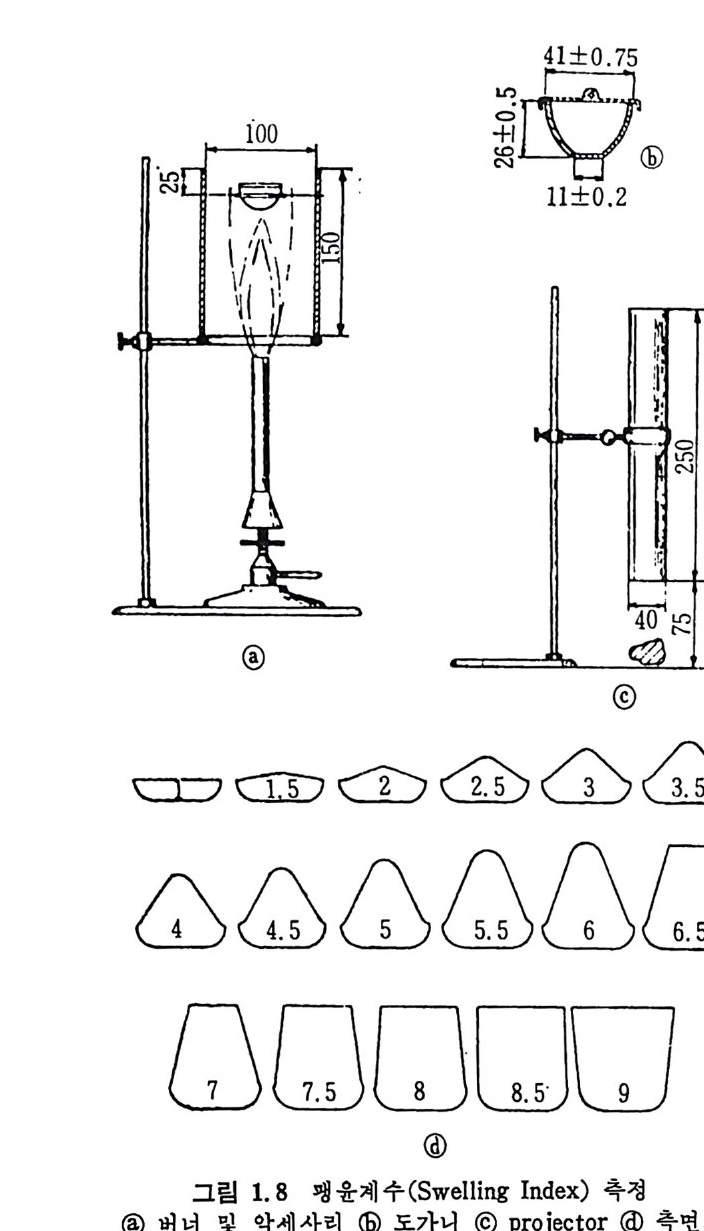 s·o+ 豆
s·o+ 豆
나 대기압에서 측정할 수 있다. 일반져으로 팽창은 시료를 원통관에 넣고 시료의 한 방향으로의 길이 변화를 축정한다. 가열 중 첫단계 에서는 접결 및 팽윤이 일어나면서 다시 고화되고 고온에서 더 구조변
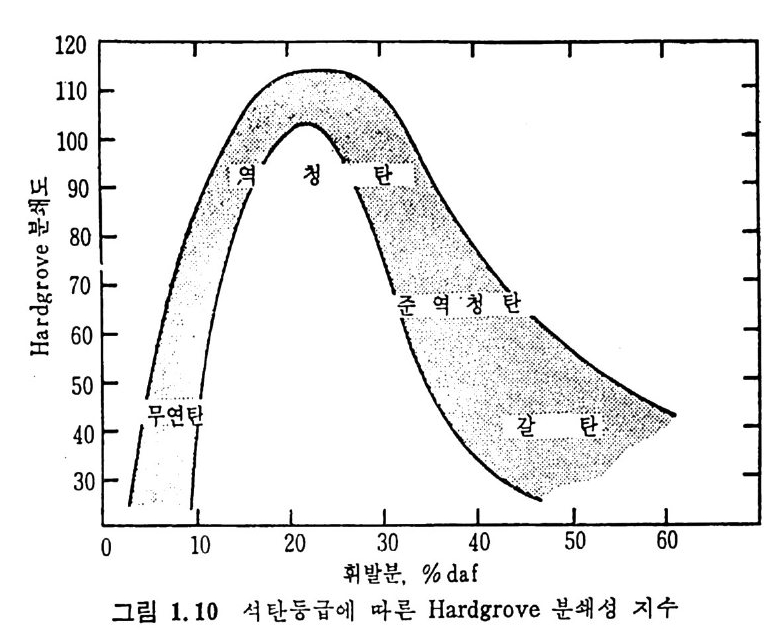
화가 일어나서 반 코크스 를 형성한다. 이 시험으로부터 얻은 결과는 재고화접의 상·하한에서의 석탄의 성질을규정한다. c) 석 탄의 가소성 (pla sti cit y) 석탄이 가열되어 녹으면 뉴토니안 유체가 되지 않는다. 석탄의 유 동성은 순간적 현상으로 가열률, 가열의 최종 온도 및 주어전 온도에 서의 가열시간 둥의 함수이다. 가소성을 측정하기 위하여 두 가지 형 태의 가소측정기 (p las t ome t er) 가 있다. 죽 일정 토오크 가소측정기와 변속 토오크 측정기가 있다 .43) 다론 방법으로는 금속 바늘을 이용하 여 가열되어 부드러워진 석탄을 일정 부하로 침입시켜 침입도를 측칭 하며 이 룬 침 입 도 실 험 기 (pe netr o mete r ) 라 한다 . I.7 석 탄의 기계적 성질 석 탄의 기 계 적 성 질은 석 탄 활용, 즉 석 탄 채 란 • 분쇄 • 수송 및 반 웅기 주입 둥에 영향을 미치는 주요 인자이다. a) 석 탄의 취 약도(fri ab ility) 보봉 사용하는 석탄의 강도시험은 ASTM(D3402~72) 의 전마기시 험과 낙하분쇄시험 (ASTM D3038~72) 이 있다. 전마기시험은 거의 같은 크기의 석탄시료를 주어전 회전율로 일정 시간 회전시킨 후 체로 쳐서 평군 입자경을 결정한다. 만일 전마시킨 석탄의 입자경이 초기 시료 입자경의 75% 이면 이 석탄의 취약성은 25% 라고 한다. 상기 방 법 의 결과는 명 목치 수 안정 도 (nomi na l siz e s t ab i l ity)와 취 약도(f r i· ab i l ity)로 나타낸다. 즉 명목치수 안정도 (S) 는 S=100A/B 로 취약도 (f)는 /=100 一 S 로 표시되며 여기서 A 와 B 는 시험 전후의 체로 쳐 서 결정한 평군 입자경이다. 석탄의 충격강도 44) 는 3X9.5mm 크기의 석탄시료 100 g을 1.8kg 무게를 30.5cm 높이에서 20 번 낙하시킨 후 3mm 보다 큰 석탄입자가 초기 입자 크기에서 몇% 남아 있는가로 결정한다. 이 시험결과를 석탄등급의 무수분 및 회분상태의 휘발분 함량의 함수로 그림 1.9 에 도시하였다 .45) b) 분쇄 성 (gr in d abil ity) 분쇄 성 의 일반적 측정 은 볼 밀 (ball m ill)시 험 과 hardg r ove(ASTM
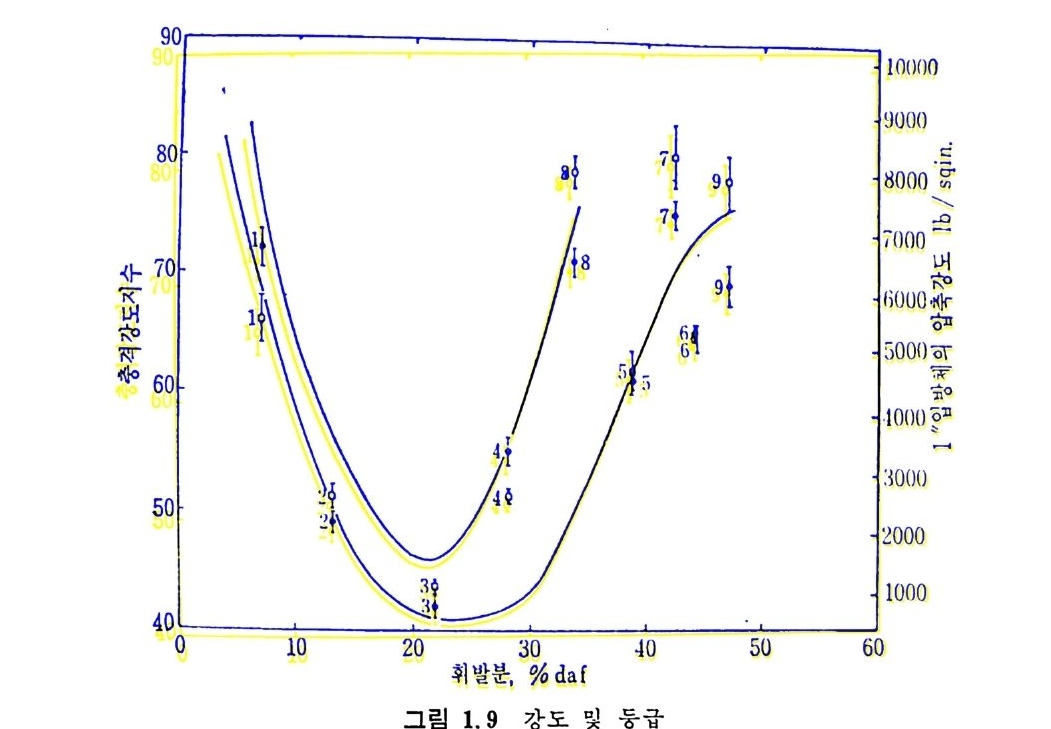 90
90
D 409~72) 시 험 이 있 다. 그러 나 후자의 방법 이 전자보다 측정 이 신속 하므로 이 방법이 일반적으로 사용되며 석탄시료 50g ( -I6+30mesh) 울 8 개의 구로 표준 분쇄기에서 60 번 회전시킨 후, -200mesh 크기분 울의 무게 (W) 를 결정하며 분쇄도(I)는 1=13+6.93W 로 정의한다. 분쇄도와 석탄등급과의 관계를 그림 1. 10 에 도시하였다. 이 방법은 석탄의 수분함량, 온도 및 시료의 준비방법 둥의 영향을 받는다. 일 반적으로 갈탄 및 무연탄이 역청탄보다 분쇄에 강하며, 그림 I.9 와 1.10 에서 보듯이 준휘발성 역청란이 가장 낮은 충격강도를 보이므로 쉽게 분쇄할 수 있다. c) 란성 및 강도 (elasti city and str e ng th) 석탄의 구조적 특성의 근본 변수들은 응력과 변형관계, 탄성계수 및 내부 마찰계수 등이다. 그러나 석탄은 일반적으로 응집력이 작고 군일하지 않으므로, 석탄의 구조상 많은 다른 성질과마찬가지로 기계 져 특성치는 절대치로서의 의미보다 상대치의 의미를 갖는다. 흡수팽윤방법 (sorp tion swellin g t echn iq ue) 에 의한 Young 's 탄성
 120
120
계수 (E) 결정은 석탄에 매탈알콜을 홍수 괭윤시켜서 내부 떤적이 팽윤 정도에 달려 있다고 가정하여서 다음 식으로부터 탄성계수를 계산하 였다 .46) E= 100 DS/l (1. 25) 여기서 D,S 및 A 는 석탄의 밀도, 측정한 내부 면적 및 팽윤계수 상 수이냐 일반적으로 이제까지 발표되어진 실험결과로는 탄성계수와 석탄등급과의 뚜렷한 함수관계가 없다 . 석탄의 압축강도 시험 47) 의 결과는 그립 1.10 에서 보듯이 무회분-휘 발분 함량이 20~25% 에서 최소치를 보인다. 일반적으로 압축시험법 이 재현성이 좋으므로 널리 사용되고 있다. 더 자세한 내용을 위해 아래에 참고문헌을 소개하였다. van Krevelen, D. W. , Coal. Top ol og y-C hemi st r y - P hys i c s -Cons- titut i on , Elsevie r , Amste r dam, 1961 . Probste i n , R. F. and Hick s, R. E. , Sy nt h e ti c Fuels, McGraw- Hil l, N. Y. , 1982. Francis , W. , Coal: Its for mati on and comp os it ion , 2nd Ed. ,
Edward Arnolds Lt d. , London, 1961. Skin e r, D. J. , Fluid i z e d Combtt st i on of Coal, Mi lls and Boon, London, 1971. Gib s on, J. and Greg o ry, D. H. , Carboniz a ti on of Coal, Mi lls and Boon, London, 1971. Lowry, H. H. , Eds. , Chemi st r y of Coal Ut iliz a ti on (Vol. I & II , 1945, Sup ple mentr a ry Vol. , 1963) , Joh n W ile y , N. Y. Pit !, G. J. and Mi llwa rd, G. R. , Coal and Modern Coal Pro- cessin g , Academi c Press, N. Y. , 1979. Berkowi tz, N. , An Intr o dtt ct i on to Coal Teclmolog y, Acade- mi c Press, N. Y. , 1979. Wen. C. Y. and Lee, E. S. , Eds. , Coal Co11versio 1 1 Tee/mo-log y, Addis o n Wesley Pub. , Inc. , Readin g , Mass. , 1979. Ell iot, M. A. , Eds. , Chemi st r y of Coal Ut iliz a ti on , Sup pl. Vol. II , W iley , N. Y. , 1981. 참고문현 1) Franci s, W. , Coal Its FormaUon and Comp o sit ion, Edward Ar· nolds Ltd . , London, 1961. 2) Sto p e s , M. C. , Proc. R. Soc. , London, 90B, 1470 (1919) . 3) Inte r nati on al Handbook of Coal Petr o log y, 2nd Ed. , Paris (1971). 4) Aberneth y, R. F. , Walte r s, J. G. , Anal. Chem. Ann. Rev. , -11, 30BR (1969): 5) Hatt m an, E. A. , and Or tug l i o , C. , Anal. Chem. Ann. Rev. , 43, 345R (1971). 6) Spa c kman, W. , Characte r is t i cs of Americ a n Coals in Relati on to the ir Conversio n int o Clean Energy Fuels, Penn. Sta t e Univ . Inte r im Rep or t (1976) . 7) Van Krevelen, D. W. , and Chermi n, H. A. G. , Fuel, 33, 338 (1954). 8) Meth o ds of Analyz i n g and Testi ng Coal and Coke•, U. S. Bur. Mi ne s Bull. , 638, 1967. 9) Ode, W. H. , Coal Analys i s and Mi ne ral Matt er , Chapt er 5, Chemi - s t자 of Coal Utiliza ti on , Sup ple Vol. , H. H. Lowr y Ed. , Joh n Wi ley & Sons, N. Y. , 1963.
10) Abernath y , R. F. , Ergu n , S. , Frie d e l, R. A. , McCarth y , J. T. and Wender, I. , in Encyc l op ed ia of Industr i a l Analys i s , F. F. Snell and L. S. Et tre Eds. , Vol. 10, 209, Wi ley - ln te r sci en ce, N. Y. , 1970. 11) Jac k son, P. J. , Fuel, 35, 212 (1956) . 12) Beet, A. E. , and Belcher, R. , F11el, 19, 42 (19 40) . 13) Fie l din g , A. C. , and Se lv ig , W. A. , U. S. Bureau Mi n es Bull 492, 16 (19 51) . 14) Schutz e , M. Z. , Anal. Chem. , 118, 245 (19 39) . 15) Unte r zaucher, J. , Ber. Dt sc h. Chem. Ges. , 73B, 391 (19 40). 16) Abernath y , R. F. , and Gi bs on, F. H. , U. S. Bureau Mi ne s Rep . Invest No. 6753 (19 66) . 17) Bate , L. C. , Nucleonic s , 21, 72 (19 63). 18) Anders, D. V. , and Brid e n, D. W. , Anal. Chem. 36, 287, (19 64). 19) S:! lv ig , W. A. and Gi bs on, F. N. , Chemi st r y of Coal Ut iUz ati on , Cha p ter 4, Vol. 1, H. H. Lowry Ed. , Joh n W ile y & Sons, N. Y. , 1947. 20) Mott , R. A. and Sp o oner, C. E. , Fuel, 19, 226, 242 (19 40). 21) Erg u n, S. , Chap ter 1 of Coal Conversio n Teclz110/og y, C. Y. Wen and E. S. Lee Ed. , Addis o n -W esley Pub. Co. , Readin g Mass. 19i 9 . 22) Gouta l , M. , J. Soc. Clzem. Ind. , 21, 1267 (1902) . 23) Schuy e r, J, and Van Krevelen, D. W. , Fuel, 33, 348 (1954) 24) Thie s sen , G. , Chemi st r y of Coal Uti ltz ati on , Vol. I, H. H. Lowry Ed. , Joh n Wi ley & Sons, N. Y. , 194 7. 25) Ode, W. H. , Chemi st r y of Coal Ut iliz a ti o n, Sup ple Vol. , H. H. Lowry Ed. , Joh n W iley & Sons, N. Y. 1963. 26) Kin g , J. G . , Ma ri e s , M. B. , and Crossley, H. E. , J. Soc. Chem. Ind. , 55, 277 (1936) . 27) Brown, R. L. , Caldwell, R. L. and Fereday , F. , Fuel, 31, 261 (1952) . 28) Zwi et e r in g, P. and van Krevelen, Fuel, 33, 331 (1954). 29) Cameron, A. and Sta c y, W. 0. , Chemy Ind. , 222 (1960). 30) Ng , S. H. Fung D. P. C. and Kim , S. D. Fuel, 63, 1564 (1984). 31) Magg s , F. A. P. , J. Inst. Fuel, 17, 49 (19 44). 32) Grif fith, M. and Hir s t, W. , Proc. Con!. Ul tra fi ne St r1 1ct. Coals, Cokes, BCURA, London, 80 (19 4 4 ). 33) Brunauer, S. , Emmett , P. H. , and Teller, E. , J. Amer. Chem. Soc., 60, 309 (1938) . 34) G(1a9n7, 2)H. . , Nandi, S. P. and Walker Jr. , P. L. , Fuel, 51, 272
35) Franklin , R. E. , Fuel, 21, 46 (1948). 36) Bond, R. L. , and Sp en cer, D. H. T. , Soc. Chem. Ind. Proc. Con!• Ind. Carbon GraP /iite, London, 231, (19 75). 37) Wandless, A. M. and Macrae, J. C. , Fuel, 13, 4 (1934). 38) Whit tak er, J. W. , Fuel, 29, 33 (1950). 39) Fritz , W. and Moser, H. , Feuer1mg s te c lmi k, 28, 97 (1940). 40) Fritz . W. and Die m ke, H. , Chem. Abstr . , 35, 4939 (1941). 41) Sin n att , F. S. and McPherson, H. , Fuel, 3, 12 (1924) . 42) Schumann, T. E. W. and Voss, V. , Fuel, 13, 249 (1934). 43) Audib e rt, E. , Rev. Ind. Mi n er, 6, 115 (1926). 44) Yancey, H. F. and Greer, M. R. , Chemi st r y of Coal Ut ilizat i on , Vol. 1, Chap ter 5, H. H. Lowry Ed. , Joh n W ile y & Sons, N. Y. 1947. 45) Pomeroy , C. D. and Foote , p. , Collie ry Eng . , 37, 146 (1960). 46) Beng h am, D. H. and Mag gs, F. A. P. , Proc. Conf . 011 U! tra fi ne Str u ctu r e of Coals and Cokes, BCURA, London, 118 (1944). 47) Brown, R. L. and Hio r ns, F. J. , Chemi st r y of Coal Ut iliza ti on , Sup pl. Vol. Chap ter 3, H. H. Lowry Ed. , Joh n Wi ley & Sons, N.Y. 1963.
제 2 장 석탄에너지 변환 석탄으로부터 에너지 변환방법은 석탄의 열분해(py rol y s i s), 석탄의 가스화(g as ifi ca ti on) , 가스화로부터 의 가스합성 및 석 탄의 액 화 등으 로 대별할 수 있겠다. 전세계적인 70 년대의 에너지 위기 아태 석탄 생 산 및 이의 활용기숟에 대한 연구가 활발히 진행중에 있다. 그러 나 석탄의 반웅속도 및 화학적 변환 때의 물리화학적 특성이 석탄에 따라 일정하지 않음으로 인하여 석탄연소, 가스화 및 액화 반응기 설 계에 많은 문제가 아직도 남아 있다 . 그러나, 보다 효율적인 석탄활용 울 위하여서는 보다 많은 석탄의 열분해, 연소, 가스화 및 액화 반응 에 대한 정보가 요구되어지고 있다. 2.1 석탄의 열분해 석탄의 열분해란 공기가 없는 상태에서 가열하여 석탄 내의 유기물 질을 분해하는 것이다. 그러나 일반적으로 무기화합물이 분해되어지 는 것도 의미한다. 석탄을 산소가 없는 상태에서 가열하떤 수소성분이 많은 휘발분이 증류되 어 나오고 고체 물질 (char) 이 남는다. 같은 의 미 로서 탈휘 발화 (devolati liza ti on ) 란 말도 사용하며 또한 char 가 찬유물로 남으므로 탄화 (carbon i za ti on) 란 표현도 사용하나 탄화는 고체 char 를 얻기 위한 것이며 합성연료를 얻기 위한 것은 액체나 기체 탄화수소를 얻 는 것이다. 열분해(py rol y s i s) 를 동해서 석탄으로부터 액체연료를 얻
는 원리라고 하겠다. 죽 열분해는 석탄 가스화나 액화공정의 일차 단계이다. 석탄의 열분해반응은 18 세기 말부터 연구되어져 왔으나, 석탄의 복잡한 구조적 성질과 물리 • 화학적 현상으로 인하여 동일된 이론이 정립되지 못한 상황이다. 그러므로 대부분의 결과는 실험적 결과로서, 합성연료 공정설계시 도움이 될 기초자료를 제공하는 데 본 기술의 목적이 있다고 하겠다. 석탄을 가열하면 일차로 석탄과 결합하지 않은 수분은 105°C 이하 에서 내부분 증발되며, 300°C 정도에서 완전히 제거된다. 그 후 온도 를 더 상승시키면 cakin g 석탄은 준안정성 가소중간체로 되어져서 재중합되어 휘발성물질 및 반코크스 (sem ic oke) 를 형성한다. 이 과 정에서 석탄입자는 팽윤되어지고 그 정도는 팽윤계수와 가열조건에 달려 있다. 영국 표준 팽윤계수 (BSSI) 와 수소 및 탄소함량과의 관계 식은 다음과 같다.1) BSSI= (H 니。) x[ ( C-94)+11(H-4.o)] (2. 1) 연분해로부터의 기체 및 액체 산물을 측정하는 방법은 a) 독일에서 개발된 Fi sher 분석법과 후에 미국 및 유럽에서 개량한 방법과 b) 영 국에 서 개발한 석 탄을 분류하는 Gray- Ki ng 분석 법 이 있 다. 두 방법아 모두 500~600°C 에서 수행되나 이 온도에서 얻은 결과 는 일반적으로 가스체적이 적게 예측되고, 타르(t ar) 와 경유(lig h t oil ) 의 수율은 최대치를 보이나 정확한 실험을 행하면 물질수지는 100 土 o.3% 를 얻을수 있다. 또한 Gra y -K ing분석법은 900°C 에서도수행할 수 있으며 고체 잔류물의 성질에 관한 정보를 제공한다. 석탄의 종류 및 등급에 따른 가스, 수분, 타르 및 경유 둥의 대표적인 분석결과를 표 2.1 에 보여주고 있다. 석탄의 등급이 증가함에 따라 산소함량이 감소하며 이에 따라 타르(t ar) 와 경유의 생성이 증가하나 탄소함량이 87% 이상이 되면 다시 감소한다. 그러므로 수소함량이 4% 미만인 무연탄의 경우 타르의 생성이 매우 적다. 그 반면 수소함량이 높은 석탄의 타르의 생성은 2~4 배만큼 높다• 그러므로 이러한 관접에서 석탄의 원소조성과 타르와 경유 및 수분 생성을 산소 및 수소함량으로부터 예측할 수 있는 실험식들을 제시하
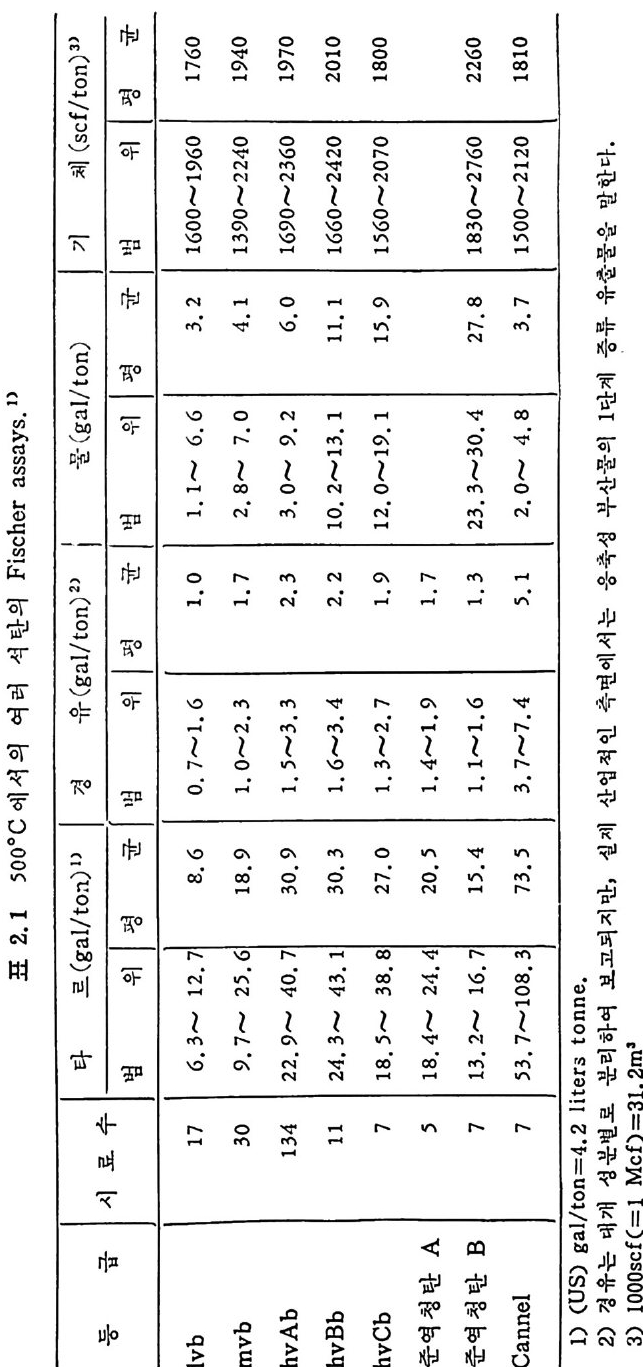 iyas aFh.srses c05 °C0. 12 탄러 의석 의여서 에 D 표 | 기수 료 1I시/ft(cn o)gs(/l ao)nt타 체/ 1 an)ot겨ln르>og)(a유 물g/tl( '3>2 I o | 구군법 우 평1범 니 l평우 법니 |위평 평[l우 군법 ~010619076 I.66 6.6 1 .. I~1 .0302 7 3 18 261 ..o~ 716 7..~vbl 1940 342 82200 ~~170 ,3, 9 1,.2 ~ 01,4,. 7 29 ~3015 6 7. 189. mb v 1709106 32~6006 ,9, 400 3, 2 .3.~~9 72.3. 9 9032.24133~.51 h bAv 2020~201411,0166 1 1.330~. 10. 1 21 1.3 4~26 2 . 31 ,334 ~ B bvh, 1.42 100850 1720~0691~012 .51 7 12,~93. .1. .027 9 .1C.88 3~.518 7 hbv ,71 ,91~,41 5.20 5 .4 4 2~.481A 역 란청준 2622706~0831 60 304.~53,23 3 7... 281 1 4~, 11. 1 76. 1~ 2 .31 7 B란 역준청50 12 1821100~0 ~.02 84. 5373 .81 07 1 7.3..3. 5a ~l en4nC 7~.. 735 7 .enno ;;trl 2.4=noag )Se(Uit/tl) 1 .다한 )2의을공·설산부성유축 응류 는서층 에계 면측단문1말 재실 만지되보고 여하리분 로벌분성 개 인적,업 산대 는유겅 '2m3)= Ml(=csOlOO )3.1fcf
iyas aFh.srses c05 °C0. 12 탄러 의석 의여서 에 D 표 | 기수 료 1I시/ft(cn o)gs(/l ao)nt타 체/ 1 an)ot겨ln르>og)(a유 물g/tl( '3>2 I o | 구군법 우 평1범 니 l평우 법니 |위평 평[l우 군법 ~010619076 I.66 6.6 1 .. I~1 .0302 7 3 18 261 ..o~ 716 7..~vbl 1940 342 82200 ~~170 ,3, 9 1,.2 ~ 01,4,. 7 29 ~3015 6 7. 189. mb v 1709106 32~6006 ,9, 400 3, 2 .3.~~9 72.3. 9 9032.24133~.51 h bAv 2020~201411,0166 1 1.330~. 10. 1 21 1.3 4~26 2 . 31 ,334 ~ B bvh, 1.42 100850 1720~0691~012 .51 7 12,~93. .1. .027 9 .1C.88 3~.518 7 hbv ,71 ,91~,41 5.20 5 .4 4 2~.481A 역 란청준 2622706~0831 60 304.~53,23 3 7... 281 1 4~, 11. 1 76. 1~ 2 .31 7 B란 역준청50 12 1821100~0 ~.02 84. 5373 .81 07 1 7.3..3. 5a ~l en4nC 7~.. 735 7 .enno ;;trl 2.4=noag )Se(Uit/tl) 1 .다한 )2의을공·설산부성유축 응류 는서층 에계 면측단문1말 재실 만지되보고 여하리분 로벌분성 개 인적,업 산대 는유겅 '2m3)= Ml(=csOlOO )3.1fcf
 표 2.2 석탄 연분해의 화학반응· 공정
표 2.2 석탄 연분해의 화학반응· 공정
였다. 1-2) %H20=o. 35(%0)1•3> (2. 2) 여기서 수분생성%는 건조, 무회분 석탄을 기준으로 한 것이다. %(타르+경유 )=5. 48( %H.)1•5> (2. 3) 여기서 H. 는 과잉수소량을 말하며 대략 3.5 정도이다 . 그러나 타르 및 경유는 열분해시의 석탄 내의 자유라디칼이 불규칙 적인 재결합에 의하여 형성되므로 타르의 생성 및 조성은 연분해의 방법에 달려 있다. 비활성 조건에시 석탄 열분해를 적절한 가열률 및 온도로 대기 압하 에서 수행하면 표 2.2 에서 볼 수 있는 화학물질들이 생성된다 . 그 반 떤 기체의 체류시간이 길거나 매우 빠른 가열물과 높은 온도로 연분 해하면, 매우 많은 양의 아세탈렌, 불포화 탄화수소 및 기체탄화수소 산물의 증기분해에 의한 탄소분해물이 생성된다. 2.2 열분해 반응속도 및 생성물 분포 석탄 열분해속도는 기화반응기의 생성물의 양 및 분포를 알 수 있 논 정보를 제공하는 주요인자이다. 또한 열분해반응을 이해하면 급속 열분해의 현상과 압력, 그리고 수소를 첨가하여 기체 및 액체 탄화 수소의 생성을 촉진시킬 수 있는 가능성도 타전할 수 있다 . 특히 급속 열분해방법은 석탄의 공업분석치 휘발분보다 많은 양의 휘발분이 생
 표 2.3 I
표 2.3 I
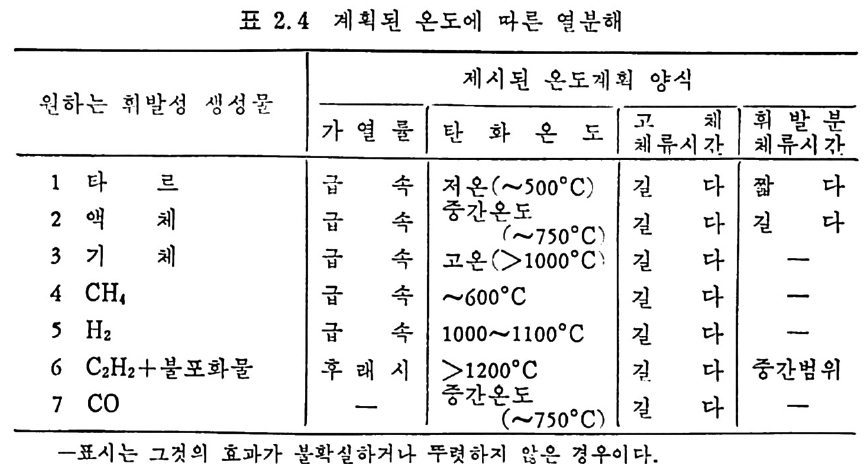 표 2.4 계획된 온도에 따른 연분해
표 2.4 계획된 온도에 따른 연분해
성됨을 발견한 이후 3-6) 많은 연구의 대상이 되어져 왔으며 바교적 낮 은 온도에서 휘발분의 최소 체류시간을 가지고도 석탄으로부터 기름 을 대략 30~35% 정도 생산할 수 있고” 수소의 분압을 증가시켜서 기체 및 액체 탄화수소의 생성을 증가시킬 수 있음을 발표하였다 .8) 생성물의 양과 분포는 가열률 및 -온도영역에 달려 있고 표 2.3 에서 보듯이 대략 4 가지로분류된다. 저속 가연은(<〈 1°C/sec) 이제까지 주 로 제철산업에서 코크스를 만드는 데 사용한 방법이며 앞에서 기술한 열분해 시험법인 F i scher 나 ASTM 방법이 이 가열영역에 속한다.
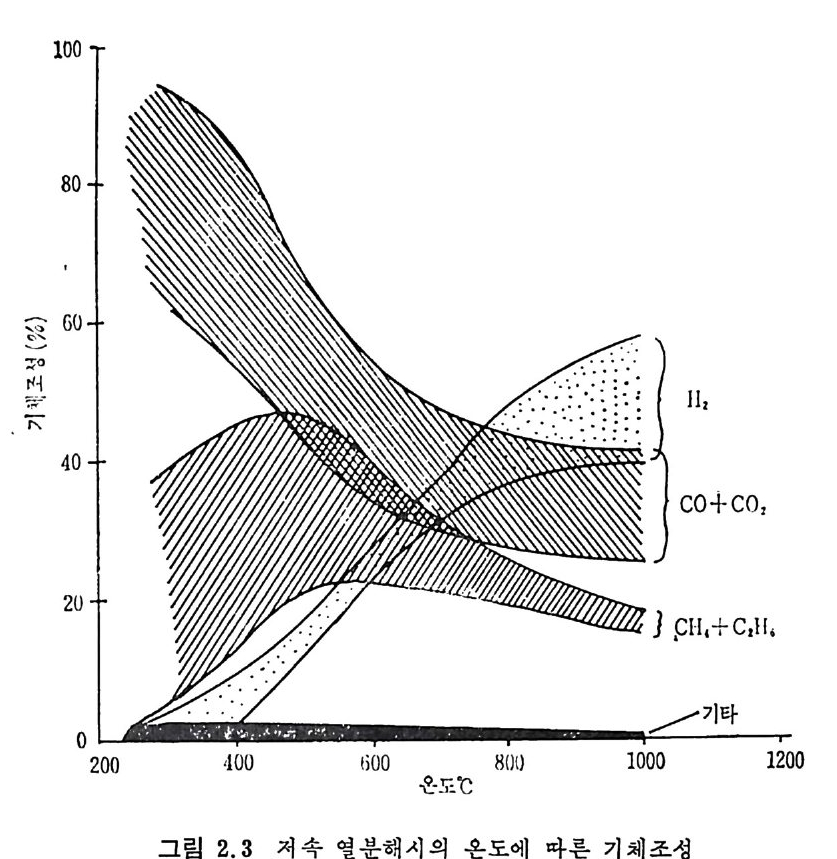
원하는 코크스나 휘발분의 생성을 위하여 각기 다른 온도영역이 사 용된다. 급속가열의 목적은 휘발분 형대의 산물을 많이 얻는 것이다. 죽 액체와 기체의 탄화수소를 많이 생성하고 그 반면 코크스나 좌 (char) 률 적게 생산하는 것이 급속가열의 득징이라고 하겠다. 근래에 후래시(fl ash) 가열에 의한 열분해로 아세탈렌 및 불포화 탄 화수소를 생성하기 위한 연구가 진행중이며 원하는 생성물에 따본 열 분해온도및 가열률과 석탄의 체류시간 등을 표 2.4 에 보여주고 있다. 2. 2. 1 저 속 열 분해 (slow pyro lys is ) 석탄이나 좌 (char) 를 처속 및 중속 가열률 (<100°C/s) 로 가열할 메 석탄을 완전히 탈휘발화하는 시간은 석탄입자가 최종온도에 도달하는 시간보다 훨싼 짧다. 그러므로 이 조건에서는 연분해윤보다 최종 생 성물과 휘발분과 좌의 질이 중요한 인자이다. 그림 2.I 은 온도에 따 론 휘발분 생성량을 Fis c her 분석법에 따라 측정한 것을 보여주고 있 다. 9-10) 여 기 서 실선은 Greg o ry 와 L itt le j ohn11) 이 제 시 한 다음 식 으로 계산된 값이다. V= 1. 1 VM-R'-W (2. 4) 여기서 V, VM, R' 및 W 는 전체 휘발분생성물, 무회분수분석탄 의 휘발분의 무거 1 분율이며 R1 과 W는 아래석으로 정의된 값이다. RW'== o1o. C2oll .(4 7V-3M.96— 1/ 1o 0sT. +9o). oosVM) ((22.. 65)) 상기식둘의 실험영역은 500~1000°c 의 불활성 질소 촌재하에서 저 및 중가열률의 조건에 적용된다. 그립 2. 2 및 2. 3 에 온도에 따른 휘 발분 및 가스생 성 률을 Fis c her 분 석법에 의한 8 가지 다론 등급의 미국 석탄 9-10) 과 영국 석탄 12) 분석치 들을도시하였다. 그림 2. 2 에서 보듯이 타르와 액체의 양은 600°C 이상에서는 증가하 지 않는 반면 기체와 물의 양온 계속 증가한다. 또한 전체 CH4 와 C2H6 의 양은 500°C 부근에서 최대치를 보이다가 온도가 더 증가하면 감소한다.
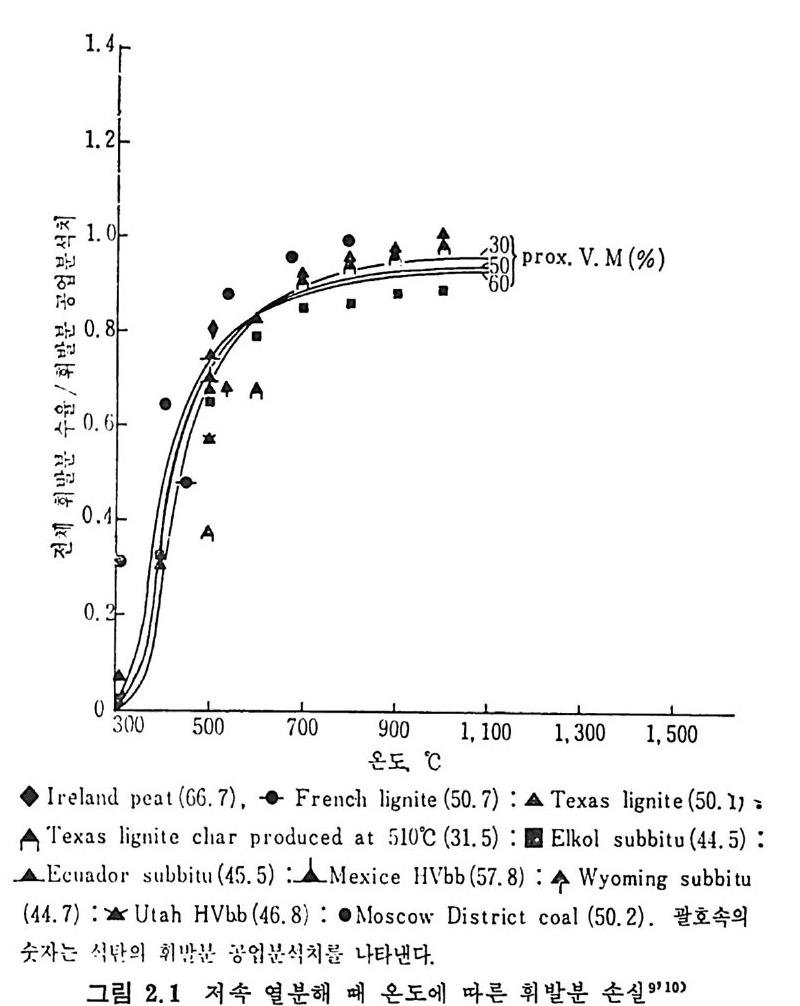 1.4r 1-21
1.4r 1-21
영천평 (t hermobalance) 을 이용하여 13) 석탄과 좌의 열분해실험을 수행한 결과 14) 를 Wen 등이 제시한 식 2,” 을 사용하여 식 중의 A’ 과 B’ 의 값을 각각 0. 33/s 및 2. 5KJ /m ol 이라고 결정하였다. 웅 =A'e 다 '/RT)( f군) (2. 7) 여기서 X 와 f는 주어진 시간에서의 변환율과 최종변환율이다. 또 한 두 가지 석탄을 사용하여 활성화에너지 값은 29.3K J /mol 임을 발 표하였다. 이 실험을 동하여 석탄과 좌의 열분해울이 Arrhen i us 형의
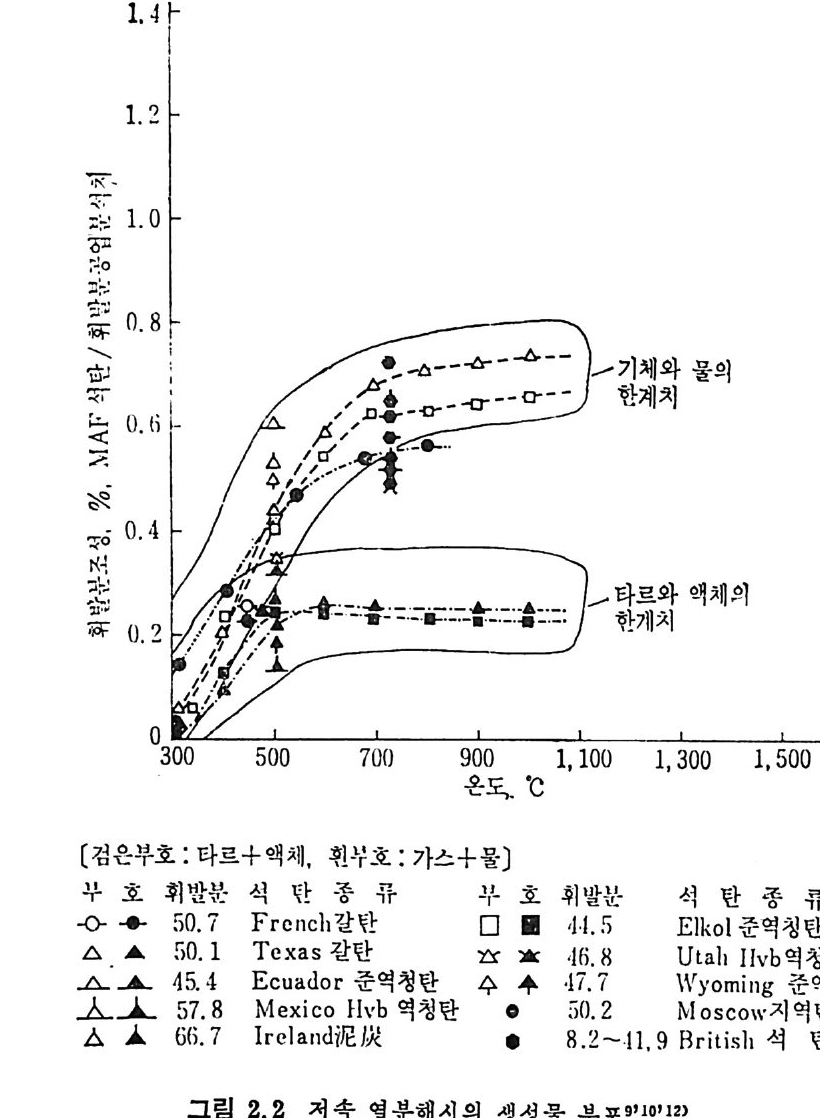 1. 4 「
1. 4 「
 100
100
식으로 표현된다고 하였다. 석탄 열분해시 전체 생성물의 양을 예측하는 것보다 더 어려운 변수 는 각각의 생성물의 생성분포를 예측하는 문제이다. 그러므로 가열풀 에 따른 기체생성률을 연구 15) 하여 아래식을 제시하였다. 댑=뭉 ex p〔_픕 적꿉仁_ •e -(E/RT)] (2. 8) 여기서 V1 은 시간 t에서의 특정가스의 생성물이고, m1 은 가열룰 dT/d t이며, 그 범위는 o.01~105°C/m i n 이므로 저 • 중 및 고가열들 범위에 적용할 수 있다. 상기식 (2.8) 을 이용하여 16>, 준역청란을 3.33°C/mi n 가열물로 110
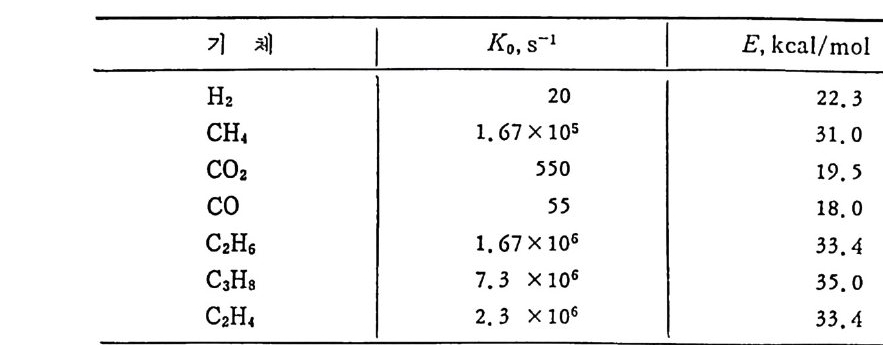 기 체 Ko,s 기 E, kcal/ m o!
기 체 Ko,s 기 E, kcal/ m o!
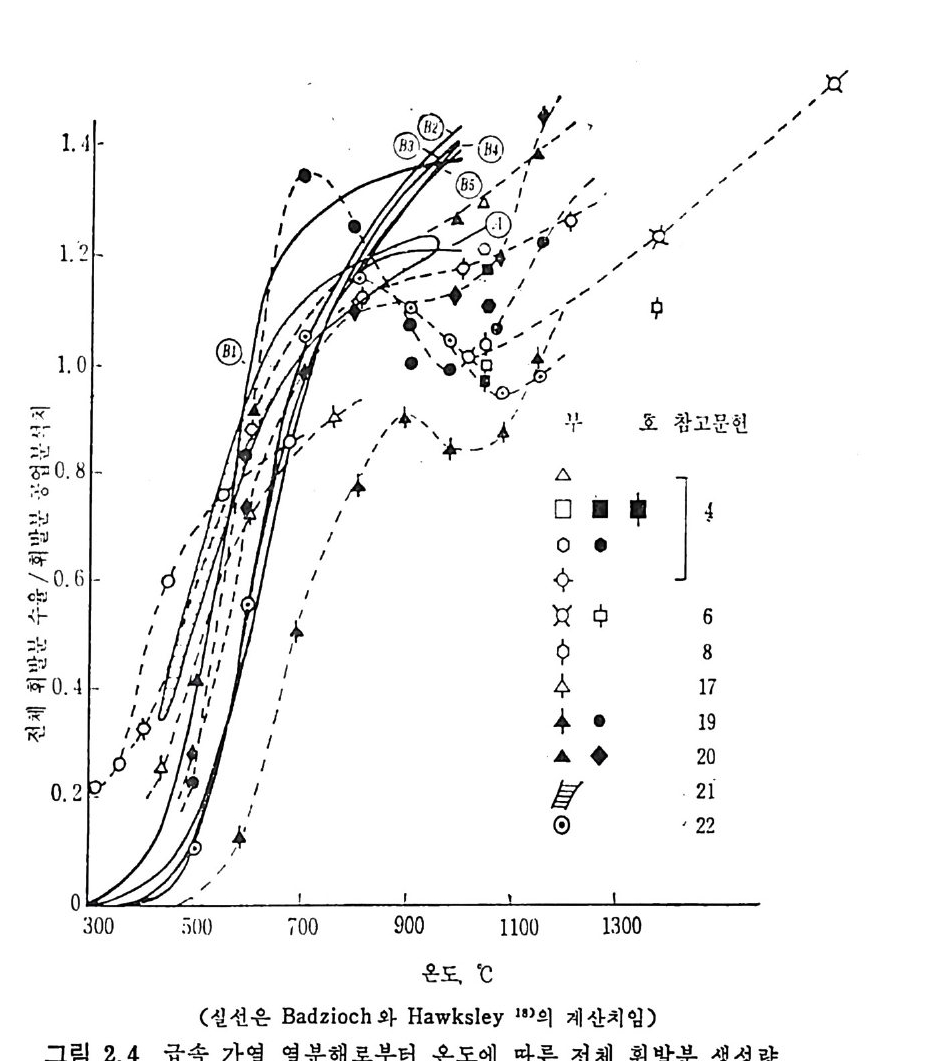
~1000°c 사이에서 연분해한 실험결과를 온도의 함수로써 적용시켜서 얻은 주요기체의 변수들은 위와 같은 값을 나타내었다. 그러나 식 (2.8) 로부터 엑체나 휘발분 중의 타르의 생성분포는 결정 할 수 없다. 또한 CH4, C2H2 및 C2H4 등의 생성도 단순한 분해반응 으로부터 얻어지는 것도 아니다. 그러므로 이 반응들도 가연룹, 온도 범위 및 석탄의 종류에 따라 생성물의 분포가 변화하므로 이에 대한 더 많은 연구가 이루어져야 하 겟 다. 2. 2. 2 급속 열분해 (Rap id pyro lys is ) 석 탄의 탄화수소를 활용하는 가장 좋은 방법 중의 하나가 급속 열분 해라고 하겠다. 앞에서 기술하였듯이 급속 열분해방법으로 석탄의 공 업분석치의 휘발분보다 많은 양의 휘발분을 추출할 수 있다고 4 - 6) 알 려져 있다. 이 급속열분해는 유동충, 자유낙하형 반응기, 분말석탄 연소기, 비 말동반충 (entr a in e d bed) 및 cyc lone 형 반응기 에 서 수행 되 어 진다. 또 한 수송반응기에서 105~106°C/s 의 가열률로 석탄의 체류시간을 4~ lOOms 동안 급속열분해한 K i mber 와 Gra y 6 ) 의 연구가 행하여졌고 그 후 여러 연구자 8,17,21) 들에 의하여 급속 열분해에 대한 연구가 수행되 었다. 그 실험결과들을 그림 2.4 에 도시하였다. 그립에서 보듯이 급 속 열분해를 동하여 공업분석치의 휘발분보다 대략 50% 이상의 휘발 분이 생 성 된다. 그러 나 Ments e r 등의 19-20) 실험 결과는 온도가 700~ 1000°c 에서 휘발분 생성이 급격히 감소함을 나타내고 있다. 여러 종류의 역청란과 준역청란의 열분해 실험결과를 Badz i och 와 Hawksle y 18) 가 보고하였 다.
 I. 4F 一판@xt' '/¢·./ et//#/? // /' / / / / / / / / / 났
I. 4F 一판@xt' '/¢·./ et//#/? // /' / / / / / / / / / 났
V=Q • VM(1-D) 〔 1_ex p(一 A e-B/Tt )J (2. 9) 여기서 Q, D,A 및 B 는 실험상수이며 준역청란에 대하여 처 및 고팽 윤석탄에 대하여 아래와 같은 값을 제시하였다• 여기서 C 는 무수분· 회분 (da f) 조건의 탄소함량이다. 그림 2.4 에서의 실선은 식 (2.9) 를 근거로 계산된 값이다. 선®는 약한 괭 윤석 탄 (BSSI::;;4. o) 이 며 선 ®는 강한 괭 윤 (BSSI>4. o) 성 질을 가전 석탄들이다. 또한 여러 실험결과의 접둘은 다른 연구자 '&17,19,
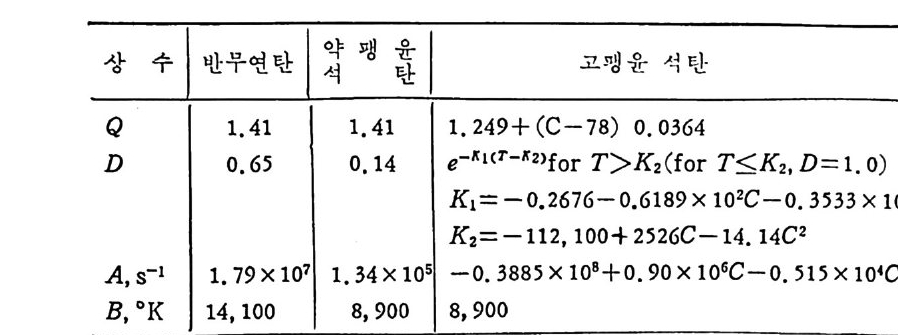 상 수 1 반무연탄 I :J 팽 갑 | 고 !'IJ 윤 석탄
상 수 1 반무연탄 I :J 팽 갑 | 고 !'IJ 윤 석탄
20,23) 들의 결과를 나타낸다. 복잡한 열분해반응을 고려할 때 계산치는 비교처 찰 일치한다고 할 수 있다. 그러나 실험치와 계산치의 차이는 계산치는 lOOms 시간 내에서 반응이 등온조건(i so t hermal cond iti on) 이 타고 가정한 것이나, 실제 반응조건은 이 주어전 시간 동안에 가열시 간과 등온조전 때의 시간의 합이다. 그러므로 식 (2.9) 는 조금높은 값 을 나타낸다. 또한 반응기의 종류, 석탄시료의 크기, 가연방법의 차 이에서 오는 식 (2.9) 와 실험치와의 차이도 예견할 수 있겠다. 그러므 로 석 (2.9) 의 예측치를보다정확하게 하기 위하여는, 비등온조건인 가 열하는 동안의 시간에 따른 온도변화를 보정하고, 그립 2.4 에서 보듯 이 석탄의 휘발분이 감소하는데 따라 분해 시작 온도가 증가하는 점도 고려하여야 하겠다• 그러나 온도가 700~900°C 에서 휘발분의 생성이 감소하는 19,20) 결과는 아직 도 분명 한 이 유룬 밝히 지 못하고 있 다. 비등온조전에서의 열분해시의 휘발분 생성양을 예측하는 식 8) 을 제 시하였다. 沿 = [1-~ :exp ( -LK。 dt) f(E ) dE] (2. 10) 여기서 K= K。 e<-B/RT), (2. 11) fV(•E =) =V.[ ~<1+( 2Vn인 :) l/ 2(J1- +le K-C1EP-E/,k)1,)/ 2,, ((22.. 1132)) 이다. 죽 열분해반응을 1 차반응으로 가정하여 dV/d t='K (V•-V) 로 표시하고 여기서 v· 논 t ..... 00 때의 값이다 . 식 중의 K 를 Arrheniu s
식 형대로 온도의 함수로서 상관식을 만든 것이 식 (2.II) 이며 식 (2. 12) 는 Vn.r 비반응성 휘발 분 과 v: 반응성 휘발분으로 나누어서 비만 응성 휘 발분은 석 탄으로부터 t -.oo 일 때 다 빠져 나오나, 반응성 휘 밭 분은 일부분은 입 자 속에 중합(p ol y mer i za ti on) 또는 분해 (crackin g ) 되어서 남고 그 나머지 휘발분만 나오게 된다. 그러므로 급속 열분해 논 반응시 간이 짧음으로 인하여 상기 한 2 차반응(중합, 분해)이 일어 날 기회가 적어지므로, 저속 열분해 대보다 많은 양의 휘발분을 생성한다. 식 (2.10) 은 반응압력을 고려한 유일한 식이나 7 가지 상기한 변수를 주어전 석탄에 대하여 결정하여야 한다 . 석 (2.12) 에서의 K,/p는 총괄 물질전달계수이며 압력 범위는 1 (J - 3~102a t m 범위와 vn:=o.37, v:· =0.17 및 K1/K=o.56 조건에서 얻어전 식이다. 식 (2.13) 은 활성화 에너지, Eo 가 Gauss i an 분포를 가진다고 가정한 활성화 에너지분포 함수이고 a 는 평군오차이다. 그 대표적인 경우의 실험 결 과는 아래와 같다 .
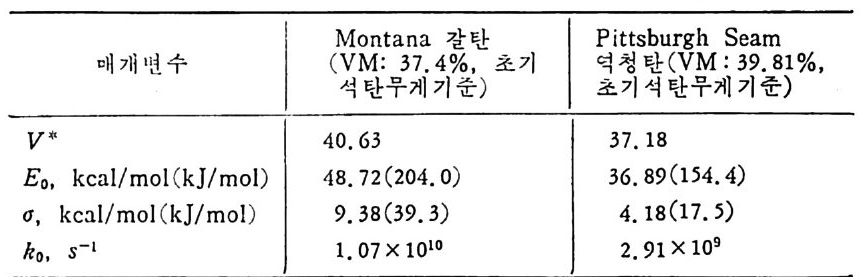 Monta n a 갈탄 Pit t sb urgh Seam
Monta n a 갈탄 Pit t sb urgh Seam
또한 조업 압력이 열분해에 미치는 영향을 그림 2.5 에 도시하였다. 가스와 타르의 생성물을 12 가지 역청란과 1 가지 갈탄에 대하여, 300 ~125ovc 및 체류시간을 3~180 초 사이에서 열분해실험한 결과 21) 를 근거로 아래식을 제시하였다. 텝 =K 。 e( E/RT)(W;_ W’) (2. 14) 여기서 W’ 은시간 t=t에서 w~ 는t -.oo 대의 특정 기체 또는 타르 의 생성무게이다. 식 (2.14) 에서 각 성분에 대한 반응상수 및 활성화 에너지 값은 다음 페이지의 표와 같다. 일반적인 고속 열분해시의 휘발분 생성과 온도와의 관계 l” 를 그립
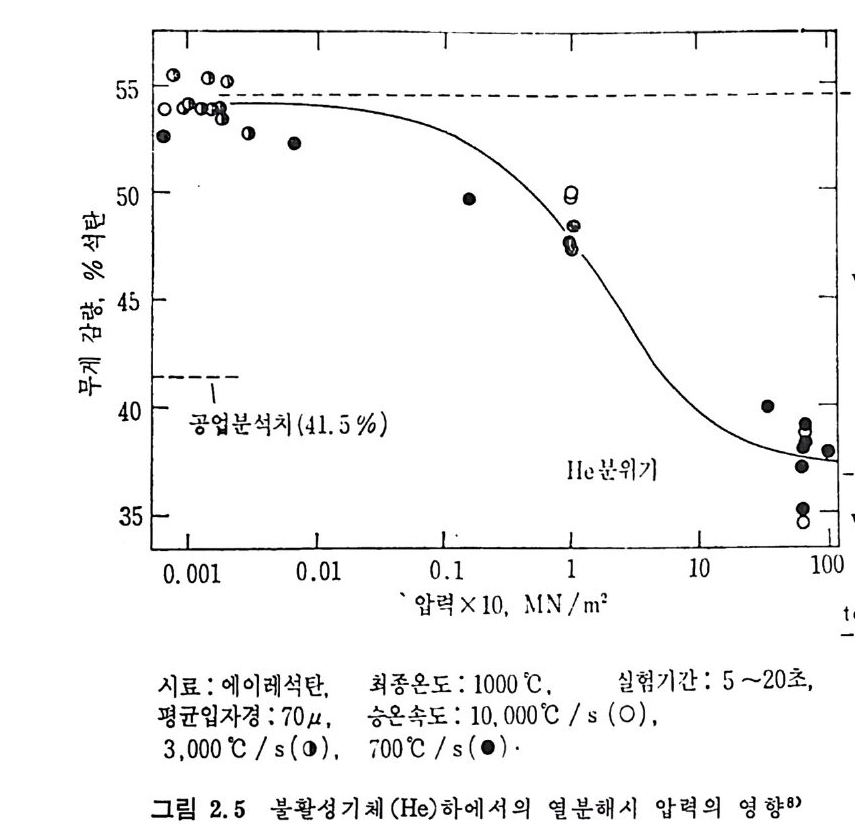 55 도------ ---- I --- -| ---- - ---「
55 도------ ---- I --- -| ---- - ---「
 생성물 Ko,s-• E, kcal/mol
생성물 Ko,s-• E, kcal/mol
2.6 에 도시하였다. 그립에서의 일반적인 경향은저속열분해시의 생성 물(그립 2.2) 과 비슷한 경향올 보인다. 죽타르와액체 생성물의 합은
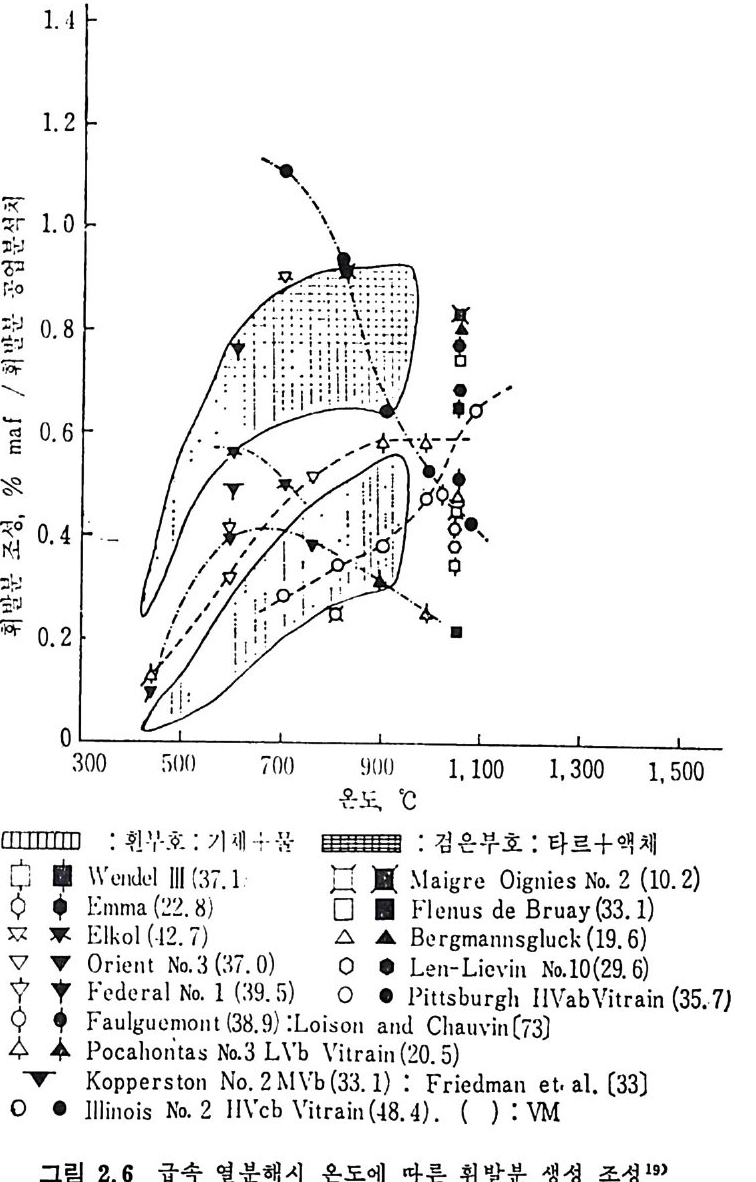 1.4
1.4
 50
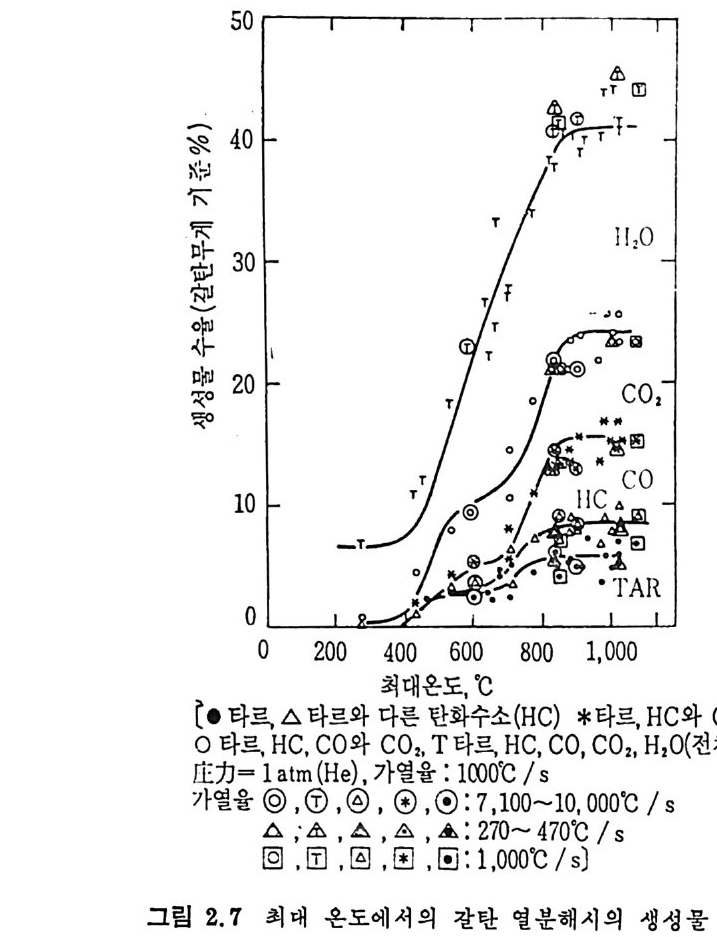
50
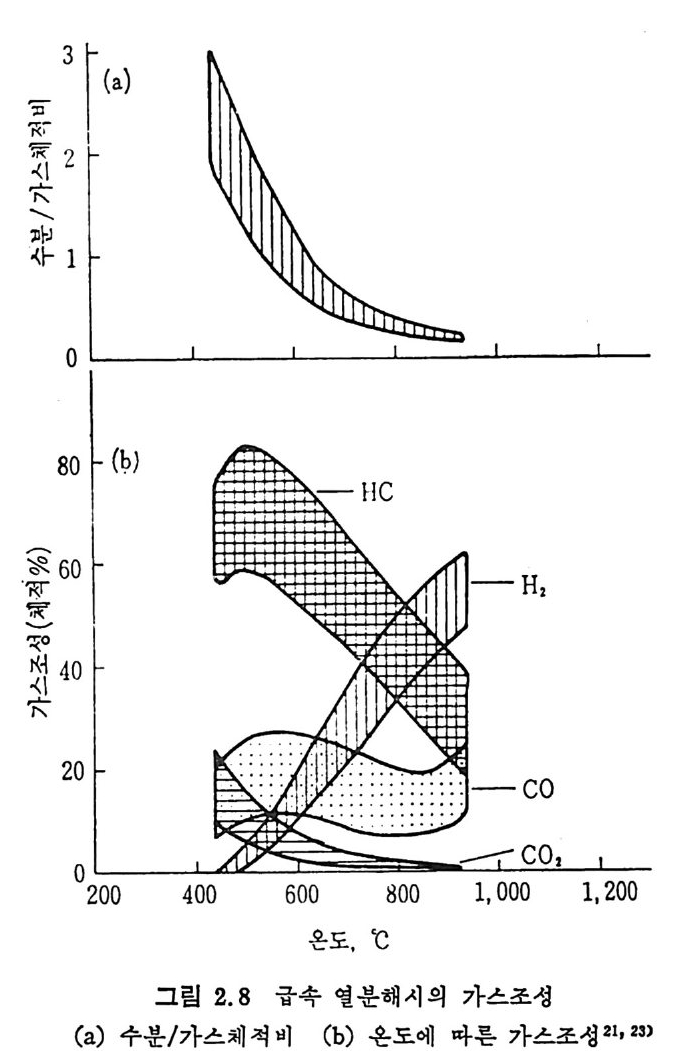
700°C 부근에서 어떤 한계치를 보이며, 기체와 수분 생성은 온도가 증 가함에 따라 증가한다. 갈탄의 열분해시 생성물의 수울을 온도의 함수로서 표시한 결과 24) 세 단계의 온도 영역이 있음을 볼 수 있다(그립 2,7 ). 첫번째 단계는 400~600°C 에서, 두번째 단계는 700~850°C 영역에 서, 세번째 단계는 1000°c 이상에서 일어난다고 하겠다. 열분해시의 수분과 가스의 比 및 가스의 온도에 따른 생성 체적%를 다섯 종류의 역 청 란을 사용한 결과 24) 를 그림 2. 8 에 도시하였 다. 그림 에서 보듯이 온도의 증가에 따라 탄화수소가 감소하면서 이에 따른 수 소의 생성량은 급격히 증가한다. 그러나 온도변화에 따른 co 양의 변
 3
3
화는 거의 없고 CO2 의 양온 감소함을 알 수 있다• 2. 2. 3 순간 열 분해 (Flash pyro lys i s ) 순간 열분해는 Xenon 플레시관을 이용하여 석탄입자 크기가 IOµm 이하인 것을 1 ms 펄스광으로 가연시켜서 열분해한다 .24-25) 이 경우 도 고속연분해시와 마찬가지로 공업분석치의 휘발분보다 더 많은 휘
 1.4
1.4
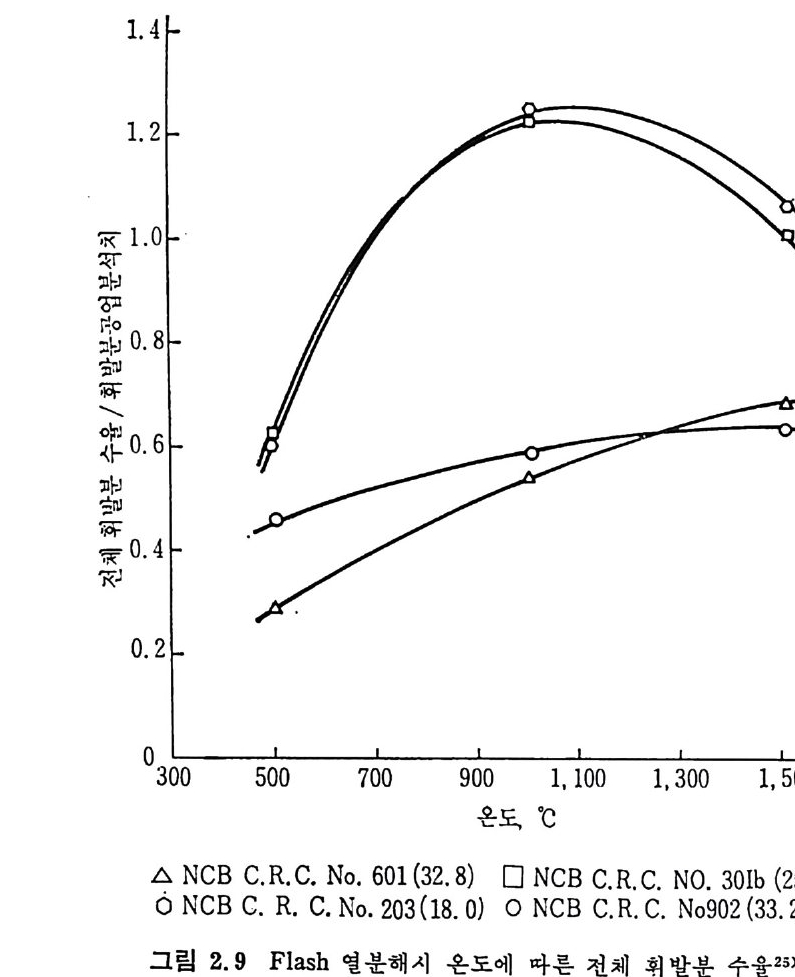
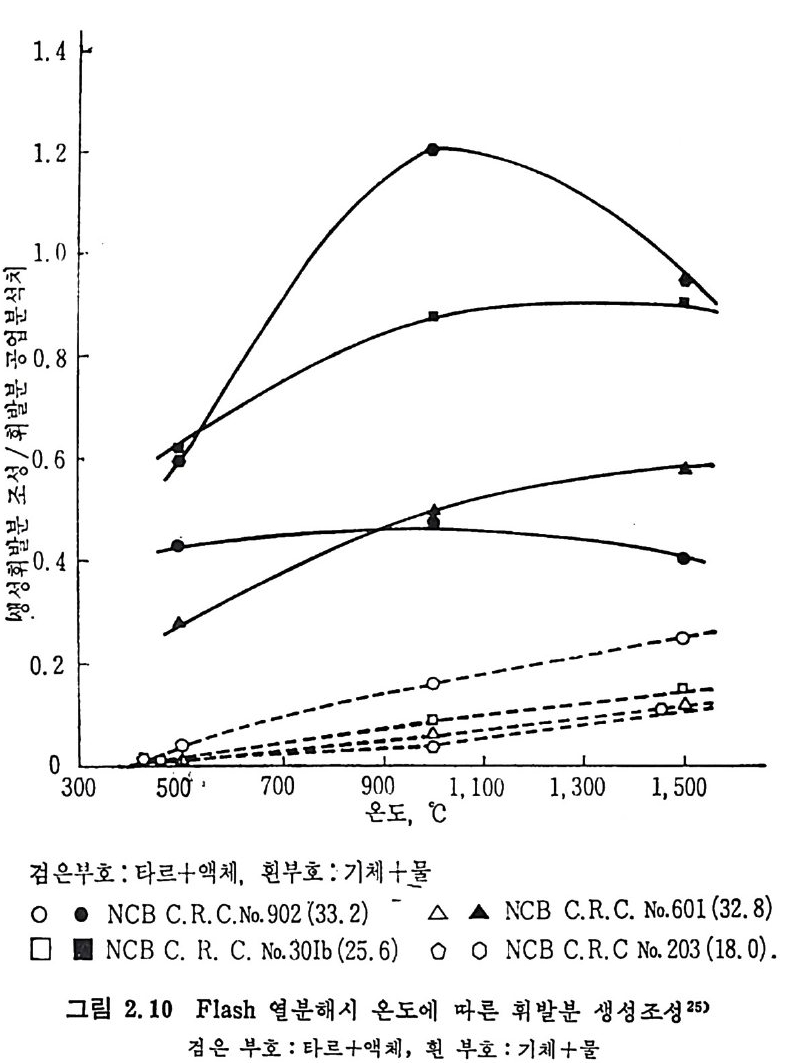
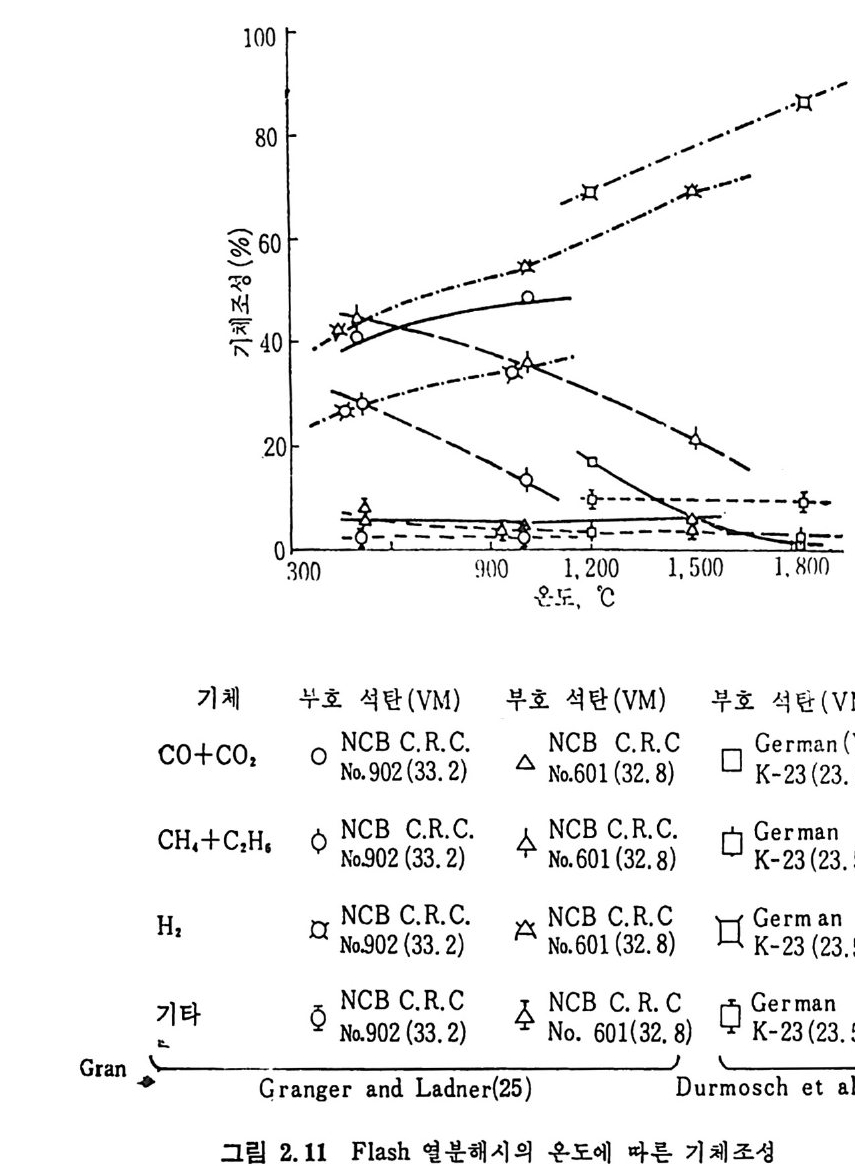
발분을 생성하며, 생성기체 중의 조성 24) 은 45~67% H2 와 10~25% 의 CO2, CH4 및 C2H6 및 20~30% 의 찬류물이 생 성 되 며 , 이 잔류물 중 의 70% 는 C2H2 이며 나머지는 불포화 탄화수소로서 구성되어쳐 있다. Grang e r 와 Ladner25) 실험결과의 두사 에너지를 온도로 치환 26) 하여 생성물의 수율을 그림 2.9, 2.10 및 2.11 에 도시하였다. 그림 2.10 에는 Durmosch 등 27) 의 실험결과도 포함하였다. 이 결과 는 m i crowave 를 이용하여서 가열한 것이며, 1750~1900°c 의 온도에 서 석탄의 체류시간은 20~40 초에서 번화시켜 85~89% 의 수소, 2~5
 1. 4
1. 4
%의 COx, CH4 및 C2H6 와 7~12% 의 찬류물을 얻었다• 순간(fl ash) 열분해에 관한 연구결과는 충분하지 못하여 일반적인 결론을 내 릴 수 없으나, 이 방법 으로써 acety le ne 과 불포화 탄화수 소의 생성수율을 증가시킬 수 있다. 일반적으로고속열분해시 생성물을 급속냉각하여야 하고석탄의 온
 100
100
도 분포를 균일하게 하기 위하여 작은 입자 (<200µm) 를 사용하여야 한다. 또한 짧은시간 (50~500ms) 내에 급속가열을하여야하기 때문 에 반웅기 의 용적 이 작아야 하고 복잡한 장치 가 요구된다.
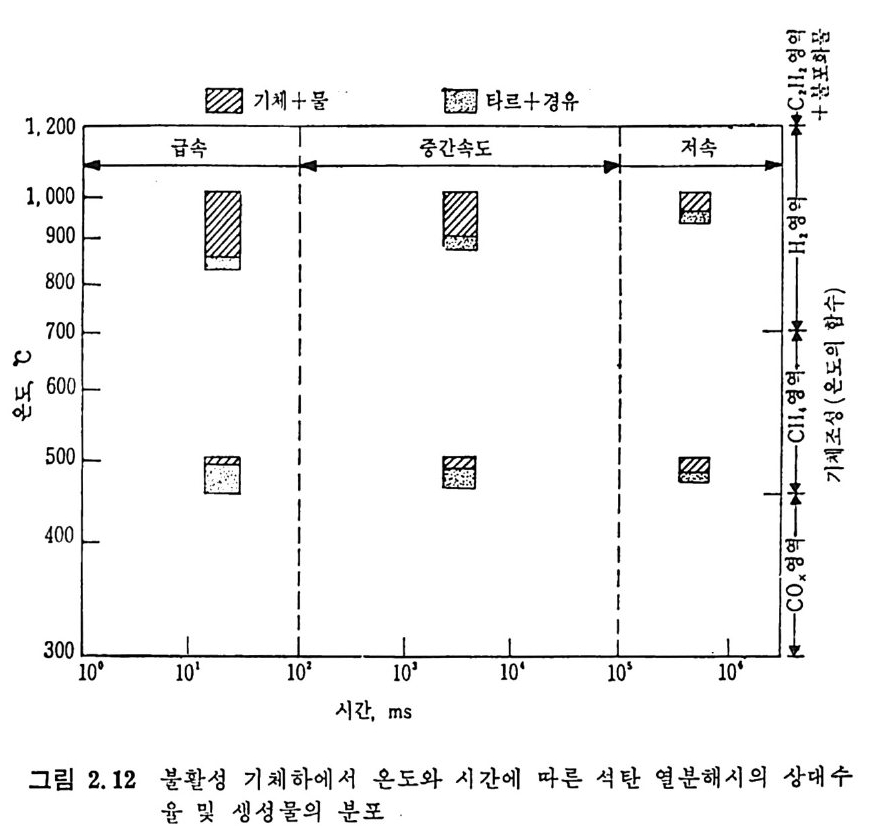 B으i '젊축
B으i '젊축
불활성(i ner t) 환경에서의 석탄 연분해에 의한 생성물 분포 및 수울 울 시간 및 온도의 함수로서 그립 2.12 에 도시하였다. 그립에서 보듯이, 가열시간을 단축시키고 온도를 500°C 에 도달시키 면 전체 수율 및 타르/가스의 비율도 중가함을 볼 수 있다. 그러나 1000°c 에서 가연시간을 감소시키면 전체 수울은 증가하나, 타르/가스 의 생성 비율은 감소한다. 낮은 온도에서는 액체 생성이 좋고, 고온에 서는 기체생성이 열역학적으로 찰 이루어질 수 있다고 하겠다. 그러나 고속열분해시의 휘발분 및 액체 생성물 동의 수율이 저속열 분해 때보다 높다는 것을 설명하지는 못한다. 정성적으로 저속 및 고속 열분해의 생성물의 수율 차이를 설명하면, 저속 열분해시에는 생성된 타르가 2 차반웅울하여서 코크스 (coke) 와 기체를 생성한다. 그러므로 500°C 에서의 저속 열분해가 고속일 때보다 더 많은 기체를 생성하며
그 반면 고속에서의 타르(t ar) 의 생성률은 더 높다. 즉 타르가 재중 합되어서 코크스 (coke) 를 생성할 반응시간이 충분치 못하며, 결과적으 로 액체 생성물량은 증가한다. 또한 고속 열분해로부터의 타르의 미중 은 처속의 경우보다 높다. 타르의 조성은 석탄의 H/C 비율에 바례한 다. 그러나 주어전 석탄의 H/C 비는 일정하므로 타르의 생성수율이 크면 H/C 비는 낮고 비중은 높다. 고온 (>1000°C) 에서는 좌 (char) 의 부가반응이 수반되어 가스생성은 더 증가한다. 그러 나 저속 열분해에 서는 코킹 (cokin g ) 반응의 산물은 주로 좌 (char) 의 모체에 되적되어서 가스 생성을 저하시킨다. 그 반 떤 고속 열분해에서는 2 차반응이 중요하게 일어나지 않으므로 상대 적으로 많은 양의 기체를 생성한다. 2. 3 석 탄의 가스화 (Coal Gas ifi ca ti on) 반응 고체나 액체를 기체로 변환하는 공정을 가스화라고 하는데 이것은 열에 의한 증발이 아닌 화학적 변화에 의한 기체로의 변환을의미한다•
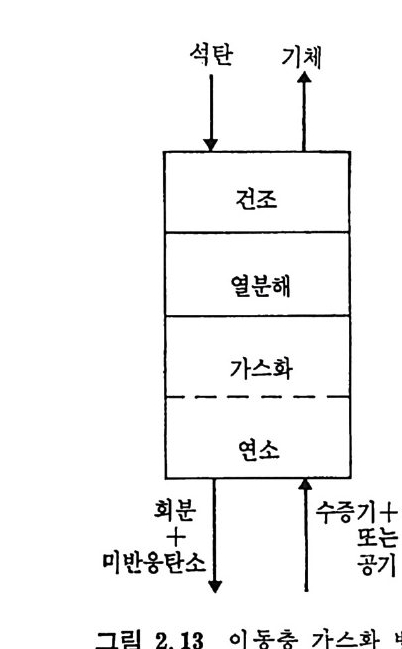 석탄 기체
석탄 기체
석 탄을 이 동충 (mov i ng bed) 에서 기화하는 단계는 그립 2.13 에서 보듯이 처 음 단계는 석탄의 건조가 위로 상승하는 고온의 증 기 및 산소나 공기에 의하 여 이루어지며 이 전조된 석탄은 밑으로 이동하면서 더 가열되어져서 연분해된 후, 아래로 이동하면서 가 스화반응이 일어나며 마지 막으로 최하단에서 석탄의 연소반응이 일어나서 상기 반응에 필요한 열량을 공 급하게 된다. 이 기화반응로에서의 반
응을 고려하기 위하여 석탄의 탄소분을 순수단소로 가정한다. 반응기 에 주입한 석탄은 열분해를 거쳐서 좌 (char) 로서 기화반응을 하게 되 므로 순수단소로 반응한다고 가정하여 반응을 다룬다. 석탄이 반응기 하부로 이동하면서 일어나는 물리 • 화학적 변화는 아 래와같다. a) 건조 (dryi ng ) 수분을 함유한 석 탄이 주입 되 어 서 온도가 상승함에 따라 수분이 건 조된다 . 수분함유석 란 --+ 건조석 탄 + 수분 b) 열 분해 (Py ro lys is or Devolati lo zati on ) 건조된 석탄은 온도가 상승함에 따라 열분해가 이루어진다. 죽, 건조석 탄 _一 좌 (char) + 휘 발분 여 기 서 생 성 되 는 가스는 H20, H2, N2, 02, CO2, CO, CH4, H2S, NH3 및 타르 둥이다. c) 가스화 (Gasif ica ti on ) 가스화반응은 일반적으로 815°C 이상에서 활발히 진행된다• 그 대 표적 인 반웅들은 탄소 구 수증기 반응인, C+l- 12 0 .:= CO+H2 L1H=l35. 7 MJ /k g -m ole Boudouard 반응인, C+C02 .:= 2CO LlH=167.9MJ /k g -m ole 변환반응인, CO+H20 .:= C02+H2 LlH=-32.18 MJ /k g -m ole 및 고온, 고압에서 일어나는 탄소 수소화반응인, C+2H2 .:= CH4 LlH= -91. 6 MJ /k g -m ole 가 주로 일어난다. 또한 부가반웅으로 C0+ 3H2 .:= CH 다 -H20 의 반응도 일어날 수 있다.
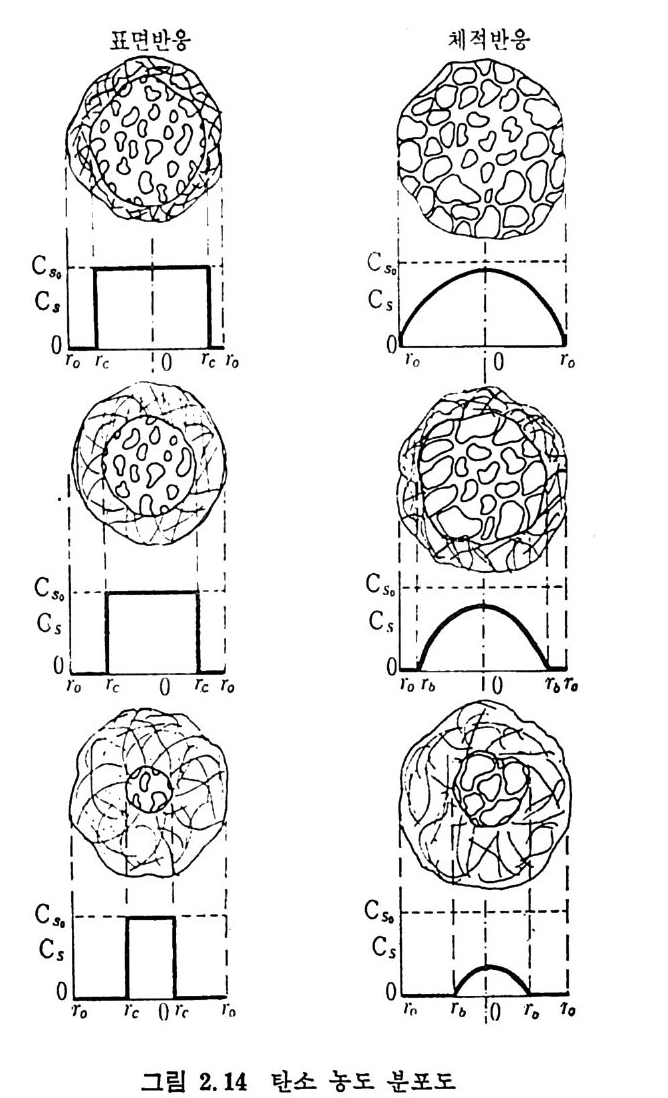
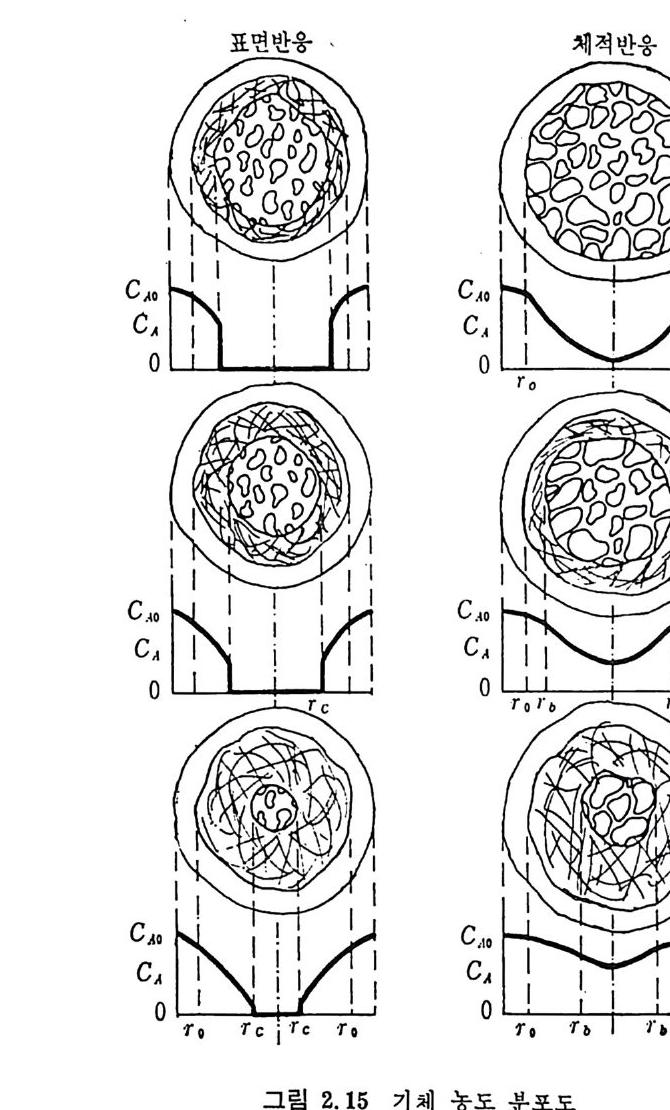
d) 연소 (combus ti on) 반응기 하단에서 좌 (char) 는 공기나 산소와 반응하여 연소한다. 여 기서 발생하는 열량은 상단의 가스화반응에 제공되어진다. 연소된 좌 (char) 는 회분을 남기고, 이 회분은 녹아서 액체 스래그 (sla g)가 되거 나 다시 고체 화되 어 서 크링 커 (cl i nker) 로 남아 반응로 하단에 서 제 거 된다. C(char) +02 -+ CO2, LlH= -395. 4 MJ /k g -m ole 회분 ―一 스래 그 (sla g) 스래그 一 크링 커 (cli nk er) 상기한 반응열 (L1H) 은 반응이 1000°c 에서 일어난다고 가정하여 계 산한 값이다. 2. 3.1 최 (char)- 가스반응 좌-가스반응은 열분해 후에 일어난다. 이 반응을 두 가지로 대별하 면 용적 반응 (volumetr i c reacti on s) 과 표면 반응 (surfa c e reacti on s) 으로 나누어지며 용적반응은 반응기체가 석탄입자 내로 확산되어서 반응영 역이 전입자 내로 확산되어 일어나므로, 반응이 진행되면서 회분의 충 이 외부 표면에서부터 증가되어 내부로 들어와서 반응영역이 수축된 다. 그 반면 표면반응은 반응가스가 석탄 내부로 확산되지 못하여서 반응은 이 반응입자의 수축중십의 표면에서만 일어나므로 반응징계면 은 회분충과 이 반응충의 중간에 위치하게 된다. 일반적으로 표면반 응은 화학반응이 매우 빠른 경우에 일어나며 확산이 울속단계이며 그 예로서 연소반응을 들 수 있다. 그 반면 용적반응은 다공성입자의 저속반응인경우로특칭지울 수 있다. 그 대표적인 경우의 탄소와 반 웅가스의 농도 분포를 그림 2.14 및 2.15 에 보여주고 있다. 용적반응의 반응률에 관하여 여러 연구가 행하여져 왔으나, 이론적 인 반응물 계산은 여러 가지 반응이 복합적으로 일어나며 또한 반응 온도의 함수이므로 만족할 만한 이론식이 제시되지 못하고 있다. 실 질적인 면에서 보면 실험적인 반응률을 예측할 수 있는 석은 반응시 간과 전환율의 관계에서부터 결정할 수 있다. 그러나 실험범위를 벗 어난 조전까지의 의삽은 신빙성이 결여되기 쉽다. 일반적으로 좌 (char) -가스반응을 아래와 같이 표시하고
 표면반응 체적반응
표면반응 체적반응
C(s) +xA(g) —-+ B(g) (2.15) 용적반응률을 표시하면 -7dC!,- =K v•av(x, T) ,CA,C,m (2.16)
 표면반옹 ` 체적반응
표면반옹 ` 체적반응
또는 뚱 =Kv•av(x, T) ,c;.c:-1(1-xf (2. 17) 여 기 서 x 는 초}-가스반응의 탄소의 전환울이고 Kv 는 용적반응률이 며
av(x, T) 는 좌의 상대 기공표면적을 전환율과 온도의 함수로 표시한 것이다. 그러나 일반적으로 av(x, T)=av(x) 의 함수로 표현할 수 있으며 그 가정은 기공표면적이 전환율에 따라 변화하며 온도의 영향이 적다고 할 수 있는 경우이다. 표면반응률은 반응계면에서의 표면적에 비례한다. 그러므로 아래의 식 (2.18) 으로 표현할 수 있다. 7dTx =K,•Sg ·CAn •C,m0 (2. 18) 여기서 K, 는 표면반응물, s g cx 는 기하표면적 (s,x/Wo), 즉 초기 석탄 무게당 수축계면의 표면적이다. 여기서 탄소의 농도는 좌의 초기 농도 이며 일정하다. 이것은 체적반응의 경우(식 2.17) 탄소농도가 전환 에 따라 감소하는 것과는 상반되는 것이다(그림 2.13). 좌 (char) -산소반응 경우에는 위의 식 (2.18) 을 산소분압 (Po2) 으로 표시할 수 있으므로 식 (2.19) 로 표현할 수 있다. 万dx =K,'•S g cx·Po2 (2. 19) 또한 시 간-전환 관계 는 수축중십 (shrin k in g core) 모델에 따른다면 아 래와 같이 정의된다. t=K」;紅Po_2 〔 1-(1-x) l/ 3 〕 (2. 20) 체적반응물은 입자의 기공표면적에 비례하므로 온도와 전환율에 따 론 기공표면적에 대한 정보가 요구되어진다. 2. 3. 2 가스화반응중의 석 탄/최의 기공특성파 이의 반응률에 미치는 영향 석탄은 2~30% 의 기공을 함유한 다공성 입자이며 석탄의 등급 및 근원에 따라 달라지는데 ~6) 고동급 (h ig h rankin g) 석탄으로 갈수록 일 반적으로 기공률은 감소하는 경향을 보이나 어떤 최소값을 보이고 다 시 증가하는 경향을 보인다(그림 2.16). 석탄의 Cd” 가 85~90% 일 때 기공률이 최소치를 보이는 것이 일반적인 특성이다. 일반적인 기
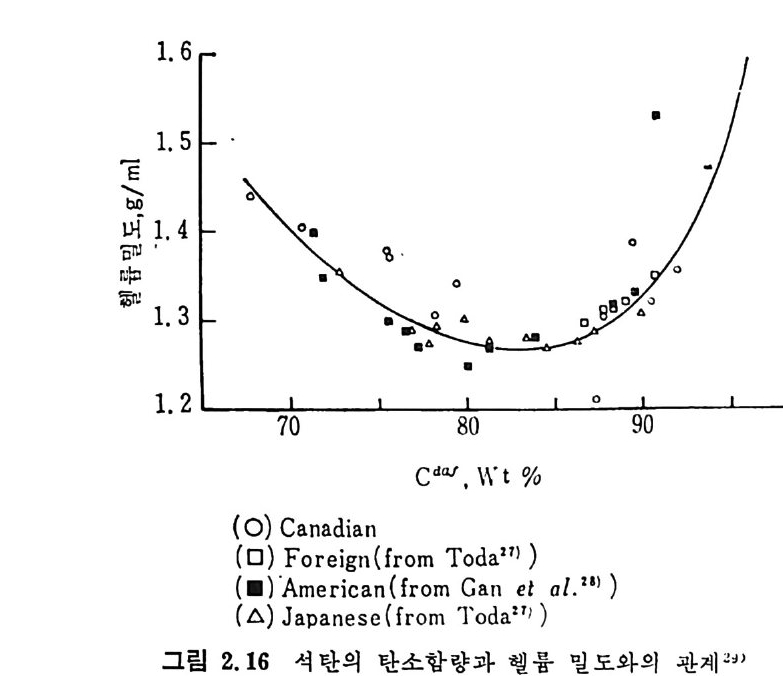 1. 6 I
1. 6 I
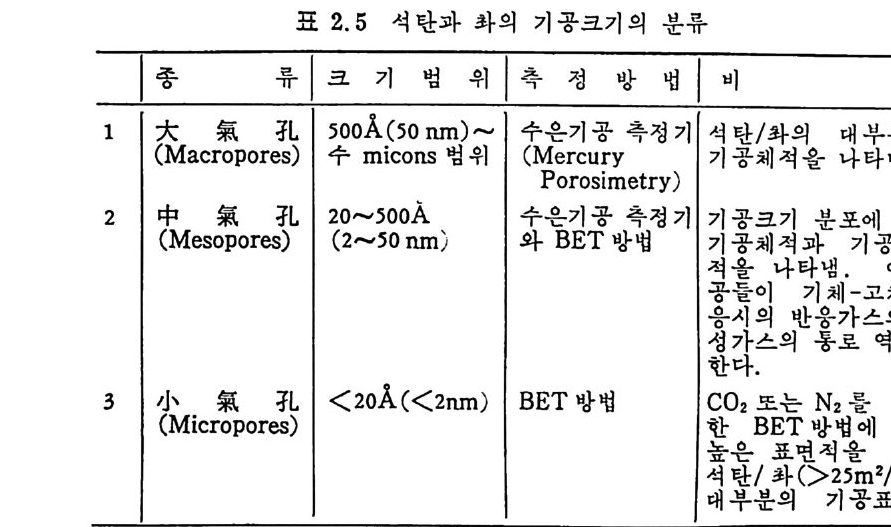 표 2.5 석탄과 카의 기공크기의 분류
표 2.5 석탄과 카의 기공크기의 분류
공크기의 분류는 3 가지로 나누어서 표시한다(표 2.5). 기공의 크기, 오양 및 내부구조가 매우 다양하여 BET 방법으로 질소를 흡착시켜서 얻은 값들도 석탄의 등급 (rank) 에 따라 o.4~88.4
m2/ g까지 다양하며 또한 C 아를 흡수 매체로 사용하여 표면적을 측 정 한 값은 96~426 m2/g 으로 축정 되 었 다. 28) 석탄이나 좌 (char) 의 열분해 동안의 구조변화는 석탄의 종류·분만 아니라 입자의 크기, 온도, 가열률 및 열분해시의 가스의 환경과 열 분해공정의 종류에 의촌한다. 그러므로 열분해를 거쳐서 석탄으로부 터 얻어진 카는 초기 석탄보다 2~40 배의 표면적을 가진다 .29) 연분해로부터 얻어전 좌 (char) 는 가스와 반응하여 기화반응이 시작 된다 . 이 반응중 좌입자의 크기 및 기공구조가 초기의 좌의 내부기 공구조, 반응하는 기체의 종류, 반응온도, 전환율 및 입자크기에 영 향을 받는다 . 좌의 기공표면적은 일반적으로 석탄등급이 증가함에 따라 감소하 나 저등급 석탄으로부터의 좌의 기공표면적은 매우 크다 29)(>50m2/ g). 그러나 표 2.6 에서 보듯이 높은 표면적을 가진 석탄의 대부분은 小기 공으로 형성되어져 있다. 그러므로 이러한 석탄/초}가 화학반웅울 하 는 경우의 미세한 소기공에 기체가 침두 못하는 반응에서 측정된 기공표면적 전체가 반응표면적아 되지는 못한다. 이 경우의 반응률은 주어전 온도와 압력에서의 반응기체와 접촉되는 기공표면적만에 비례 할 것이다. 그러나 반응에 활 용되는 표면적은 반웅 동안에 변화가 십 하게 일어난다고 보고되어져 있다 .13,30,32) 또한 기공표면적의 변화는 탄소의 전환과 반응온도에 영향을 받는다 .13) 그러나 온도의 영향은 탄소 전환율의 영향보다는 적다. 체적반응에서 화학반응률이 융속단계이면 반응 동안 입자의 기공 목성의 변화에 따라 4 가지의 형태를 나타낸다(그립 2.11(A)). 첫째 전환율 (x) 에 따라 유효한 기공표면적이 거의 변화하지 않는 경우 (1), 둘째 전환율의 증가에 따라 기공표면적이 증가하여 최고접을 보이 고 감소하는 경우 (2), 세번째 전환율 (x) 의 증가에 따라 표면적이 계 속 증가하는 경우 (3) 와 네번째로 초기 전환율의 증가에 따라 표면적이 증가한 후 초기 표면적보다 감소하는 경우 (4) 둥이다. 첫번째 경우가 식 (2. I7) 에 따라 전환율과 기공표면적이 비례하는 함수의 경우이며, 두번째부터 네번째 경우까지는 식 (2.17) 의 av(x) 가 전환율에 따라 변화하므로 비 선형 적 관계 를 가지는 경 우이 다(그립 2. 17 (B)).
 1.2 35 2139, 52 5.2.6 49 6.8 5.590. 1 36.5 7
1.2 35 2139, 52 5.2.6 49 6.8 5.590. 1 36.5 7
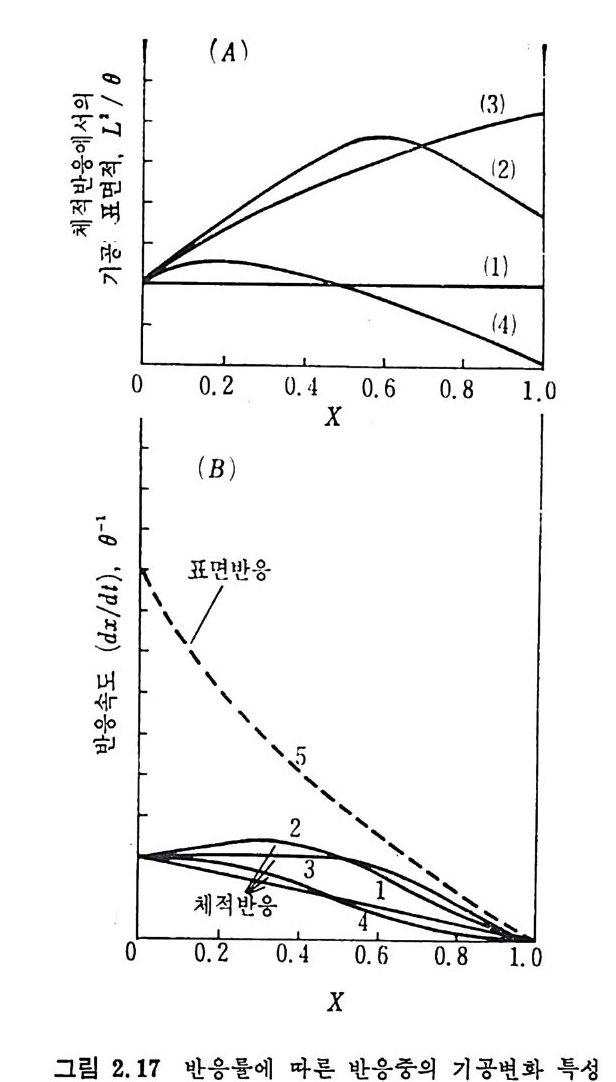 (A)
(A)
표면반응률이 울속단계 인 표면반응은, 비표면적항인 Sll’z( 식 2.18) 와 전환율 X 와의 상관관계를 아래와 갇이 표시할수 있다 . 죽 sge x= (4/431)r 1 rr r;5 p , _=- r35rp; , (2.21) 여기서 rc=ro(1_x)l/3 로 표시하면
dx ,_, 3 규 (I 군 )2/3 7=k;.7 詞 ·PA=3k;.~-PA (2. 22) 즉 표면반응물과 전환율과의 관계가 검f- oc(I ― x)2/3 이면 그립 2.17 (B) 의 표면 반응곡선으로 표시될 수 있다. 석 탄의 높은 가스화율은 높은 활성 화탄소의 거 접 (acti ve carbon sit es ), 이 탄소와 반응가스의 접 촉률 및 무기 질 불순물의 촉매 역 할이 좌우하게 된다 .33) 석탄은 방향족과 수소화 방향족 (h y droaroma t i c) 으로 구성되어지고, 구조블럭 (blocks) 과 기능그룹이 주위에 있어서 가교되어전 형대로 되 어 있다. 이 구조를 가열하면 기능군은 휘발분으로 제거되며, 어느 정 도의 가교는 끊어 지고 수소화 방향족은 방향족으로 전환되 었다가 조그 만 탄소결정으로 변환된다. 석탄 내의 많은 무기질 불순물이 효과적인 촉매역할울 한다고 알려 져 있 다. 33-34) 이 불순물들은 분자들을 원소나 자유라디 칼로 바꾸어 서 기화율울 증가시킨다. 죽 탄소구조에 산소나 수소원자가존재하면, 산소나 수소분자가 존재할 때보다 빠른 기화반응이 일어난다. 석탄의 회분 중에 무기물질 중 Cao 와 M g O 가 다른 무기산화물보 다 촉매역할이 크다는 것이 알려져 있다 .33 - 34) 즉 석탄/초l-의 표면에 서와 기체상에서 반응이 일어날 때 촉매역할이 크다. 가스상의 반응 은 회분입자의 영향을 받는 반면 석탄/좌의 표면이나 내부에서 일어 나는 반응은 무기물질이 입자 내에 분산된 정도에 영향을 받게 된다. 일반적으로 석탄/좌와기체반응에 촉매를 첨가하여서 반응률을 높일때 의 효율적인 촉매는 알카리 금속, 알카리 토금속 및 전이금속 동으로 알려져 있다. 죽 각 반응에 따라 좌 -02 반응은 Fe, Co, Ni 둥이, 카 H20 반웅은 K, Na, Ni 둥이 , 좌 -C 아 반응은 K, Na, Li, Ni, Ca, Co, Fe 둥이 , 좌 -H2 llJ:응은 K, Ni 등이 좋은 촉매로 알려 쳐 있 다. 각 반응에서의 촉매의 역할은 촉매의 화학적 형태, 물리적 형태, 촉 매의 양 및 반응온도등과함수관계이다. 상기 촉매 중 Fe,Co 및 Ni은 원소형태일 때 가장효과가크며, K,Na 은 탄산영 형태가효과적인 반 면 인산염 경우는 효과가 떨어진다. 철산화물과 다른 전이금속들은 C-C02 와 C-H20 반응에 서 산소가 져온 산화물들이 더 좋은 촉매역할을 하여, FeO 나 Fe304 가 Fe203
보다 좋은 촉매역할을 한다. 또한 유기염이 무기영 금속보다 더 좋은 촉매역할울 한다. 그 이유는 유기영 금속이 보다 작은 군을 이루어서 입자 속에 분산되기 때문이다. 촉매의 활성도는 분산된 촉매의 크기 가 클수록 감소한다. 일반적으로 촉매의 양이 증가함에 따라 반응물은 중가하나 어떤 포 화점에 도달하면 그 이상의 양은 활성도에 영향이 별로 없다. 석탄의 회분 중의 금속산화물들은 촉매여할을 하여 C- 아반응에서 CO-,C02 반응을 증가시 키 므로 CO/CO2 의 비 는 감소한다. 2. 3. 3 석 탄/초卜수소 반응 보통 수소기화반응 (h y dro g as ifi ca ti on) 이라 하며 수소탄화반응 (hy d rocarboniz a ti on ) 이 라고도 부른다. 이 석 탄의 수소화반응은 합성 천연가스 (SNG) 와 액체 탄화수소 등을 생성하기 위하여 사용된다. 합 성 천연가스는 90% 이상이 CH4 울 함유하게 된다. 죽 수소화 기화반 응은 반응식에서 보듯이 C+2H2 ~ CH4 .dH 2g s =-74. s KJ /m ol 비 교적 낮은 온도와 고압에 서 찰 이 루어 지며 공급조건(f eed condit ion ) 이 CH4 생성에 미치는 영향은 적다고 알려져 있다. 석탄을 수소와 반응시켜서 CH4 를 합성할 때 순수탄소만이 반응하 는 것이 아니므로 반응 메카니즘은 매우 복잡하다. 죽 석탄과 수소의 일차반응은 열분해와 수소화반응이 동시에 일어난다. 수소화반응률은 비교적 느려서 o.167~o.833% carbon/kg • atm 정도가 927°C 에서 일어난다 .35) a) 반응온도 및 수소분압의 영 향 저속 가열 (slow hea ti n g)시 의 대 표적 인 시 간과 전환율에 대 하여 여 러 종류의 석 탄을 유동충 반응기 35 서 1) 와 반흐름 반응기 (semi flow reacto r ) 42> 또는 열 천평 반응기 (the rmobalance) 47) 등에 서 의 수소화반 웅의 전환율을 그림 2. 18~2. 20 에 보여 주고 있 다. 반흐름 반응기 42) 에서의 결과(그림 2.18) 에서 보면 처음의 10 초 동 안의 반응물이 후의 반응보다 매우 빠르게 일어난다• 이는 초기 반응 의 높은 반응률은 빠른 열분해과정과 더불어 수소가스화반응이 일어
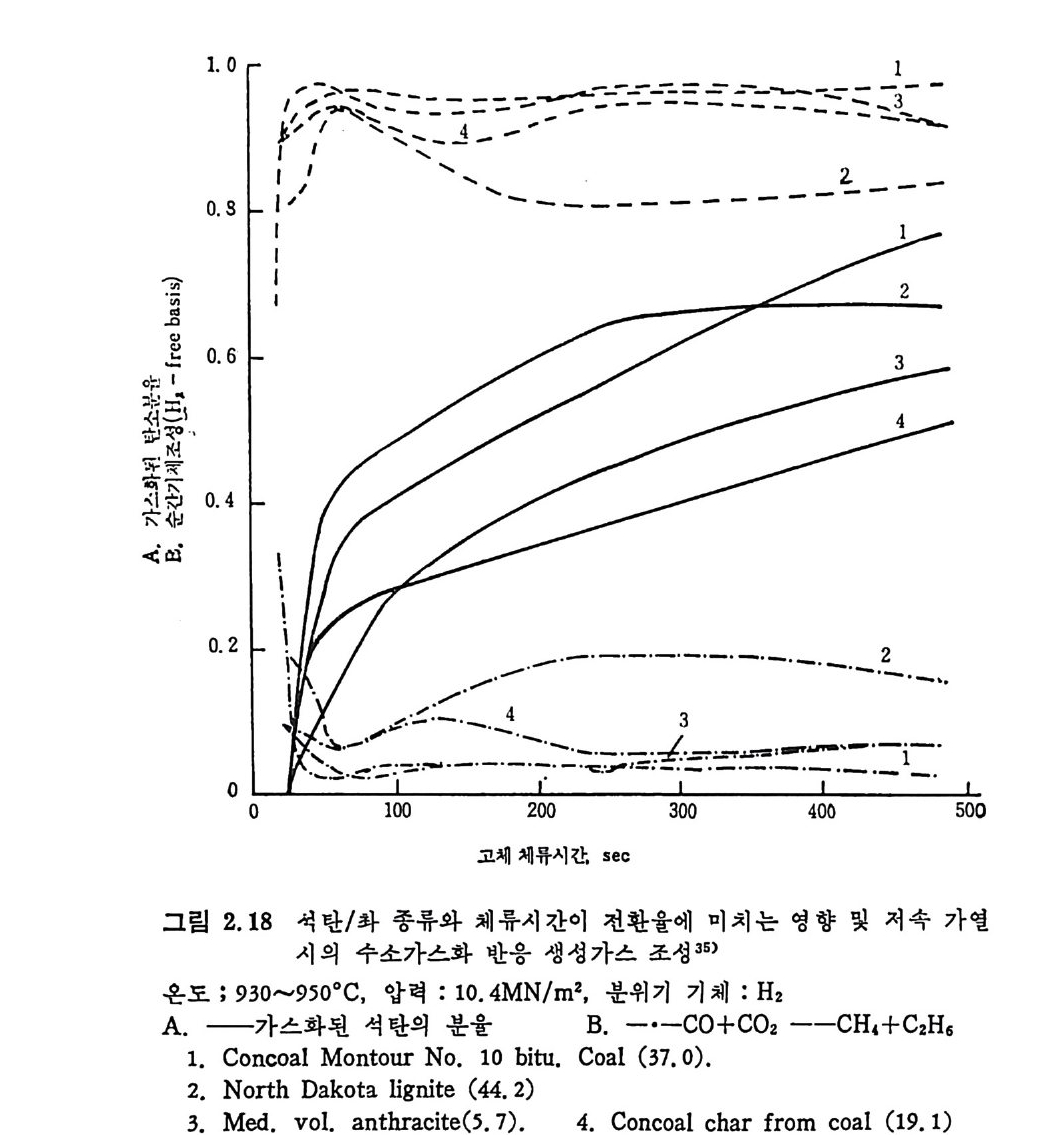 oI.. s0 IIl l ,/' :' :' .~:`-:`::.-----` -- `- .-.. -.- `--- -- --_ _- _-- _---- -_---소-=--= =--소--= _-.-.--,- _- -_:---2:- .-- -:-:l -,-급-―
oI.. s0 IIl l ,/' :' :' .~:`-:`::.-----` -- `- .-.. -.- `--- -- --_ _- _-- _---- -_---소-=--= =--소--= _-.-.--,- _- -_:---2:- .-- -:-:l -,-급-―
나기 때문이다. 그러나 (CH.+C2H6) 의 생성은 초기의 50 초까지 급격 히 증가 (~95% )하다가 그 후에는 시간에 따른 변화가 별로 없다. 그
 반면 (CO+C02) 의 생성은 일반적으로 초기 70 초까지 감소하다가 그
반면 (CO+C02) 의 생성은 일반적으로 초기 70 초까지 감소하다가 그
압력—[ K3 v. o5 실= M2험. N치2/7 m x2 1,― 0분3―s위-계1기(산M 치기N 체/m 2:) H-1 2 E공=(기flo7로=2 oK .J예a /o m 연mo된Jl . &9_>PJ i. t .t. s_b u r계gh산 치N o. 8 coal char (O. O).
 1. 0 2
1. 0 2
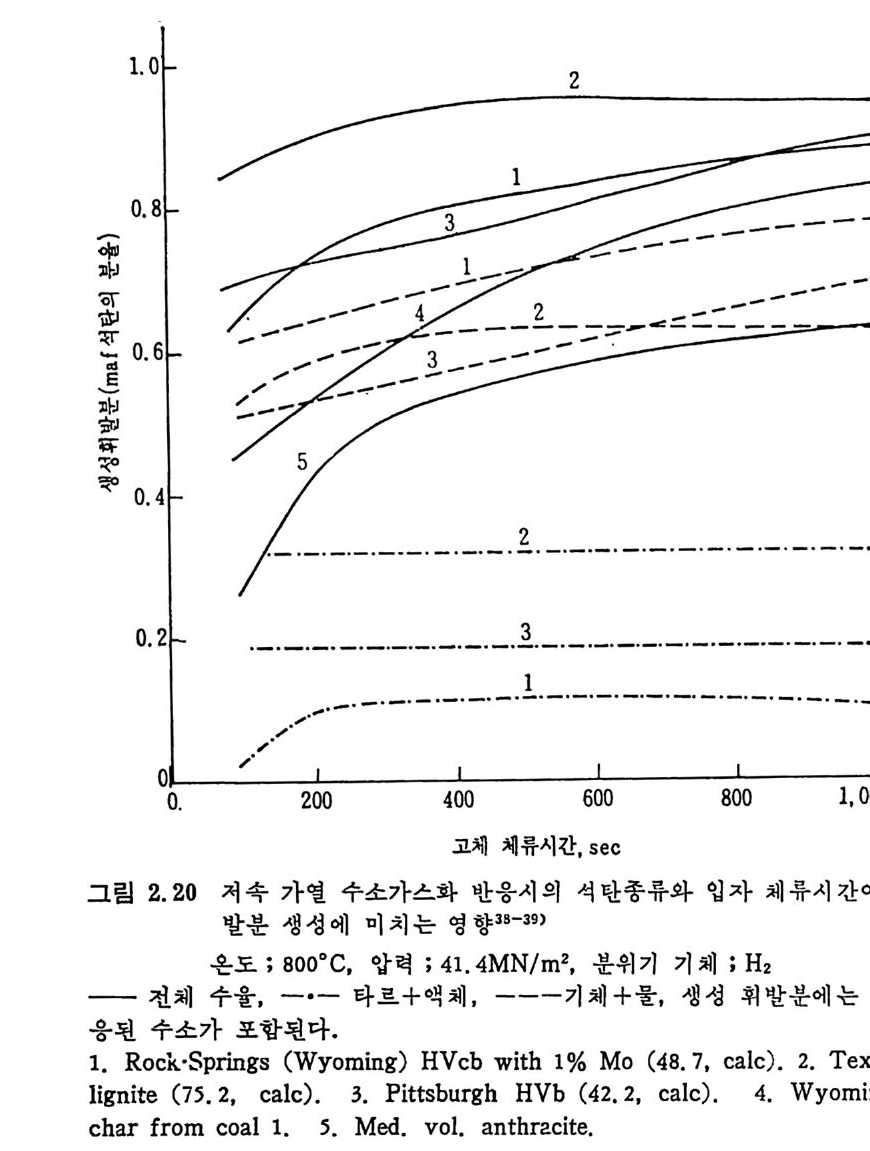
유동충 반응기 38-39) 에 서의 수소화 가스반응은 매우 짧은 체류시 간 때 의 결과를 얻을 수 없으나, 휘발분 성분의 생성량과 석탄의 체류시간 과의 관계를 그립 2.20 에서 보면 그립 2.18 의 경우와 비슷한 경한울 보인다. 죽 처음의 반응시간 100 초까지 매우 빠른 전환율을 나타내고 그 이후에는 느란 전환율을 보인다. 타르와 액체의 생성온 첫단계에
서 일어나며 가스휘발분은 뒷단계에서도 계속하여 생성된다. 같은 온도 및 압력에서 수소와 질소가스를 사용한 경우의 가스화율 을 그림 2.21 에 비교하였다. 첫단계 가스화는 처음 수초내에 일어나 며, 수소가스하에서는 50% 이상의 탄소가 가스화되는 반면 질소가스 하에서는 30% 정도만탄소가가스화되었다. 또한높은수소분압은고 체 좌 (char) 의 수소화반응을 증진시키며 초기 휘발분의 분해물을 비 반응시켜서 석탄입자로부터 유리되는 물질량의 변화를 적게 하므로 반옹률운 높여 준다. 2. 3. 4 급속 가열 수소화 가스반응 급속 가열은 바말동반 반응기 ~2-45) 와 직접 전기가열방법 ' (8) 으로 수행
 0, ~
0, ~
되었다. 이때의 반웅온도와 수소의 분압이 전환율에 미치는 영향을 그림 2. 22 및 2. 23 에 도시 하였 다. 그림 2. 22 에 서 보듯이 반응온도가 증가함에 따라 탄소의 전환율은 증가한다. 또한 불활성 기 체 (He) 하에 서의 전환울보다 H2 기체하에서의 전환율이 높고 (가스+수증기)의 생 성도 온도에 따라 증가한 반면 (타르+액체) 산물은온도상승에 따라 감소하다가 900°C 이상의 온도에서는(수소분압 100atm ) 생성되지 않았다.
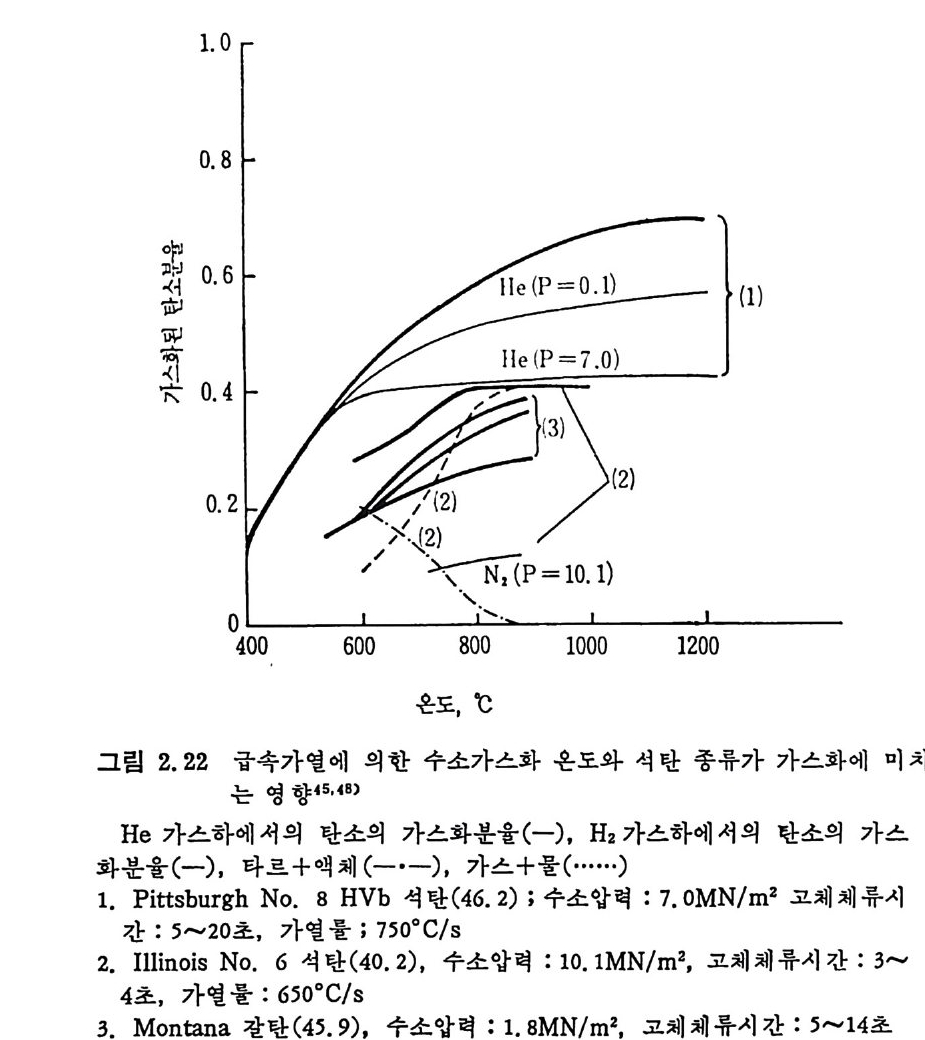 1. 0
1. 0
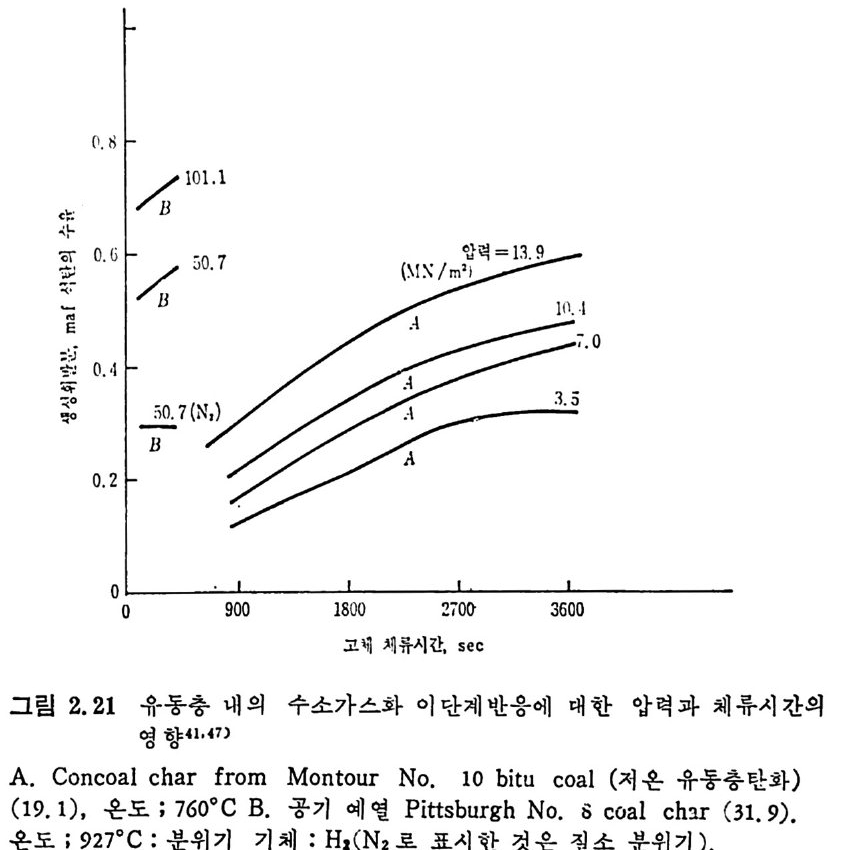
반응압력이 탄소전환율과 생성가스량에 미치는 영향을 그립 2.23 에 서 볼 수 있다. 그림에서 보떤 일반적으로 압력이 증가하고 온도가 증가하면 탄소 의 전환율은 중가한다. 그러나 1000°c 경우에는 초기의 압력 상승에 따라 전환율이 최저값을 보이고 증가한다. 그 이유는 수소분압의 증 가는수소 화 가스반응률을증가시키나 열분해를 저해시키기 때문이다. 또한 수소분압이 증가함에 따라 (CO+C02) 는 감소하는 반면 (CH4+ C 晶)의 생성량은 증가한다 . 석탄입자와 가스의 체류시간이 탄소의 전환율에 미치는 영향을그
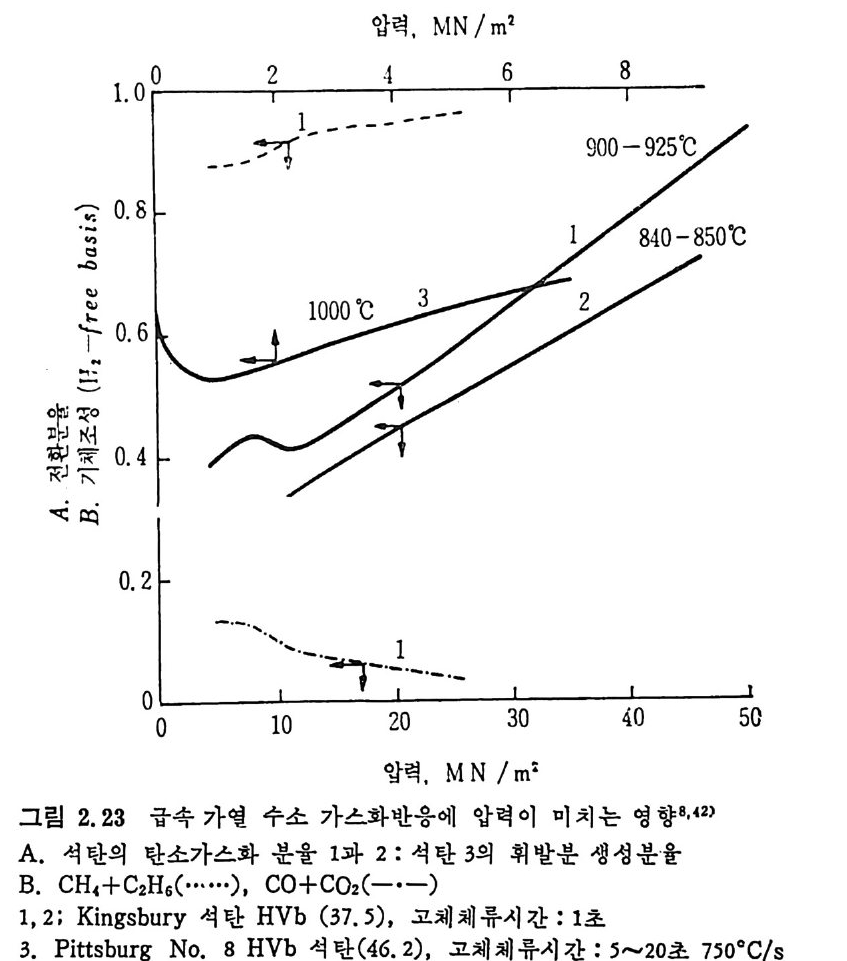 압력 , MN/m2
압력 , MN/m2
림 2. 2 4 에 보여 주고 있 다. 그림 에 서 보 듯 이 soakin g 시 간을 증가시 키 떤 휘 발분의 전환, 분해 (crackin g ) 및 중합이 증가한다 . 그러 나 (타 르 +액체) 전환율은 soak i n g시간에 별다른 영향윤 미치지 않음을 볼 수 있다. 가열을이 탄소 가스화에 미치는 영향은 그립 2.25 에 보여주는 바와 같다.
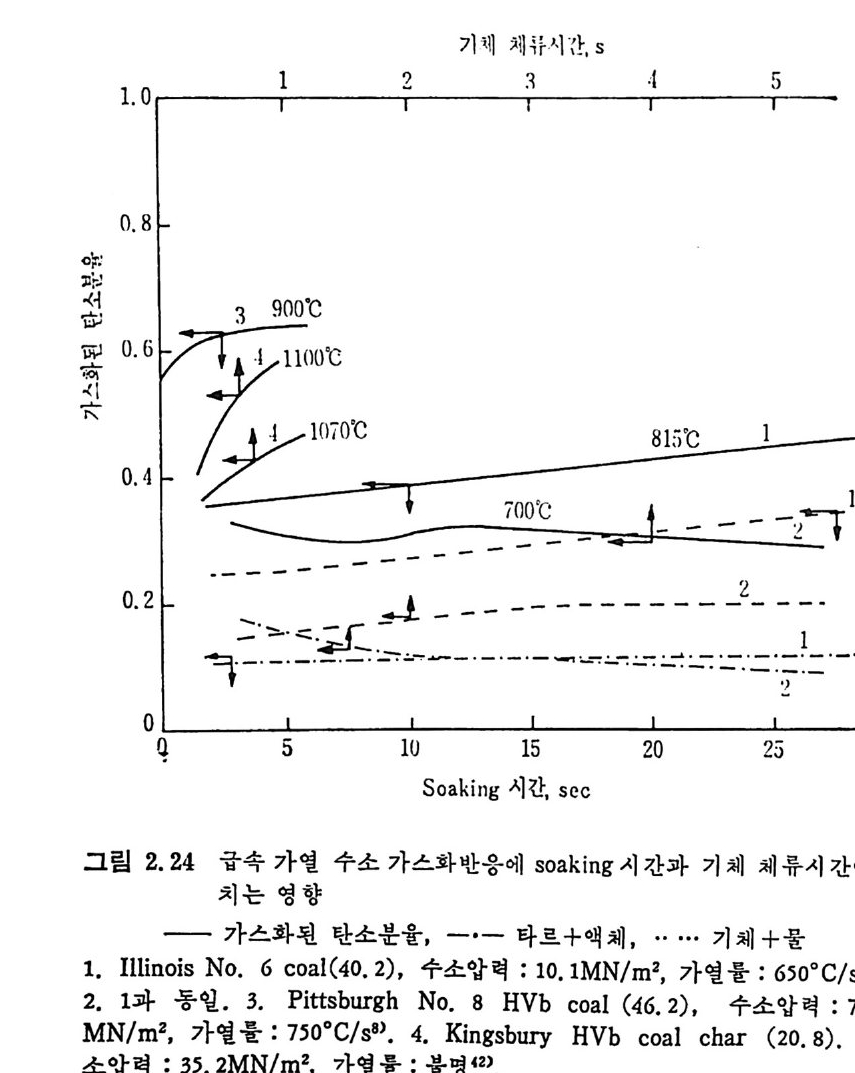 기 체 체 류시 간 , S
기 체 체 류시 간 , S
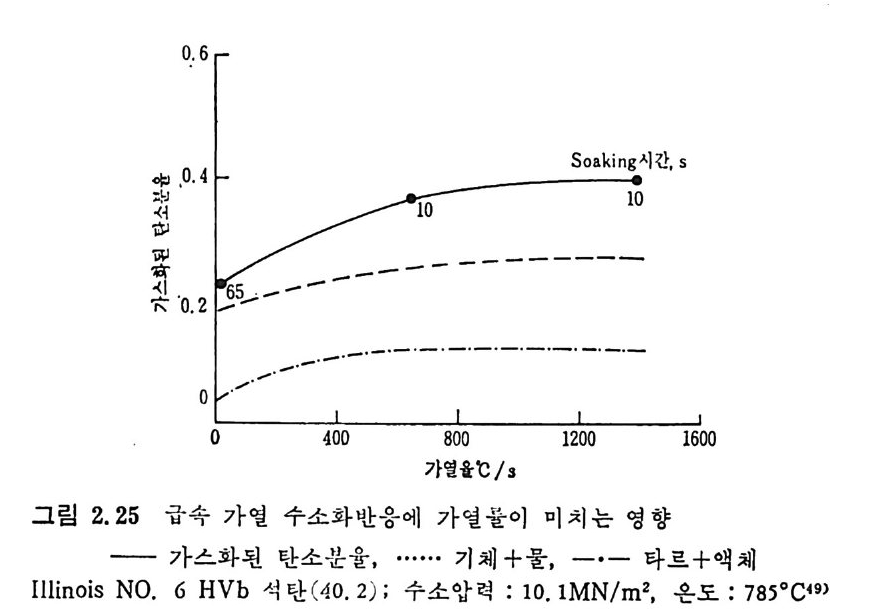 0.6
0.6
가열률이 증가함에 따라 전환율은 증가한다. 그러나 그림에서 보듯이 가열률 500 ° C/s 까지는 전환율이 증가하다가 그 이상에서는 그 중가 울이 크지 않음을 알 수 있다 . 또한 시료입자 크기가 전환율에 미치 는 영향은 이제까지의 연구결과가 미비하여 정량적인 결론을 내릴 수 없으나, 입자크기가 증가하면 전환몰이 감소한다고 발표되었다 .42) 탄소와 수소가 직접 반응하여 CH4 이 합성된다고 알려져 있으나, 석탄은 탄소만으로 구성되어져 있지 않으므로 석탄과 수소반응은 열 분해반응과 휘 발분과 좌 (char) 가 수소와 동시 에 반응한다. 석 탄/초} (char) 의 수소화반응 메카니 즘을 석 탄의 평 군 분자의 기 본 원 형 구조 (rin g str u ctu r e) 가 수소에 포화된 후 rin g 이 파열 된 후 dealky la - tion 되 는 과정 으로 설명 하였 다. 50) 그 중에 서 dealky la ti on 과정 이 제 일 빠르다고 가정 하여 반응률을 다음과 같이 정 의 하였 다. =C /\/ CCH—= CcH /\\ C— 포+ H화2 .KK=21 =C //\C 'H c2--CcH /\\2 C— (A) (B)
=C //\C Hc2—- cCH \/\2 C~ 원+H형2과 一열K3 =C //\ CCH—3 C /\C\ H C3 一 (B) (C) =C /C\/ H' c3 — CC H/\\ 3 C 一 +2H2 —K4+ = C \// cH —- CH \/ \ C 一 +2CH4 (C) (D) 반응뮬= Kk\갑 t갑갭):._ (2. 23) 여기서 좌 -H2 반응률은 낮은 수소분압에서는 2 이고 높은 수소분압하 에서는 1 로 나타난다고 하였다 .50) 2. 3. 5 탄소-이산화탄소반응 (C-C02 Reacti on ) 석탄 가스화반응에서 석탄은 열분해되어서 좌 (char) 로 변환된 후 C 아와 반응한다. 그러므로 여러 다론 종류의 석탄을 여러 다른 공정 에서 얻어전 좌와 C 아반응시켜서 반응을을 측정한다. 이 반응은 바 교적 느린 반응이다. 작은 크기의 좌입자 (<300µ) 를 1000°c 이하에 서 CO2 와 반응시키면 전체 내부표면적에서 반응이 일어나며 화학반 응이 울속단계이다. 또한 이 화학반응 단계는 가스화방법보다 석탄의 성질에 의촌한다. 좌 -C 아반응메카니즘은여러 연구자들에 의해 발표되었다. 그중에 서 Walker 동 51) 이 제 안한 메 카니 즘은 다음과 같다. C+C02(g) .K=1 C(O) +CO(g) K2 C(O) —K3 • CO(g) 윗 식 으로부터 의 반응률은· 반언t= 1 +휼 (KCOl (2C) 0+2) 웅 (CO) (2.24)
상기 식 (2.24) 에서 보면 CO 는 char-C 아반응을 처해하는 영향이 있 다. 도한 반응차수는 낮은 CO2 분압하에서는 1 차반응이고 높은 분압 하에서는 0 차반응으로 나타난다. Dutt a 둥 13) 은 석탄과 좌 (char) 를 CO2 와 840~1100°c 에서 반응시 켜 서 그때 의 반응성 (reac ti v ity)을 측정 하여 다음과 같은 실험 식 을 제 시하였다. Tdtx =aKv 어 (1-Xc) (2.25) 여기서 Q는 CO2 의 농도이고, a= 쯔\::의::f =1 士 100Xc/'e-,xc (o s; v:::;;1) 이며 V 와 /3는 주어전 석탄이나 좌의 물리적 독성 및 반응조건 상수이다. n 은 CO2 의 분압에 비례하여 반응률이 변할 때의 상수로 서, o:: :;;n:::;;1 법위에서 변화하며 실험조건에 따라 변한다. 식 (2.25) 는 탄소농도분윤, Xc>O.9 일 때는 적용시킬 수없다. 그이유는 전환율이
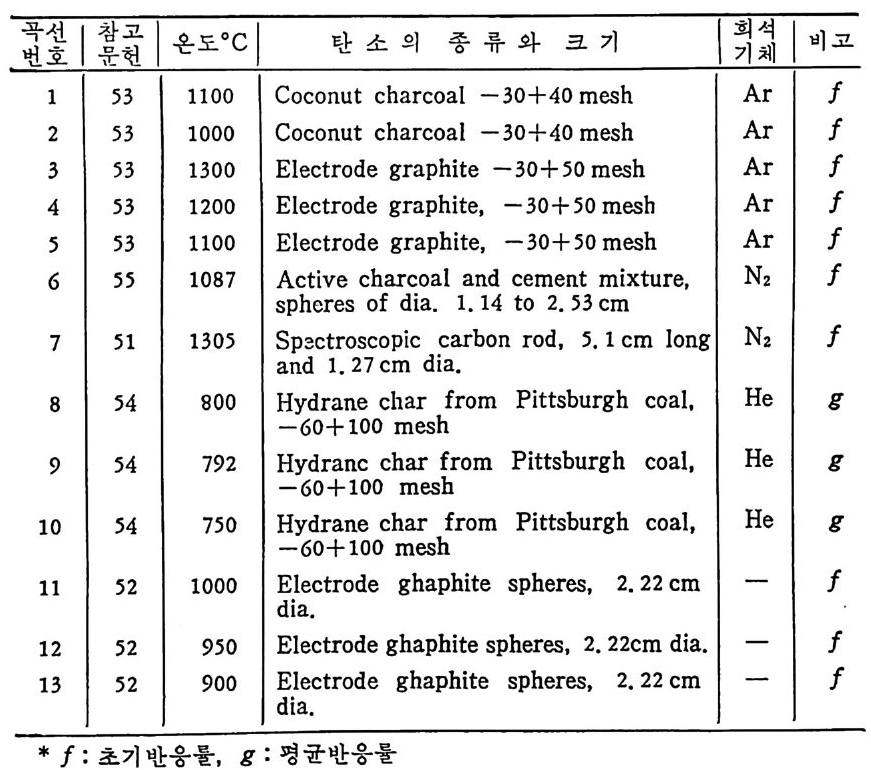 겁걸 I 麟 | 온도 ocI 탄소의 종류와 크기 녑겁 |비고
겁걸 I 麟 | 온도 ocI 탄소의 종류와 크기 녑겁 |비고
큰 경우에는 입자의 기공이나 표면적이 급격히 변화하기 때문이다. co 며 농도가 C-C02 반응을에 미 치 는 영 향을 여 러 연구자들이 연 구하였고 ,51,65) 그 결과를 그림 2.26 에 보여주고 있다. 여기서 보면 char-C 아 반응률은 C 아농도에 대하여 1 기압까지 1 차반응이나 15 기압 이상의 높은 압력하에서는 0 차반응이 된다. 식 (2.25) 에서 a 는 좌 (char) 의 표면적이 전환율에 따라 상이하게 변 화하므로 성이한 전환율을 C 아농도에 따라 보인다. 또한 반응상수 K
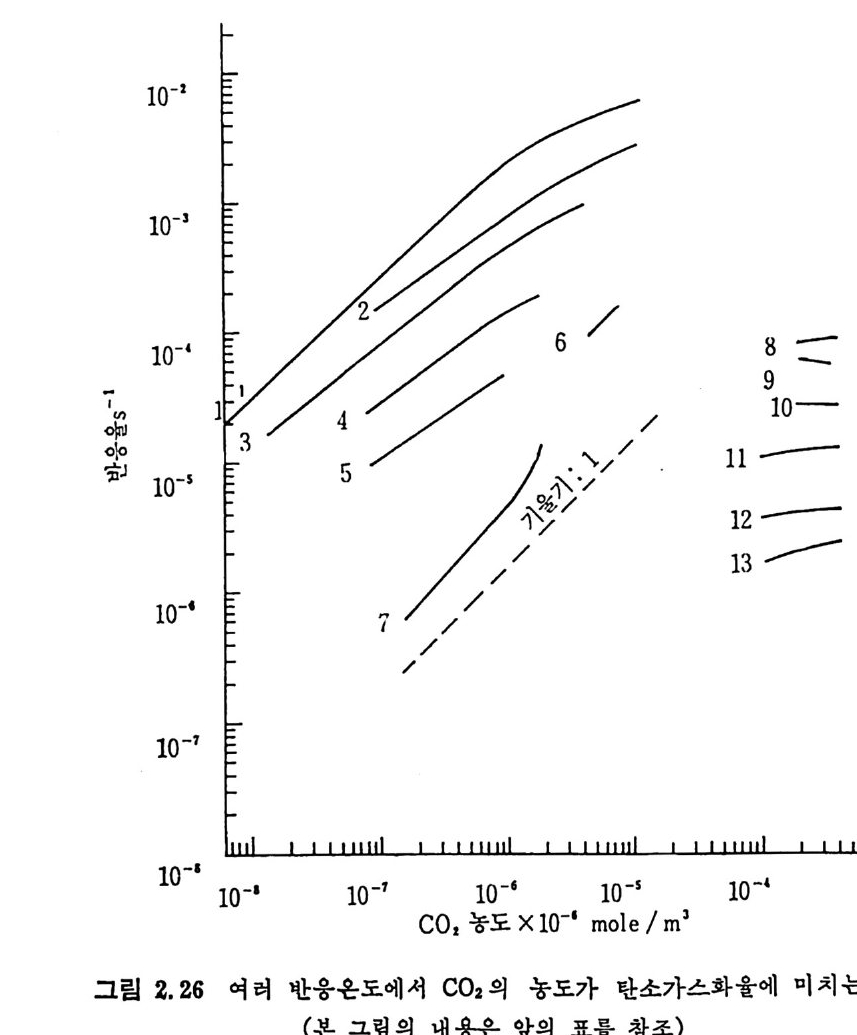 10-2
10-2
논 화학반응이 울속단계 일 때 적 용되 며 Arrheniu s 식 에 따른다고 가 정하여서 x,=O.2 일 때 1/T 와 dx J d t를 도시하면 활성화 에너지 E
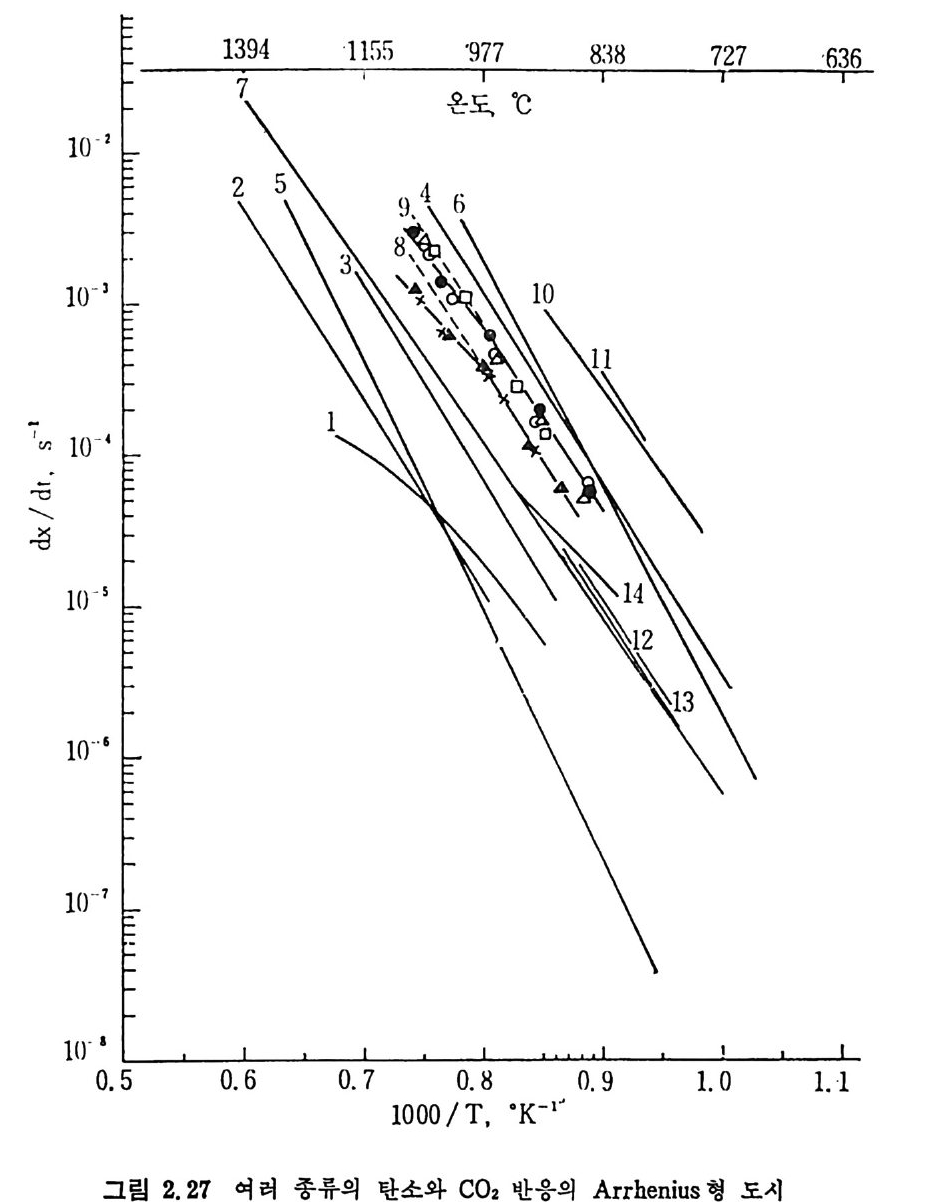 1394 1155 ·977 838 727 ·636
1394 1155 ·977 838 727 ·636
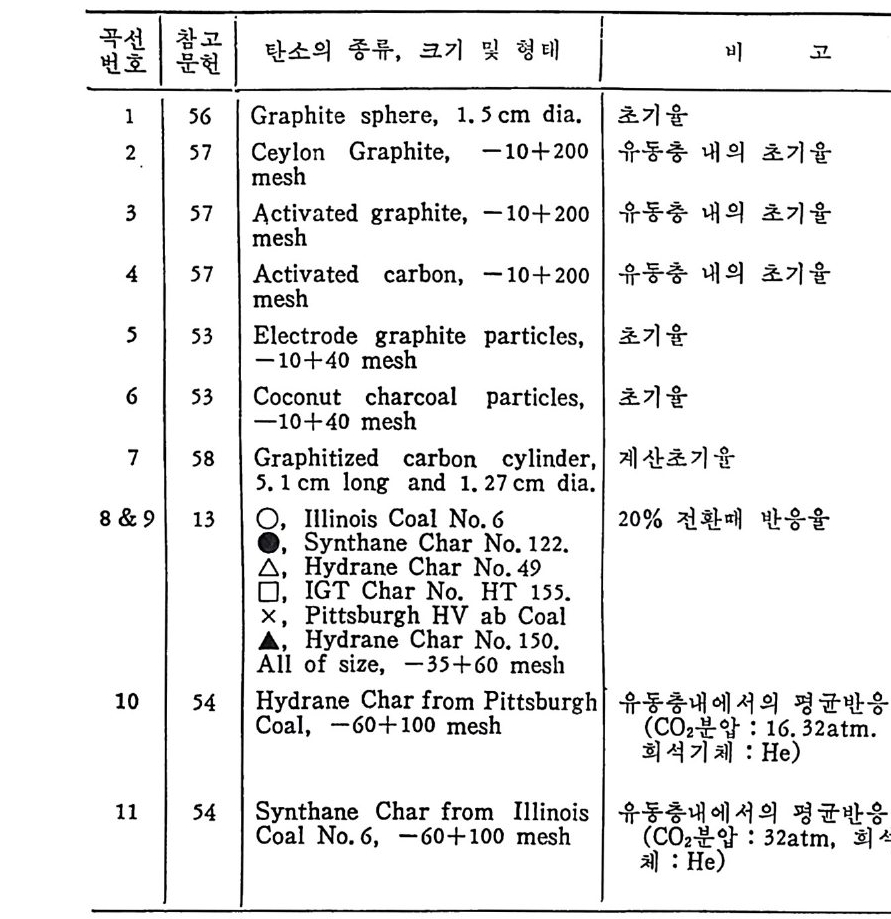 託 I 蠶 I 탄소의 종류, 크기 및 형태 비 고
託 I 蠶 I 탄소의 종류, 크기 및 형태 비 고
를 구할 수 있다(그림 2.27). 그립 에서 보면 좌의 반응률은 좌를 만든 석 탄의 등급이 낮을수록 증가함을 알 수 있다. 즉 석탄의 산소함량이 증가하고 탄소함량이 감 소할수록 반응룰이 증가한다고 할 수 있다 .13) 그러나 석탄입자 내의 확산저 항 (dif fusi o n resis t a n ce) 이 반응에 큰 역 할울 하게 되 면 유효계 수 (eff ec ti ve ness fa c t or) 를 고려하여야 한다. 유효계수는 다음과 같이 표현된다. ‘ (fn:( Dr,& 송)Ca'k ·v roc)A •c4 s국0(I -x,)] (2. 26)
여기서 유효확산계수 De 는 반응중에 변화하므로 그 변화를 다음과 같이 표현한다. De=De0g ( x,) 여기서 De0 는 주어진 좌의 Xc=O 때의 확산계수이며 g (Xc) 는 전환율 Xc 의 함수이며 a'=a/ g (Xc) 이다. 식 (2.26) 를 적절한 경계조건을 가지 고풀면 r;=습( ta n\ M —-k-) (2. 27) 이 되 며 여 기 서 M=0[(1-Xc)a'J! /2 이 며 o=r 。 J Kocso/De0 이 다. 여 기 서 화학반응이 윤속단계 이 면 ¢。은 0 이 되 며 가스화율은 입 자간의 확산을 고려 하면 식 (2. 28) 詞d=x r; aKCA(l ― Xc) (2. 28) 로 표현된다 . 그러므로 전환율이 확산에 의하여 결정되면 전환율에 따른 상대 반응물계수 a 및 유효확산계수 De 를 알아야만 한다. 화학 반응이 융속단계 일 때 의 C-C02 반응의 좌 반응률은 반응방법 보다 석탄의 물리적 성질에 의촌하며 좌의 기공크기가 15A 이상인 기공이 반응에 참여하는 표면적은 크지 않다고 알려쳐 있다 .13) 또한 C-C02 반응에서 CO 의 농도가 낮을 때는 반응을 저해하는 영향이 있으나 높 은 농도 (CO/CO2 >2. 7) 일 때 는 석 탄 중의 산화철이 환원되 어 서 금속철 이 되 어 서 CO2 가스화의 촉매 역 할울 하여 반응률을 증가시 킨다. 59) 2. 3. 6 최_산소반응 (char-oxy ge n reacti on ) 좌-기체의 반웅 중에서 좌-산소반응은 연소로나 가스화 반응기 내 에서 제일 빠른 반응이다. 대개의 경우 반응은 좌의 표면에서 일어나 며 회분충의 확산 (ash - la y er d iffu s i on) 에 의하여 반응이 조절되어진 다. 그러나 온도와 좌의 입자크기가 증가하면 반응이 기처 1 막 확산 (ga s-fi lm d iffu s i on) 에 의하여 조철되어서 입자의 전내부 기공표면적 에서 일어날 수도 있다. 죽 분란을 연소시 입자가 50µm 이하인 경 우는 화학반응이 울속단계이나 입자가 IOOµm 이상이면 확산에 의하
여 반응이 조철된다. 60) 석탄/카의 크기가 90µm 인 것을 산화시키면 온도가 대략 500°C 까 지는 화학반응이 조절하나 입 자가 작아지 면 (~20 µm) 화학반응에 의 한 영 역 이 1300°C 까지 확장된다• 61- 6 3) 좌 _c 아 반응이 회 분막 (ash-fi lm ) 확산과 기 체 막 (ga s-fi lm ) 확산에 의 하여 조철될 때의 반응률은다음과 같이 표시할 수 있다 .6 1) ddxt -_ I Po2. I (2.29) 了+了 여기서 dx/d t는 입자의 외부 표면적당 반응률이고 Po2 는 산소의 분 압, K,,,. 는 확산반응물이며 Ks 는 표면반응물 계수이다. 유동충 반응기에서 작은 입자의 경우, 입자와 기체의 상대속도가 작 울 때 Kd i/1는 다음 식을 사용할 수 있다 .60) o. 292
으로 입자크기가 작고 온도가 높으면 co 생성이 찰 되며 입자크기가 크고 온도가 낮으면 CO2 생성이 찰 되는 것으로 알려져 있다. 반응 메 카니즘계수 少는 다음 식으로부터 예측할 수 있다. d p후 005 cm 일 때 2 mm) 는 이중막 모델에 따른다. 65- 6 C) 그러나 상기한 두 가지 모델은 두 가지 극단의 경우를 나타내며 실 제 의 산화반응은 좌입 자의 크기 , 온도, 산소의 농도 및 좌의 반응도 둥 여러 인자에 의존한다. 그러므로 산소나 CO2 는 좌 표면에서 동시 에 반응하므로 그립 2.28 의 모델패에 온도와 반응가스 농도분포를 입 자 내부까지 고려한 것이다. 순전히 확산에 의하여 반응이 조철된다 떤 co 의 연소에 의하여 산소는 다 소모되고 좌의 표면에 산소가 도 달하지 못하여 좌는 CO2 와만 반응한다. 화학반응만이 반응을 조철한다면 (<100µm) CO2 와 산소는 좌 표면 에 거의 같은 정도로 도달하게 된다. 그러나 좌 -02 반응이 좌 - CO2 반응보다 매우 빠르므로 60) 츠卜 - 아반응이 좌표면에서의 주요반응이다. 그러므로 좌 표면에서의 산소와의 접화반응과 경계층 내에서의 co 의 불꽃접화반응이 있다고 할 수 있겠다. 좌표면온도가 높거나 좌가 매 우 반응성이 큰 경우 좌의 표면에 주기적인 산소공급차단이 일어나서 연소가 전동하는 현상이 가끔 생긴다 .C4)
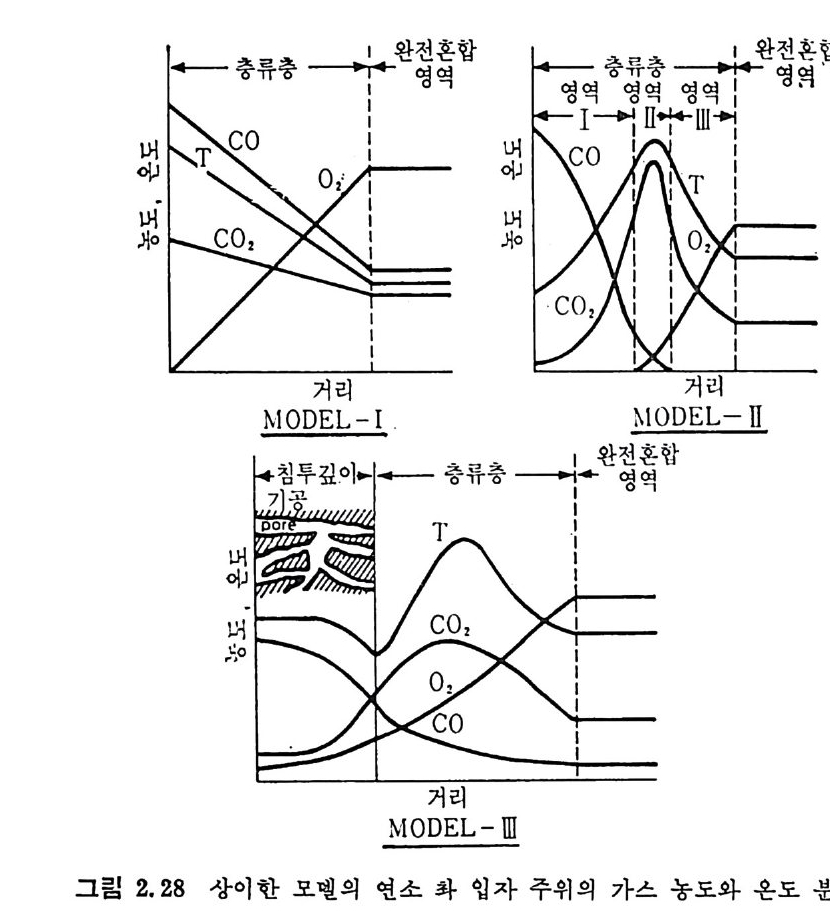 +一 충류층 _一―! 4 ·완 전영 혼역 합 영역 충영류역층 _영_역' ,I! _ 완 영전염혼 합`•
+一 충류층 _一―! 4 ·완 전영 혼역 합 영역 충영류역층 _영_역' ,I! _ 완 영전염혼 합`•
좌의 표면반응상수 Ks 를 다음 식으로부터 계산할 수 있다 .60) Ks=Ks 。 exp ( -17, 697/Ts) (2. 31) 여기서 K% 는 석탄이나 탄소의 종류에 따라 변화하나 좌의 대략적인 값은 8710g /c m2-s 이 다. 화학반응이 반응을 조절하는 경 우의 좌 -C 아 반응률을 다음과같이 표시할 수 있다 .32) 겅dx =aKvP02(I-Xc) (2. 32) 여기서 dx/dt 는 고체 반응물의 단위 질량당 반응률이 고 a 는 전환율에
따른 반응인자이며 반응에 참여하는 기공표면적을 나타낸다. 또한 반 웅물은 산소분압에 비례한다고 가정한 것이나 반응차수가 1 차라는 가 정 은 아직 도 확정된 것 은 아니 며 , 보고되 어 진 바로는 0~1. 0 사이 에 서 반응차수가 변화된다고 알려져 있다 .63 제 6-69) 산소분압에 대 한 반응차수를 겉보기 차수 (a pp aren t order) (식 2. 29) 와 전차수(t rue order) 로 나누어 서 (식 2. 32) 그 관계를 na= 」노2브 _ 로 나타내 었다. 70) 화학반응 조철영 역 (O. 05
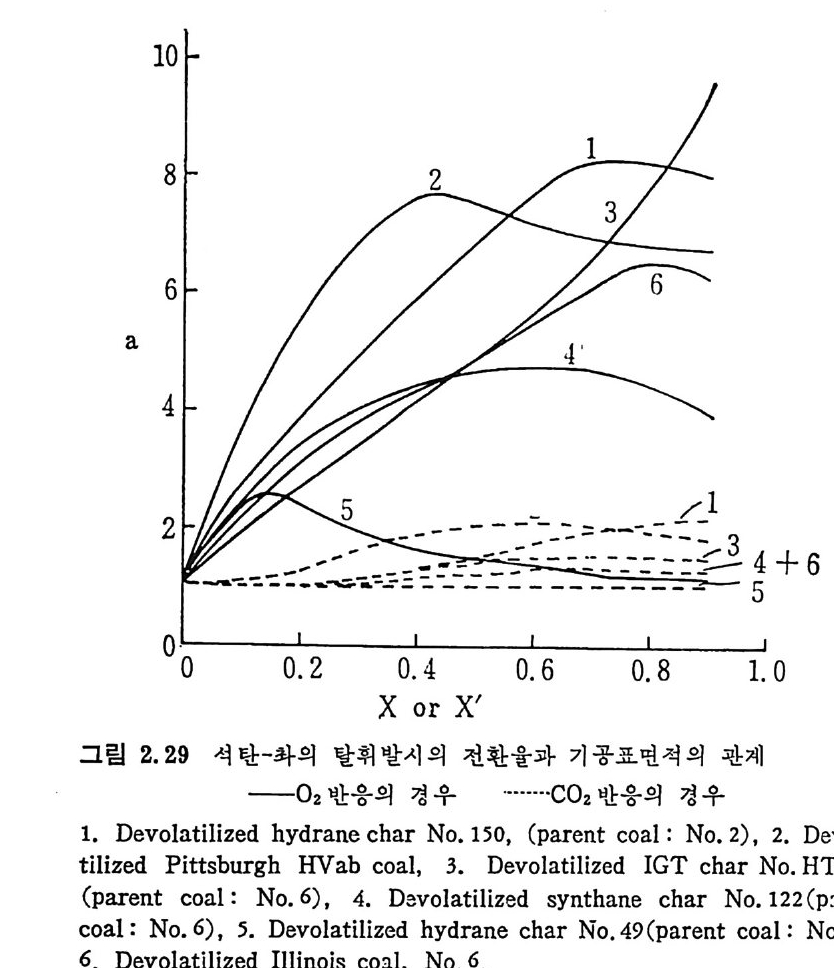 10
10
회분막이나 기체막 확산이 전체 반웅물을 조철할 때 여러 종류의 좌에 따른 반응률 (reac tiviti es) 의 차이는 크지 않으나, 반응이 화학반 옹에 의하여 조철될 때는 그 차이가 크다(그림 2. 30). 그립에서 보듯이 화학반응에 의하여 반응이 조절될 때는 좌의 가 스화 정도가 석탄의 종류에 따른 영향보다 크다• 이는 좌 -C 아반응 과는 대조적이다. 그러므로 반응도는 석탄의 물리적 성질분만 아니라 반웅시키는 방법에도 달려 있다. 여러 종류의 좌를 500°C 에서 산소와 반응하였을 때의 반응률 (re ac tivity)은 좌를 생성한 석탄의 탄소함량이 증가할수록 감소한다. 그
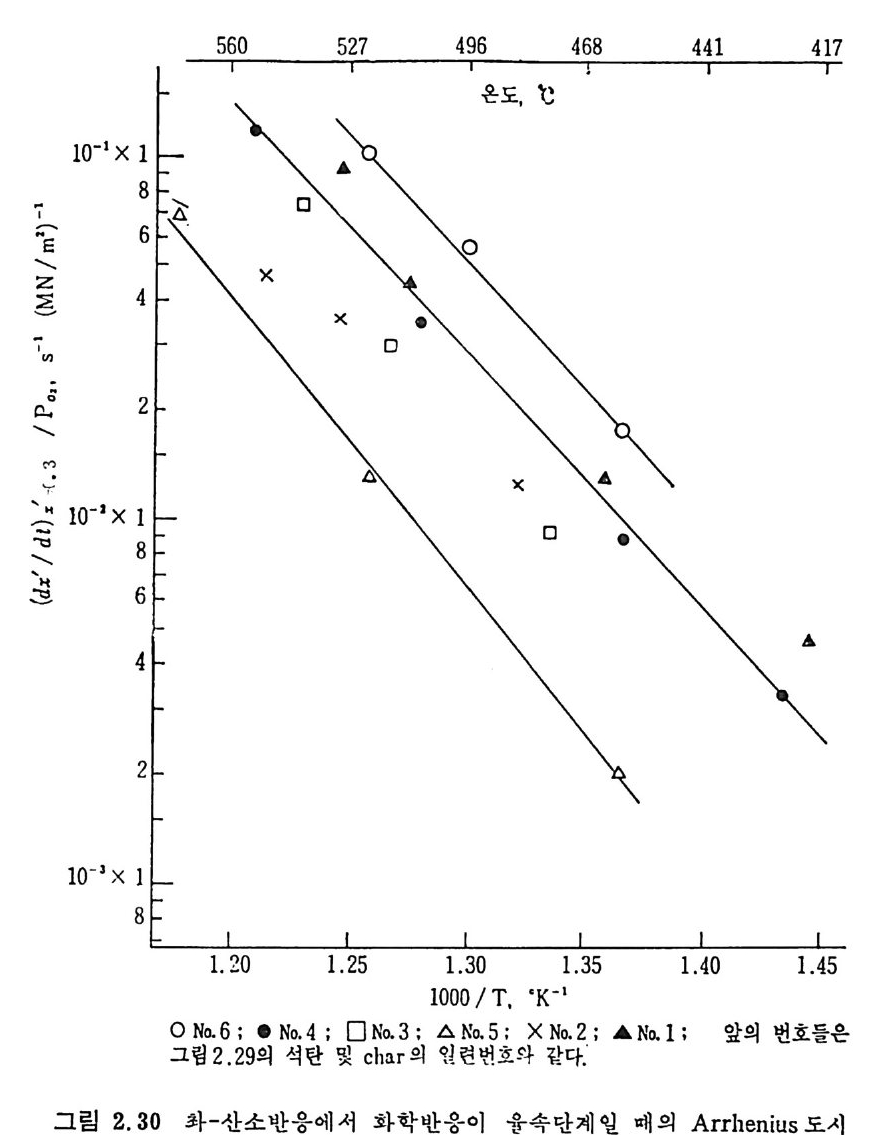 560 527 496 468 441 417
560 527 496 468 441 417
관계 73) 는 다음과 같다. R=I383I exp ( -o. 12C) (2. 3.5 ) 상기 식은 미국 72) 과 카나다 7 3) 석탄으로부터 얻어전 좌에 대한 결과
이며 갈탄에서 무연탄까지 변화하였으므로 탄소량의 범위는 63.3< Cd•l<93. 5% 이다(그립 2. 31). 또한 좌의 회분 내의 CaO 및 M g O 가 좌-아반응을 증가시키는 촉매역할을 하며, 또한 반응 초기단계는 화학반응이 좌 - 02 반응을 조 철하나 회분충 형성이 된 반응 후에는 회분충 확산저항 (Ash-la y er dif fus io n resis t a n ce) 이 반응을 조철함을 보고하였 다. 73)
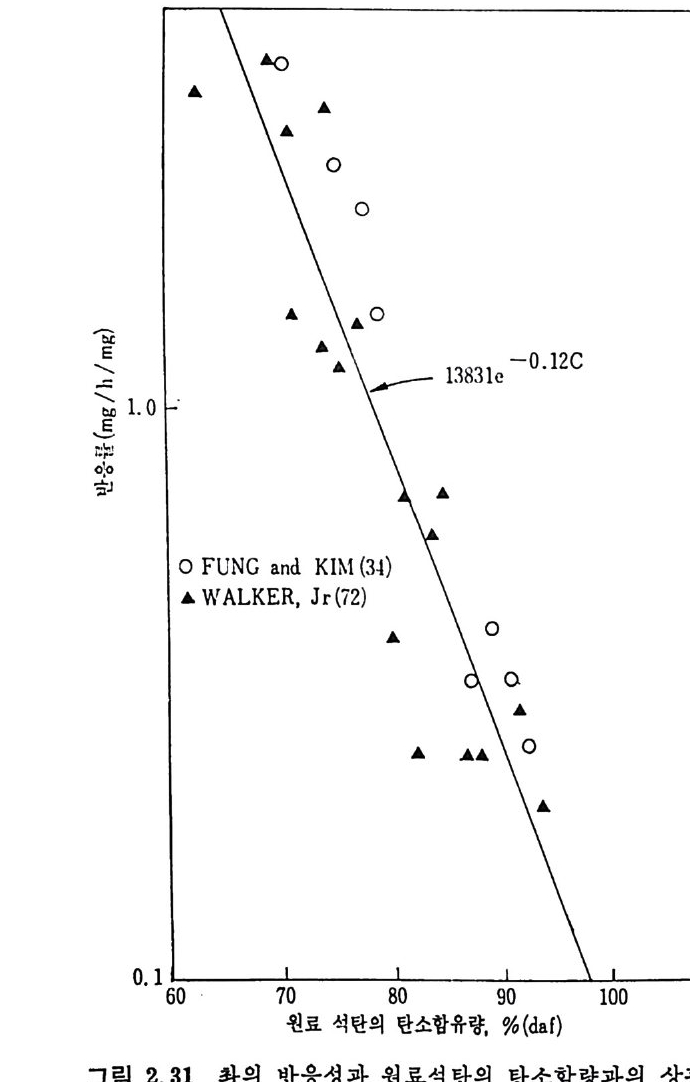 ...
...
2. 3. 7 석 탄 / 초|-수증기 반응 이 반응은 산업적으로 중요한 반응 중의 하나로 이제까지 많은 연 구가 이루어져 왔다. 즉 좌와 수증기를 반응시켜서 CO 와 H2 를 얻는 반응이나 반응 메카니즘에 대하여, 동일된 이론을 제시치 못하나 이 반 응의 주요 생성물은 CO 와 H2 이고 수소가 이 반응을 저해하는 영향 이 있다고 알려 져 있다 .74-75) 좌 -H20 반응 메 카니 즘을 Walker5u 둥은 다음과 같이 제시 하였 다. K1 C1+H20(g) .:= Hz(g) +C(O) K2 K3 C(O) 一 CO(g) 반응률= 1+— KK~ 3 ( H K2I(0H)2+0)— KK23 (H 2) (2.36) 상기식은 H2 가스가 전체 반응을 저해하는 영향을 보인 데카니즘인 반면, CO 와 H2 가 모두 반응을 저해한다는 반응 메카니즘을 다음과 같이 제 안하였 다. 79) c,+H20(g) .K=1 Hz(g) +C(O) K2 K3 C(O) —+ CO (g) C(O) +co .K=4 C02(g) +c, Ks 반응률= 1 +웅 (HK2I 0()H +20)운 +K 4(H(2C)0 + 사 운 (CO) (2. 37) 그 반면 실험결과를 근거로 하여 Wen76) 은 다음과 같은 식을 제시 하였다. 움 =Kv(CH,o-~) (1 군) (2. 38) 여기서 Kv 는 반응상수이며 K 는 반웅평형상수이며 Kv 는 여러 가지
탄소 종류에 따라 Arrheniu s 도표를 그려 서 구하였 다. 이 도표로부터 평군 활성화 에너지는 35 kcal/mol(146 K J /mol) 로 나타났으나 35,47,74,77, 80) 다른 연구자들의 활성화 에너지값은 60~so kcal/ mo l(251~335 KJ / mol) 의 상대적으로 높은 값을 제시하고 있다 .75,8 1, 82) 탄소/초} -H20 반응은 입자가 작고 (<500µ) 반응온도가 850~1200°c 에서 화학반응에 의하여 조철되며 75,80,83,8 4), 이때 반응은 기공표면적 을 동하여 균일하게 일어 난다. 좌/수증기 반응차수는 수증기 의 농도에 따라 변화하며 수증기 의 분 압이 1 atm 까지는 1 차반응인 반면 수증기 압력 이 높으면 반웅차수는 0 차반응이 된다. 51) 또한 좌의 회분 중의 금속성 분이 반응의 촉매 역 할을 한다. 83) 그러 나 츠 }/C 아 반응에 서 촉매 역 할을 하는 CaO 나 Fe203 둥이 초}/수증기반응에서 비촉매역할을 하는 등 일정한 경향을 보이 지 않는 것은, 회분 내의 금속성분이 다양하여 각각의 성분에 대한 영 향을 구별하기 가 힘 들기 때 문이 다. 일반적으로 초}-수증기 반응에 서 는 Na2C03 나 K2C03 가 촉매 역 할울 한다고 알려 져 있 다. 상기한 여러 좌-가스반응을 비교하면, 첫째로 석탄 또는 좌의 열분 해반응이 일어나며 타반응에 비해 빠른 반응이다. 좌-가스반응들 의 Arrheniu s 型의 반응률 대 1/ T 를 그림 2. 32 에 도시 하였 다. 76) 그 립에서의 좌 -H2 및 좌 -H20 반응은 고압하에서의 상관식을 의삽하여서 1 atm 조건으로 표시한 것 이 다. 좌 -H2 반응은 1 차반응으로 가정할 수 있 으나 좌 -H20 와 좌 -C 아 반응은 높은 가스분압하에 서는 1 차반웅이 라고 가정하기는 힘들다. 그림에서 보듯이 대기압조건에서의 초 }-H2 반응은느리다. 그러나 압 력 이 증가하면 좌 -H20 나 초 } - C 아 반응은 0 차반응 쪽으로 수림 하므로 높 은 압력 하에 서 의 좌 -H2 반응은 상기 두 반웅보다 반응률은 매 우 크다. 좌-가스 반웅들의 대략적인 활성화 에너지는 좌 -CO2 ; 247 KJ /m ol, 좌 -02; 149 KJ /m ol, 초} -H2 ; 172 KJ /m ol 및 좌 -H20; 146 KJ /m ol 이 다. 좌-산소 반웅은 다론 좌-가스 반응보다 105 정도 반응률이 빠르다(그 립 2. 32). 이 반응을 확산한계 (dif fusi o n -lim i ted ) 표면반응으로 간주할 수 있 으므로. 미 반응 중십 수축모델 (unreacte d shrin k in g core model) 로 85-86) 설명할 수 있겠다. 그 반면 좌 -H2, 좌 -H20 및 좌 -C 아 반응은 비교적 느리게 반웅하고 입자내부 기공에 기체가 침두하여 반응하므
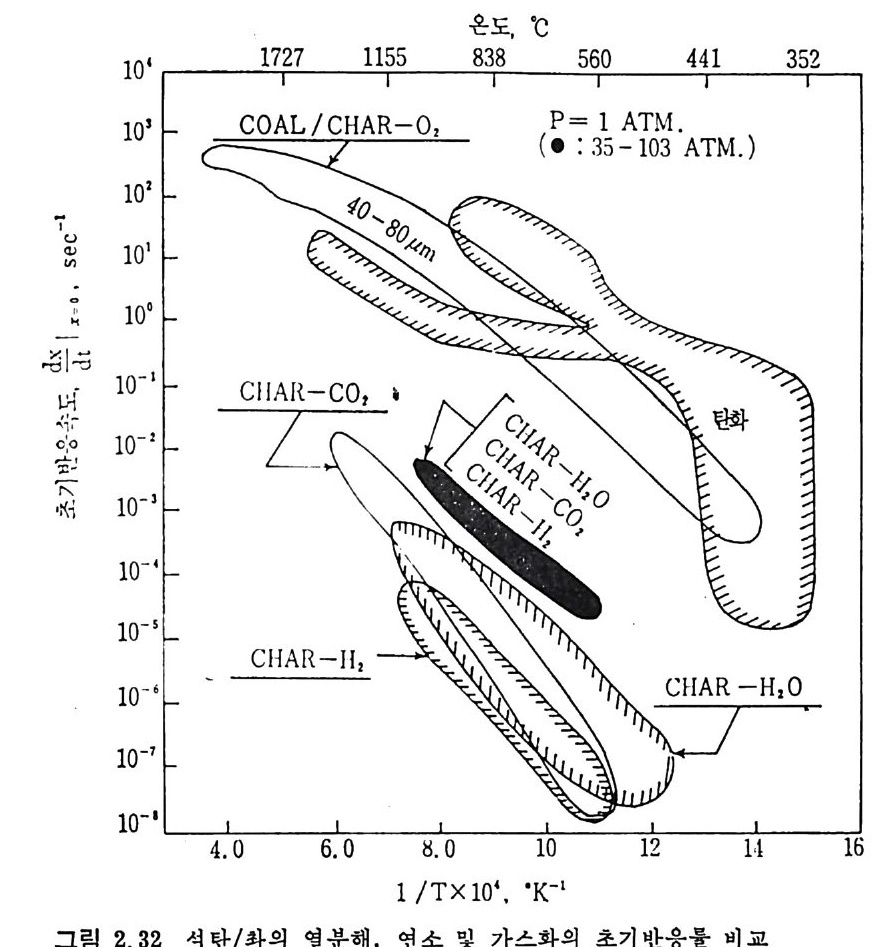 온도. •C
온도. •C
로 체 적 반응모델 (volumetr i c reacti on model) 이 적 용될 수 있 다. 85-86) 실제 가스화반응기 내에서는혼합기체가 탄소와 반응하고대부분석 탄이 반응하여 생기는 회분은 매우 다공질이며 깨지기 쉽다. 그러므 로 유동충이나 비말동반 반웅기에서의 석탄의 회분충은 마모에 의하 여 입자 표면에 남아 있지 못할 것이다. 그러므로 가스화 반응기 내 의 입자와 기체의 접촉방법에 따라 반응하는 좌의 회분막 형성이 없 다고 가정하여 상기한 각 반웅의 물질수지식을 세울 수 있겠다. ® 좌-아반응 미 반응 중십 수축모델 (unreacte d core shri nk in g model) 에 서 회 분충
형성이 없을 때의 산소수지는 KmA(C..4 . -C.A ) =aKsC.A r=r, (2. 39) 탄소수지는 _Cs. (뚱 )=KsCA (2. 40) 여기서 초기 조건인 r,=r0, t= O 때 반응률은 다음과 같이 표시할 수 있다. 반응률= Jt1 - +~. 7( 효m1 T ol /L2•8) (2. 41) 여기서 PA,=CAoRT, K;=K,/RT, Kd; JJ =KmA f aRT 이며 KmA 는 반 웅가스의 물질 전달계수, a 는 양론계수, K, 는 표면반응윤이고 K,' 은 1 차 표면반응울이다. ® 좌 -CO2' 초l- -H2 및 초l- -H20 반응 체 적 반옹모델 (volumetr i c reacti on model) 에 서 회 분충 형 성 이 없 다 고 가정한 경우의 H2 수지는 D,( 출국 · 움 )-aKvnCnCs=O (2. 42) 경계조건은 De( 움 )=KmH(CH,-CK) r=r, 때 (2. 43) ddCrH =O r=o (2. 44) 단소에 대한물질수지는 ~d=CCs ,(KvHCH+Kv .. 9w+KvDC 하 (2. 45) 이며 t= O 때 C,=Cs0 의 초기 조건을 가진다. 식 (2. 42)-(2. 45) 에 서 D,, CH, KvH 와 Kmu 는 수소에 대 한 값이 므로 H20 와 CO2 수지에서는 이에 상응하는 값을 사용하면 되겠다. 또한 식 (2.45) 에서 H,W,D 는 H2, H20 및 CO2 를 나타낸다. 식 (2. 42) 에 서 양론계 수 a 는 좌-수소반응에 서는 좌의 수스함량에 의
존하여 전환율이 0 에서 1.0 까지 변할 때 a 는 I. 2 에서 2.0 까지 변 한다. 87) 그 반면 좌 -H20 및 좌一 CO2 반응에 서 의 a 는 I. 0 에 가깝다. 카아반응에서는 CO2 나 CO 를 생성하게 되며 이 생성분포 또는 반 응 메카니즘계수 少는 I/a 로 표시된다. 좌 -H 초 }-CO2 및 좌 -H20 반응뮬둘을 간단하게 다음과 같이 표현 할수있다. -=d;x;; -= KvCA (l-x) (2. 25) 그러나 다음과 같은 가정을 만족하여야 한다. 죽 수소의 평형농도 (C112) 는 수소의 전체 농도에 바해 무시할 수 있으며, 좌입자의 기공함 수 a.=I.O 이다. 또한 좌 -H20 반응에서 H2 와. co 가 반응을 저해하는 영향은 무시할 만큼 작다. 이러한 가정을 만족하면 식 (2.45) 는 탄소 농도에 대하여 다음과 같이 표현할 수 있다. ~dC=, -KvCACs (2. 46) 여 기 서 CA 와 C, 는 가스농도와 초}의 탄소농도이 다. 상기한 고속 및 순간 열분해에 대한 석탄의 종류 및 크기에 대한 영향은 아직까지의 연구결과가 부족하여 정량적인 결과가 미비하 다. 그러므로 이에 대한연구가 앞으로필요하다. 또한 초}-가스반응들 에 대한 여러 석탄의 등급 (rank), 입자크기 등이 상대반응도 (rea cti v i ti es) 에 미치는 영향도 더 자세히 규명되어야 하겠다. 이제까지 반응 률에 대한모델은반응중에 회분충형성이 없다는조건과 있다는두가 지 국한상황에 대한 것이나, 실제 반응은 이의 중간에 속하므로 이 에 대한 모델개발이 이루어쳐야 하겠고 좌-가스반응중에 CO+H20 .=C02+H2 반응, 죽 가스 변환반응(g as shif t reac ti on) 이 동시에 일 어나나 각각 반응에 대한 이의 영향을 구벌할 수 없으므로 아에 대한 연구가 필요하다. 특히 석탄/좌의 회분 중의 금속성분이 촉매역할을 한다는 국부적 정보가 있으나, 이에 대한 체계적 연구도 필요하다. 2.4 석탄 액화반응 석탄의 직접 액화방법은 가스상에 수소를 첨가하돈가 석탄으로부터
추출된 액체에 수소를 첨가하여 합성 유류를 만드는 방법이다. 석탄 을 기화시켜 생성된 기체에 칙접 수소를 첨가하는 방법은 미세 석탄을 석탄에서 생성된 액체와 혼합하여 얻어전 석탄 스러리상에 수소를 첨 가하는 반응으로 촉매를 첨가하여 반응을 촉진시킨다. 이를 수소엑 화 (hy d roli qu efa c ti on ) 또는 촉매 액 화 (cata l yt ic liq u efa c ti on ) 라고 부 른다. 직접 석탄 액화반응을 간단히 표시하면 c+o. 8H2 --+ CH1•6 (2.47) 이 반응은 액화온도에서 낮은 발열반응이므로 열효율은 좋다고 하 겠으나 반응은 느리다. 주로 H2 공급은 수중기를 사용한다 (C+H 2 0~ CO+H2). 그러나 이 반응은 홉열반응이므로 열을 공급하여야만한다. 석탄액화시 수소첨가는 석탄내의 산소, 유황및 질소를환원시켜서 대 략적인 몰형태는 CHo.s O o.1No.0 2 So.0 2 인 조성을 갖는다 . 이 모든 조 성 들이 수소와 반응한다고 하면 CHo.s + o. 4H2 —* CH1.6 o. 0502+0. 1H2 一 o. 1H20 o. O lN~+o. 03H2 —+ o. 02NH3 o. 02S+o. 02H2 一 o. 02H2S 양론적으로 1.1k g의 수소가 15.32k g의 석탄과 반응하여서 I3.6 k g의 액체연료를 생성하게 된다. 대 표적 인 액 화공정 조건은 반응온도가 450~475C 에 서 10~3o MPa 압력하에서 수소첨가반응으로 행하여지며 반응시간은 1 시간 가량의 체 류시간을 요구한다• 좌나 가스의 생성을 여제하기 위하여 고압에서 반응을 진행시키며 탄소의 전환울은 90~95% 가 이루어진다. 상기 조 건에서의 액체성분중 50~60% 가 증류할 수 있는 성분이며, ~70MPa 압력에서 조업하면 거의 모든 액체성분은 증류할수있는성분이 된다. 역청란이 제일 많은 양의 액체를 생성하므로 제일 좋은 원료로 사 용되며 액체 조성은 수소화 정도에 의촌한다. 석 탄 액 화의 중간 산물은 pre a~p h alte n es 또는 asph a lto l s 또는 asp h a-lte n es 이 타고 하며 이 것 이 기름으로 전환된다. 미 반웅석 탄, 기 름의 전
조 (oil p r ecursors) 및 기 름의 정 의 는 benzene 용매 에 녹는가 안 녹 는가에 따라 결정한다. 그 정의를 도표로 표시하면 아래와 같다(그립 2. 33).
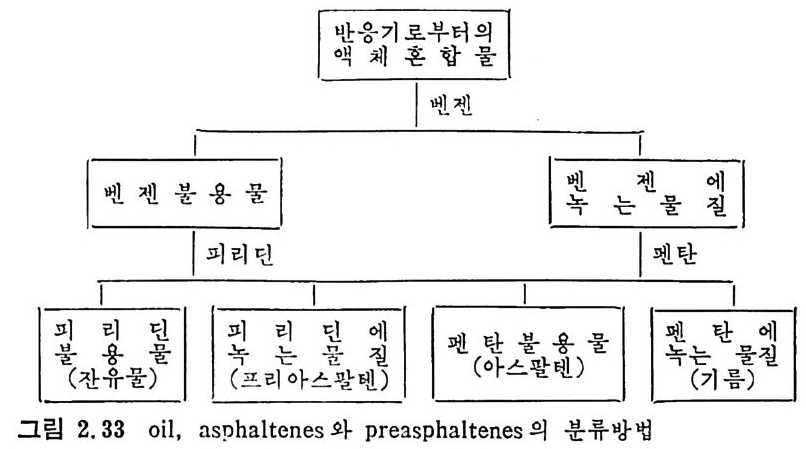 액반웅체기혼로부합터물의
액반웅체기혼로부합터물의
벤젠에 녹는 물질을 다시 p en t ane 에 녹여서 녹으면 기름 (o i l) 이고 녹지 않으면 asph alte n es 으로 나누며 벤첸에 녹지 않는 물질을 pyr i- din e 에 녹여 서 녹는 물질을 반응성 석 탄으로 보며 , 이 를 pr easph alte n es 이 라 부르며 높은 접 도를 가전 물질로서 구분한다. 또한 pyridi n e 에 녹지 않는 부분은 미 반응 석 탄으로 구별한다. 석탄 엑화공정의 중요 변수들은 석탄의 종류 및 등급 (rank), 석탄액 쳐] 또는 용매의 성질, 반응온도 및 압력, 반응 체류시간 및 촉매의 영 향 등을 고려하여야 하겠다. 무연탄은 액체산물이 적어서 수소화반응에 적합하지 못하다. 처등 급(l ower rank) 석 탄들은 쉽 게 액 화되 나 수울은 역 청 란보다 높지 뭇 하다. 또한 저동급석탄이 함유한 많은 산소는 수소를 소모시키며, 이 는 액체산물의 높은 접도를 유발한다고 알려져 있다. 제일 높은 액체 수율은 높은 휘발분을 가전 역청란이라고 보고되었다. 석 탄의 암석 조성 (pe tr o g r ap h ic comp o sit ion ) 이 석 탄 액 화에 영 향을 미친다고 알려져 있다. 죽 비트리나이트 (v it r init e) 와 ex init e 는 좋은 액체수율을 나타내며 i ner ti n it e 는 액화를 저해하는 것으로 알려져 있 다. 그러 나 석 탄의 종류나 동급 (rank) 과 액 화와의 상관관계 는 규명 되지 못한 상황이다• 그 예로서 여러 등급의 석탄을 450°C 및 10MPa
하에 서 수소화시 켜 서 (Exxon donor solvent pro cess) 이 때 의 층류 생 성 물을 수소화시 키 며 이 때 반응물들의 흐름은 병 류 (cocurren t) 일 때 반응체류시간에 따른 액체 생성물을 보면(그립 2.34) 상기한 대로 역 청란 및 준역청란이 갈란 둥 처등급탄보다 액체 생성량이 많다. 그러 나 그림에서 보듯이 거의 같은 성질을 가전 Illin o is No.6 석탄의 수율 이 서로 상이한 결과를 보이므로 일반적인 상관관계를 얻기가 매우 어려운 상황이다. 석탄액체 또는 용매와 석탄을 혼합하여 고압의 반응로에 수송 주 입하여서 액화반응을 시킨다. 그러므로 이 석탄스러리의 성질이 석탄 액화 또는 용해에 중요한 영향을끼찬다. 용매의 수소화반응은석탄의 용해 전에 석탄스러리 및 수소와혼합하여서 행하여진다. 좋은 수소전 달 (hy d rog e ndonor) 성 질은 석 탄의 추출 액 체 에 많은 tet r a Ji n 과 같은 수소방향족화합물 (h y droaroma ti c com p ound) 의 성질에 달려 있다. Tetr a lin 의 수소전달 능력과 가역 용매 수소화 반응식 은 다음과 같다.
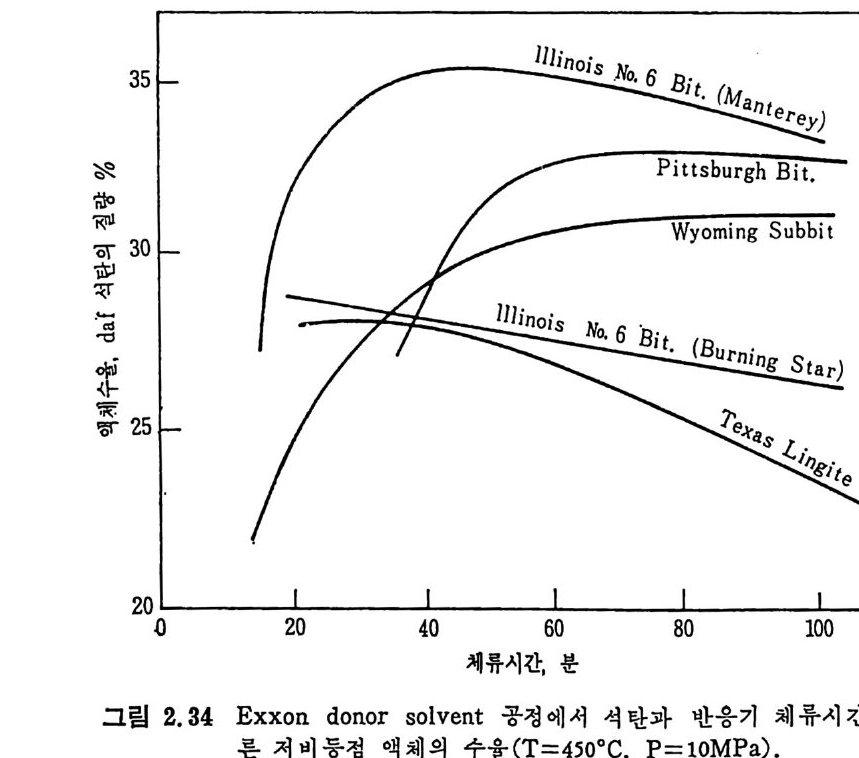 35 lllin oi s No, 6 Bi t .
35 lllin oi s No, 6 Bi t .
^I\_ /I/I\ \/I - —액—화 시/\ \/II/\ \/·1 +4H (2. 48) Tetr a lin 수소전달 용매의 촌재는 비전달 혼합물 (non-donor m i x t ure) 의 수소 전달 능력울 증가시킨다. 그러므로 t e t ral i n 과 cresol 을 반반씩 혼합 한 혼합물은 순수 용매보다 수소전달 능력 이 크다. 온도의 영향은 350°c 정도에서 석탄은 열용해에 의하여 물리적 분 해를 한다. 이때 입자크기가 2~3mm 이하일 때는 입자크기의 영향 은 적다 .88) 열분해에서 언급하였듯이 석탄의 활발한 열분해는 400°C 이상에서 일어난다. 석 탄과 수소의 반응으로 alic y cl ic 및 alip h ati c 액 체 산물을 생 성 하 는 반응은 열역학적으로 낮은 온도가 좋다. 그 반면 높은 온도에서는 열분해를 동반하여 기체 및 aroma ti c 의 생성이 찰 이루어진다. 열역 학적 견지에서 보면 석탄의 수소화반응의 최적 액화율은 450°C 에서 얻어진다고 알려져 있다. 고정 충반응기 에 서 고휘 발분 역 청 란을 수소화액 화 (h y drol iq ue fa c ti on) 할 때의 온도의 영향을 그림 2.35 에 도시하였다. 여기서 용매는 높은 온도에서의 타르(t ar) 를 사용하였고 그림에서 보듯이 450°c 이상에서
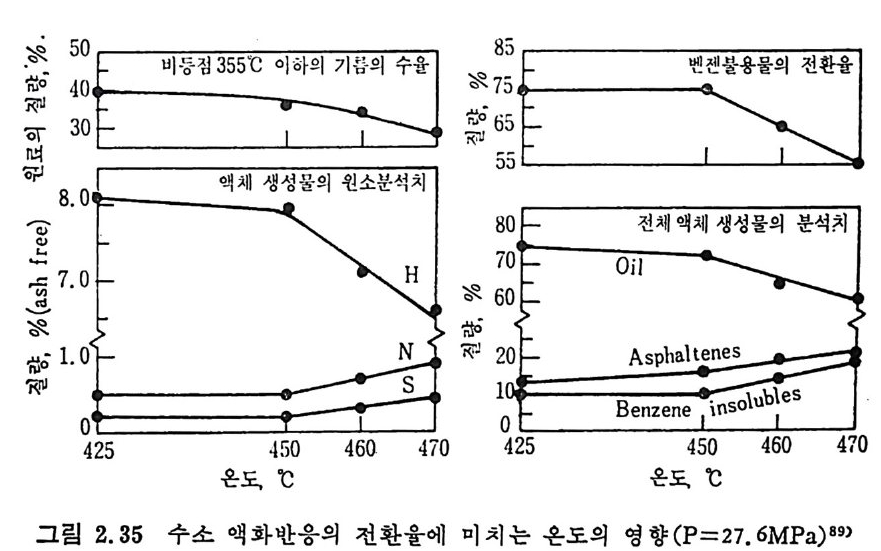 ·5040.0· 857536555
·5040.0· 857536555
는 기름 (o i l) 전환율이 액 체 산물 내 의 H/ C u] 가 증가함에 따라 급격 히 감소한다. 반응압력 의 중가는 직 접 액 화반응울 증진시 키 며 , 코크스 (coke) 생 성 및 탈수소화반응 (deh y dro g ena ti on) 으로부터 의 기 체 생 성 을 저 하시 킨 다. 또한 가스상으로부터의 수소화가 일어난다면 수소가 액체에 녹는 것이 첫단계이며 녹는 정도는 Henr y의 법칙에 따라 수소의 분입이 크면 클수록 많이 녹게 된다. 또한 반응압력은 반응뮬을 중가시킨다. 수소 액화반응에 대한 반웅압력의 영향(그림 2.36) 윤 반옹온도 425° C 조건에서 보면 반응압력 법위가 7~2sMPa 일 때 기품 및 액체생성불 내의 수소함량이 압력 증가에 따라 거의 직선적으로 증가한다. 그러나 밴겐에 녹지 않는 액체의· 양을 근거로 한 전체 전환율은 앙 탁 에 따라 매우 느리게 증가한다. 석탄의 반응 체류시간은 중요한 반응공정변수의 하나이다. 일반적으 로 반응시간은 수시간이 걸려서 벤젠에 용해되는 엑체산물을 생성한 다. 석 탄이 重 asph a lte n es 으로의 전환은 빠르다. 체 류시 간이 길면 as-
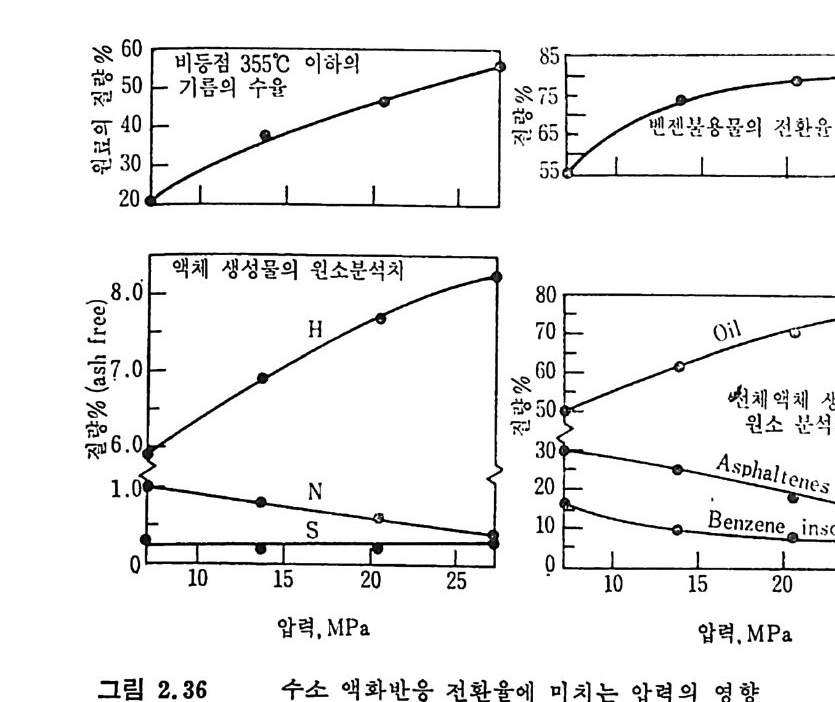 6050403020 85
6050403020 85
p ha lt enes 의 함량을 감소시키나 영분해에 의하여 기름생성량을 감소 시킨다. 체류시간에 따른 액체생성량은 그림 2.34 에 보였으나, 다론 조업변 수에 따라 년화한다. 여러 가지 반응전환율에 대한 반응속도 모델이 제시되었으나 반응경로에 대한 일치된 모델은 없다. 일반적으로 반응 률은 입자의 물리적 분해, 열에 의한 결합의 파열, 재중합 및 석탄의 수소수급 및 수소공급에 의 한 자유라디 칼의 안정 화 등이 반응률을 결 정하게 된다. 석탄스러리의 전환시간이 간 것은 석탄입자의 가열시간 이 길고 석탄을 싸고 있는 액체의 확산 저항이 크므로 열 및 물질전달 의 영향 때문이라고 할 수 있겠다. 그러므로 반응기 내의 열 및 유체 의 흐름조건이 중요한 역 할을 하게 된다 . 액화반응에 촉 매를 첨가하면 생성기름 중에 유황분을 줄이고 경유 분율(lig h t oil fr ac ti ons) 윤 증가시킬 수 있다. 그러므로, 촉매의 역할 은 선맥적으로 석탄을 수소분해 (h y drocrack) 하여야 하고 생성수분 및 가스의 양을 소모함이 없이 질소와유황윤제거하여야한다. 보다좋은 촉매 개 발을 위하여 많은 연구 개 발이 팔요하다고 하겠다. 90) 그러 나 대 개의 경우 촉매가 없이도 반응의 70% 정도가 이루어지며 이는 석탄회 분내의 금속성분들이 촉매역할을 한다고 알려져 있다. 그러나 완전한 변환을 위하여는 촉매가 사용되어야 하며, 이 촉매들의 비활성 및 석 탄 내의 금속성분이 촉매에 되적되는 것과코크스 (coke) 형성으로 촉매 가 해독되는 것이 중요한 문제이다. 석탄액화공정의 중요촉매로사용 되는 금속성분은 Co, Mo, Fe, Zn, Ni 및 Sn 둥이며 효과적인 촉매는 cobalt molyb date 를 alumi na 에 담체 시 킨 것 으로 알려 져 있 다. 여러 석탄 액화반응을 열거하면 다음과 같다 .9 1) a) 수증기를 이용하는 직접 액화반응 3C+2H20(g) ~ 2( 一 CH2 一)(g )+C02 6H ?so o = 67. 9KJ K1soo= 1. 19 X 10-6 이 반응은 홈열반응이므로 고온에서 수행되어야 하며, 팔요한 수증 기 를 공급하기 위하여 충분한 탄소의 연소가 필요하다. b) 수소를 이용한 직접 액화반응 석탄 기화반응에서 생성된 수소와 반응시켜서
—12 C+H2 0(g) .== +21c o2+H2 6H~500=53. 1KJ K1500=14. 7 여기C+서H 2생 一성된 (수-소CH를2 一액) 화반응6.기H~ oo내 =의 — 1탄4. 소 6K와J 반응시킨다. c) Fis c her-Trop sh 액 화공정 반응 H2/C0 비 가 2 인 합성 가스를 기 화반응기 로부터 생 성 시 킨다. 3C+4H20(g) ~ 2C0+4H2+C02 6H~soo=374. 9KJ K1soo=7. 7 X 107 이 합성가스를 철촉매 위에서 반응시키면 수증기를 배출한다. co+2H2 一 (-CH2-) (g) +H20(g) 6moo = -I49. 7KJ d) Meth a nol 을 경 과한 간접 액 화반응 상기한 합성가스 (H2/C0=2) 를 ZnO 촉매 위에서 반응시켜서 meth a· nol 을 생성한다 . co+2H2 —+ CH30H 페 00= 一 101.9K J 이 meth a nol 을 Zeoli te ZSM-5 촉매 위 에 서 반응시 켜 gas oli ne 과 olefi ns , aromati cs 및 수증기 를 생 성 한다. CH30H(g) 一 (-CH 리(g )+H20( g) 6H~oo=-473KJ e) Meth ane 과 CO2 생 성 반응 기화반응기로부터의 H2/CO 비가 작은 합성가스를 생성한다 . C+H20(g) +:==! co+H2 6H?soo=134. 4KJ K1soo=594 이 C합O성+H가2스 一를 철 —담2 지C촉H4매+ — 위2 에CO서2 반응시켜 CH4 과 CO2 를 생성한다. 1 1 6H~oo=-129. 2KJ
f) Meth a ne 과 수증기 생 성 반응 합성 가스의 H2/C0 비 를 3 으로 증가시 켜 서 철 또는 Cu-Zn 촉매 위 에 서 가스전환반응시 킨다. co+H20 .= C02+H2 6HYoo=-37. 9KJ K100=8. 8 합성가스를 N i촉매 위에서 반응시켜서 CH4 를 생성한다. C0+3H2 一 CH 라 120 6HYoo= —220 . 4KJ 상기한 직접 및 간접 석탄 액화반응방법들율 표 2.7 에 보여주고 있 다. 상기한 반웅들은 이상적인 반응을 가정한 것이다.
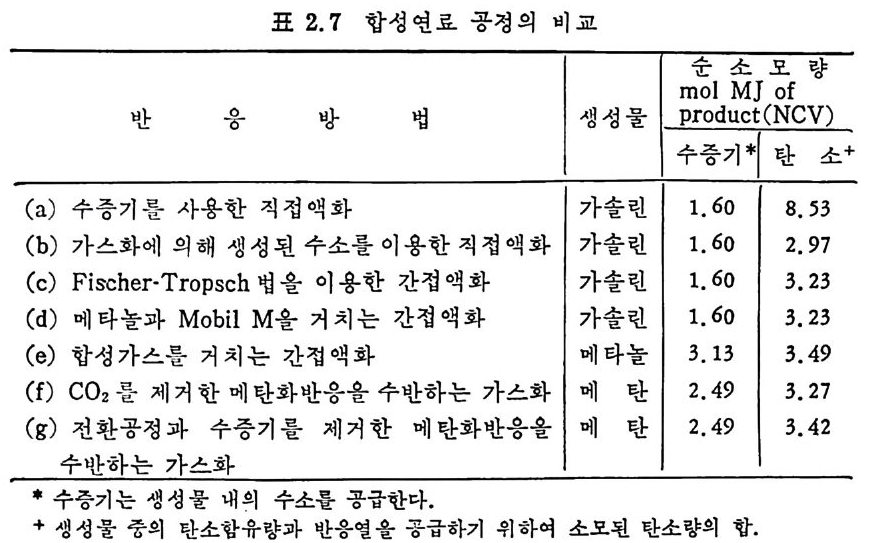 표 2.7 합성연료 공정의 비교
표 2.7 합성연료 공정의 비교
더 자세한 석탄액화반응및 공정은뒤의 석탄액화장에서 다루겠다. 참고문헌 1) Lowr y, H. H. , Chem,str y of Coal Uti liza tr 'on , Vol. I, Joh n Wi el ey 2) &Fi s Sc ohnesr,, FN.. Yan. d, 1S8c7h,r a1d9e4r5, . H. , z. Ang e w. Chem. , 33, 172 (1920) . 3) Hawk, C. 0. , Schlesin g e r, M. D. and Hi te.s h ue, R. W. , U. S. Bur.
Mi ne s Rep . , 6264 (1963) . 4) Lois o n, R. and Chauvin , R. , Clt em . Ind. , 91, 3, 269 (19 64). 5) Eddin g e r , R. T. , Fried man, L. D. and Rau, E. , Fuel, 45, 245 (1966) . 6) Kim ber, G. M. and Gray, M. D. , Comb11st. Flame, 11, 360 (19 67) . 7) S'.l s: ,, A. , Chem, Eng , Prog . , 70, 72 (1974). 8) Anth o ny, D. B. and Howard, J. B. , AIC!z E J. , 22, 625 (19 76) . 9) Goodman, J. B. , Gomez, S. and P:i rr y, V. F. and Lande rs , W. S. , U. S. Bur. Mi ne s Bull. , 530 (1953) . 10) GReopo. d mInavne, stJ,. B5.3 ,8 3G o(m 19e5z8, ) .S . , and Parry, V. F. , U. S. Bur. Mi ne s 11) Grego ry, D. R. and Lit tle jo h n, R. F. , BC URA Mon. Bull. , 29, 173 (1965). 12) Fit ze rald, D. , and van Krevelen, D. W. , Fuel, 38, 17 (19 57) . 13) Dutt a, S. , We n, C. Y. and Belt, R. J. , Ind. Eng . Chem . Proces s Des. Dev. , 16, 20 (19 77) . 14) Wen, C. Y. , Bail ie, R. C. , Lin , C. Y. , and O'Brie n , W. S. , Coal Gasif icat i on Advances ill Chemi st r y ser, 131, ACS, Washin g ton , D. C. (1974) . 15) Jun tg e n, H. , and van Heek, K. H. , Fuel, 41, 103 (19 68) . 16) Camp b? II, J. H. and Ste p h ens, D. R. , Prep ri n t s , Am. Clt em . Soc. , Di v. Fuel Chem. , 21, 94 (1976) . 17) Fried man, L. S. , Rau, E. , and Eddin g er , R. T. , 47, 149 (1968). 18) Badzio c h, S. , and Hawksley, P. B. W. , Ind. Eng . Che m . Process Des Dev. , 9, 52 (1970) . 19) Ments e r, M. , O'Donnell, H. J. and Ergu n , S. , Prep ri n ts Am. Chem. Soc. Di v. Fuel Chem. , 14, 94 (1970) . 20) Ments e r, M. , O'Donnell, H. J. , Ergu n, S. and Frie d el, R. A. , Coal Gasif icat i on Advances in Chemi st r y Ser. , 131, l (1974) . 21) Solomon, P. R. , The Evoluti on of Polluta n ts durin g tlte Rap id Devolati lizat i on of Coal, Rep. NSF/RA-770422, NTIS PB. ?78 496 /AS(1977). 22) Pit t, G. J. , Fuel, 41, 267 (1962) . 23) Solomon, P. R. , The Evoluti on of Polluta n ts durin g the Rap id Devolati lizat i on of Coal, Rep. R76-95258S- 2, Unit ed Technnl.og ies Research Cente r , East Hartfo rd , Conn. , 1977. 24) Rau, E. and Seg lin, L. , Fuel, 43, 147 (1964) . 25) Grang e r, A. F. , and Ladner, W. R. , Fuel, 49, 17 (1970) .
26) Durmosch, R. , Islam, K. V. and Oleret, H. , Che m . Ing . Te cl z. 46, 961 (1974) . 27) Toda, Y. and Toy o da, S. , Ft tel , 51, 199 (1972) . 28) Gan, H. , Nandi, S. P. and Walker, Jr. , P. L. , Fuel, 51, 272 (19 72) . 29) Ng , S. H. , Fung , D. P. C. and S. D. Ki m , Fuel, 63, 1564 (1984). 30) Pate l , R. L. , Nandi, S. P. and Walker, Jr. , P. L. , Fuel, 51 , 47 (19 72) . 31) , Be rg e r, J. , Sie m i en i e w ska, T and Tomkow, K. , Fuel, 55, 9 (19 76) . 32) Dutt a, S. and Wen, C. Y. , Ind. Eng . Chem, Process Des, Dev, 16, 31 (19 77) . 33) Walke r, Jr. , P. L. , Sc ien ti fic Problems of Coal Ut iliza ti on •, Proc. of a Conf. at W . Vi rg ini a , Uni v. , May, 237, 1977. 34) Fung , D. P. C. and S. D. Ki m , Ft te l, 62, 1337 (1983) . 35) Fe ld kir c hner, H. L. and Li nd en, H. R. , Ind. Eng . Chem. Process Des. Dev. , 2, 153 (19 63) . 36) Gorin g , G. E. , Curr:m , G. P. , Tarbox, R. P. , and Gorin , E. , Ind. Eng . Chem., 44, 105 1 (19 52) . 37) Gorin g , G. E. , Curran, G. P. , Zie l k e, C. W. , and Gorin , E. , Ind. E;z g_ Chem. , 45, 2586 (19 53) . 38) Hi et e s h ue, R. W . , Anderson, R. B. , and Schlesin g e r, M. D. , Ind. Eng . Chem. , 49, 2008 (19 57) . 39) Hi tes hue, R. W. , Anderson, R. B. , and Schlesin g e r, M. D. , Ind. Eng . Chem. , 52, 577 (19 60) . 40) Bir c h, T. J. , Hall, K. R. and Urie , R. W. , ]. Inst, Fuel, 33, 422 (1960) . 41) Py rc i oc h, E. J. and Lind en, H. R. , Ind. Eng , Chem. , 52, 290 (19 60) . 42) Moseley, F. and Patt er son, D. J. , Inst. Fuel, 38, 13 (1965). 43) Moseley, F. and Patt er son, D. J. , Inst. Fuzl, 40, 523 (1967) . 44) Coate s , R. L. , Che!l , C. L. and Pop ~. B. J. , Co!l l Gasif icat i on , Adv. in Chemi st r y Sr1r. , 131, ACS, Washin g ton , D. C. , 92, 1974. 45) Joh nson, J. L. , Prep, Am. Chem Soc. •, Di v. Fuel Chem. , 20, 61, 145 (1975) . 46) Anth o ny , D. B. , Howard, J. B. , Hot tel, H. C. and Meis s ner, H. P. , Proc, of the 15 th Sy m p . on Combusti on, Combusti on Inst. , Pi ttsb urgh , Pa, 1303, 1974.
47) Joh nson, J. L. , Coal Gasif icat i on Adv. in Chemi st r y Ser, 131, ACS, Washig ton , D. C. , 145, 1974. 48) Sq ui r e s, A. M. , Graff , R. A. and Dobner, S. , Scz 'en ce, 189, 793 (1975). 49) Graff , R. A. , Dobner, S. and Sq u ir e s, A. M. , Fuel, 55, 113 (1976) . 50) Zie l ke, C. W. and Gorin , E. , Ind. Eng , Chem. , 47, 820 (19 55) . 51) Walker, P. L. Jr. , Rusin k o, F. Jr. , and Austi n, L. G. Adv. in Cata lys i s , Vol. 11, Academi c Press, N. Y. , 133 (1959) . 52) Turkdog an , E. T. , Koump , V. , Vi nt e r s, J. , V.· a nd Perzak, T. E, , Carbon, 6, 467 (1968) . 53) Turkdog a n, E. T. and Vi nt e r s, J. V. , Carlz!:l n , 7, 101 (1969) . 54) Fuchs, W. E. and Yavorsky , P. M. , Prep ri n ts , Am. C/z e m. Soc. Di v. Fuel C/z e m. , 20, 115 (1975) . 55) Wen, C. Y. and Wu, C. N. T. , AIC/z E ]. , 22, 1012 (1976) . 56) Yoshid a , K. , and Kunii , D. , J. Chem. Eng . Jap an , 2, 170 (19 69). 57) Ergu n, S. , J. Phys , Chem. , 60, 480 (19 56) . 58) Austi n, L. G. and Walker, P. L. , Jr. , AIChE J. , 9, 303 (1963) . 59) Walker, P. L. , Jr. , Shelef, M. and Anderson, R. A. , Clzem. Phy s, Caron, 4, 287 (1968) . 60) Fie l d, M. A. , Combust. Flame, 13, 237 (1969) . 61) Serge ant, G. D. and Smi th, I. W. , Fuel, 52, 52 (1973) . 62) Harmar, R. J. , Smi th, I. W . , and Ty le r, R. J. , Combust, Flame, 21, 153 (1973) . 63) Smi th, I. W . and Ty le r, R. J. , Combust, Sc i, Technol, 9, 87 (1974). 64) Caram, H. S. and Amunson, N. R. , Ind. Eng , Chem. Fund. , 16, 171 (1977). 65) Avedesia n , M. M. and David s on, J. F. , Trans. Inst. C/z e m. Bng , , 51, 121 (1973). 66) Lewi s, J. B. , Connor, P. and Murdoch, R. , Carbon, 2, 311 (1964) . 67) Armi g!io, H. , and Duval, X. , J. Chem, Phy s. , 64, 916 (1967) . 68) Ty le r, R. J. , Woute r hood, M. J. and Mulcahy , M. F. R. , Carbon, 14, 271 (1976) . 69) Wen, C. Y. and Huebler, J. , Ind. Eng , Chem. Process Des. Dev. , 4, 142, 147 (1965) . 70) Smi th, I. W. and Ty le r, R. J. , Combust. Sci, Technol. , 9, 87 (1974) . 71) Dutt a, S. and Wen, C. Y. , Ind. Eng . Chem. Process Des. Dev. ,
16, 31 (19 77) . 72) Jen kin s , R. G. , Nandi, S. P. and Walker, P. L. , Jr. , Fuel, 52, 288 (19 73) . 73) Fung , D. P. C. and Ki m , S. D. , Fuel, 63, 1197 (1984). 74) Joh nsto n e, H. F. , Chen, C. Y. and Scott , D. S. , Ind. Eng . Chem. , 44, 1564, (1952) . 75) Klei, H. E. , Sahagi an , J. , and Sundstr o m, D. W. , Ind. Eng . Chem. Process Des. Dev. , 14, 470, (19 75) . 76) Wen, C. Y. , and Dut ta, S. , Chapt , 2, Coal Conversio n Technolog y, Wen and Lee Eds. , Addis o n-Wesley Pub, Co. Inc. , Mass, U. S. A. , 1979. 77) Jol ly, L. J. , and Pohl, A. , J. , Inst. Fuel, 26, 33 (1953.) . 78) Gadsb y , J. , Hins he lw ood, C. W. and Sy k es , K. W. , Proc. R. Soc. (Lo ndon) , A 187, 129 (19 46) . 79) Ergu n, S. and Menste r , M. , Chem. Phy s. Carbon, 1, 203 (1965J. 80) Jen sen, G. A. , /11d. Chem. Eng . Process Des. Dev. , 14, 314 (1975). 81) Ergu n, S. and Ments ~ r. M. , U. S. Bur. Mi ne s Bull. , 598, 1962. 82) Monte t , G. L. and My e rs, G. E. , Carbon, 6, 627 (1968) . 83) Kaye mbe, N. and Pulsif ier , A. H. , F11el, 55, 211 (1976) . 84) Fung , D. P. C. and Kim , S. D. , F11el, 62, 1337 (1983) . 85) Wen, C. Y. , Ind. Eng . Chem. , 60, 34 (1968) . 86) Wen, C. Y. and Wang , S. C. , Ind. Eng . Chem. , 62, 30 (1970) . 87) Wen, C. Y. , Mori, S. , Gray, J. A. and Yavorsky , P. M. , A/ChE Sy m p . Ser, 73(161), 86 (1977). 88) Neave!, R. C. , Fuel, 56, 237 (1976) . 89) Akhta r , S. , Frie d man, S. , and Hites hue, R. W. , Am. Chem. Soc. , Di v. Fz,el Chem. Prip r in ts , 14(4), I, 27 (1970). 90) Cusumano, J. A. , Dalla Bett a, R. A. and Levy, R. B. , Cata l ys i s in Coal Converst'o n , Academi c Press, New York (1978). 91) Wei, J. , Ind. Eng . Chem. Process Des. Dev. , 20, 294 (1981).
제 3 장 석탄연소 3.1 서론 석탄을 가열 연료로 사용하기 시작한 것은 12 세기 영국에서라고 알 려져 있지만, 난방이나 수증기 생산을 위하여 석탄을 본격적으로 활 용한 것은 18 세기의 산업혁명 때부터라고 할 수 있겠다. 그러나 현 재 사용되고 있는 석탄 보일러의 활용은 19 세기 말부터 시작되었다 고 할 수 있다. 현존하는 석탄 연소로에 대한 지식은 아직도 과학적인 이론의 정립 보다 실험에 의한 과거의 경험에 더 근거를 두고 있다. 그러므로 연 소과정에 대한 이해는 어느 정도 정립된 반면 주어전 연소계의 목성 을 수학적 모델로 예측할 수 있는 지식은 아직 정립된단계는아니다. 연소로의 전체 성능을 간단한 이론과 과거의 경험식을 근거로 하여 예측할 수는 있으나 경험식에 대한 충분한 이해를 가지고 연소기술 이나 장치설계를 하여야만 한다. 이러한 관접에서 연구가 이루어지고 있으나 아직도 실제 조업조건 및 장치에 대한 관접에서의 이해가 최 선책으로 알려져 있다. 그러므로 현존하는 연소로의 소개와 이의 기 본개념 및 특성, 이제까지 실험결과들의 지식을 소개하고자 한다. 3.2 연소의 화학적 반응 석탄의 연소는 충분한 공기를 공급할 때 증기상의 산화 및 석탄으
로부터 배출되는 휘발분의 접화에 따른 좌의 접화에 의한 연소로써 일어난다. 여기서 휘발분의 양은 불꽃의 안정도와 좌 (char) 를 접화시 키는 온도에 영향을 미치게 된다. 석탄/초 P 의 연소는 좌 표면의 활성거접 (acti ve s it es) 에 산소의 화학 흡착 (chem i sor pti on) 에 의하여 일어나며 표면의 산화물은 co 몰 생성 하고 이것이 다시 산화되어서 CO2 가 된다. 이 C 아는 배기가스로 배 출되든가 좌표면에 다시 환원되어서 CO 를 생성한다. 그러므로 전체 적인 반응은 다음 4 가지로 대별할 수 있다. c+ 느2 02 一 CO co+~20 2 一 CO2 C02+C 一 2CO C+02 一 CO2 동시 에 탄소가 아닌 원소의 반응은 다음과 같다• S+02 一 S02 HH22+0 +--2C4 -— 0 2 一,CO H+2H02 CO+H20 一 C02+H2 좌의 탄소반응물은 좌 표면의 산소 양에 의존하므로 전체 연소울 R 은 다음과 같이 표시할 수 있다. R=KSP。 여기서 K. 와 P 。는 반응속도와 입자표면의 산소분압이다. 또한 반응 속도를 온도의 함수로써 Arrehniu s 식 을 사용하면 K,=Ae-E/RT 여기서 A 와 E 는 빈도계수(fr e gu enc y fa c t or) 와 활성화 에너지이다. 그러나 상기식 중의 Po 는 좌 표면에 산소가 수송되는 것의 영향을 받으므로 연소계의 분압으로부터 직접 결정할 수 없으며 반응물 R 은 C02+C-+2CO 와 co++o2-+C02 반응률에 따타 결정되므로 결국 반 옹경계 영역에서의 CO/CO2 비에 따라 민감하게 영향을 받는다.
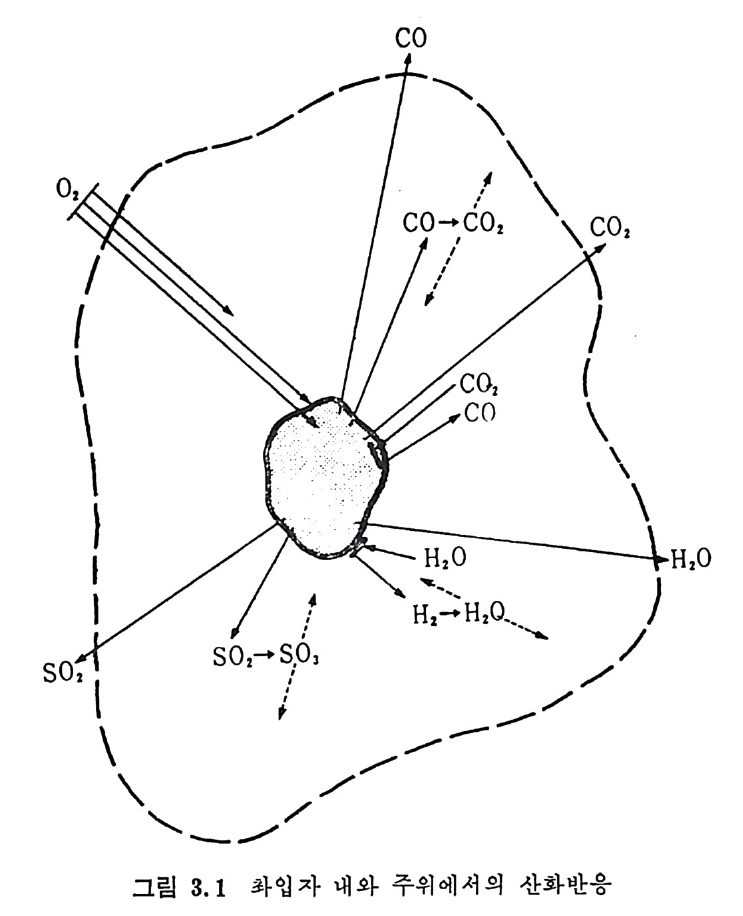 /. / --/ ---co ,' ‘.c \ \ \ c。 2
/. / --/ ---co ,' ‘.c \ \ \ c。 2
결국 반응률 R 만으로는 연소매카니즘을충분히 이해할 수 없고 반 웅속도, K, 를 결정하여 평가함으로써 더 자세한 정보를 얻을 수 있 겠다 . 좌 표면으로 접근하는 산소를 질소나 연소산물 (CO,CO2,H20 등)이 경계영역에서 방해한다고 가정하면 그림 3.I 처럼 좌의 산화반응을 도 시할 수 있다. 또한 좌는 다공성물질이므로 산소가 기공으로 침두하 여서 기공 내부 연소가 제한적으로 일어난다고 할 수도 있다. 이러한 관접에서 연소반응속도를 확산 (d iffu s i on) 이 조철하는 흡착/탈착 과정 으로 이론적 반응률을 표현할 수 있으나 실제의 연소울은 탄소의 배열, 밀도, 반응온도 및 산소의 분압에 영향을 받는다•1)
3.3 연소방법 석탄의 연소방법은 격자(g ra t e) 위에 석탄을· 장입하여 연소하는 고 정충과 유동충 연소로 및 분란을 비말동반 (en t ra i ned) 시켜서 연소시 키는 세 가지 형태로 대벨할 수 있다. 연소방법을 표 3.1 에, 이에 따른 이용방법을 표 3.2 에 기술하였다. 또한 상기한 세 가지 힝태 의 고체입자와 가스의 접촉 혼합목성운 그립 3.2 에 도시하였다. !. 그정충(fi xed bed) 에서는 입자와 기체는 향유 ( coun t er fl ow) 로 흐 르며 입자의 체류시간은 p lu g흐몸에 근사한 흐몸이므로 쉽게 예측 할수있다.
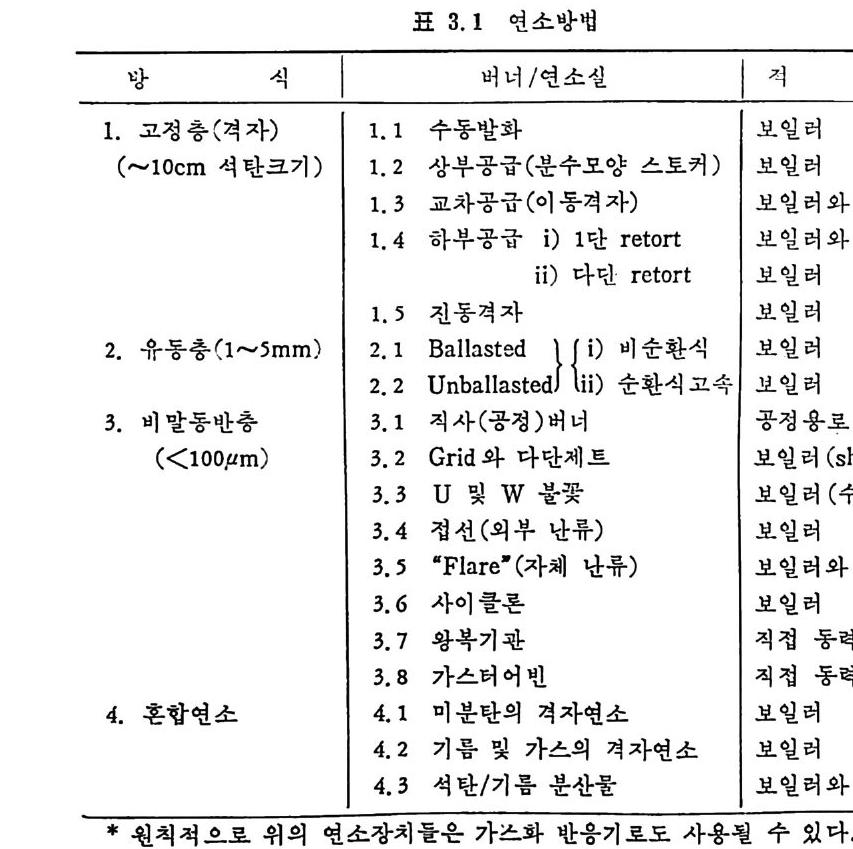 표 3.1 연소방법
표 3.1 연소방법
 표 3.2 석탄 여소방법의 적용
표 3.2 석탄 여소방법의 적용
2. 유동충(fl u i d i zed bed) 은 입자흐름이 찰 혼합된 계라고 가정할 수 있으나 입자의 체류시간 결정은 간단하지 않다. 3. 비말동반충 (en t ra i ned bed) 은 입자가 기체와 같이 흐른다. 입자 흐름은 逆混合 (backm i x) 흐름과 p lu g흐름 영역을 가진다. 그러므로. 역혼합 영역에서의 입자 체류시간 결정은 쉽지 않다. 그러나 전체 입 자 흐름은 기체흐름과 병류로 흐른다고 할 수 있다. 표 3.I 와 그림 3.2 에서 보듯이 입자크기가 각 장치에 따라 번하게 된다 . 죽 고정충 연소로에서는 1~1 .5 cm 크기 입자가 최적 크기이며 최대 크기는 5cm 까지가 허용되나 보통의 연소 조건에서는 5~7.5cm 크기에서 작은 분말석탄까지 사용되고 있다 . 유동충 연소로에서의 입자크기는 유등화 속도에 함수이므로 보다 제한된 크기에서 조업되며, 보동 1~5mm 크기가 사용된다. 그러나 유 동총 내의 격렬한 혼합에 의한 입자의 마모로 1mm 이하의 입자들이 존재하게 된다. 이 작은 입자들은 주어전 열량을 얻기 위한 기체 유 속에서 쉽게 비말동반되어서 연소로를 나가므로 연소효울이 저하된 다. 비말동반충에서의 입자의 크기논 평군 입자경이 10~25µ 으르 그
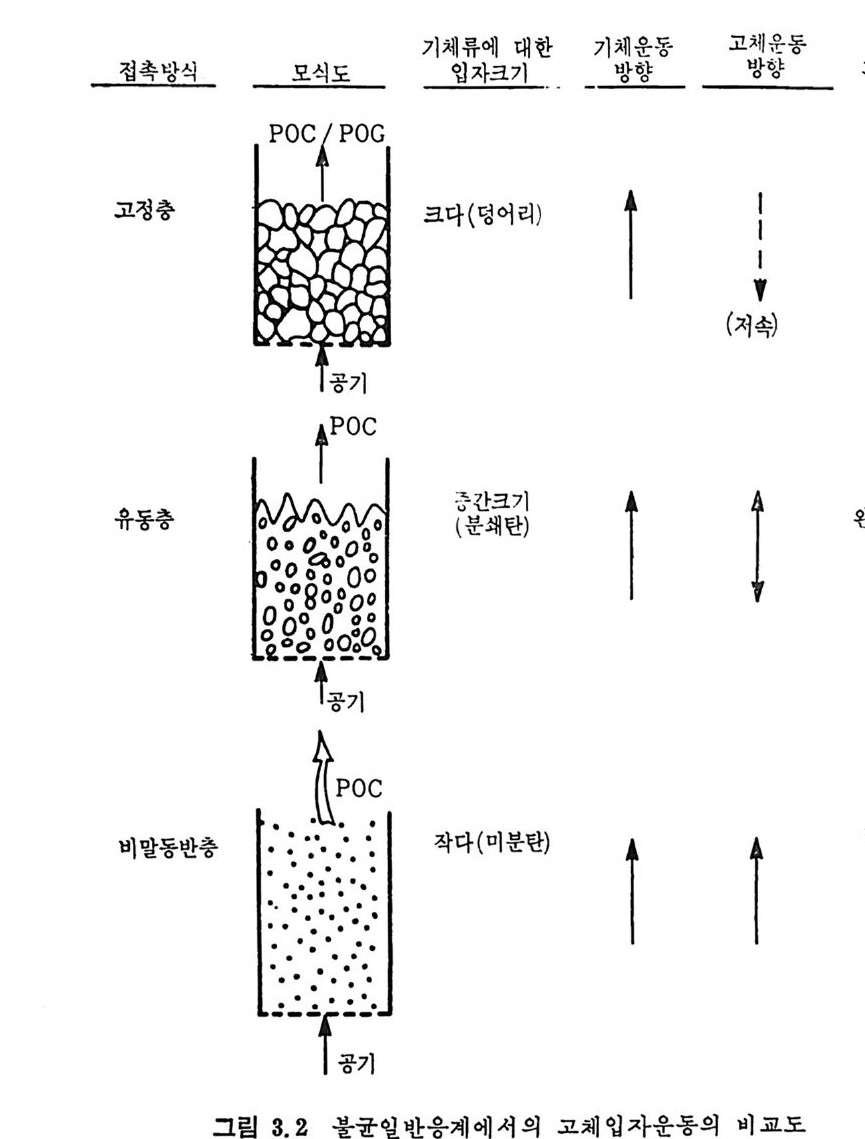 기 체류 에 대한 기체운동 고 체운동
기 체류 에 대한 기체운동 고 체운동
크기 분포는 1~100µ 법위에 있으므로 보통 log -n o rmal 분포에 따 른다. 현재 석탄의 주사용원은 보일러에서 석탄연소이며 분란(p ulver i zed coal) 으로서의 주된 사용은 발전용 보일러에서 사용되고 있다. 보일
러에서의 분란연소는 1920 년대부터 성공적으로 이용되고 있으며 보일 러 크기가 대략 350,ooolbs t eam/hr 까지 활용되고 있으며 이 크기 가 기 계 적 스토커 (s t oker) 의 한계 크기 이 다 . 근래의 석탄연소 기술개발은 석탄과 기름을 혼합 (coal-o i l mi xt u re) 하여서 기름의 소모를 줄이는 기술과 유동충 연소로의 개발이 활발하 게 이루어지고 있다. 특히 유동충 연소로에 석회석 (li mes t one) 윤 넣 어서 석탄의 유황분에서 나오는 S02 를 제거할 수 있으므로 공해문제 믈 해결함과 아울러 유동충의 높은 열전달 독성을 활용할 수 있기 때 문이다. 3.4 연소장치 자세한 연소장치 에 관련된 자료는 발간된 책 3 - 5) 과 자료집 6) 을 참조하 기 바라며 여기에서는 간략하계 장치의 개념에 대해 소개하고자한다 .7) 그림 3. 3 에 tu be 또는 shell 형 의 수평 , sin g le -retu rn 형 의 보일러 를 보여주고 있다. 연소열은 주위의 원통형 shell 에 채워전 물에 전달된 다. 전열관들은 일정 간격으로 배치하여서 대류열전달 부분을 만들거
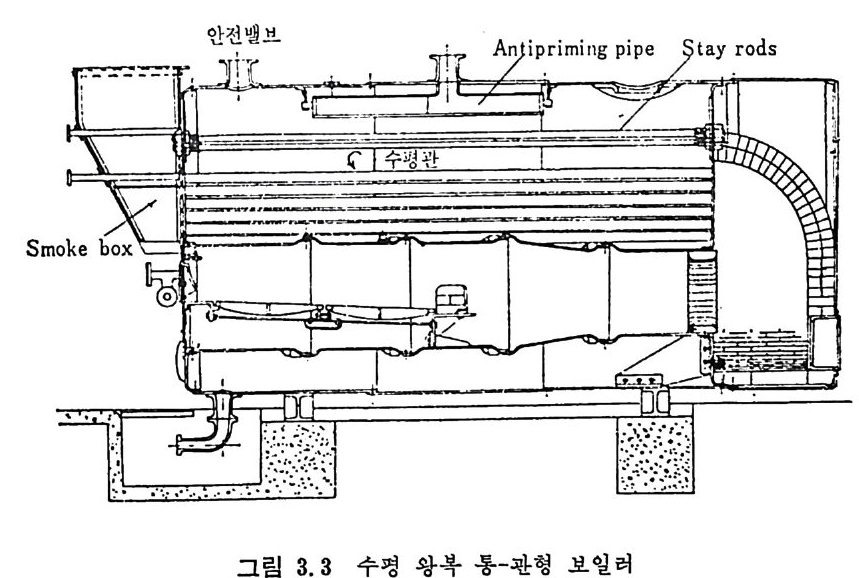 그립 3.3 수평 왕복 통-관형 보일러
그립 3.3 수평 왕복 통-관형 보일러
 -.글三三二 _ ·. -_--스 - . _ D• . -··· ! I
-.글三三二 _ ·. -_--스 - . _ D• . -··· ! I
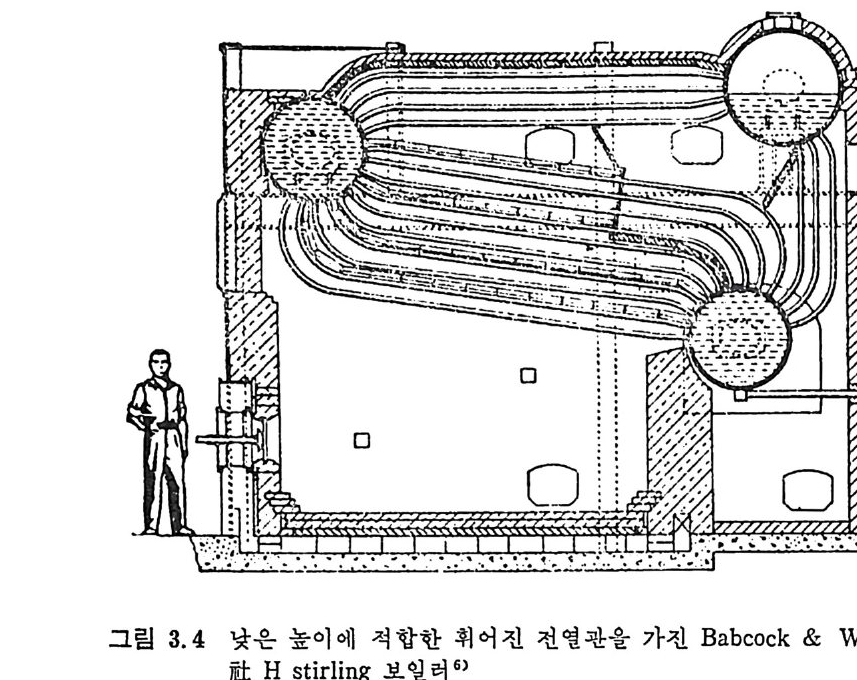
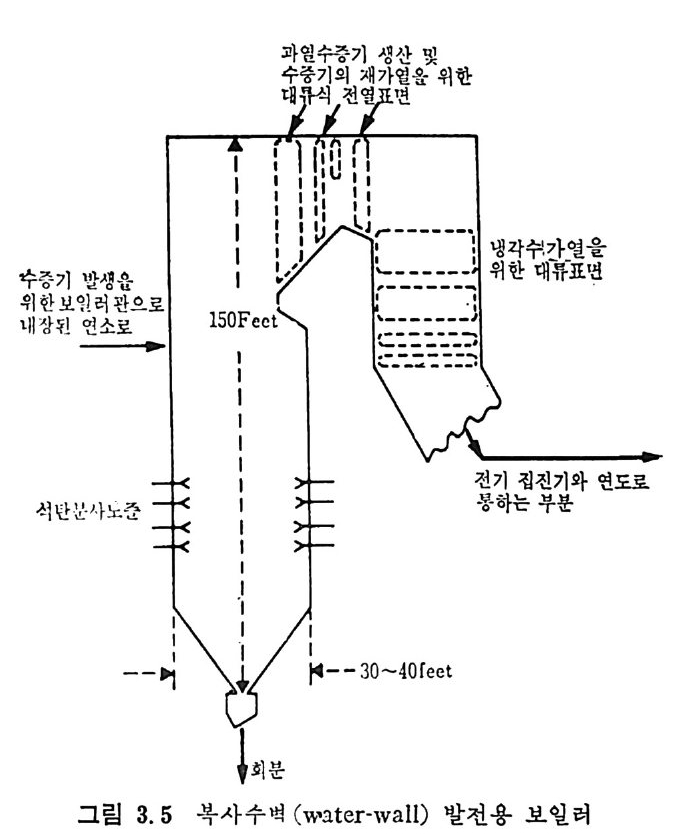
나간격없이 배치하여 연소로의 벽으로만들기도한다. 이를 wa t er t ube 또는 wate r -wall 보일러 라고 한다. 전열관을 휘어서 제작한 보일러를 그림 3.4 에 보여주고 있다. 일반 적으로 석탄을 연소시키기 위하여는 기계적 격자를 사용하며 휘어전 전열관은 주연소 chamber 위에 위치하고 연소 chamber 는 내화벽돌 이 나 wate r -wall 로 구성 되 어 져 있 다• 최대형의 보일러나 용광로(fu rnace) 는 분란을 연소시키는 복사 수벽 (radia n t- w ate r -wall) 보일러 로 복사/대 류 (radia n t/ c onvecti ve ) sup e rheate r s 로 구성 되 어 쳐 있 다. 일반적 인 설계 의 차이 가 각각의 장 치에 따라 있으나 그 대표적인 장치는 그림 3.5 에서 보듯이 수직형의 상자형태로 높이가 대략 50m 이고, 사각형의 한 변이 IO~I3m 까지의 대형 연소로도 있다. 석탄연소 버너는 연소로 밑에서부터 1/3 되는 높이에서 석탄을 주입시켜서 연소시킨다.
 :i1I H!II I1U ii u~ : ’' r :’ ’- - 기 냉각'r'·가열을
:i1I H!II I1U ii u~ : ’' r :’ ’- - 기 냉각'r'·가열을
3. 4.1 격자발화 (Gra t e firin g ) 석 탄을 다공판(p er fo ra t ed pla te ) 에 쌓고 밑 에 서 공기 를 불어 넣으면 서 연소시키는 연소장치로 그림 3.6 에 보여주고 있다. 이 석탄 고정충에서의 반응은 주로 열분해(py rol y s i s) 와 건조 (dr y i n g)가 일어나며 동시에 가스화반응이 일어난다 . 여기서 생성된 가 스는 충위에서 주입되는 공기 제트와 다시 반응한다. 연소로에서 석탄의 주입, 연소및 회분제거가주요설계변수이다. 그림 3.6 에서 보듯이 석탄은 상부·하부 또는옆에서 주입할수있다. 상부에 서 석 탄을 주입 하는 (top fee d or overfe e d) spr e ader sto ker 를 그림 3.7 에 보여주고 있다. 찰 설계된 분란 주입장치는 석탄을 군일하게 연소충에 주입하거나 회분을 제거하기 위하여 한쪽에 쌓이게 주입할 수 있다. 고정 gr ate
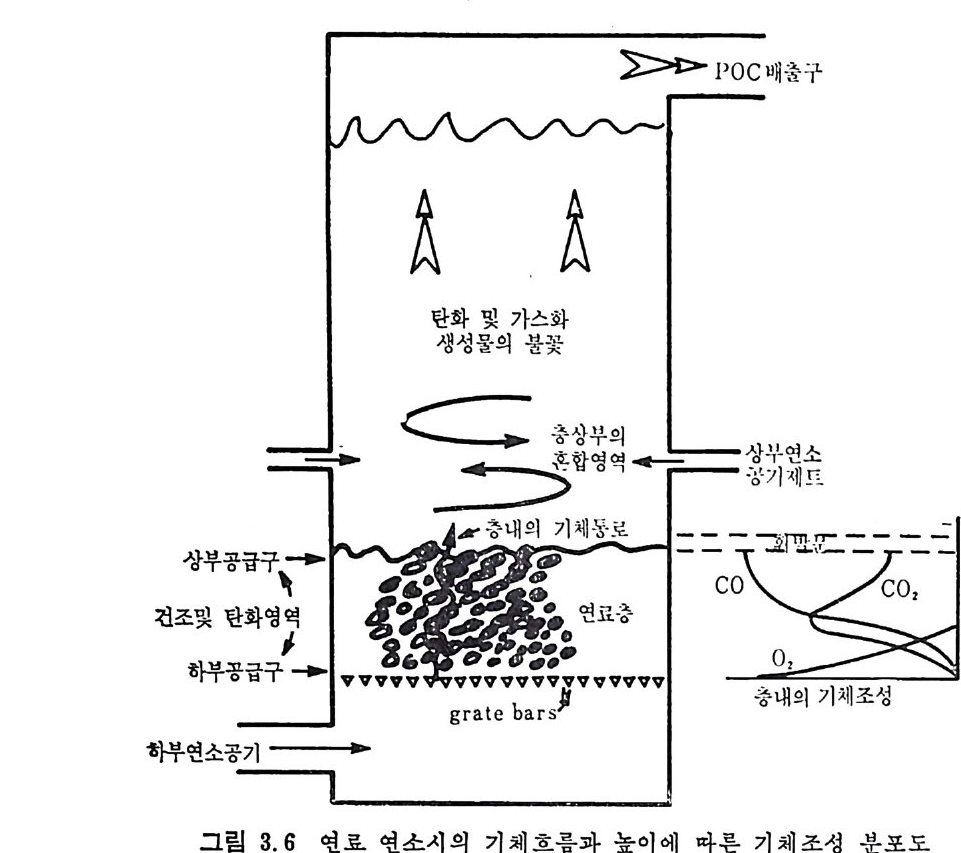 ~POC 배출구
~POC 배출구
논 재를 refu s e pit에 떨어지게 하기 위하여 전동시켜 주어야 한다. a) 이 동 격 자 (Travelin g Grate ) 석탄올 ho pp er 로부터 연속 gra t e 에 공급하여 연소실을 가로지르 게 이동시키면서 연소시켜 회분은 뒤쪽 벽에 있는 회분 pit에 운반하 논 장치이다(그립 3. 8 ). 그립에서 보듯이 석탄충이 얇으므로 공기흐름의 저항이 작아서 군 일한 공기분포를위하여 공기공급통 (w i ndbox) 울 여러 개 만들어서 공 급한다. 또한 오른쪽에서 공급되는 석탄이 빨리 가열되어야 하고 왼 쪽의 회분 배출쪽의 급속냉각을 방지하여야 완전연소를 얻을 수 있으 므로 arch 형의 내화벽을 만들어서 연소열을 반사시켜서 주입석탄을 가열하게 설계되어 있다.
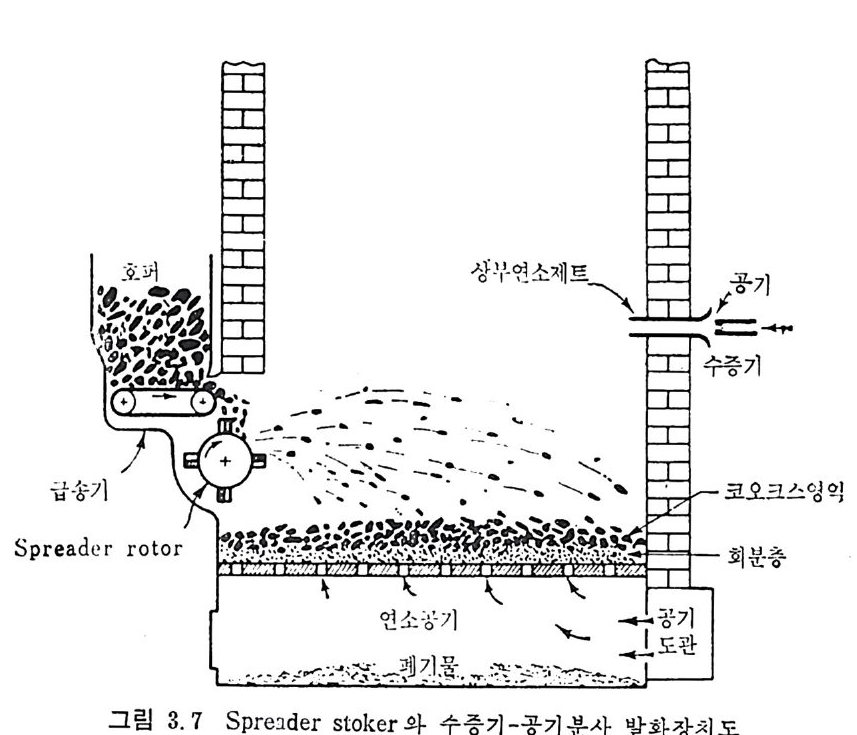 =一
=一
b) 충상부 연소 (overbed combusti on ) 상기 한 이 동 gr ate 나 sto k ers 분산의 석 탄충으로부터 의 기 체 산물은 휘발분과 기화반응물 (CO, H2) 의 혼합물이다. 이것은 충 위에서 공군 되 는 overfi re 공기 와 다시 반응한다. 만일 충상부의 기 체 의 혼합이 좋지 못하면 완전연소가 안되어서 연기가 발생한다. 그러므로 장치가 간 점화 영역과 뒤쪽의 arch 를 만들어서 기체가 전열관을 통하는 즘 은 口 經울 통과하계 함으로써 기 체 의 혼합울 증진시키 거 나 overfi re 공기 주입 의 크기 및 각도를 조철하여 서 혼합을 증가시 킨다. 혹은 over fi re 공기에 중기를 첨가하여서 jet 침두시켜서 연소혼합울 증전 시킨다. c) 하부 공급 스토커 (underfe e d sto k er) 불완전연소에 의한 연기를 제거하기 위하여 석탄을 밑에서 공급하 여 반웅 경계면을 하향시키고 휘발분은 상향시키는 장치가 필요하 다. 그림 3.9 에 석탄 공급구가 하나인 s t oker 를 보여주고 있다. 그립 에서 보듯이 석탄을 하부 중앙에서 위로 공급하여서 충상부에서 흘러
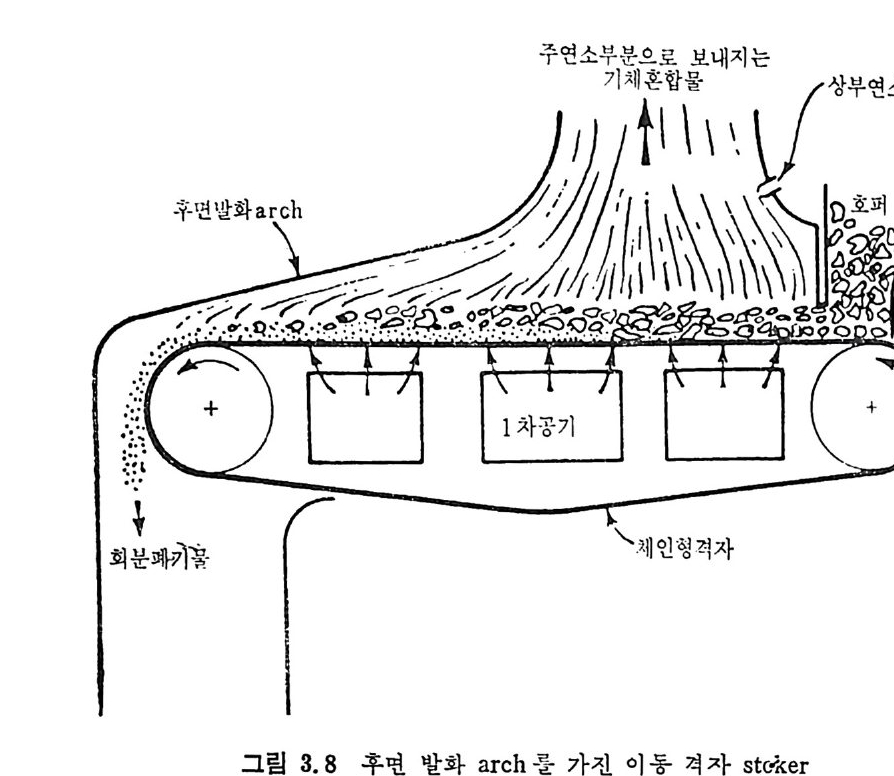 후
후
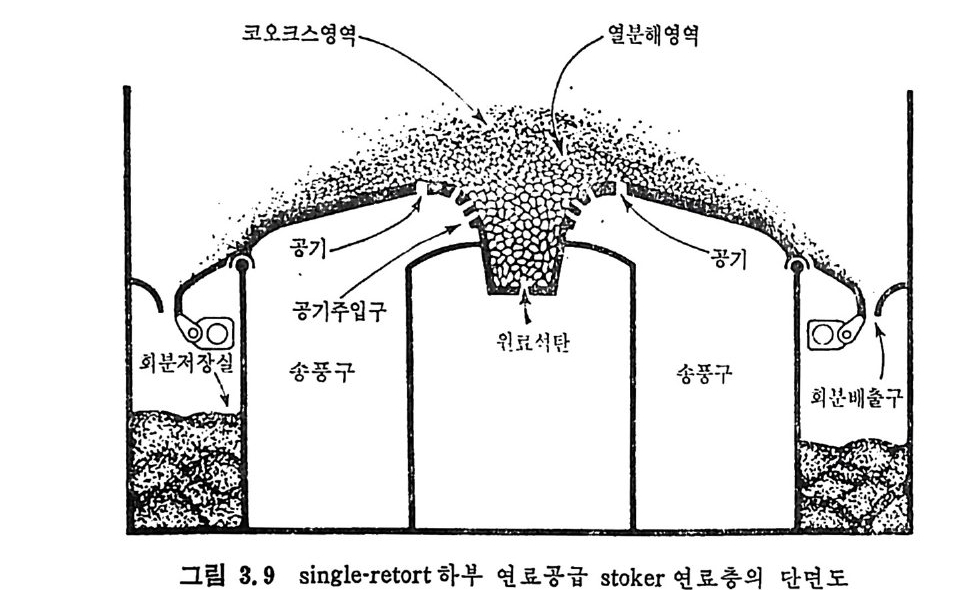 코 오 크罰 켜“역구 주티\,畵輝t 열분工해영]l역 ’.. . f . 、‘ .. ., , .`같|'4 '_
코 오 크罰 켜“역구 주티\,畵輝t 열분工해영]l역 ’.. . f . 、‘ .. ., , .`같|'4 '_
내려서 좌우의 회분 p. t 로 흘 러 들 어간다. 공기는 양쪽의 공기공급통 ( w i ndbox) 으로부터 공기 주입구(t u y eres) 를 통하여 공급한다. 충 위 는 연소와 가스화 영역이 촌재하고 그 밑에 증류영역, 그 아래에 건 조영역이 존재한다. 석탄을 계속 공급하면 연소석탄충의 높이는 석탄 이 자연적으로 흘러 내 리 는 repo s e 각도까지 증가하다가 흘러 서 회분 pit 로 들 어 가게 된다. 그러 므로 단일 공급구문 갖는 장치 의 gr ate 크기 는 자연 rep os e 각도 (natu ral ang le of rep o se) 가 결 정 하게 된다. 만일 gra te 의 크 기가 너무 넓으면 충의 중앙이 너무 깊게 되어서 연소를 조절할 수 없게 된다. 그러나 보일러 장치의 크기를 증가하기 위하여서는 두
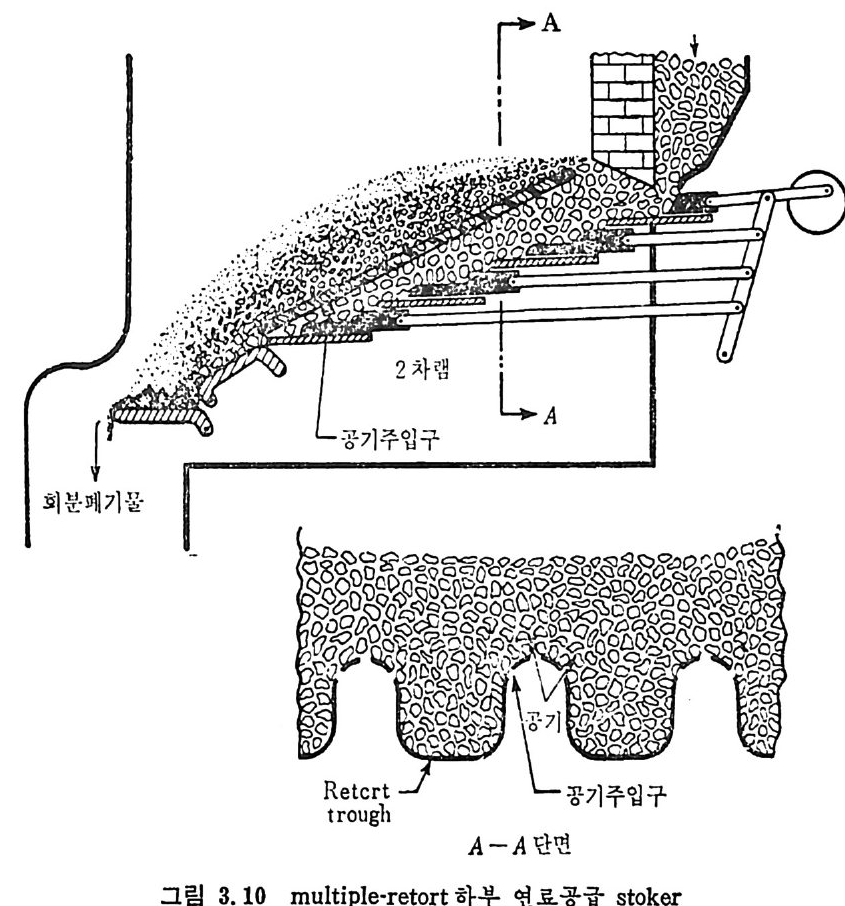 -., 口 노 A
-., 口 노 A
가지 방법이 있다. 죽 아동 gra t e 를 사용하여 전 g ra t e 의 충 두께를 군일하게 하는 방법과, 여러 개의 석탄 공급구(그림 3.10) 를 사용하 여 경사지게 만들어서 회분을 왼족 하단으로 흘러내리게 하는 장치이 다. 3. 4. 2 유동총 연 소로 (Fluid i z e d Bed Combusto r ) 유동충에서 석탄입자를 연소시키기 위하여는 입자크기가 비교적 작 아서 주입공기 양으로 유동상태에 있어야 한다. 유동충 내에서의 입 자의 혼합은 매우 격렬하기 때문에 완전혼합 (back m i xed) 이라고 할 수있다. 초기에 석탄을 유동충에 장입한 후 공기유속을 증가시키면 입자 들 이 유동을 시작하는 유속을 초기 유동화속도라고 한다. 이 유속보다 큰 유속을 주입하면 충내에 기포가 생성된다. 이 기포는 기체 분산판 에서 생성되어서 상승하면서 기포간의 합체에 의하여 그 크기가 중가 한다. 기포가 상승할 때 기포 밑에는 wake 가 형성되어 기포와 같이 상승하면서 입자들을 위로 운반하는 역할을 하므로 수직방향의 입자 혼합을 유발한다. 이 기포가 고체충의 표면에서 깨어지면서 동반한 입자들을 위로 분산시킨다. 이의 반작용으로 입자들은 충내로 역혼 합을 일으키게 된다. 이러한 흐름 현상이 수평방향의 균일성을 제공 한다. 만일 고체충 높이가 유동충의 칙경보다 크면 기포가 유속중가에 따 라 증가하여 충의 칙경과 거의 같아지게 되며 이때를 슬러깅 (slug - ging) 상태 라고 한다. 충 표면의 기포가 깨어지면서 fr eeboard 에 분산시킨 입자들은 TDH (tra nspo rt dis e ng a g ing heig h t) 내 에 서 다시 떨어 져 서 층으로 되 돌 아오고 주어진 기체유속이 작아전 입자들의 종말속도보다 크면 이 입자들은 유동충 밖으로 비말동반 (en t ra i ned) 되어 나가게 된다. 이 비 말동반되어 나가는 입자를 줄이기 위하여서 열전달관을 fr eeboard 에 설치 하거나 baff le 을 설치한다. 또한 비 말동반되 어 나가는 입 자는 cy c lone 을 설치 하여 다시 유동충으로 주입 한다. 그러 나 유속이 입 자의 종말속도보다 크면 모든 입자는 유동충을 떠나게 되므로 보통 유동충의 최대 속도는 주어전 입자의 종말속도가 된다. 기체유속이
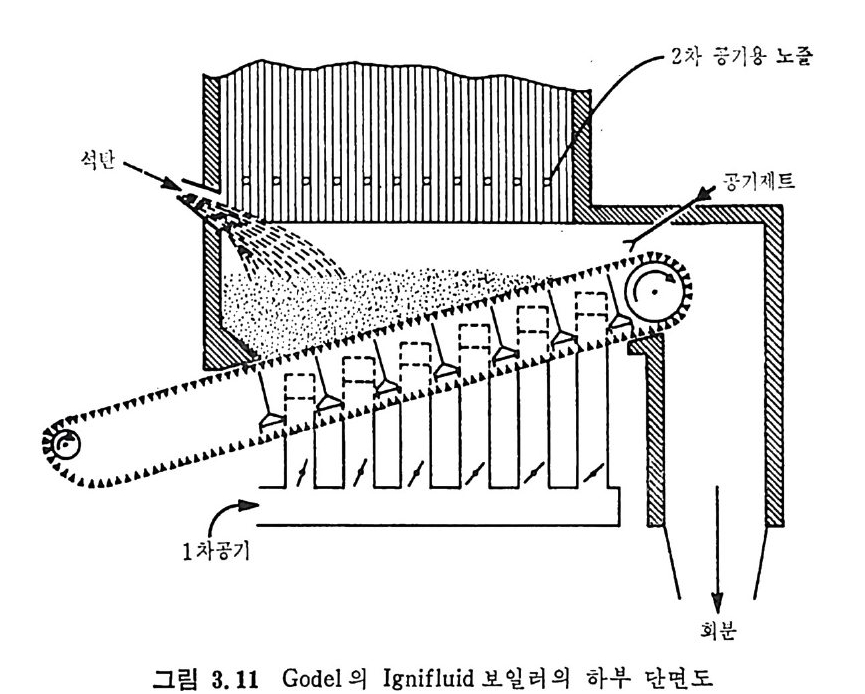 2 차 긍가용 노줄
2 차 긍가용 노줄
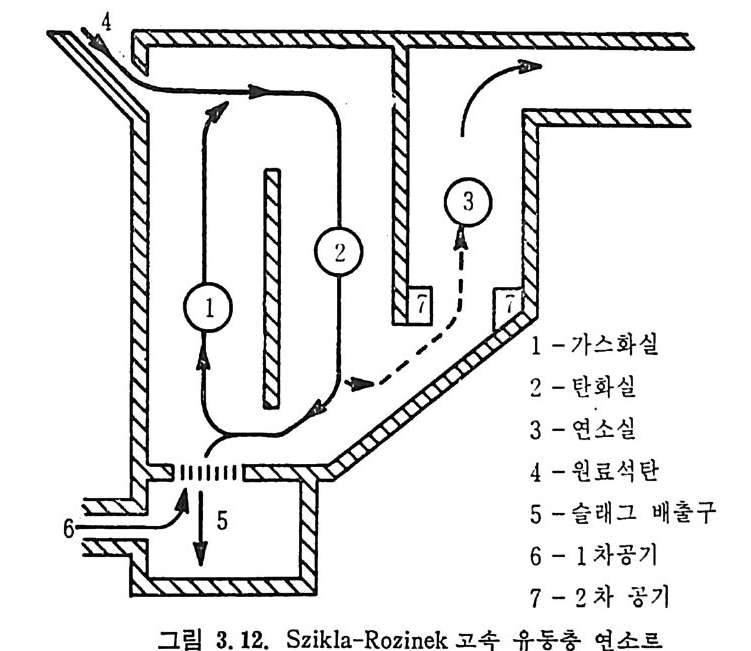 2- 탄화실
2- 탄화실
비교적 낮은 영역에시는 기포의 크기가 충 높이에 따라 비교적 군일 한 기포충이 되지만 유속을 더욱더 증가시키면 slug ging 상대듄 지 나기 때문에 기포가 께어져서 기체와 고체의 접촉이 원활한 난류층 (tur bulent bed) 상대 가 된다 . 여 기 서 유속을 더 중가시 키 게 되 면 입 자는 기체에 의해 수송되어져서 충 밖으로 냐가게 되는 고속유동중 (fast bed) 상태 가 된다. 8- 1 0) 석탄은 유동충 밑부분의 분산판 (d i s t r i bu t or p la t e) 에 지지된 다. 예 외 로서 연속 gr ate 순환 분산판에 석 탄을 주입 하는 Ign if l ui d 보일 러 와 Szik l a-R ozin e !( 연소로는 관형 의 slott ed gra te 를 순환시 키 는 분산 판을 가전 유등충 연소로가 있다. 각각의 장치도를 그립 3.11 과 3.12 에 도시하였다 . 유동충 연소로 설계도 다른 연소계와 마찬가지로 중은 열 전달, 회 분 제거, 연료 주입 등의 설계목적을 가전다. 유동층 연소로에서는 상기 목적을 열전달률을 쉽게 조철하고 회분 제거방법을 변화시켜 충 높이로 온도를 조절하여 달성할 수 있다. 즉 온도 조절을 위하여 유 등충 내에 열전달관을 설치하거나 모래와 같은 비활성 (ine rts ) 물질을 열매체로 사용한다. a) 비 활성 매 체 가 없 는 유동충 (Unballaste d bed) 유동충에 석탄입자만을 연소시키면 충 상부의 복사를 제외하면 거 의 단열조건에서 조업한다고 할 수 있다. 만일 유동충이 얇아서 완전 연소가 되 면 충 온도는 최 대 단열 온도인 2000°c 부근까지 될 수 있 다. 그러나 유동충의 높이가 증가하면 g ra ti n g연소에서 상부에서는 홉열 가스화반응이 일어나서 유동충 입자를 냉각시킨다. 이 국부적 냉각 은 입자의 수직 혼합에 의하여서 그 밑부분을 냉각시키게 된다. 그러 므로 충 높이 를 초기 에 조철하거 나 조업 중에 조절하여 온도를 조철 할 수 있다. 그 예로서 lgn if luid 공정에서도 최저 온도는 IOOOC 정 도이다. 석탄 회분은 보통 1000~2000°c 사이에서 용융되므로 주어진 석탄에 대한 회분의 용융온도를 충 높이를 조철하여서 최적온도를 결 정 하여 야 한다. 회 분 제 거 는 회분의 응결 (agg lo merati on ) 현상에 의 촌 한다. 죽 용융회분이 서로 불어서 크기가 커지게 된다. l g n ifl u i d 연 소로(그림 3.11) 에서는 용융된 회분의 크기가 커쳐서 거의 유동화되 지 않고 이동 g ra t e 위에 놓여서 상부로 이동되어 회분 pit로 나가
게 된다. 또한 이 응결현상은 Szik l a-R ozin e k 연소로(그림 3.12) 에서 도 활용된 다. 연소입자들은 반응실에서 나와서 탈휘발실 (devola ti li za tion chamber) 에 서 기 체 와 분리 되 어 서 다시 가스화실 (ga sif ica ti on chamber) 로 들어 간다. Slag 입 자들은 응결 (agg lo merate ) 되 어 가스화 실에 머물게 되고 그 크기가 커져서 gr ate 위에 놓이게 되면 원동형 의 g ra t e 를 통하여 회분을 제거하게 된다. 상기한 연소로는 gr ate 위 에서 석탄을 가스화한 후 이차 공기를 주입하여 최종 연소시켜서 열 을 얻는 장치이다. b) 비 활성 매 체 가 있 는 유동충 (Ballaste d bed) 비교 적 낮은 온도에서 조업되는 유등충 연소로는 열전달계수가 높 은 장접을 활용하 여야 하겠다. 그 예로서 보통 고온의 기체가 열전달 관에 열을 전달하는 보일러의 열전달 계수는 5~25W/m2K 범위인 반면 유동충에서의 열전달계수는 250~sooW/m2K 정도로 매우 높다. 그러므로 이 높은 열전달을 활용 하기 위하여서는 모든 연소는 충내 에서 일어나고 열전달관은 연소충 내에 설치하여야 하겠다. 그러나 순수석탄만을 가스화 없이 연소시킬 수 있는 충 높이는 매우 낮기 때문에 열전달관을 설치할 충 두께가 되지 못한다. 또한 온도가 매우 높으므로 회분이 용융이 일어나서 분산판의 공기주입을 막는다. 그러 므로 실제 조업에서는 비활성 물질로 모래나 석탄의 회분을열전달매 체로 첨가하여 열전달관에 열울 전달시킨다. 또한 열전달 매체로의 모래나 회분의 양온 상대적으로 매우 커서 연소물질인 석탄의 양은 전체 체적에 1~4% 정도에 지나지 않는다. 비활성 물질의 첨가로 인한 연소총의 두께를 열전달관의 표면적과 연유시켜서 유동충의 온도를 조전할 수 있다. 온도의 조철은 회분 이 용융되지 않는 조건이어야 하며 이 온도는 대략 1000°c 이하이 어야 하지만 석탄 회분에 따라 그 이하에서 용융되기도 한다. 그러 므로 보통의 조업온도는 800~900°C 범위이며 이 온도 범위에서 석 탄은 매우 빠르게 연소된다. 이 조업온도는 비교적 낮은 온도이므로 NOx 의 배출도 매우 적다. c) 유동충 연소로의 설계 상업 적 유동충 연소로는 많지 않으나 pilo t pla nt 크기 의 유동충 연 소로에 대한 연구는 활발히 진행중이다• 그 대표적인 유동충 연소로
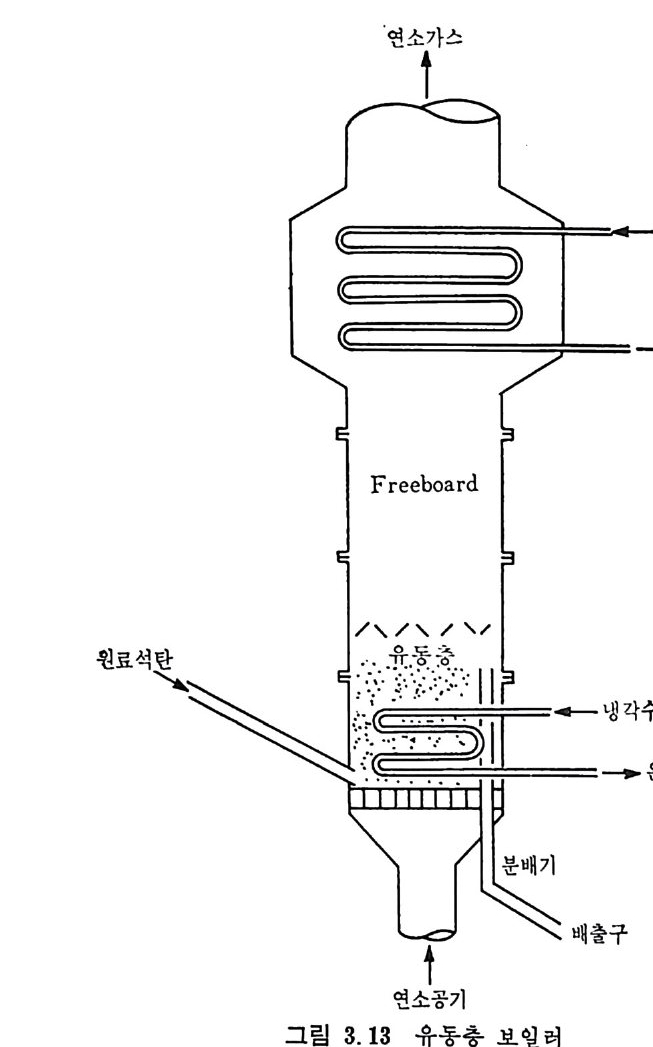 ~-·냉각수
~-·냉각수
를 그림 3.13 에 보여주고 있다. 그림에서 보듯이 석탄과 불활성 열매체가 분산판 위에 장입되어 있 고 분산판을 통하여 전연소충에 군일하게 공기를 주입한다. 석탄의 주입은 그립에서 보듯이 분산판 위에 주입하거나 또는 유동충 위에 주입 하기 도 한다· 보통 석 탄을 screw · fee der 로 hop pe r 에 서 나오는 석 탄을 주입 하며 설계 에 따라 screw-fe e der 와 공기 압 수송울 가미 한 주입도 사용한다. 연소로 내의 열은 연전달관에 물을 동과시켜서 회
수한다. 이 열전달관은 유동충 벽에 물을 몽과시키거나, 수직 또는 수평관을 유동충 내에 삽입하여서 열을 회수한다. 연구결과에 따라 차이는 있으나 수직관이 더 중 은 열전달계수를 갖는다고 발표되었지 만 더 많은 실험결과가 팔요한 상황이다. 또한 유동충 상부인 free - board 에서 고온가스로부터 열을 회수하기 위하여 fr ee - board 에 전 열고J:울 설치하고 회분을 재거하기 위하여 배출관을 설치한다. 이 배 출관을 동 하여서 석회석 (S02 흡수)과 회 분율 제거하여 유동층 높이를 조절하고 사용된 석회석은 다시 재생시키거나 폐기한다. 이제까지의 결과는 유동중의 연소충 높이는 높은 것보다 낮은 경우가 더 좋은 것 으로 (H / D < 1.o) 알려져 있다 .11) 3. 4. 3 비 말동반 발화계 (Entr a in e d Fir i n g Sy st e m ) 분단을 연소공기에 비말등반시켜서 발화하기 위하여서는 석탄의 입
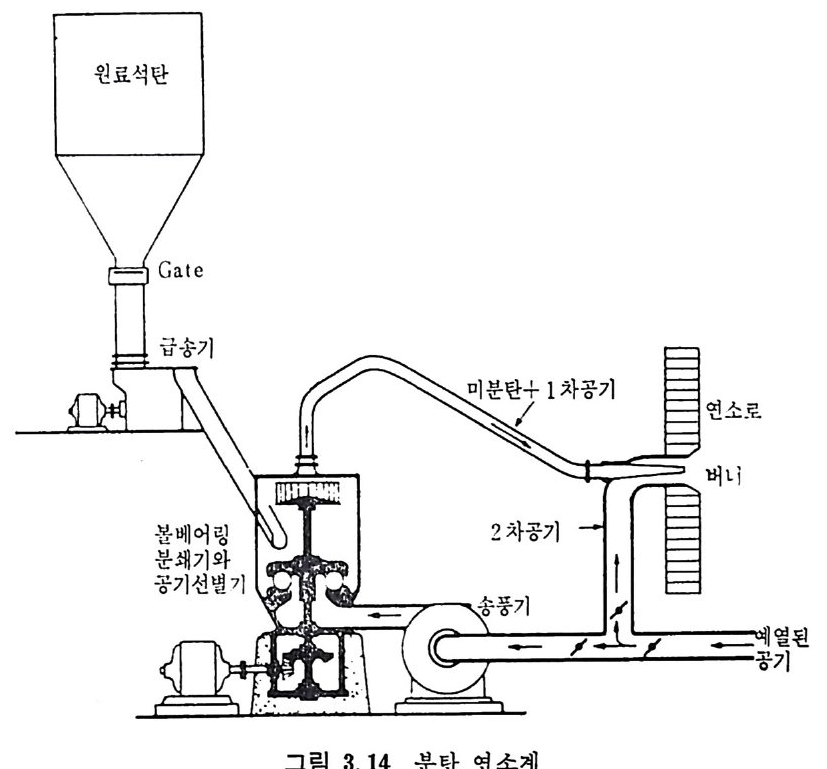 연소로
연소로
자크기가 100µm 보다 작아야 하고 비말동반되는 관의 선속도가 20m /sec 이상이어야 한다. 보통 석탄을 수송하는 공기와 별도로 연소공 기를 주입한다(그립 3.14). 그림에서 보듯이 이중관의 원환의 중십에 분란을 수송하는 공기와 분란이 주입되고 외관에 연소공기를 주입한 다. 이 러 한 설계 를 str a ig h t shot 형 상이 라 한다. 여기서 원료석탄은 b i n 에서 나와 fe ed 에서 일정량 주입되어 분 쇄된 후, 공기 분리기에서 분리되어 공기에 의해 수송되어서 fur nace 에 주입된다. 또한 이차 공기는 별도의 송풍기로부터 주입된다.
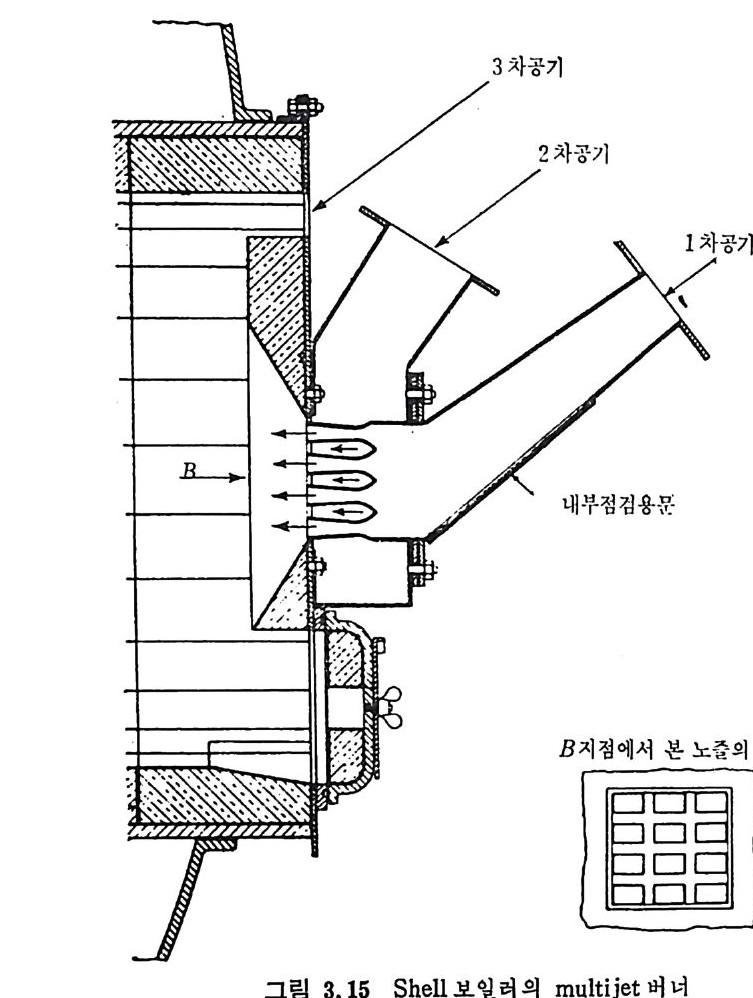 3 차공기
3 차공기
a) 통-관형 발화 보일 러 (Shell and fire tub e boil e rs) 발화 보일러는 길고 즘 은 직선 불꽃은 적합하지 못하다. 이제까지 의 개발 결과 최적의 것은 g r i d 와 mul tij e t버너로 알려져 있다. 그림 3. 15 에 서 보듯이 작은 크기 의 str a ig h t shot 버 너 들의 행 렬 (matr i x ) 이 주요 요소이다. 죽 불꽃의 길이를 크게 증가시키지 않고 두께를 중가 시킬 수 있다는 접이다. 이 버너 설계에 있어서 주의하여야 할 접은 버 너 block 에 서 나가는 불 꽃 흐름의 난류(t urbulence) 를 최 소화하여 야 한다는 접 이 다 . 또한 석 탄-공기 흐름을 개 개 의 흐름으로 nozzle 에 서 분리시켜서 이차 공기와 갇 혼합하게 성계하는 접이다 .12-13) b) 불 꽃 버 너 (flar e burner)
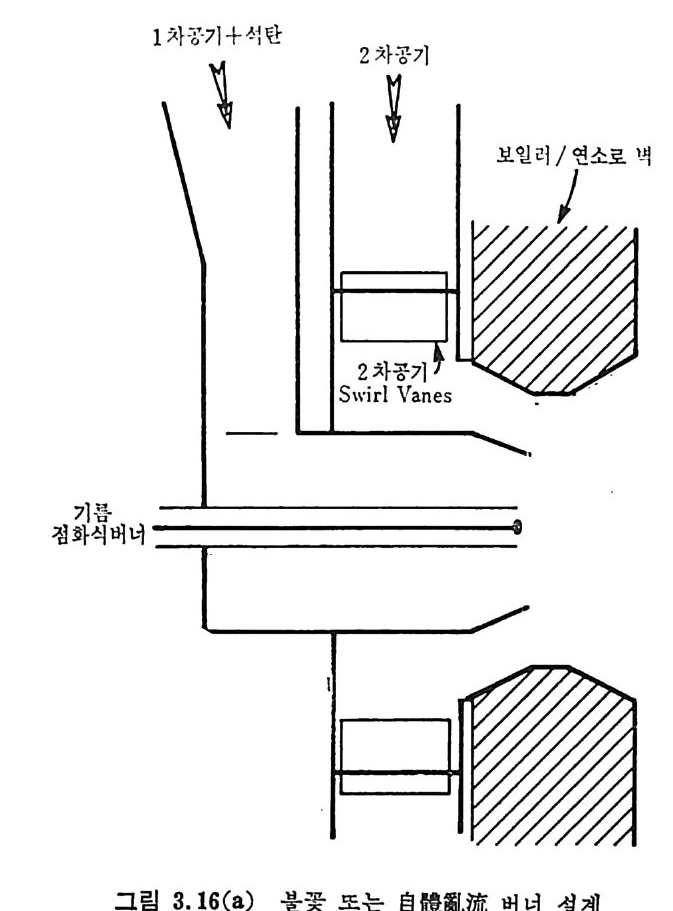 1 차공 기\ + 석탄 2 1^ l'M공7· UV
1 차공 기\ + 석탄 2 1^ l'M공7· UV
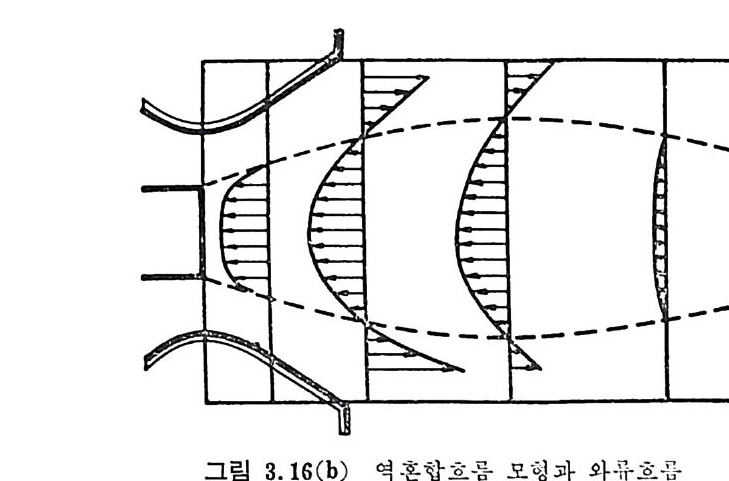 --
--
초기 의 str a ig h t- s hot 버 너 의 개 량형 이 flar e 또는 self- t u rbulati ng 버 너라고 명명된 것이다. 그 대표적인 장치도를 그립 3.16(a) 에 도시하 였 다. 기 본 설계 는 str a ig h t- s hot 버 너 와 같으나 이 차 공기 가 원환의 의 부에서 주입될 때 소용돌이를 만들 수 있게끔 날개를 설치하여서 두 꺼운 불꽃을 만들게 설계 한 것으로 소용돌이 (swi rl ) 버 너 라고도 부른 다. 죽 불꽃이 회전되게 하기 위하여 버너의 구멍을 적철히 조철해서 생성된불꽃이 버너 바로앞공간에 안정된 불꽃 영역 또는불 꽃球 를 형성하게 하여야 한다. 블꽃의 안정도는 불꽃의 회전에 의한 공기 의 역혼합 (backm i x) 흐름에 의하여 완전연소 영 역의 기체가 버너 쪽 으로 되돌아음으로써 발화에 필요한 80~90% 열을 공급하는 것으로 인지할 수 있다(그림 3. 16(b)). 불꽃의 구형은 완전혼합으로 간주한다. 큰 보일러에는 8~16 개 이 상의 이러한 버너가 설치된다. 보통 전체의 2/3 는 버너 부근의 불꽃 구에서 연소되고 나머지 1/3 의 연소는 보일러를 통과하면서 일어난다 고 생각된다. c) 접선기울음 버너 큰 보일러를 버너로서 활용히는· 하나의 시도는 제트흐름을보일러에 주입하여 보일러 중앙에서 혼합시켜 불꽃球를 만들기 위해 보일러 밑에 서부터 1/3 되는 위치에 버너를 설치한다. 실제 연소장치는 tan g e nti al corner fi red 보일러라고 부르며 그 장치도를 그림 3.17 에서 보여주고
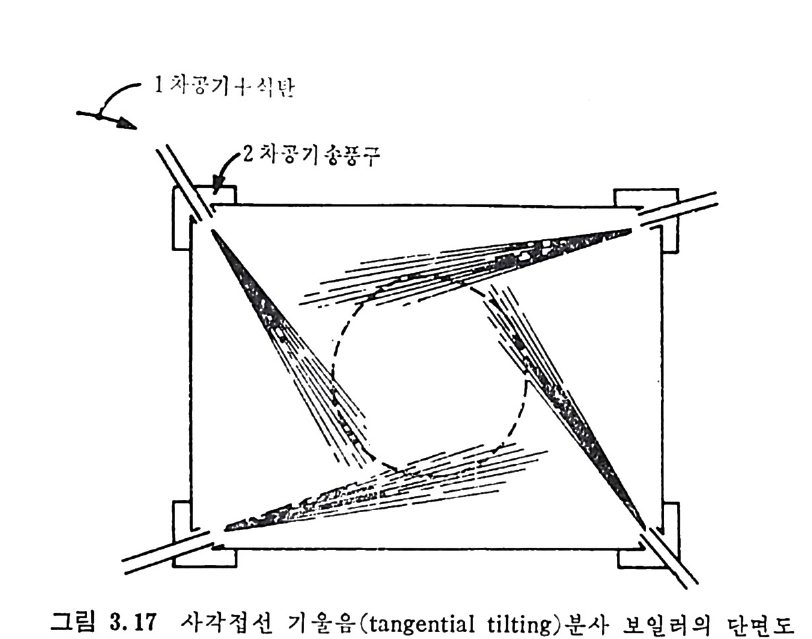 -L: 1 치공 기--l , 21 단
-L: 1 치공 기--l , 21 단
있다. 사각 연소로에서 각 모 퉁 이에 3~5 개의 버너를 높이가 다르게 설치 하 여 연소로 중앙을 향하여 분사발화시 켜 서 環形의 불꽃을 연소로 중 앙에 생기게 한다. 각 버 너 群 은 sin g le -shot 버 너 를 쌓아서 만든 형 태 로 사각형 의 일차 공기-석탄 주입관과 이차 공기관이 둘러싸안 형태이다. 일차 공기-석 탄 주입관 끝은 IO~30 도 각도 범위에서 움직일 수 있게 되어 있다. 죽 불 꽃 을 움직이게끔 설계하여 불꽃 球를 안정화시키며 불꽃을 상하 로 이동시켜서 과열을 조철한다 . d) 사이 크론 버 너 (cy c lone burner) 대형 발전용 보일러의 버너는 이제까지의 버너 설계와 달리 그림 3.18 에서 보듯이 사이크론 버너를 보통 복사열 보일러 중간 밀부분에 부착한장치이다 . 여기서는석탄을분쇄시키거나분말로만들지는않는 다 . 분쇄 된 석 탄과 공기 를 일단계 버 너 관에 공급하여 서 tan g e nti al 하게 설치 된 사이 크론으로 공급된다. 이차 공기 는 tan g e nti al 방향으로 주 입하여 회전시킨다. 그러므로 석탄-공기 혼합물이 사이크론 속에서 회전되면서 분쇄석탄이 원심력에 의하여 벽에 부딪치게 된다. 연소가 매우 찰 일어나므로 불꽃의 온도가 높아서 회분은 용융된다.
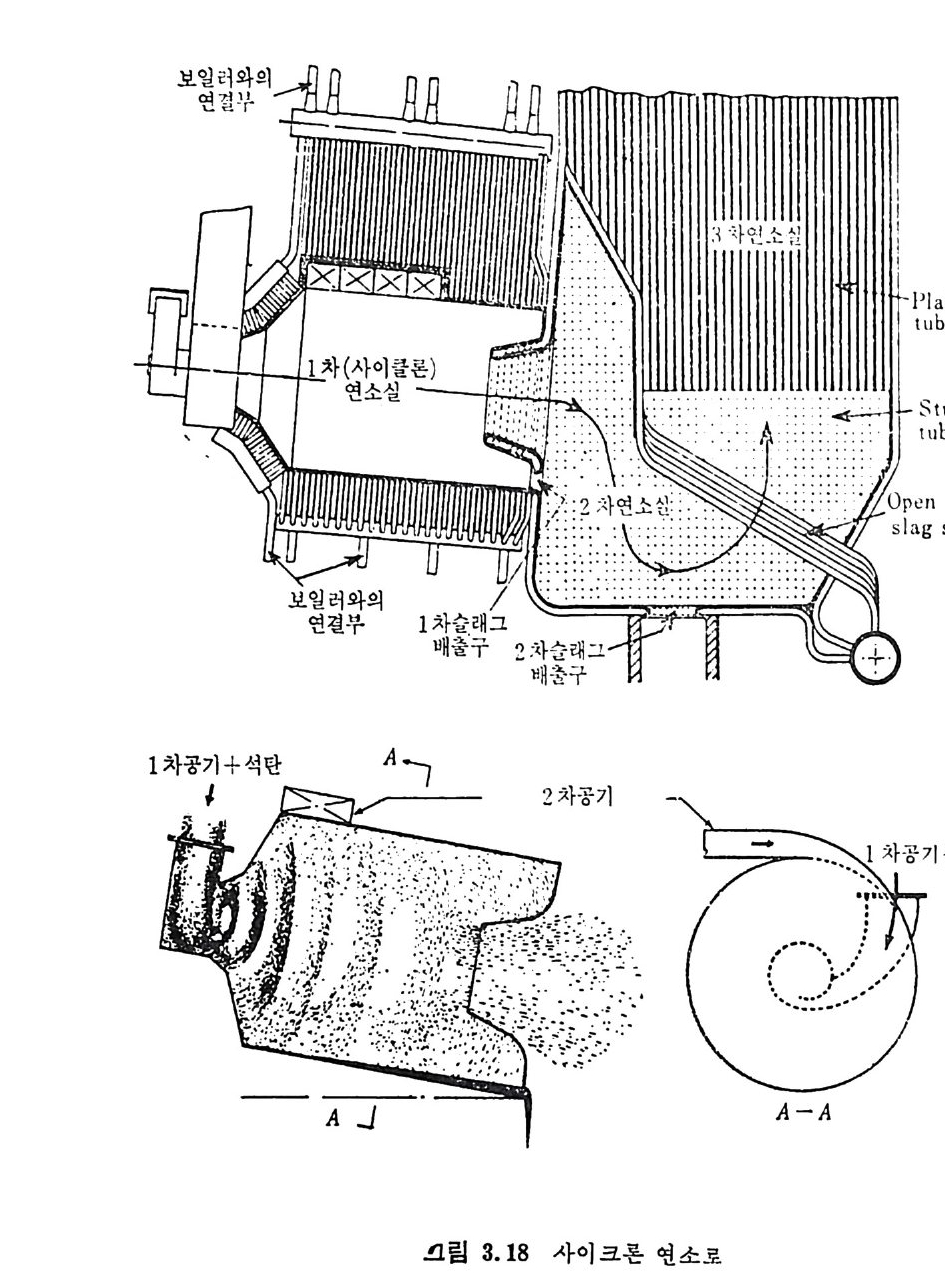 Plain
Plain
이 용융된 회분 (sla g)도 벼에 원십력에 의하여 던져지게 되고 냉각수 가 순환되는 전연관에 접촉하여서 굳어진다. 이 굳어전 sla g의 두께 가 접차로 중가하여서 자연 내화물질이 되어침에 따라 온도가 상승하 떤 고화되 었 던 slag 가 다시 녹아서 기 울게 설치 된 사이 크론의 slag 제거관을 통하여서 제거된다. 벽의 용융 sla g에 부착되었던 석탄은 불꽃기체에 의해서 연소되어진다 . 분쇄석탄 대신에 분란을 사용하기도 하나 이 장치의 하나의 목적 은 분란 대신 큰 분쇄석탄을 사용함으로써 분말단을 만드는 에너지를 철감한다는 점이다. 그러 나 분쇄 탄 (crushed coal) 은 체 류시 간이 길어 야 하고 slag 에 붙 어서 체류시간은 길어지나 sla g가 탄소분을 적서서는 안 된다. 만일 탄소분이 sla g에 젓게 되면 sla g배출시 같이 나오게 되어 연소성분의 손실이 커지게 되므로 이 접을 고려하여야 한다. 3. 5 가열률 및 접 화일도 (Hea t Rate s and Fir i n g Densit y) a) 비교 가열률 용광로(fu rnace) 의 가열률은 열공급률과 같다. 즉 가열률은 접화율 (J 1) 과 연료의 연소열의 곱으로 표시되며, 각각의 접화방법에 따른 가 열략 률0.을 03 표~ 303.030 에M W보 ( 여10주5~고1o 10있B다t .u /h r)여 기범 서위 에보 서듯 이변 화각하각고의 있가 다열. 률보은일 러대 크기는 가정용에서부터 발전용에 이르기까지 넓은 범위를 보여주고 있으나발전용보일러는 3oMW 보다큰경우이며 산업용보일러의 크 기는 30MW(108B t u/hr) 보다 작은 법위의 것을 사용한다. 용량이 큰 보일러는 주로 분란을사용하며, 상업용이나산업용보일 러의 크기가 o.3MW 정도이면 앞에서 보여준 g r i d 와 mul tij e t보일러 (그림 3.15) 를 사용한다. 또한 거의 모돈 발전용 보일러는 분란을 주 입하는 버너를 사용하고 있다. 그 반면 기계적 s t ocker 식 보일러의 최대 용량은 30MW(I08Bt u / hr) 이며 이는 g ra t e 의 크기의 한계에서 오는 것이다. 불활성 물질을 함유한 (ballas t ed fluid i z e d bed) 유동충 연소로를 발 전용에 적용코자 하는 시도는 최대 용량이 800MW 크기까지 시도되고
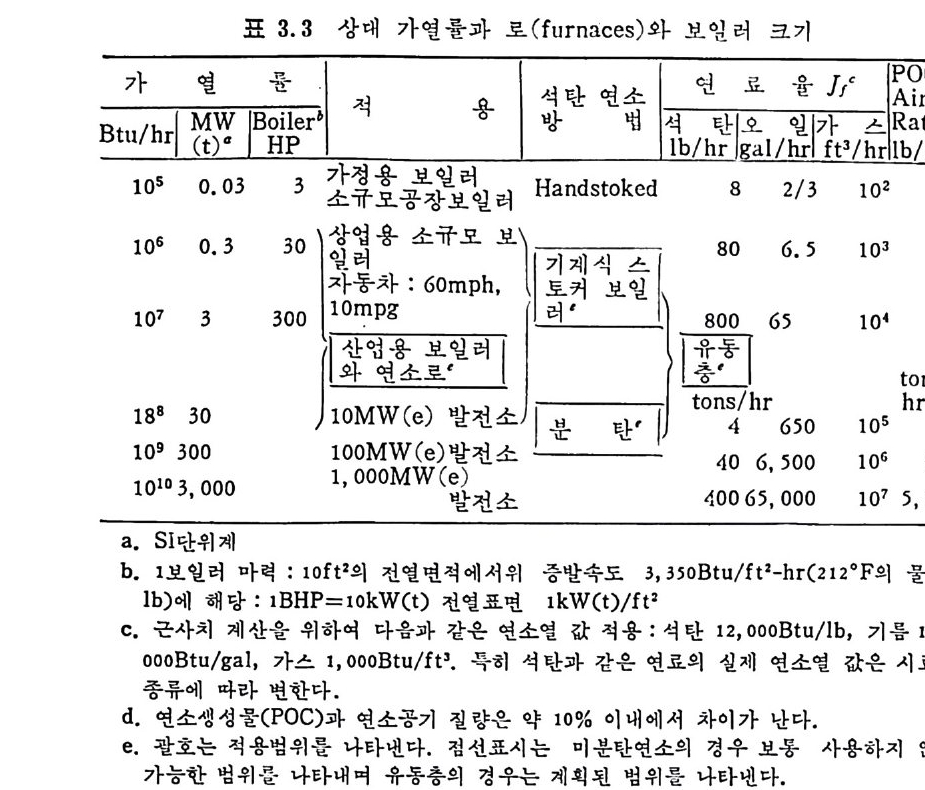 표 3.3 상대 가연문과 로(fu rnaces) 와 보언러 크기
표 3.3 상대 가연문과 로(fu rnaces) 와 보언러 크기
있 다. 그 반면 unballaste d 유동총 (그림 3. 12) 의 크기 는 10MW 이 며 고온에서 조업되므로 NO 의 생성과 S02 의 제거 문제로 개발이 더 이상 이루어지지 않고 있다. 연소산물과 공기의 비율을 표 3.1 에 보여주고 있다. 연소로 를 몽 하여 서 나오는 산물의 대 부분은 연소공기 중의 질소이 다. 보통 보일 러에서 증기생성률과 연소산물 또는 공기울은 대략 비숫하다. 일반적으로 1 f선의 찬공기 /100B t u 발화로서, 죽 1,oooB t u 발화하는 데 1lb 의 공기가 필요하다고 알려져 있다. b) 접 화밀도 (F iri n g densit y)
접 화밀도는 체 적 연소강도(Iv ) 또는 면적 연소강도(I A) 로 표현된 다 . 죽 체적 연소강도는 연료울 (h) , 연료의 발열량 (h1) 과 주어진 압 력에서의 연소로의 체적을 알면 다음과 같이 정의된다.Iv=vc~p (3. 1) 또한 면적 연소강도는 압력이 대기압이고 연소실의 기준단면적 (A,) 이 있으면 다음과 같이 표시할 수 있다. IA= 」모AcL 一 (3. 2) 여기서 기준 단면적 Ac 는 유동충에서는 분산판의 단면적이고 기계 적 s t oker 인 경우에는 g ra t e 의 면적이 된다. 그 반면 분란 버너연소 때에는 보일러의 단면적이타고 할 수 있겠다. 질량 접화밀도 (mass firin g densit y), IIh1 는 체적에 상응한 값은 평군 제적반응률 Rv 이라고 할 수 있다. 만일 총괄연소 체적이 면적 Ac 에 대하여 유효높이가 HC 라면 유효 높이는 다음과 같다. He= 上Iv (3. 3) 분탄연소시 연료는 연소공기와 같이 수송되어진다. 연소로를 통과 하는 시간 t,을 연료-공기의 공급률과 체적 연소강도 I 四가 연관시키 떤 Iv= K(TtJ, T I) (3. 4) 여기서 T f는 평군 불꽃온도, 따는 주위 온도, K 는 다음과 같은 정 수이다. K=1 +G~,/ (3. 5) 여기서 Po 는 표준온도와 압력에서의 연소산물의 밀도, Gs 는 공기/ 연료의 양론 질량비이며 ¢는 당량비로서 ¢= 1+ (E%I /IOO) (3. 6) 어기서 E% 는 전체 과잉공기 %아다. 일반적으로 G,!¢>>10 이며 h f /100 三 G/Po, 죽 1/ p。 lb 의 찬공기 /100
B t u 가 된다면 K 는 10 야가 된다. 대부분의 탄소성 연료의 최고 단열 불꽃 온도는 2000°c 이나 실제 불꽃 평군온도는 1200~1800°C 범위 에 있 다. 불활성 물질 (ballas t ed) 이 있 는 연소로를 제 외 하고 Tf/ To 는 대략 6.5 土 I.5 가 되며 T1 가 대략 900°C 일 때의 비논 4 .0 이 된다. 과잉 공기 양은 유동충 연 소로의 경 우 0 에 서 gra te 연 소 경 우의 30 ~50 %까지의 법위에서 변화하므로 (1/¢) 는 대략 I.2 士 0.2 법위에 놓이게 된다. 분탄주입 보일러 의 체류시간은 대 략 2 초이므로 연소강도는 대 략 250 kW/m 떠 되며 질량 접화밀도는 약 3okg /h rm3ol 된다. 연소시간 tc 이 체류시간 t『과 대략 같으면 체적 연소강도는 연소 시간에 주로 의촌하게 된다. 실제 보일러의 연소시간은 불 꽂 이 연소체 적의 1/2~2/3 를 차지하고 있으면 1 초밖에 되지 않는다. 분탄주입 연 소와 폭발가스의 연소시간은 1 초에서 10- 2m sec 범위에 있고 기몸방 울은 1-1oomsec 정도이다. 보동 산업용 가스버너의 체적 연소강도는 100 MW/m3 (107 Bt u /ft 3h r) 이 고 산업 용 가스 또는 기 름 접 화 용광로 의 값은 100 KW/m3(104B t u/ ft 3hr) 이고 이 값은 분란 접화 보일러의 경우와 비슷한 값이다. 현촌하는 보일러 들의 연소강도는 대 략 250 kW/m3~75okW/m3(25, 000 一 75,oooB t u/ ft 3hr) 이며 연소를 CO 와 휘발분가스 생성으로 생각 하면 상기 값들은 낮은 쪽의 값들이 다. 이는 연소 그 자체보다 연소충 위의 기체의 혼합이 찰 이루어지지 못하여서 유발되는 불완전연소가 문제라고 생각된다. 그러므로 이에 대한 완전혼합 가능성의 연구가 필요하다. 유등총 연소로의 체 적 연소강도는 대 략 250~soo kW/m3(25, ooo~ 50,ooo B t u/ ft 3hr) 이며 이는 주어전 연료공급과 연소울에서 생성된 연소산물(p roduc t of combus ti on) 을 근거로 한 값이다. 그러나 유동 충 연소로에서 얻은 실험값들은 2~10MW/m3(200,ooo~106Bt u /ft 3 hr) 이며 C y clone 연소로(그립 3.18) 의 경우도 이와 비슷한 값을 갖는 다. 그러나 유동충체적을 근거로한값울 예견하는 방법은아직 없다. 유동충과 분란주입 보일러의 연소강도의 比는 10 이므로 유동충의 연소체적은 분란보일러의 10% 로써 같은 강도를 얻을 수 있으므로 장 치비의 절감을 얻을 수 있겠다 .
면적 접화밀 도 (area firi n g densit y), I ,. 는 g ra t e 의 열발산율을 규 정하는 일반적 방법이다. 석탄종류, g ra t e 의 설계와 조업조건에 따라 IA 는 최 대 2MW/ m2( 245k g /m2hr) 까지 변화한다. 그 반떤 유동충 연 소로에 서 는 50~500kg /m 2hr 범 위 에 서 변 화한다. 기존설계식 및 제한성 ; 여러 연소로의 연소강도치와 이에 상관되는 값 둘율 표 3 . 4 에 보여주고 있다 . 7)
 표 3.4 상대 연소강도 및 상관량
표 3.4 상대 연소강도 및 상관량
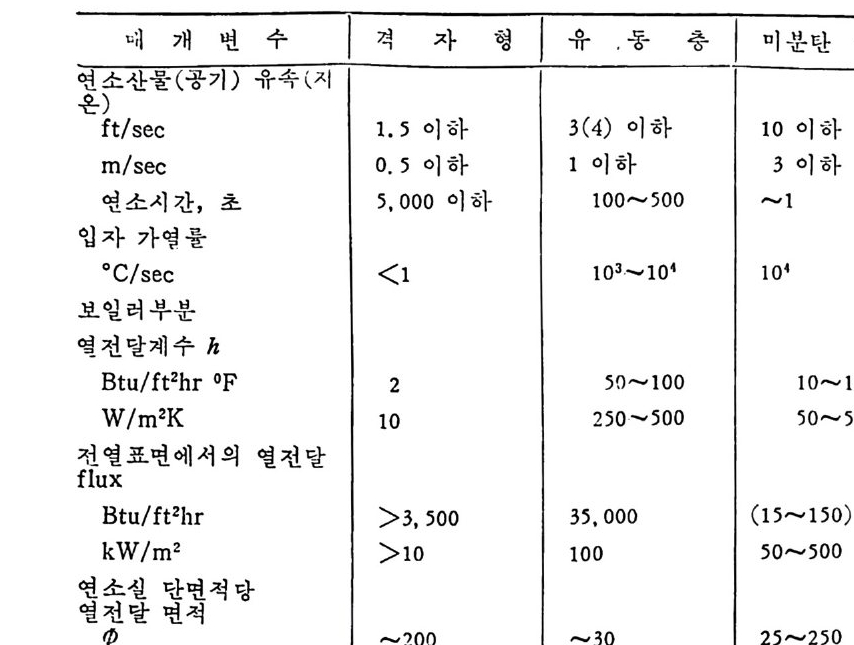 내 개 변 수 격 자 형 | 유 . 동 충 미분단 연소
내 개 변 수 격 자 형 | 유 . 동 충 미분단 연소
만일 연소가 안정하고 거의 완전하며 연소로가 정상상태라면 공기 유량 ]a 는 연료유량 h 에 직접 비례한다. 죽 L= (운)fI (3.7) 여기서 Gs 는 공기/연료의 양론비이고 =l/ 〔 1+E%/100 〕이다. 식 (3.2) 를 대입하여 h 를 소거하고, 연소산물 밀도 p。 률 도입하 면 연소실의 연소산물의 평군속도 V 는 다음과 같다. v= (습)(令)( ~ )1A 국了눕)(운 )IA ft/h , (3. 8) 온도비 (T1/To) 를 적당한 값, 죽 유동충의 경우 4, 분단주입 연소 나 gra t e 연소 때를 6.5 인 값과 20% 과잉공기 (1 /
더운 공기일 때 3~ . 1. Sm/sec 로 비슷하며 이는 면적 전화밀도 가 비슷 함을 반영한다. 그 반면 분탄주입 보일러는 고온 연소산물의 속 도가 20m/sec 까지 되며 4 5m 높이 보일러의 체류시간은 결국 2 초 정도에 지나지 않으며 실제 연소시간은 1 초보다 적다. 또한 I. 25m 높이의 유동충이나 o. 33m 석탄충 높이의 gr ate 연소시 의 체류시간은· 0.I~I.0 초 정도이다. 그 반면 연소시간은 유동충 연 소로의 경우 100~500 초이며 g ra t e 연소일 때는 5000 초까지 된다. 보일러의 HP 윤은 Gra t e 연소일 때 열교환 fl ux 는 11kW/m2 이고 연전달계수는 10W/m2k 의 값이며 이는 관형 보일러에 적합한 값이다. 대 형 발전 용 보일 러 의 열 flux 값은 50~5ookW/m2 의 높은 값으로 이 는 복사열의 영향이다. 여기서의 열전달계수는 대략 85~340W/m2k 값을 갖는다. 그 반면 유동충의 열 전달계 수는 대 략 280~560W/m2k 이며 연교환 면적의 fl ux 는 IOOkW/m2 이 넘는다 . 그러므로 유동총 연소로의 열전달계수는 높은 복사열을 갖는 경우에 팔적하며 gra te - 연소 보일러보다 매우 크며 균일한 온도분포를 갖는다. 열교환 면적과 연소실의 단면적의 비를 표 3. 4 에서 보면 유동총 연 소로의 경우가 제일 작으므로 작은 장치의 유동충 연소로써 원하는 열량을 얻을 수 있음을 나타낸다. 표에서 보여주고 있는 값들은 연 료의 연소 반옹속도와 독립적인 제한접이 있으며 이 제한접을 각각의 연소계에 대하여 기술코자 한다 . CD Grate 연소 Gra t e 연소의 첫째 한계접은 g ra t e 의 크기이다 . 실제 제작상의 한 계는 그 길이와 폭이 9m 를 넘지 못한다. 또한 실제 s t oker 보일러의 증기 생산량은 135,oook g /hr 를 넘지 못한다 . 그러므로 실제적인 한 계는 g ra t e 의 면적과 접화밀도에 달려 있다. 공기주입량의 한계는 없으나 반응면의 이동률이 연료유량과 일치하 지 않으면 불꽃의 blow-o ff가 생 겨 서 불이 꺼 지 게 된다. 반응전면 의 진행속도를 R, m/sec 아라 하고 연료유속이 반응전면에 수직이라 고 하면 R• p 1= J1 ,A 가 되며 여기서 Pl 는 연료의 bulk 밀도이다. 연료 충이 깊은 가스화 반응기에서나 gra te 위에서 가스화가 일어날 때의 전체 계는 연료과잉 (fuel -r i c h ) 상태이다. 이때 R 은
R= 노Pl= -上 G,土 p, =- 브G, 고p, (3. 9) 여기서 v!, p!는 찬 공기의 속도와 밀도이며 동가비 (eq u iv a lence rati o) ¢는 2(RCS) 와 같다. 여기서 RCS 는 Thr i n g상대 탄소 포화계수 (Th rin g relati ve carbon satu rati on fac to r) 이 다. 4) 이 값은 o. 5 (C 아 가 전부 생성될 때 )
여기서 lt T 는 열교환계수이고 O 는 연소실의 단면적당의 열교환면적 비이다. 만일 (G,/
괭윤 (swe lli n g)을 동반한다. 열분해는 입자크기에 달려 있으나 대개의 경우 반응시간이 초 이상 분 단위이면 IOOO C 에서 완료된다. 그러나 열분해 후의 좌에 휘발분이 남아 있게 되며 이는 주로 수소 및 질소가 각각 1% 정도 남게 된다 .14) 이 잔류휘발분은 2000 ° c 이상 에서야 제거된다. 휘발분 손실에 따른 무게 감소는 5~45% 까지 면하 며 시료의 충전밀도와 가열률의 함수이다. 석탄분말을 가스상에 분산 시켜 희박상 (d il u t e p hase) 에서 높은 가열률 (104C/s) 로 열분해시키면 무게 감소는 현격히 증가한다. 이는 급속가열로 휘발분의 분해 를 줄 이고 좌 표면에 탄소가 되적되는 것을 감소시키기 때문이다. 석탄을 1000°c 에서 충분한 시간 동안 열분해하여 얻은 좌 는 주로 탄소이며 일반적으로 석탄보다 큰 개방기공 (o pen p oros ity)과 표면적 윤 갖는다 •15-16) 석탄 속의 금속성분은 회분으로 번하여 열분해온도 가 높으면 sla g가 되며 sla ggi n g온도는 회분의 조성에 달려 있고 열 분해시의 반응조건에 따라 변화하나 보통 1200~1800°C 정도이다. 열 분해시의 주위 기체가 공기 또는 산소이면 열분해와 산화반응이 동시 에 일어난다. 또한 주위의 공기가 고온이면 휘발분이 접화되어 불꽃 울 형성한다. 열분해중 비교적 큰 입자에서는 휘발분 방출은 표면의 산소를 동반하여 방출되므로, 좌와 산소반응은 휘발분 방출이 끝난 후 에야 시작되며 좌의 온도가 높아야 산소가 표면에서 반응을 시작한 다. 그러나 좌의 완전연소에 걸리는 시간은 매우 느려서 휘발분 방출 과 이의 연소에 걸리논 시간보다 IO 배 아상이 된다 .17-20) 가열률은 gra t e 연소 경우에는 매우 느리나 유동충 연소로에서는 mm 크기 입자의 경우 1000°C/s 정도이고 분단주입 연소시에는 1040 c /s 이상이 되고 폭발불꽃의 경우에는 106~I06°C/s 정도가 된다. 열 분해 의 산물은 수소에 서 부터 heavy tar 또는 pitch 까지 매 우 넓 은 분자량을 가지고 있다. 또한 대 부분의 석 탄은 pla sti c 또는 액 체 상태 로 변하여 서 코크스나 좌를 생 성한다. 그러 므로 gra te 연소에 서는 coke 형성에 의하여 석탄충에 가스가 침두하기가 어려워 연소효율을 떨어 뜨리나, 유동충이나 분단연소 경우에는 cak i n g이나 cok i n g의 문제가 십각하지 않다. a) 석탄의 구조 석탄구조에 대한 모델은 석탄연소시의 열분해현상과 한정된 실험
결과를 근거로하여 일반화해서 시험하고자 하는 조건 및 시료에 대한 예측치를 구할 수 있겠다. 발표되어전 두 성분가정 21-22) 은 조업 모델 로서 석탄은 두 가지 구조를 가지는것으로 1) 개방구조 (o p en str u c- t ure) 로 탄소함량 %<90% 것과 2) 무연탄구조 (an t hrac it e str u c- tu re), 죽 C%>92. 5% 로 아루어져 있다는 것이다. 즉 석탄화 (coal ifi ca ti on) 는 개방구조에서 무연탄구조로의 변화 과정이며, 그 사이에 액체 구조 (l iq u i d s t ruc t ure) 를 갖는, 즉 B5%
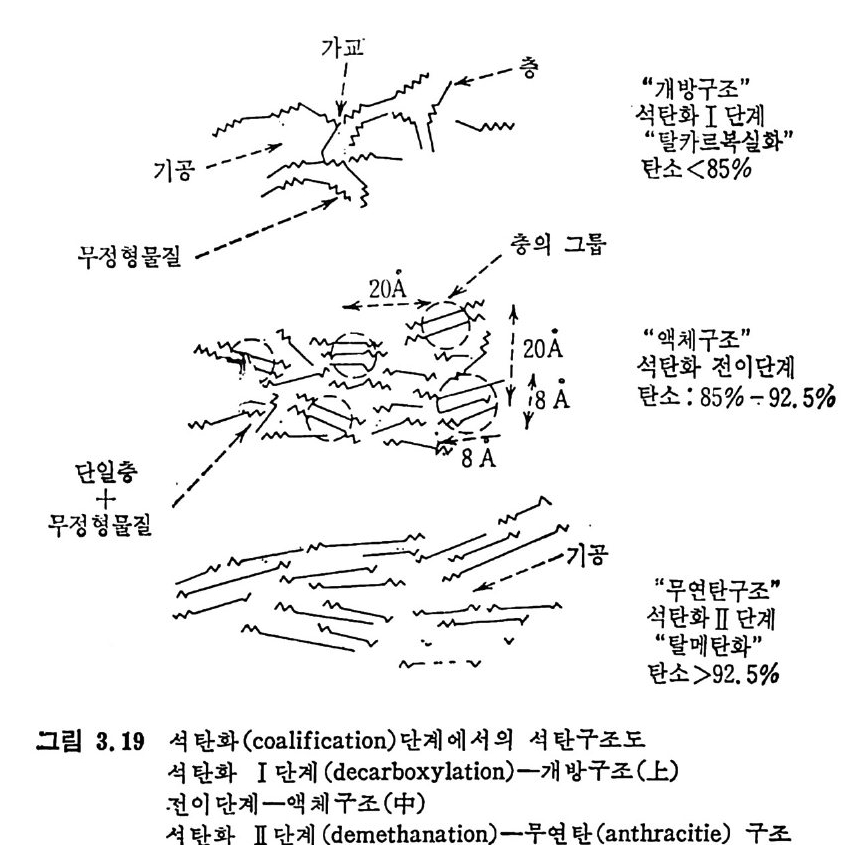 기공-二三가\ :/仁r\ (*-―- 충 탄“개소방 <구8조5%
기공-二三가\ :/仁r\ (*-―- 충 탄“개소방 <구8조5%
H/C1+=K2(~0/C ) (3. 14) 여기서 K 며 K2 는 실험상수로서 H/C 가 1000 이고 S/C 가 900 일 때 각각 80 과 90 이 된다. 상기식의 H/C 와 0/C 비를 도시한 것을 석탄띠 (coal - band) 라고 부른다. 이 석탄띠는 두 개의 영역으로 나누어져서 0/C(C%<9o) 비 가 큰 경 우에는 0/C 비 가 감소 (decarbox y la ti on 에 의 한 석탄화)하는 경우에도 H/C 와 A/C 비가 거의 일정한 경우와 탄소 함량이 90% 이상인 경우에는 0/C 의 증가에 따라 H/C 와 A/C 비가 직선적으로 감소하는 경우 (deme t hana ti on 에 의한 석탄화)로 대밀되
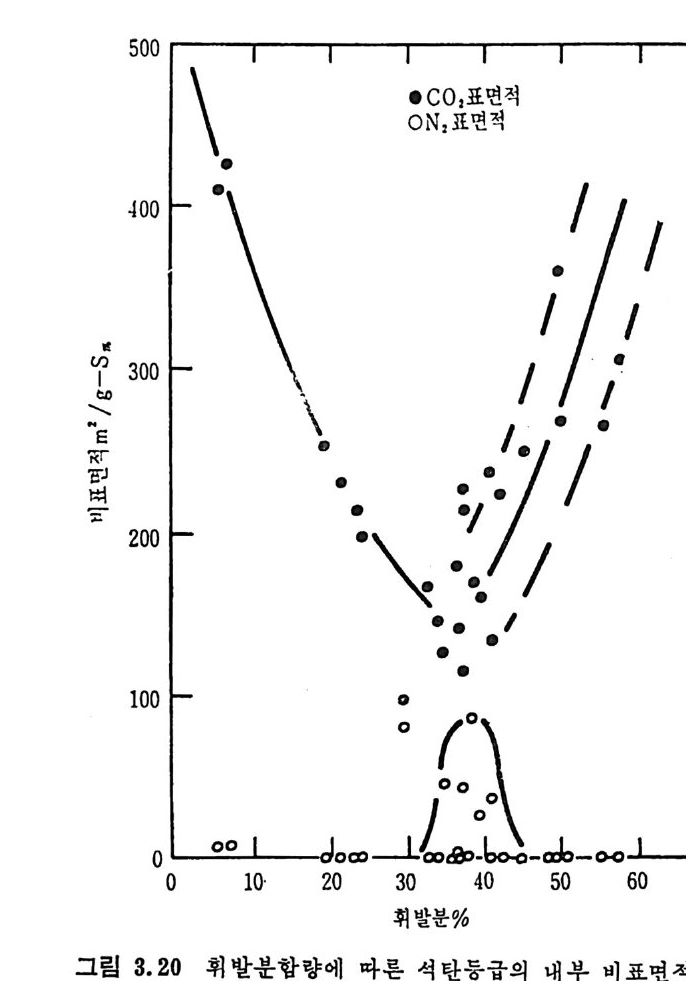 500 \ •'\
500 \ •'\
며 그 전이과정이 탄소함량 %가 82~92.5% 인 경우로 이 영역에서 의 석탄은 가장 괭윤 (swe lli n g)이 크고 초]처밀도를 가지며, 최소의 소 기 공 (m i cro p ore-C02 흡착)과 최 대 의 대 기 공 (macro p ore-N2 홈착)의 내 부 표면적을 갖는다(그림 3.20). X-ra y로 석탄결정을 조사한 결과 첫째로 C-H r i n g구조가 결정에 싸여쳐 있고 두번째로 결정 사이에 비결정 (amorph ous) 물질이 가교 (cross l i nks) 되어쳐 있다. 탄소함량이 낮은 갈탄과 같은 물질은 기공이 많고 r i n g구조나 결정 당의 얇은 충(l amallae) 이 적다. 탄소함량이 증가하면 배열된 r i n g에 서의 탄소분율이 증가하고 탄소 무게당의 체적과 밀도는 감소한다. 대 략 탄소함량이 90% 인 석 탄의 경 우에 이 의 결정 pa ckin g 이 최 적치가 되어서 밀도는 최소치가 된다. 그러나 내부 기공이 적어침으 로 인하여 외부로부터의 내부 기공에 접촉할 수 있는 능력은 최소가 된다(그립 3.20). 또한 탄소함량이 90% 이상이 되면 lamellae 는 농
 표 3.5 석탄화, 구조 및 석탄연분해 및 두 성분 가정
표 3.5 석탄화, 구조 및 석탄연분해 및 두 성분 가정
축되 어 서 단면 (lay e r) 당의 rin g 의 숫자가 증가하며 , 죽 결 정 당의 단 떤이 증가한다. 또한 많은 양의 전체 탄소가 lamellae 에 배열되게 된 다. 죽 비 결 정 (amorph ous) 물질은 조성 I 에 서 , 배 열 된 lamellae 의 구조 논 조성 Il 에 서 X-ray 조사결과 나타났으며 , C-H rin g 구조(l amellae) 가 가교구조 I 보다 연에 더 안정하며 열분해시 700°C 이상에서 수 소와 초}를 생성한다. 자제한 이단계 석탄화과정을 표 3.5 에 보여주 고있다. b) 휘 발분 연 소 (Volati le Combusti on ) 휘발분의 연소울은 1) 열분해율과 2) 공기와의 혼합물에 따라 조철 된다. 또한 휘발분 조성의 기체상의 반응속도에 의존하게 될 것이다. 그러나 이에 대한 정보는 거의 없다. 휘발분연소는 첫째로 휘발분이 산소와 찰 혼합되어전 후 화학반응에 의하여 일어난다. 여기서 화학 반응이 기체혼합보다 매우 빠르다고 가정하고, 휘발분은 석탄입자 주 위에 군일한 구형의 fi lm 을 형성한다고 가정하자. 그러면 fil m 두께만 알면 휘발분의 체적을 알 수 있다. 단위 체적당의 휘발분을 연소시키 기에 필요한 산소양울 예측하고 fi lm 의 수축률을 산소의 주입량의 함 수로 표시할 수 있으며 전체 휘발분 연소시간은 fi lm 이 완전히 없어 질 때의 시간이다. 만일 석탄입자의 직경, d p는 번하지 않고 건조, 무금속 성분 (dm 게mf는 ) 무((게r/를6) d근 p 3거 pJ한이 고석,탄 휘의발 5분0이% 가차 휘지발한분 초이기라 체고적 가 V정 하는면 [,o. 5입 프자6 - 의d p 3 p무• 弓芹·읍〕이 된다. 휘발분의 초기 외경 ro 는 다음과 같다. 2r0=( 운 V+d p 3)l^=4( 옵-p T+1)v3 (3. 15) 휘발분을 완전히 연소시키기 위하여 필요한 산소량은 초기 석탄을 연 소시키는 데 필요한 양의 대략 반이라고 하고 산소가 휘발분 fil m 에 접촉한 순간에 반옹한다고 가정하자. 휘발분 fil m 표면의 단위 면적당 의 휘발분 연소 체적을 -dr 이라 하고, 주어전 온도 T 에서 휘발분 의 분자량을 M 이타 하면
_d言r =35. 31 Tv fq0, (3. 16) 여기서 %는 산소의 확산율 (d iffu s i on ra t e) 로 다음과 같이 표시된다. q。 2= F1 g D 。 (순 )0·75 (3. 17) 여기서 F g는 기체흐름의 산소질량 분율이고, p‘는 기준 온도, To, 때 의 기체밀도, Do 는 기준 온도에서의 기체 확산계수이며 r 은 휘발분 구형의 의부반경이다. 상기 식에 적절한값, 죽p 1=1.96X10-4 g /cm 3, D0=4.4cm2/s, T0=1800°K 울 대입하면, 전체 휘발분 연소시간 t b 는 다음과 같다 .23) tb= 。. o6~ T Fg (무)。.? 5 〔 r3- (우 )2 〕 (3. 18) 여기서 석탄입자크기 d p를 0~90µm 범위에서, 온도 T 가 1000°c 일때 분자량, M 을 10,100 및 1000 으로 변화시키고 산소의 질량분울 Fl 를
 50
50
o.1 이라고 하고, 석탄의 밀도를 I g /cm3 이라고 하여서 계산한 결과를 그림 3.21 에 보여주고 있다. 석탄입자가 50µm 일 때 휘발분의 분자량을 100 이라고 하면 상기 가 정으로 계산된 값은 약 7msec 의 연소시간을 갖는다. c) 좌연 소 (char combusti on ) 좌연소 메카니즘은 열분해 또는 휘발분 연소보다 더 찰 이해되고 있다. 정량적인 면에서는 규명하여야 할 접이 많으나 정성적인 모델 의 이해는 되어 있는 상황이다. ® 물리적 모델 석탄은 多孔性입자와 氣體相이 확산경계면 두께 0 룹 가지고 있고, 기공들은 입자 내부의 홈에 접차적으로 직경이 감소하는 기공이 배열 되어 있으며 이 평행한 기공들의 배열은 서로 독립적이나 서로 전달될 수 있다고 가정하자(그림 3. 22). 탄소와 산소간의 반응은 내부 및 외부의 활용할 수 있는 표면적에서 불균일반웅이 일어난다. 반응의 산소농도 구배는 경계면에시 형성되 어서 산소를 고체입자 표면과 내부 기공에 공급하는 率을 조절하게 된다. 이 반응에서 CO 와 CO2 가 생성되고 온도가 중가되면 CO/CO2
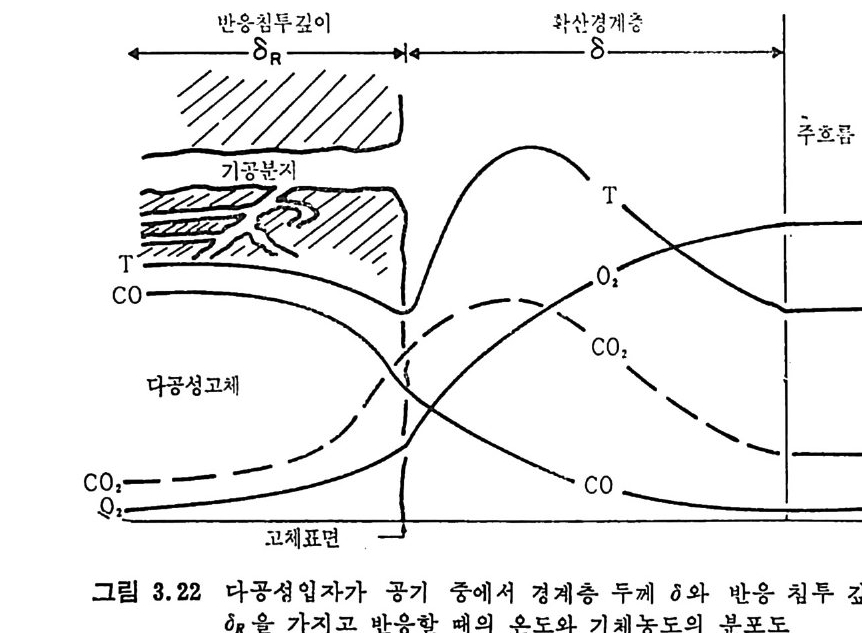 二반응점두깊이
二반응점두깊이
의 비논 증가되어서 1,000° c 이상에서는 co 가 주로 생성된다 .24) 또 한 이 CO 는 입자의 기공이나 경계면에서 기상반응을 일으켜 CO2 를 생성한다. 기상흐름에 산소 농도를 증가시키면 입자 내부의 CO 생성이 증가하며, 입자 또는 입자 경계충의 반응 평형온도가 증가하 고 이로 인하여 반응을 가속시칸다. 매 우 높은 온도에 서 는 C-C02 오} C-H20 반응이 활발해지므로 반응 모델을 고려 하여 야 하고 두 반응의 반응성 (reac ti v ity)은 거 의 같은 정도의 크기둥 가진다. 이제까지 C 가스 반응에 백금 촉매를 사용하 여 왔으나, Na, K, Ca 및 Fe 염 둥이 좋은 족매 역 할을 한다고 보고되 었고, 득 히 석 탄 호 1 분 중의 상기한 영 둥의 함량이 중요한 촉매역할을 한다고 보고되 고 있 다. 25 26) 산소는 고체입자 표면에 화학흡착 (chem i sorbed) 충을 형성하고 이 충은 비활성 기체하에서 고온에 의하여 제거되면서 CO 와 C 아를 생성한다. 이때의 활 성화 에너지는 대략 40kcal(170K J)이나 석탄의 기공도에 좌우되어 반응이 기공에 김두되는 정도에 달려 있다. 산 소는 분자 또는 원자로 분리되어 흡착되어진다. 그러나 반응은 산소 원자나 분자 밑에 있는 탄소가 산소에 의하여 제거될 대 반응이 완료 된다. 공학적 모델의 주요 인자는 묵정 반응률이며 실험적으로 단일입자, 분란을 충전시켜서 반응시키거나 탄소막대를 전기적으로 가열하거나 전기로에 분란을 비말 (en t ra i n) 시켜서 온도를 25~2200°c 까지 압력을 1 기 압에서 10- 4t o rr 까지 입 자크기 를 5Oo A~2. 5 cm 범 위에서 반응시 켜 서 실험을 수행한 실험결과들의 대표적인 경우의 반응률을 은도의 함 수로 Arrheniu s 型으로 도시 ((In RT V, 1/ T) 한 것 이 그림 3. 23 이 다. 27) 여러 종류의 탄소와 석탄의 다른 반응조건하에서의 결과이며 주어진 온도에서 반응률은 2~3 배 크기로 변화하고 활성화 에너 지는 10~40 kcal/ mo ! 범 위에 있으며 , 많은 경 우에 반응률은 고온으로 갈수록 중 가하다가 그 울이 감소하고 최고 반응률을 보이는 접은 확산의 한계 (dif fusi o n lim i t) 에 접 근하는 접 이 다. 산소의 확산경계면 두께 8 를 통한 물질전달은 일반적으로 다음과 같이 표현할 수 있다.
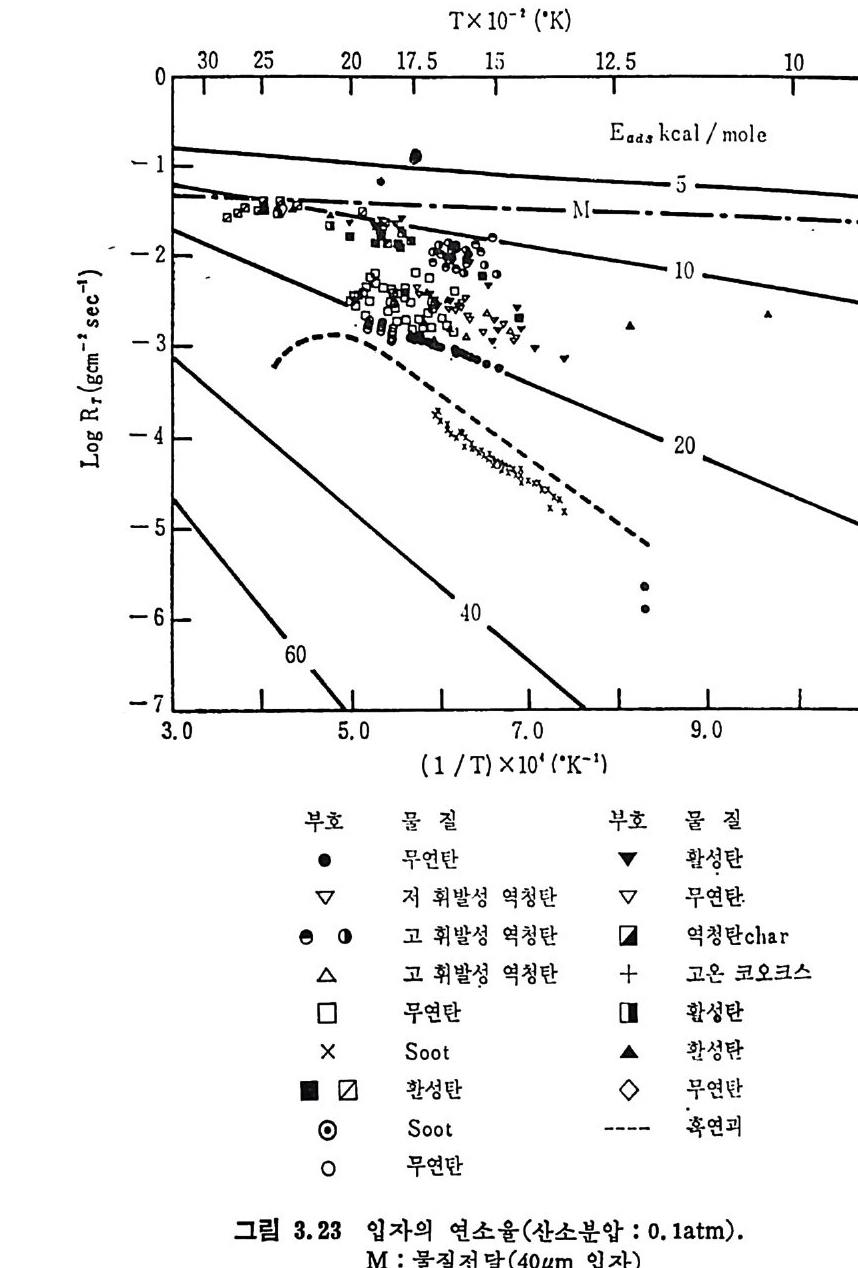 TX 10- ’ (·K)
TX 10- ’ (·K)
RT=Ko(C 。 _C,) (3. 19) 여기서 Co 와 C, 는 기체흐름과 입자표면의 각각의 산소농도 %이고 KD 는 물질전달에 대한 속도 상수로서 KDex(D/8) 로 표시할 수 있으며, 여기서 D 는 기체경계면을 통한 확산계수 (d iffu s i on coe ffi c i en t)이다. 그러므로 RT 는 탄소표면의 단위면적당의 반응률이다. 산소가 입자표면에 도착하여 소모되는 율은 표면의 산소 농도로 결정할 수 있고, 만일 입자가 반응성이 작으면 C, 는 0 이 아니고 산 소는 입자 내부로 확산되어 들어간다(그립 3.22). 표면에서의 산소소 모울은 표면반응과 확산에 의한 내부 반응률의 합이다. 반응률은 반 옹에 활용될 수 있는 표면적에 비례하므로 입자의 두께 또는 침투할 수 있는 깊이에 의하여 결정된다. 그러므로 내부 표면적을 쉽게 활용 할 수 있는지의 여부에 따라 반응률이 변화하므로 그림 3.23 에서 보 듯이 주어진 온도에서의 반응물이 큰 차이를 보인다. 만일 주어전 온 도에서 입자표면의 산소 농도가 주어전 탄소 또는 좌 (char) 에서 일 정하다고 하면 반응물은 주로 기공률과 기체의 기공으로의 침두성에 달려 있다. 그러나 좌 내부의 금속물질의 촉매역할과 반웅중의 내부 기공크기, 크기분포, 기공의 합체 현상이 일어남으로 인하여 단순한 모델로서 정의하기가 쉽지 않으며, 이에 대한 실험결과도 미흡한 상 태이므로 이와 같은 복잡한 현상에 대한 실험과 모델 개발이 요구되 고있다. ® 반응 및 반응률식 탄소와 산소 또는 CO2, H20 와 반응하에 서 CO, C02 와 H2 를 생 성 하 는 반웅들은 다음과 같다. C+02 一 C(Ox) ,t --.CO, CO2 (A) C+C02 一 C(Ox) s--.CO (B) C+H20 一 C(Ox)c--.CO, C02+H2 (C) 고체탄소와 기체간의 반응은 가역반응으로 간주할 수 있고, 첫째 단계는 화학적 흡착에 의한 산화화합물 (Ox) 을 생성한 후 이것이 분해 되어서 최종산물을 생성한다고 할 수 있다. 여기서 각 반응 중의 Ox 논 같은 성질을 가질 수도 있고 다론 성질을 가질 수도 있다. 생 성 또는 흡착속도, 상수를 KlA, 가역 반응 상수를 K-lA, 분해속
도 상수를 K2A, 가역 반응속도 상수를 K-2A 라고 (A) 반응에 대 하여 칭의하면 상기 가 반응에 대한 반응률 식은 다음과 같이 표시할 수 있 다. 28) RR,,I,Oco,=,= K 1,A CKol2·AK+1 KK,B22 ,,KAA2 IC(B+o 2KC C.O 12, A) (3•2(O3a•、`)/)2(O3 b'2 O c KbB Cco,+ K 2IB Cco+K R,,KH1,c CH,,oo+K_=2,c C~H~ o-- -F K;.,c 여기서 모든 기체의 농도는 입자표면에서의 농도이다 . 상기 반응률식은 입자표면에 기체가 군일하게 흡착되어 있고 휴착 열은 흡착된 면적에 독립적이며 홍착된 분자는 단일 위치를 차지하면 서 분해되지 않는다는 가정을 가지고 있다. 식 (3.20) 에서 가역반응을 · 무시하면 모돈 식은 낮은 반응룹 농도, C3 에 대하여 1 차 반응석으로 표시할 수 있다. R,=Kli C,=K1:i P , e -( Eui / RT ) (3. 2 I) 또한 높은 분압에서는 0 차반응으로 표현된다. 죽 R,=K2,;=KL e-
이 표시할 수 있다. RT=f ·K ' C,' + (+) ✓ K c f Ai Di c;l+n)I2 (3. 24) 여기서 f는 조도인자 (rou ghness fac to r ), s 는 시료의 형상인자 (sha p e fa c t or) 로서 평면형 (p lane) 은 1, 관은 2, 球는 3 의 값을 가지며, A,. 는 단위체적당 내부표면적, D i는 확산계수이다. 식 (3.24) 에서 첫번째 항은 의부 표면적반응을 두번째 항은 내부 기공 표면반응을 나타낸다. 만일 n= l 이 면 실제 반응차수는 1 차가 되 나, n=O 이 면 실제 반응차 수는 o.5 차가 된다 . 실제 반응에서 입자가 다공성이면 내부 표면반 응이 전재 반응윤 좌우하게 된다. 그러나 상기 표현은 반응의 침두 길이가 입자 두께의 반보다 작을 때 적용되며 시료의 중앙에서의 산 소의 농도는 0 이 된다. 그러나, 김두가 증가하면 중앙의 산소농도가 중가하고 내부 산소 전탈룹은 더 이상 반응률에 영향을 미치지 못한 다. 만일 산소의 농도가 표면농도와 같아지면 전체 시료의 반응률, R .. 는 다음과 같이 표시할 수 있다 . 죽 Rw = (A,·f + A; V)Kc t. C; (3. 25) 여기서 V 는 시료의 체적, As 는 의부 표면적이다. 전체 반응률이 입 자크기와 모양에 영향을 받는다면, RT 는 다음과 같다. RT = [f+( 은)시邸 Cn (3. 26) 여기서 a 는 입자 두께 반의 반경이다. 만일 반응이 경 계면 확산 (boundar y lay e r d i ffu s i on) 과 반응속도 현 상에 의하여 영향을 받으면, 상기식 (3.19), (3. 20) 및 (3. 24) 를 등시 에 풀어야 한다. 만일 입자표면에 기체가 침두할 수 없을 경우, 식 (3.19) 와 (3.20) 을 동시에 풀면 RT 의 2 차식이 된다 .29) 또한 확산이 빠르면 KD 가 커서 C, ::::: Co 가 되고, 탈착 (desor pti on) 이 빠르면 K2 가 커서 1/RT=(I/Ko +1/K1)Co 가 되고, 흡착 (adsor pti on) 이 빠르면 K1 이 커서 2 차식은 다 음과 같이 된다. 29-30)
(RT-Ko C 。) (RT-K2) =0 (3. 27) 그러므로 상기석은 확산이 반응을 조철하돈가 (RT=KoC 。) 탈착이 조철 (RT=K2) 한다는 의미가 된다 . 만일 입자가 다공성이라면 상기식 (3.19) 와 (3. 24) 또는 (3. 25) 를 1l 의 조건에 따라 플 수 있다. 즉 식 (3.25) 에서 n=O 이면 반응률은 탈착이 조철하고 경계면 확산은 무시할 수 있고, n=l 이면 식 (3. 2 4 ) 와 (3.25) 에서 변형저항식을 얻을 수 있는 반면 n=o.5 이면 식 (3.25) 에서 다음과 같은 2 차식을 얻을 수 있다. R 구+(궁)( 乃 ~)RT- (fz- )(A,. D; K.11)C0=0 (3. 28) 만일 입자가 다공성이나 표면에서의 반응이 매우 빠르면 K1 과 K2 가 크고 C3 는 식 (3.24) 와 (3.26) 에서 매우 작다. 그러므로 식 (3. 19) 는 다음과 같이 된다. RT= K따 (3.29) 또한 식 (3.28) 을 K.rr 로 나누고 K.rr 가 매우 크면 식 (3.29) 와 같은 결과를 얻을 수 있 다. 죽 식 (3. 29) 는 확산한계 (dif fusi o n -lim i t- ed) 반응을 규정하는 것이다. 3. 7 理想系의 연소분석 이론적인 연소에 대한 해석은 에너지, 질량 및 운동량 둥의 收支式 으로부터 적절한 경계조건을 가지고 수식적으로 解를 구하나 실제 系 에서의 복잡한 현상을 다 고려할 수는 없다. 그러므로 이론식에 필요 한 실험결과를 보정하여 연소시간, 연소영역 둥의 정보를 결정하여야 한다. a) 고정충 연소 코크스 (coke) 를 연소할 때를 가정하면 건조와 열분해과정을 제의 시킬 수 있다. Grate 위에서 코크스를 연소할 때(그립 3.6) 밑에서 들어오는 공기와 코크스의 반응은 1 차반응에서 CO 와 C 아를 생성하 고 CO 는 기체상과 기공에서 입자와 더 반응하여서 CO2°J =울 증가시킨
다. C 아는 다시 코크스와 반응하여 (C+C02--+2CO) 다시 co 가 된 다. 만일 수증기가 존재하면 CO, C 아와 H2 가 더 생성된다. 그러므 로 CO,C02,H2 및 H20 의 혼합기체는 주어진 온도에서 평형반응울 하 게 된다. 그러나 수증기 반응을 제외하면 고체 입자와 반응하는 기체 는 아와 CO2 및 기체상에서 CO 와 02 의 반응기체가 존재한다. 상기 한 탄소와 기체의 반응들에서 생성기체의 농도가 gra t e 로부터의 높이 에 따라 어떻게 변화하는가를 그림 3.24 에 나타내었다 .31) 만일 반응기체의 몰분율을 N i라 하고 i =I 을 02, i =2 를 CO2, i= 3 을 co 라고 하면 탄소와 02, CO2 의 반응률은 다음과 같다. 31) 맵텝= L = --nn21 NN2 1타-+ nN33 (N 31( + 급N3/2 y ) m (3. 30) (3. 31) 여기서 ?l1 과- n2 는 02 와 CO2 에 대한 반응속도 상수이고 氣相反應 은 co 에 대하여 1 차반응이고 02 에 대하여 m 차반웅아라고하자 .32) 식 (3.30) 과 (3.31) 을 더하면 아래와 같이 되며, co 에 대한 반응속
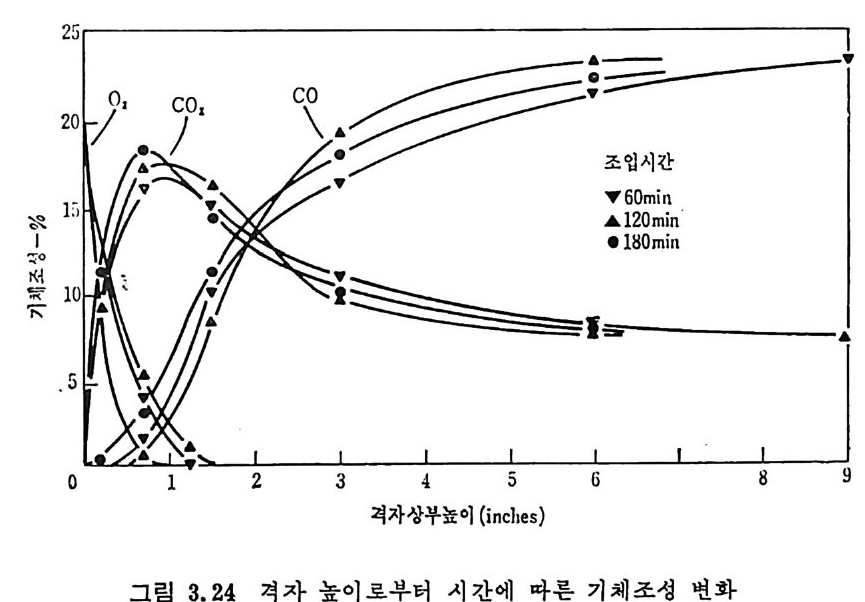 25
25
도 정보는 필요하지 않게 된다 . 죽 (움 )(N나 부 )+?l2(N1+ 부) = (112 카 )N1 (3.32) 산소의 속도상수, 111 또는 k1 은 충의 공간윤 흐르는 기 체 의 흐름으 로부터 코크스 표면으로의 경계면 확산에 의해 결정된다. 그러나 CO2 의 속도상수는 활성화 에 너 지가 약 50kcal 일 때 의 반응속도로부더 결 정된다. 상기식 (3.32) 에서 1l1 과 112 를 확산에 의하여 전정한다면,
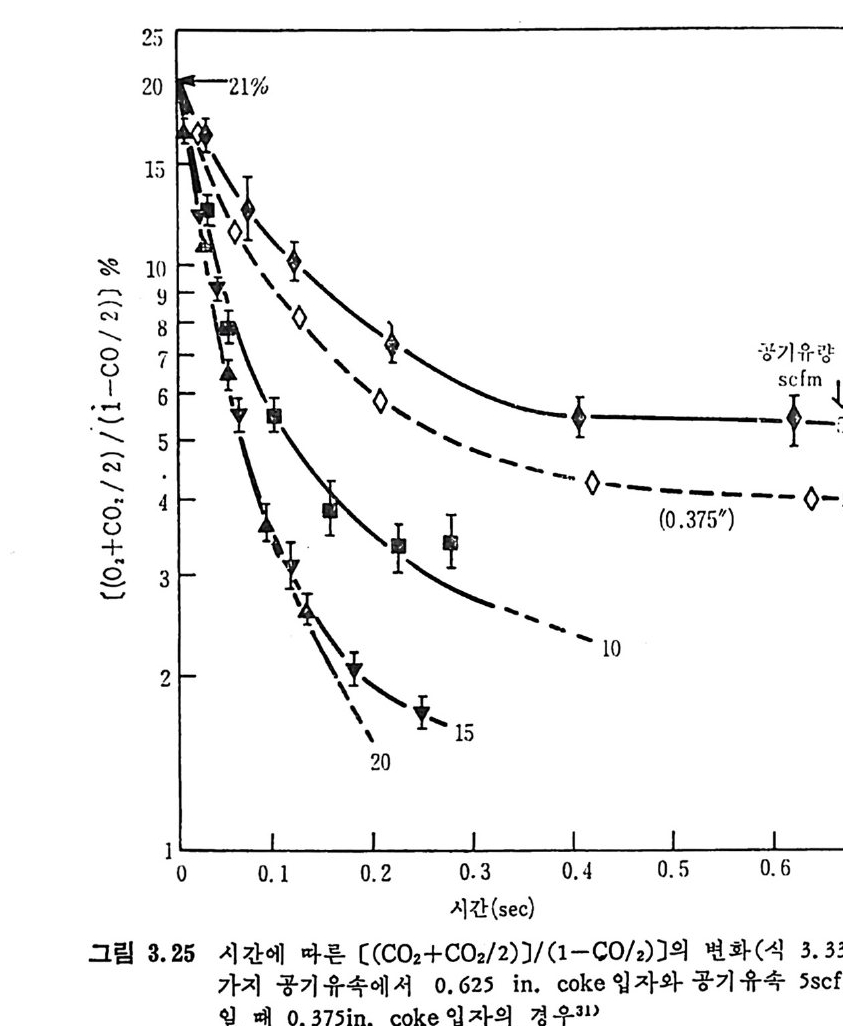 』? -a
』? -a
n1=n2 가 될 때 식 (3.32) 는 正解가 되므로 지역 몰분율/지여몰 =Y; 라고 표시하면 그 해는 (Y1+Y2/2)/(1 ― Y3/2)=Yre ~ '’ 가 되고 여기 서 Y; 논 산소의 몰분율 o.21 이다. 그러나 n1~n 군]떤 그 해는 복잡 해지며 3 1) 근사해는 다음과 같다. ~1 一: :Y:3/:2A e-' +B e-• ' (3. 33) 여 기 서 A= YP (n 1-112)I(n_n2), B= YP(n-n1)/(n-n2) 이고 n 은 임 의 상수로 t가 작을 때는 n1 과 거의 같다. 시간 t의 변화에 따른 코크 스의 연소로부터의 생성기체의 식 (3. 33) 群, [0 2+C02/2)I(1-C0/2)J
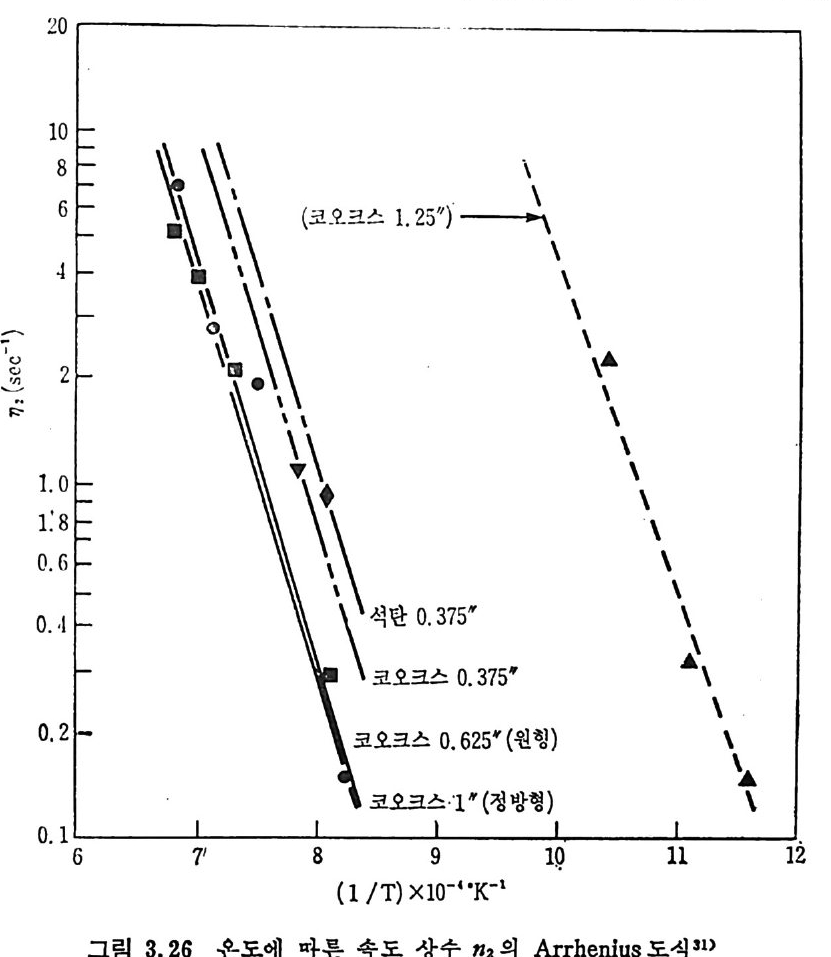 20
20
를 그림 3.25 에 보여주고 있다. 그립에서 보듯이 상관관계가 칙선이 아니므로 ”1~112 인 경우가 실제 반응조건이다• 식 (3.33) 에서 시간이 간 경우 각 선의 기울기는 n2 의 대략치를 나 타내 고 석 탄과 코크스의 n2 를 온도의 함수로 Arrheniu s p lo t 31) 하면 (그립 3.26) C 아반응에 대한 활성화 에너지는 대략 50kcal 로 나타 난다. 여기서 반응이 1 차라고 가정하면 반응률식은 n=I 을 갖는 식 (3. 24) 가 된다. 그림 3.25 에서 각 선의 접선은 시간이 0 일 때 기울기 ?h 이다. 식 (3.19) 의 경계면 확산속도 상수 KD 를 결정할 때 ?11 은 기체유속 V의 함수이 다. 죽 Kocx : Vm 이 라면 이 제 까지 의 결과 33-34) 는 m 값이 0. 49~ o. 83 까지 변화하였다. 실험결과를 ?l1 과 V에 대하여 log -l og plo t 하 떤 V0·7 에 비례하며 입자크기의 영향까지 고려하면
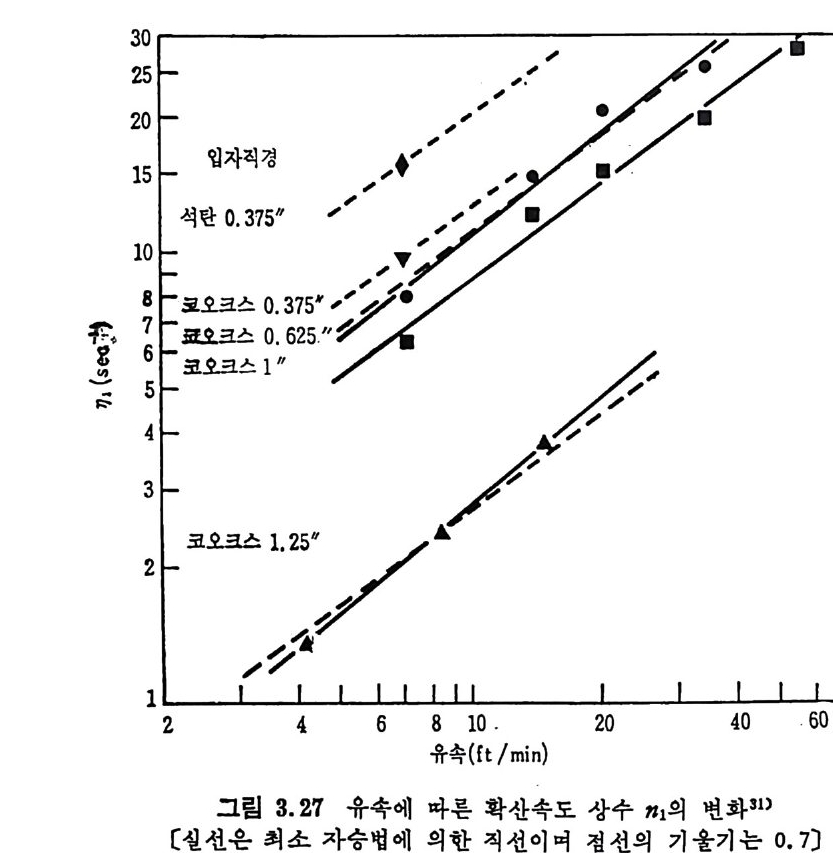 30252015
30252015
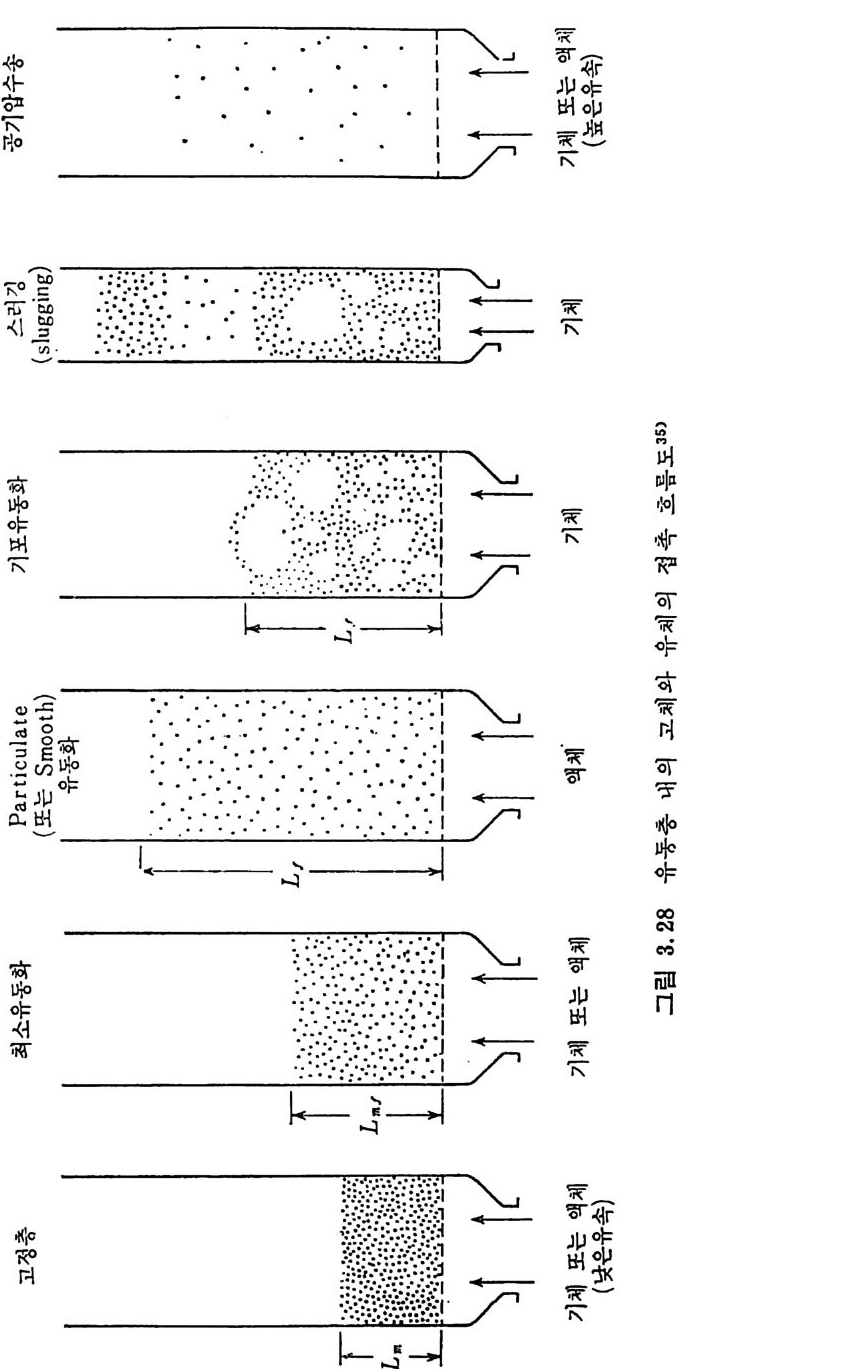 공 기압송수--~- ~--鳳 ^L 기 는또체 액체속높(유은 )
공 기압송수--~- ~--鳳 ^L 기 는또체 액체속높(유은 )
KD=C 나) (3.34) 가된다. 이제까지의 모델은 탄소를 근거로 한 것이고 이상계를 가정한 것이 므로 실제의 각각 다른 연소장치에서는 그 장치의 수력학적 목성에 의한 연소에 대한 영향을 규명하는 실험연구가 수행중이나 더욱 많은 연구결과가 요구되고 있다. b) 유동충 연 소 (Fluid i z e d bed combusti on ) 유동충에 서 의 유체 흐름에 따른 유동현상을 그립 3. 28 에 보여 주고 있 다. 여기서 기포충 (bubb li ng bed) 유동인 경우, 두 相으로 가정하여서 키 포相과 emulsio n 相으로 구성 되 었다고 본다. 기 포相은 거 의 입 자가 없다고 가정 (1~2% 입자농도)하며, emuls i on 相은 입자로 구성되었다 고 본다. 만일 연소 입자가 고온이고 산소농도가 높으면 발화가 일어 나서 그 지역의 온도가 상승하는 현상이 일어난다. 앞에서 언급한 대 로 불활성 물질을 사용하는 유동충 연소로의 경우는 석탄의 농도는 I ~4% 정도에 불과하다. 유동충 연소로의 장접은 열전달계수가 커서 열회수운이 높으므로 장치비가 절감되고, 넓은 범위의 연료를 사용할 수 있고 석회석 둥을 동시에 주입하여서 공해물질인 SOX 를제거할수 있으며, 바교적 낮은 온도에서 조업이 가능하므로 NOx 배출이 적다는 접 등 여러 가지 장접으로 근래에 와서 이에 대한 연구가 활발히 진행 중이다. 유동충 연소로에서 석탄연소 메카니즘은 석탄입자 크기에 따라 변 한다. 죽 입자크기가 1~3mm 인 경우에 연소는 주로 산소가 탄소 표면에 확산되는 울에 따라 조철되나, 입자가 1mm 보다 작으면 연소 는 C+~22 ->CO 의 반응속도에 의하여 좌우된다 .36) 단일입자의 유동 충 연소시의 현상을 그립 3,29 에 도시하였다 .37) 단일입자 연소 확산에 의한 단일 탄소입자 연소의 경우 산소의 농도가 입자표면 에 거의 없다면 탄소 내부 반응은 없을것이다 . 그러면 dp .fdt = o, 죽 시간에 따른 탄소의 밀도 변화는 없고 확산계수 Ko=D/r 이라면 쓰d도t : MC DrC 。/I!! (3. 35)
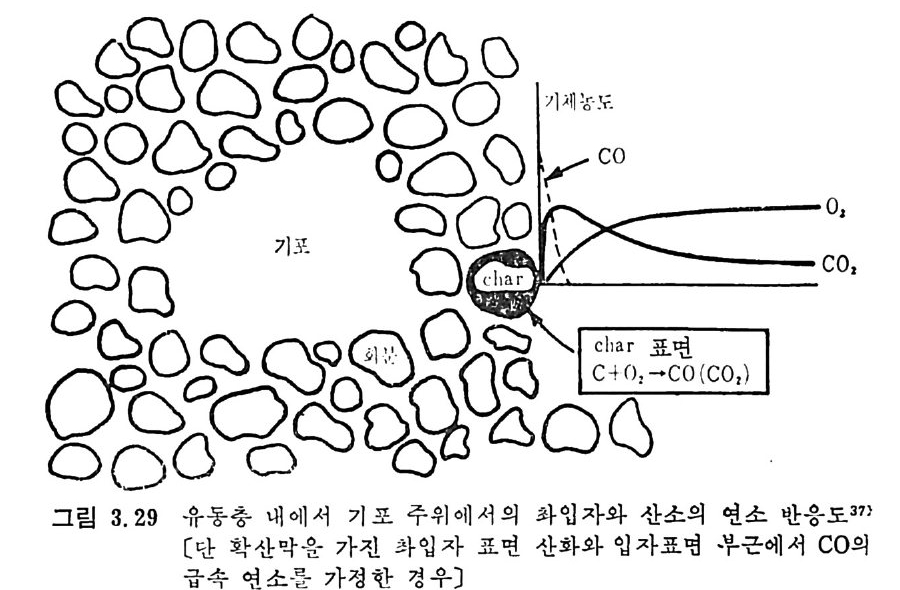 >기 재놉 도co o,
>기 재놉 도co o,
여기서 r 은 입자의 반경, M c 는 탄소의 분자량, Co 는 산소의 몰농도, p c 는 탄소의 밀도이다 . 상기식을 시간의 함수로 표시하면 t= KD(dJ- d 2) (3. 36) 이 되고 여기서 do 는 초기 입자크기이고 KD 는 확산연소상수로써 다 음과 같 이 정의된다 . KD=- .Bf!M..c: . D C 。 (3. 37) 또한 d=O 일 때 t=t c =KD 석이 되고보통 이 관계를 Nussel t연소시 간 자승법 (squ are law) 식 이 라고 한다 . 상기 식 (3. 35) 와 tc = KD d3 식 울실험으로 조사한결과입자크기가 300µ~4mm 인 10 종류 석탄과 산 소 %가 3~70% 범위에서 비교적 찰 일치한다고 발표되었다 .18) 석탄연소 실험의 경우 연소시간과 연소상수를 계산할 때 입자의 밀 도가 질량감소와 괭 윤 (swe lli n g)에 의 하여 감소되 는 것을 보정하여 야 한다. 팽윤계수 f는 여러 석탄의 경우 대략 I.5 로 나타났고 38) 그 보 정은 K0xC1 J 1oo f로 하고 여기서 c, 는 석탄시료의 고정 탄소합량이 며 이에서 얻은 이론치와 실험치는 찰 일치하였다 .18) 이는 실제 반웅
은 탄소표면반응 (C+0 2 -,C02) 이 지 배함을 의미한다. 그러나 CO 의 경계면에서의 연소가 빠르면 CO 2 가 주생성물이 된다 . 만일 co 가 경 계면에서 느리게 반응하면 연소울은 증가한다. 고온 (>1000°C) 에서는 CO 2 가 다시 반응을 시작하여 CO 로 입자표 면에서 환원되고, 다시 산화되어 고체표면으로부터 반경거리 밖의 표 면에서 CO2 가 되어 이중막이 형성되었다고 봅 수 있다. 최 근에 Ranja n 과 Wen39 ) 은 유동충 연소로의 연소효 율, 초 }와 S02 의 흡수물인 석 회 석 의 elutr i a t i o n 과 이 의 입 자분포 및 비 말 동반 율 과 입 자배출률, 충온도분포, S02 의 제 거 울, S02 와 NOx 의 배 출율 , 산소, 일산화탄소, 이 산화탄소, 휘 발분, S02, NOx 의 충 높 이 에 따른 농도 를 예측할 수 있는 모델 식을 제시하였다. 바교적 낮은 온도 (750-950°C) 에서 조업되는 유동충 연소로에서는 S02 와 NO,, 의 배출양온 공해의 한계치 내에서 조업이 가능할 분만 아 니타 유황함량이 많거나 저열량의 석탄도 잘 연소시킬 수 있는 장접 을 가지고 있다. 석탄연소시에 배 출 되는 S02 가스의 흡수 를 위하여 서 li mes t one/dolom i t e 를 첨가하며 보통 유동충 연소로를 조업할 때 의 석탄의 농도는 대략 전체의 4 % 이며 상기 첨가제는 S 아와 반응하 여 CaS 아가 된다. 또한 비교적 낮은 온도에서 조업되는 관계로 NOx 의 배출도 낮고 회분의 cl in ker 형성도 거의 없다. 유동충의 장접중 의 하나는 높은 열전달 특성을 둘 수 있다 . 죽 유동충 내의 열전달 관 표면과 연소충 사이의 열전달계수는 250~420W/m2°K 의 법위에 있으며 열생성률도 비교적 높은 2.o-5.oMW/m3 범위에 있으므로 보 통의 분란 보일러보다 작은 체적으로 주어전 용량의 연을 얻을 수 있 다. 이제까지 여러 연구자들이 유동충 연소로의 수학적 모델을 이상 이 론(t wo ph ase the ory) , 죽 유동총은 기 포상과 emulsio n 상으로 이 루 어졌다고 가정하여서 제시하였다. 37•40•45) Ra j an 과 Wen39) 의 모델의 가정인자들은 1) 석탄은 탈휘발 후 휘발분의 연소가 일어난다. 2) 석 회석 에 이 산화유황이 흡수된다. 3) NO,, 의 생성과 좌에 의한 NO,, 의 환원 4) 좌와 석 회 석 의 마모 및 elutr i a t i on
5) 기포의 수력학적 독성 6) 고체입자의 혼합 7) 기체-고체간의 열전달 및 열전달관 표면과 유동물질간의 열전달 a) free board 의 반응 유동충 연소로의 모델을 설정하기 위하여서 다음과 같은 가정을 세 웠다. 1) 고체입자 혼합을 계산하기 위하여 단상 back-flo w cell 모델을 사용한다. 2) 기체상의 물질수지는 이상 기포 assembla g e 모델을 사용한다. 3) 기 포상과 emulsio n 상간의 고체 입 자의 교환은 매 우 빠르다. 4) 기 포크기 는 유동충의 내 경 과 분산판으로부터 의 높이 의 함수이 다. 5) 기포상은 기포와 cloud 로 구성되어 있고 기포와 emuls i on 상간 의 기체교환계수는 축 방향으로서 기포크기의 함수로 분포되어져 있다. 6) emulsio n 상을 통한 기 체 유속은 최 소 유동화 속도와 같다. 7) 석탄의 탈휘발은 순간적이나 유동충 내에서는 균일하지 않으며 휘발분 배출률은 석탄의 혼합물에 비례한다. 8) emulsio n 상에 서 휘 발분이 배 출된다. 9) 휘 발분 질소와 유황분은 충 온도의 함수로 증가한다. 46) IO) 찬류 좌의 유황과 질소성분은 좌 연소시 S 아와 NOx 로 배출된 다. 모델의 배경, 유동충 내의 여러 물리 • 화학적 공정을 그립 3. 30 에 보여주고 있다. 전체적인 연소공정의 기본요소들은 다음과 같다. ® 탈휘 발 (Devola ti l i za ti on) 과 좌 연소 고온의 연소로에 석탄 입자의 주입은 급속한 가열로 인하여 탈휘발 또는 열분해가 일어난다. 이 휘발분은 emuls i on 상에서 생성되며 충 온도와 초기 휘발분함량의 휘발분 생성윤을 결정한다. 휘발분 생성물을 다음의 경험식으로부터 결정할 수 있다 .47) V=VM 결책 A=exp (2 6.41-3.961 1n t+ o.0115VM) B=o. 2(VM 一 10. 9) (3. 38)
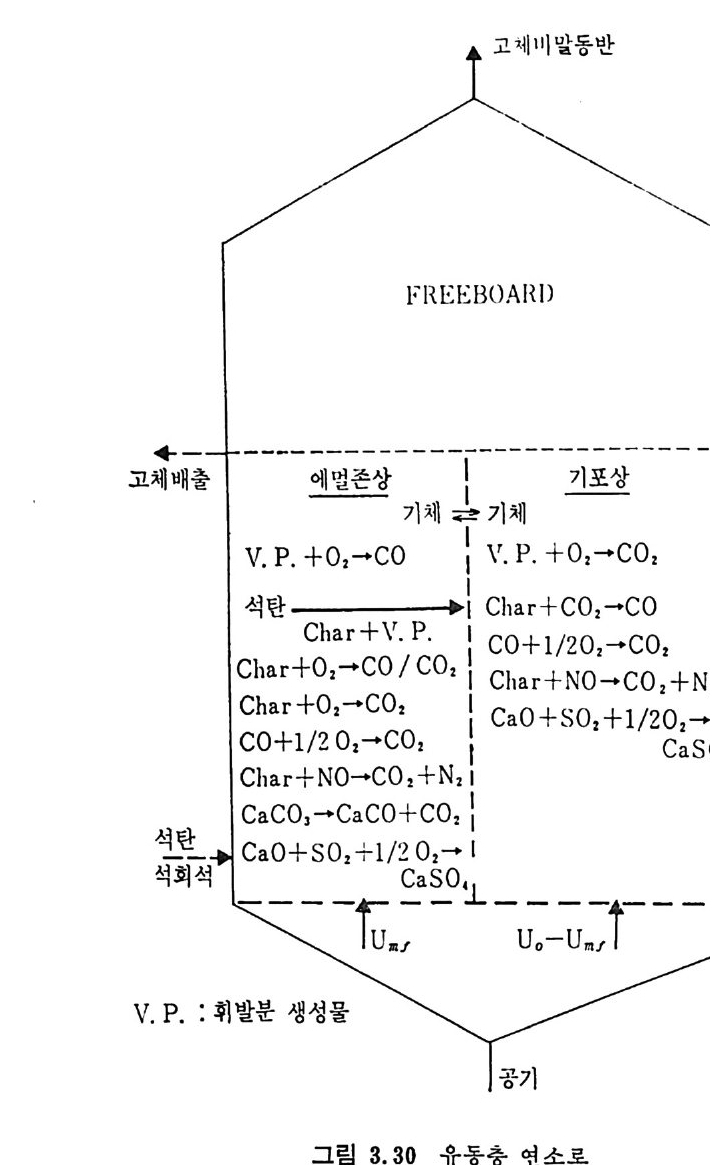 고 세 비말등반
고 세 비말등반
탈휘 발 ( _ devola tili za ti on) 생 성 물의 무거 1 분율의 조성 은 Lois o n 과 Chau· v i n48) 의 휘발분 VM 을 근거로한 실험식으로부터 예측할 수있다. 죽 CH.=o. 201-0. 469 VM+o. 241 VM2 H2=0.157-0. 868 VM+1. 388 VM2
C02=0. 135-o. 900 VM+ 1. 906 VM2 (3. 39) CO=o. 428-2. 653 VM+4. 845 VM2 H20=o. 409-2. 389 VM-4. 554 VM2 Tar=-o. 325+7. 279 VM-12. 880 VM2 열분해시의 휘발분 질소 생성물, VN 은 건조석탄을 근거로 할 때 46) 주 어전 온도 T 에서 VN = o. 001 T - o. 6 g/g coal (d. b) 또한 휘발분 유황 생성률 Vs 는 Vs = o. 001 T - o. 06 g/g coal (d. b) 이제까지의 영분해 (devola ti l i za ti on) 에 관한 많은 연구가 이루어졌으 나 열분해율에 대한 확고한 표현은 없고 특히 열분해울과 유동충 내 의 입자혼합의 상관관계도 정립되지 못한 상황이다. 이는 열분해 과 정이 입자크기, 온도 둥의 함수관계로서 석탄의 종류에 따라 변화하 기 때문이다. 유동충 내에서 완전열분해되는 데 필요한 시간은 1mm 입 자의 경 우 o. 5~1. 0 초라고 Beer49) 가 예 측한 반면, 준역 청 란과 석 회 석 을 혼합한 유동충에서의 완전열분해 시간을 Wen 과 Chen51) 은 800°C 에서는 4 초, 900°C 에서는 3 초로 예측하였다. 그 반떤 유동충 내의 입 자혼합 시간은 유동충의 크기, 석탄의 주입점둘의 위치에 달려 있고 o.61m 며 단면적에 높이 1.22m 인 충 높이에서 기체의 공탑속도가 1. 22m/s 일 때 2~10 초 정도로 유동충 내 의 열전달관의 유무에 따라 변화한다. 그러므로 석탄의 탈휘발은 주로 석탄의 주입접에서 일어난 다고 할 수 있겠다. 여기서 휘발분은 입자혼합계수 f w 에 비례하여서 생성되는 것과 나머지는 석탄의 주입접에서 생성되어 (1-f w) 에 비례 한다고 가정한다. 에멀촌 (emuls i on) 상의 산소농도가 낮으므로 여기서 휘발분 기체는 부분연소로 인하여 CO 를 형성하고 기포상으로의 휘발분의 교환은 충 분한 산소를 가전 기포상에서 완전연소되어 C 아를 생성하게 된다. 죽 co 가 산소와 완전반응하여 C 아를 생성하는 반응률은 다음과 같 이 표현된다 .50) CO 十 --20 2-->C02
r,.=3 x 1010(bf 8exp ( -6. 699 x 107/RT) Y,~;i • ¥;。• ~1m7. 5o Y 。l e/cm3•s (3. 40) 찬류 좌의 연소반응은 다음과 같다. C+702 一 (2 국 )co+ (중 -1)co2 여기서 Yn,o, Yo 는 H20 와산소의 몰분율이고 R 은 기체상수이며, ¢는 좌연소의 메카니즘계수로서 좌로부터 CO2 가 수송될 때의 값은 1 이 고 co 가 수송될 때는 20 이다 .23) 그러므로 ¢는 좌의 입자크기와 온 도의 함수이다. 입자가 작으면 좌연소시의 co 가 빠론 물질전달에 의 해 확산되어 나가서 입자 밖에서 CO 2 를 형성한다. 그 반면 큰 입자 의 경우 물질전달이 느려서 입자 경계면 안에서 co 가 연소하여 CO2 가 수송되 어 나간다. ¢ 는 다음과 같이 표시 된다. d• = 무p+ 2 ; dp< o. 005 cm ifJ=p+ 2 ~;o .oo5
이며 Tc 는 좌입자의 온도, D 는 산소_질소에 대한 분자확산 계수, d p는 좌입자의 직경이다. 작은 입자의 경우 산소가 좌입자 표면으로 확산되는 것이 연소의 화학반응률보다 빠른 반면, 큰 입자의 경우 산소의 확산이 화학반응률 보다 느리다. 그러므로 고온에서 확산항이 큰 입자의 경우 반응을 조 절하나 저온에서는 화학반응항이 전체 반응을 지배한다(그립 3. 31). 연소시 생성된 CO2 는 다시 좌와 반응한다. 죽 C+C02 一 2CO 또한 이 반응물 52) 은 다음과 같이 표시 된다. reo,=rrd; Keo, Ceo, gm ole/s•p a rtic le
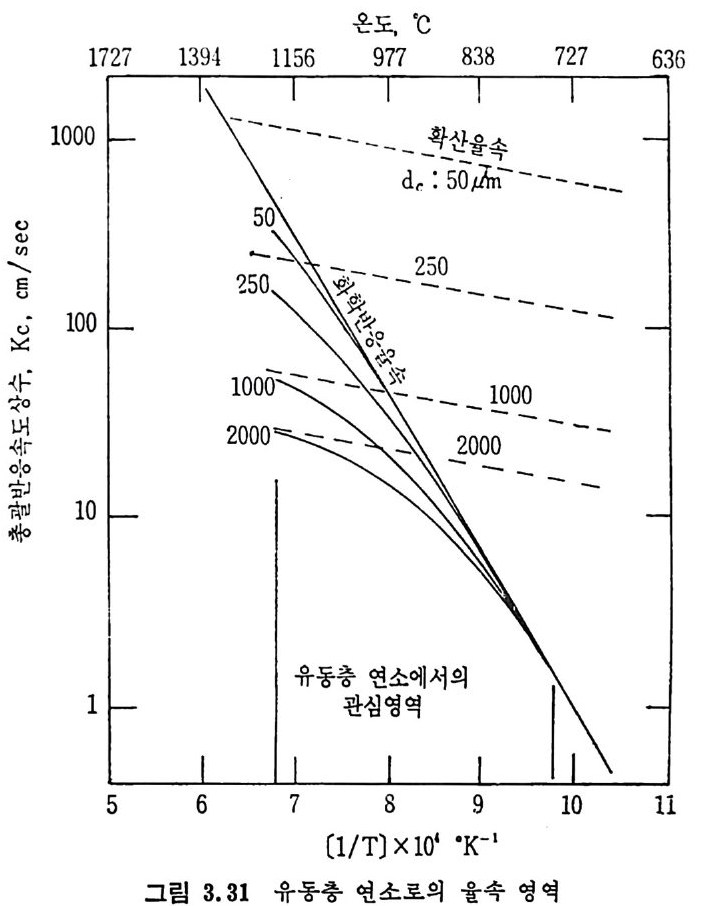 온도. •C
온도. •C
Kco,=4. 1 x 108 exp ( -2. 478 x 108/RT)cm/s ® S02- 석회석반웅 석탄 유동충 연소로에 석회석을 첨가하면 석탄연소시 발생하는 S02 와 반응한다. 즉 cao+so 곱 ~2 2 一 Ca S04 석 회 석 과의— 반응 률 n 은 다음과 같이 표현된다. 63- 6 4) m= r6_ dl Kv i Cso, gm ole/s•p a rti cle 여기서 KVL 은 전체 체적반응물 상수로서 석회석 전환, f L 에 따라 급 속히 감소한다. KVL 은 다음 식으로 계산할 수 있다. Kv i=K ~L Sg AL 여 기 서 K~i = 490 ex p(一 7. 33 x 107/RT) g/c m3s 이 며 54) Sg 는 비 표면적 으로 Borgw ardt 의 실 험 결과 52) 로부터 calcin a ti on 반응온도에 따라 다 음과같이 표현된다. S6=-38. 4T+5. 6 x 104 cm2/g ; T~I, 253°K =35. 9T-3. 67 x 102 cm2/g ; T<1, 253°K 여기서 i L 은 석회석의 반응률로서 전환율과 온도 및 입자크기의 함수 이다. 석회석의 반응률에 대한 gra i n 모델을 Ish i da 와 Wen55' 및 Raja n 등 56) 이 제시하였다. ® NOz- 최· 반응 질소 산화물은 휘발분과 좌 연소시에 발생되며 휘발분 중의 질소 성 분과의 반응으로 질소로 환원된다. 휘발분이 연소될 메 암모니아가 산화되어서 질소 산화물을 만들며 찬류좌가연소될 때도 좌의 질소성 분이 산화되어서 질소 산화물을 생성한다. 생성된 질소 산화물은 다 시 카와 다음과 같이 반응한다. C+2NO 一 C02+N2 질소 산화물의 상기 환원반응물, rNa57-58) 는
rNo = rrdi KNo CNo, gm ole NO/s • pa rti cle 여기서 KNo=5. 24X 107 exp ( -1. 424X 108 RTm) emf s @ 좌와 석 회 석 의 마모 (a tt r iti on) 와 비 말동반 (en t ra i nmen t) 유동충 내의 격렬한 고체입자의 혼합에 의하여 입자는 마모된다. 마모윤은 에너지 주입불에 비례한다. 그러나 마모된 입자의 크기분 포는 입 자 종류나 조업 조건에 거 의 무관하다. 59) 유동충에 주입 되 는 에너지는 주어전 공탑속도 Uo 에서 최소 유동화속도 um, 의 차이 (U 。― u m ,) 에 비례하며 입자 무게에도 비례한다. 마모입자의 생성률 R. 는 다음과 같이 상관시킬 수 있다. 죽 R.=K(U 。― Um1)Mb, g/s (3. 41) 여기서 K 는 입자의 취약도(fri ab ility)에 의존하며 그 값은 회분의 경 우 9. I I X I0- 8 이 고 석 회 석 의 경 우 2. 73 X 10-s 이 다. 주어전 크기분율에 대한 좌와 석회석의 비말동반울 Rx 는 유동충내 의 그둘의 농도 bx 에 비례하여 증가한다. 즉 R, =E , b,, g/s (3. 42) 여 기 서 Ex 는 elutr i a t i on 윤 상수로서 다음과 같이 상관지을 수 있 다. 59) E,=G•ex p〔키 0. 4( 몫)( uou:Um / )0· 기 , g/ s (3. 43) 상기 식 은 수송이 탈 높이 (Transpo rt Dis e ng a g e Heig h t- T DH) 이 하에 서의 비말동반은 고려하지 않았다. 또한 TDH 이하에서의 비말동반울 은 free board 높이 의 함수이 며 유동 입 자충 표면 이 상 높이 의 함수로 서 다음과 같이 비말동반윤을 표시할 수 있다. Rx=Fo,x ex p〔금 T•ln( 근)〕 , g/s (3.44) 여기서 Fo,x 는 X 크기 분율입자의 바말동반울이고 275.0 은 주어전 유 동충의 free board 높이 (cm) 이 다. 기포가 유동충 표면에서 깨어지면서 기포의 와류 (wake) 에 있던 입
자룬 free board 에 뿌리 게 된다. 이 양을 Fo 라 하면 다음 식 60) 으로부 터 계산할 수 있다. F0=A,·( U:。 -Um1) fw (l-Em1)p , f,w , g/s (3. 45) 여 기 서 A,, fw, Cm/ 및 f,” 는 각각 유동충의 단면적 , 고체 혼합계 수로 wake 체적/기포체적 비, 최소 유동화시의 기공물 및 fr eeboard 에 뿌 려진 wake 의 고체 입자분율이다. 이 제 까지 문헌상에 TDH 계 산식 이 발표되 어 져 있 으나 61 - 64) Ami tin 둥 65) 이 제시한 석이 간편하고 연소로의 유동화 속도 법위에서 정확하 므로 다음 식을 사용한다. TDH=O.147 '[]~·2 ( 22. 4-1. 2 l,, Uo) , cm (3.46) 만일 TDH 가 free board 높이 보다 작으면 TDH 로 입 자의 비 말동반 율을 계산할 수 있다. @ Freeboard 반응 Freeboard 에서도 좌 연소, S02 홍수 및 NO,, 의 환원반응둘이 일어 난다. 또한 연소로로부터의 연과 배기가스 중의 열은 free board 내에 서 설치된 열전달관으로 회수된다. 또한 free board 내에서의 수력학적 흐름 목성은 유동충 내와 다르다. 즉 유동충 내에는 기포가 촌재하나 free board 에 는 기 포가 없 다. Freeboard 영역을 같은 크기의 여러 개의 구역으로 나누고 이 구역 의 크기를 Pecle t수, Np c’ 를 근거로 하여 추정할 수 있다 .6G) 죽 志=값文+틀 ; NR,<2,000 _志=풍운+賊 ; NR,>2, 000 (3. 47) 여 기 서 NR,=D1 U0 Ps:I µ, N,,= Uo Di /E2 , N,.=µ/Dp 6 로 D‘ 논 유동충 의 직경, uo 는 평군 유동화 속도, pg.는 기체밀도, µ는 기체접도, Ez 는 free board 에 서 의 축방향 분산계 수이 다. 만일 여 기 서 Ez 값을 안다면, free board 내 의 comp ar tm ent 의 수는 아래 식 으로 계 산할 수 있다. 석 r= 부u 。
주어전 com p ar t men t에서의 농도는 일정하고 그 높이를 알 때 그 구획 (comp a rtm ent) 의 크기 를 6Z 이 라고 한다면, 입 자의 체 류시 간은 6Z/(U 。― UT) 로 표시할 수 있다. 여기서 UT 는 입자의 종말속도 (ter mi na l veloc ity)이다. 그러면 고체입자의 체류량 (holdu p)은 각 구획내의 고체의 체류량=(고체 입자의 상향+하향유량) x (고체 입자의 체류시간) 으로 표시할 수 있다 . 좌입자의 연소시간 t b 는 다음 식으로부터 예측할 수 있다 .23) tb = pC Rg T,R/ (96 ¢ D P。 , ) @모델 설명 주어전 입자크기의 마모에 의한 크기에 따른 분리울 (elu t r i a ti on rate ) 은 각크기 분율의 합이 다. 각크기 분윤, x 에 대 한 물질수지식 은 59) w,,x+Wx . I+axK 述 = M 갯 %/M i +Rx qi x(I 一 P1) +Rx q2 x(I-q1 x ) (I —P 2) +Rx(I-q1 x)(I-q2 x ) +KxMx+ Wx (3 .. 48) 여기서 w,,x 는 입자의 주입률, Wx 는 주어전 크기 분율에서 크기 감 소로 인한 입자의 전환율, ax 는 X 크기 분율에서의 전체 마모 분말 의 비율, Kx 는 마모윤 상수, Mx 는 묘크기 분율의 유동충 내의 무 게, W 국 입자의 배출물, Mb 는 유동총 내의 입자 무게, Rx 는 elu- tri a t i on 울, qlx , % 는 1 차와 2 차 싸이 크론에 서 의 X 크기 분율의 포 집효율, P1 , P2 는 1 차와 2 차 싸이 크론으로부터 순환되는 입 자의 비 례 상수이다. 입 자크기 의 감소울은 다음과 같다. 뿜 = -K,M(U 。 -Um f) (3. 49) 여기서 M 은 초기 석탄입자 크기로부터 d 쵸 1 기로 감소된 입자들의 무게이다. 입자의 크기가 4 와 d/J +I 사이에서 감소된 울은
뚜d, =二3 d p (U 。_麟) (3. 50) 상기 식 (3. 49) 를 (3. 50) 으로 나누면 쓰dd쓰p -= d그p 그리고 4 와 dEI 사이에서 적분하면 다음과 같다. 붑=(뚝 )3 이 분율은 전체 주입입자의 X' 크기분울이 ( x +1) 크기 분운 로 감 소된 것에 비례한다. 그러므로 W x = 〔 W1,x+axK(U 。 _U w 1) M ; -t- Wx 玉 ]· (dP+ 1/ dp) 3 이 된다 . ® 물질 및 에너지수지 물질수지는 휘발분 기체, CO,CO2,02,S02 및 NOx 의 기포상과 에 멀존상에서의 유동충 내와 free board 내에 대하여 세워야 한다. 에멀 촌 (emuls i on) 상의 산소농도에 따라 물질 수지식은 변한다. 에멀존상에서의 충분한 산소가 존재하지 못하게 되어 휘발분이 완전 연소가 되지 못하므로 에멀존상에서의 휘발분 농도는 0 은 아니다. 또한 좌와 co 의 연소는 에멀촌상에서는 없다고 본다. 에멀존 ( emuls i on ) 상 수지식 산소 : YE,i= o.0 (3. 51) 휘발분 : FEM,i YE , v,;=F 마티 YE, v,; -1-a1 YE,V,i- 1 ( 휘 발분出 ) ( 휘 발분入 ) ( 휘발분의 기포상의 교환 ) --+XoR2 v,; (3.52) (휘발분 연소 ) (열분해시의 휘발분 생성 ) 여기서 FEM 은 에멀촌상에서의 기체의 물유량(g mole/s) 이고 따는 에 멀존상의 산소의 몰분율이 며 a1=KsE,i A ,,,· 4Z,. CBi P/Rg T,· 이 다. CO : F(CeOJl ,出; )Y e,co,;-1=F(eC1O1 ,入{)-1 Ye,co, i -1 군(CO 가Y e기,c o포,,·상 에 의 교환) (FEM,{-l E~,;-l+al YB,;) Vco+Rco,;+2 a4 YE,co,,; (3. 53) (휘발분 연소에서 생성된 CO) (연분해시의 (C 一 CO2 반응에서의 co 의 생성) co 의 생성)
여기서 a4=am A,AZ,·(I _c'._e ,,,.)(Kco,i7 < :X ) am= 6p b (1 —cmf ) dp Pch c,h 여기서 cC 와 E t는 기포룬 포함한 cloud 의 분율과 관의 기공물이며, Pb 오} Pch 는 유동충과 좌의 밀도이 며 cch 는 좌의 탄소농도이 다. CO2 : FEM,; YE,co,,;=FEM,i- 1 YE,co,,;-1-a1(YE,co,,;-Ya,co,;) (CO 백) (CO2 入) (CO2 의 기 포상교환) +Rco., ;— a4 따 ,co,,; (3. 54) (연 분해 시 의 (C-C02 반응시 의 C 야생성) CO2 의 소모 ) 기포상 수지식 산소 : FBM,i YB,i= FBAI,i1 따,i -1_a1 YB,i (산소出) (산소入) (에일존상과의 산소교환) 크감업,,. _ a1 YE~,co-,; a1 YE,Vi X o,,c (3.55) (카반응에 의 (CO 의 기포상에의 교 (휘발분의 기포상에의 한 산소 소모) 환에 의한 산소 소모) 교환에 의한 소모) 여기서 a2=am Ai ,; /::,Z;(Ec,;-ERaep,·; T )a ~,; X; CO2 : Fall,; Ya,co,,;=Fsu,;-1 Ya,co,,;-1-a1(Ya,co,,;-YE,co,,-) (CO2 出) (CO2 入) (CO2 의 에멀존상에의 교환) +a2YBi +a1 따 ,co,; +a1 Ye, v,; Vco2 (3. 56) (카연소로부 (CO 연소로부터 (휘발분 연소에서 터의 C 야생성) 의 CO2 생성) 의 CO2 생성) Freeboard 수지 식 산소 : Yo,;=O. o. (3. 57) 휘 발분 : FuT Yv,;=FMT Yv,;-1-FuT Yo,,·- /Xo2 (3. 58) (휘발분出) (휘발분入) (휘발분 연소) CO : FM(CTO Y 出c)s ,;=FM(TC OY 入c)o ,;-1+2 (aC'4_ YC e아o, ,;반 응에서의 co 생성) +Fm( YV'iJ -YV ',·) Vco (3. 59) (휘발분 연소시의 CO 생성)
여기서 a;= 了도근 re,; rr d;,,; Keo,.,· CO2 : FMT Yeo,,;=FMT Yeo,,;-1-a 갑 reo,,; (3. 60) (CO2 出) (CO2 入 ) (C-C 아 반옹시 CO2 소모) 상기석들에서 FBM,FEM,Fm 는 키포상 에멀촌상과 연소로 전체에서 의 기체 몰유량이고, YB, YE 는 기포상 및 에밀존상의 각각의 기체의 몰분율이 다. i 는 i 번째 comp a rtm ent 를 의 미 한다. 두번째로 에멀촌상에 충분한 산소가 존재하여 휘발분을 완전연소시 킨다는 조건에 대하여 상기한 바와 같은 수지식들을 세울 수 있다 .39) S02 와 NOx 의 수지식 열분해시 생성된 휘발분 내의 질소와 유황분 함량은 유동충의 조업 온도의] 함수이다. 휘발분 질소함량은 온도가 800 에서 1300°K 로 증 가하떤 그 함량이 20 에 서 70% 로 증가한다. 46) 열분해 후 좌에 남아 있는 유황과 질소성분은 좌 연소시 S02 와 NOx 로 배출된다. 이 S02 와 NOx 에 대한 물질수지석을 유동충과 fr eeboard 에 대하여 세우면 다음과같다. 에멀존상 수지식 S02 : FEM(S,i0 2Y 出E),S O,,;=FE,I( IS,i0-12 入YE), SO,,i- 1-(aS102(Y 의E ,기so 포,,.상-:과-Y의a ,so교,환. .-)) -aE,SO,,i YE,so,.;+RE,SO,,c,.·+RE,SO,,V,i (3. 61) (석회석에 (좌연소시 (휘발분 연소시 흡수된 S02) 배 출된 S02) 배 출된 S02) 여기서 as,so,,.-=A,,,.~Z,.(1-1: .,,.-1:,,,.) (I-1:m 1)K.,(~) NO : FEM,i YE,NO,;=FE'11 ,i- l 따 ,No,.--1-a1(YE,No,;-Ys,No,.-) (NO 出) (NO 入) (NO 의 기 포상과의 교환) -aE'NO, 』 Yg N0'i+ RE,N0'i+ R,E·No,v·i (3. 62) (좌에 의한 NO (카 연소시 (휘발분 연소시 감소) NO 배출) NO 배출) 여기서
ae,No,;=am A,,; 6 Z1(l- f ,,; -E1 , i )K£ . N O , iR一r 上TE _ .xi ,. 여기서 X,, TE 는 ith com p ar t men t에서 좌의 탄소 무게분율과 에밀촌 상에서 좌 경계면의 온도이다. 기포상 수지식 S02 : Fs(MS ,0 i 2 Y1: 1a:\), s o , ,;= FsM(S,i 0-2 1 入Y)s . so , , i - 1 군(S 0 (2Y a의. so에 , , 멀;-존YE상.s간o,의,; ) 교환) _(aB석.회 so 석,A에% 홉. 50 ,., +(R차B 연,S O소,,시C ,1 +R(B 휘,S발O분,.v .‘연 소시 (3. 63) 수된 S02) 매 순된 so 김 배 출 된 so 기 여기서 aB. SO ,.i = A,·‘. 식 Z, · (Ec, · -cB . i ) (1 _Em f) KVI(- ir:-) NO : FB(MN. Oi Y出D )N O,1= FBM(,N i -O I 入Y)B ,N o ,i- ) -aI((NY OB ,의N O에,, ·멀— 촌 따상 ,간NO의, i ) 교환) 一야 ,NO,,. YB,No,i+ RB,No,c,i+ RB,NO,v,i (3. 64) (카에 의한 ( 화 연소시 ( 휘발분 연소시 NO 감소) NO 배 출 ) NO 매출) 여기서 an,N O,i= am A,,,· 6Zi( E< ,i - ft,i)Ks ,NO,i~ R, ,P T Rx,i i Frep ' ·o ud 수지식 짜 : F(MST 02, Y出s)o ,, ;= F(MS0T2, Y入s)o ,,;_ 1(+SR 0s2o , 배.출; )一 a(so석 ,.회 Y s석o에,,; S02 흡수) (3. 65) 여기서 aso , . 1= (군 )NA,.( ~)Kv1 NO : FMT, YNO,i= Fm YN0`iJ 1+RNO,;-aNO,i yN ?'; (3. 66) (NO 出) ( NO 入) (NO 배출)(좌에 의한 NO 감소) 여기서 aNo,;= (급 )N,,; 1rd;,.i K No,;
경 계조건은 : YE,s0,,1= Ya, s0,,1= YE,No,1= Ya,No,1=0. 0 고체상의 물질수지식 고체 입 자의 ith comp a rtm ent 에 서 의 고체 흐름, Wnet, i 에 대 한 전 체 물질수지식은 다음과 같다. w,,,I,i= Wna,1·- 1+ wk.I· R ch+ w/a, i一 WAI._ ri (3. 67) (고체出) (고체入) (카 入)(첨가재 入)(고체제거)(카 연소) 경계조건 : w,1Cq =o.0 탄소의 ith comp a rtm ent 의 물질수지는 완전혼합흐름, Wmi x 를 도 입하면 다음과 같다. (Wmi x,i _ w' · i )X i +1 군 Wm i x , i - 1-Wn,r. i - 1+ Wmi x,; - Wo,;]X; + wmI.x, i _ l=ri_ w/c.I· C ch M (3. 68) 여기서 WIr 는 석탄의 주입량아고, X 와 r i는 쩐 com p ar t men t의 탄소의 무거 1 분율과 좌의 연소울이다. 경계조건은 Wmi x, 1=Wmi x,1 11= 。•° 에너지수지 에 너 지 수지석 은 i 구획 (com p ar t men t)에 대 하여 다음과 같다. C,(Wmi x.i — WC'.j) T; +1_c.{(WmI . x . i干 -w'· i _l+ 〔(i +1)1hcell 로부터 연入](싼 cell 로부터 열 배층) wm,.z.i_ wD.i) +cEm FMT} T,·+[ CS wmh. i -1+C 나 ?MT J T 티 〔 6 크)” cell 르부터 연入] +r; Q, h +gE, Q v ,co +gB, i Qv +!!co, 긴 ?co (좌연소로부 (에멀촌상에서의 (기포상에서의 (CO 연소에 터의 발영) 휘발분 연소열) 휘발분 연소연) 서의 발열) -q,n , W1a,;+ (W. ra. i C ,1+ W,,.i C ,1) T,,,.· (소성 (c q lc i na ti on) 연) (고체주입의 현영) =A,,; 6 ,Z; aHE,i U;(T.--Tw.i) + A,,; 6Z.-aH Rw,i u..... (3. 69) (냉각관에 의한 열재거) 여울 통한 영·손실) 여기서 C,,C,1,C,m,C,1 는 고체 입자, 첨가제, 기체와 석탄의 영용량 (heat ca p ac ity)이고, g E, g B, g co 는 에멀존상과 기포상의 휘발분연소 율과 co 연소울이며, aHE 와 aHE II'는 냉각관과 벽의 비열전달 표면적 이다.
Freeboard 의 에너지수지 에 너 지 수지 (i' comp a rtm ent) 식 은 다음과 같다. ( W‘’I/,1· C,+cF Fm) T,.-1 +ri q ch 〔(i -1) 구획으로부터 연入〕 아 연소열) (+ 휘g 발E 분.1 v연,c o소 연 ) +(gCOco 연,1 소co연 ) -((Withc cneull C로s부+터c rm연 F방m출))T i =A, .. - b,Z, -ane.,· U,-(T;-T,.,1.) +AI,1AZ; aHEW ,I. u ,v,,·(T,·-T ,.a11,;) ( 냉 각관에 의 한 열제거 ) ( 벽 을- 동한 열손실 ) (3. 70) 여기서 W,n, 는 입자의 비말동반윤, q ch, q u q co 는 좌, 휘발분 및 CO 의 연소열이다. T,. 와 T,.all 은 냉각수와 벽면 온도이다. 유등충 연소로의 수력학적 특성을 예측키 위하여 다음과 같은 실험 식 둥을 사용하였다. 최소 유동화속도 (Um1,cm/s)6n : Um1=( 경:)〔 {33.72 +~}1/2-33.7] 기 포직 경 (Ds, cm)68' : Ds=Ds11-(DsM-Dao)exp ( -o. 32/D,) DsM=O. 652(A,(U 。 -Um1)}0· -1- Dso=O. 347 (A,(U 。 -Um1)/nd}0·4 기 포속도( Ua, cm/s)69' : Us= U 。- Um1+0. 711 ./iDa 기 포분율 (€B)35) : g= (U 。 -UmI)/UB Cloud 분율 (Ec) 35) : Ec= EBm/ (ab —1) , ab = 느u각m/뇨 기체교환계수 .(K8E, I/S)70' : KsE=ll/Ds 고체 혼합물 (Wm;x, g /s)56' : Wm i x=(U。 -Um1)A ,f. . (1-fm /)p . 마모울 (Ra, g/s )59' : Ra=K(U 。 -Um1)M~ K=9. 11 X 10-s~2. 73 x 10-8, I/cm 또한 상기 모델식에 사용한 값들은 다음과 같다. 유동충과 냉각관 사이의 열전달계수 : U=o.03203J /s •cm2°K Freeboard 열전달계수 : (1/3)U, J/s •cm2°K 유동충과 벽 사이의 열전달계수 : o. 00879]/s•cm2°K
고체 혼합변수 : J,.= o. 075~0. 3 기체 와류 속에 고체입자를 free board 에 뿌란 분율 : f,,. = O. I~o. 5 냉각수 온도 : T,.=300°K Freeboard 벽 열전달계수 = o. 001047 J/s •cm2°K 고체의 열용량 : C, = o. 9001 J/g° K 기 체 의 열용량 : c,,. = 28. 47 +2. 0934 X l0- 3 t(° C ) 석회석 밀도 : 2.4g /c m3 석탄 밀도 : 1. 4 g/c m3 상기 모델에서 고체 혼합이 적을 때는 o. os
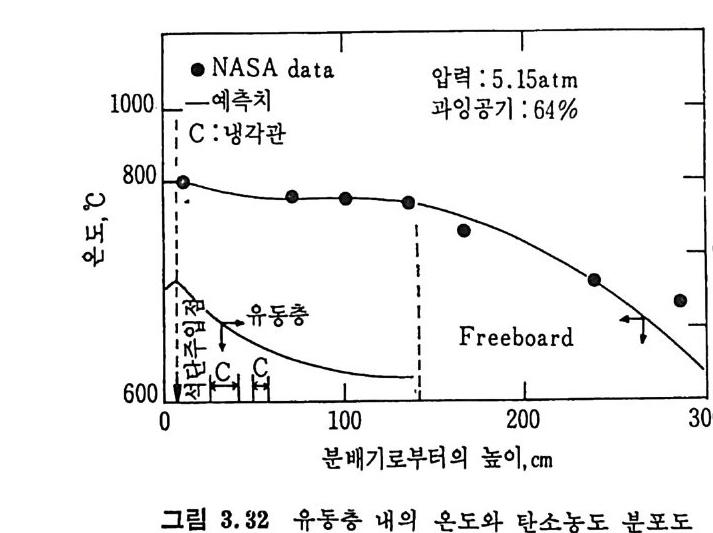 • NASA data 압력 :5.1 5 atm
• NASA data 압력 :5.1 5 atm
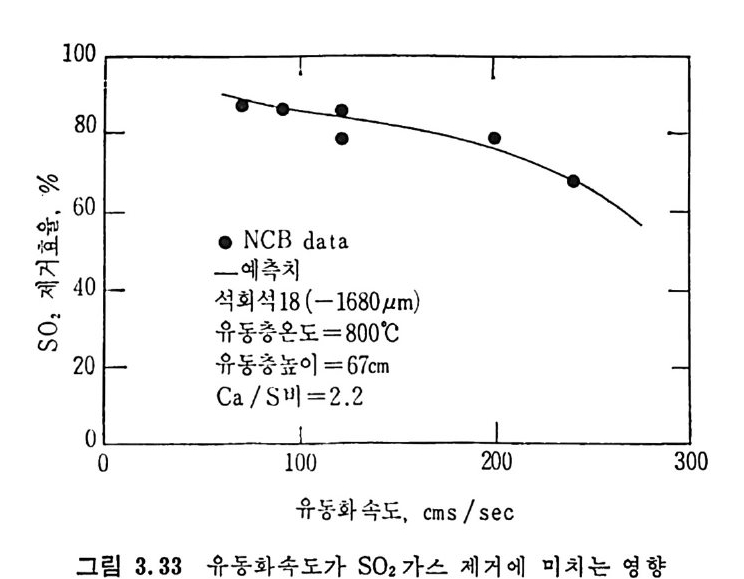 10 o8o6o4o
10 o8o6o4o
유동화속도가 S02 제거 효율에 미치는 영향을 그림 3.33 에 보여주 고 있다. 낮은 공기 유속에 서 는 elutr i a t i on 이 적 고 평 군 입 자경 도 적 다. 즉 석
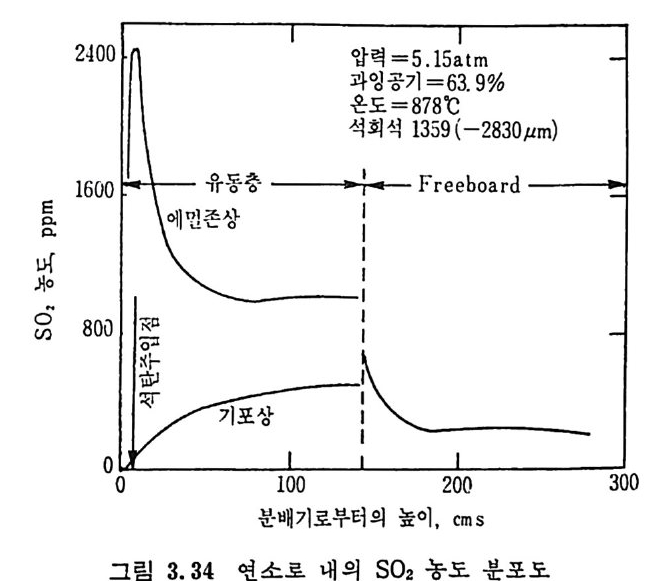 2400
2400
회석입자의 반응율은 높다. 또한 기체와 고체의 체류시간은 증가한 다. 그러므로 S02 제거 효율은 크다. 그러나 높은 공기유속에서는 비 말동반이 크고, 입 자크기 도 크다. 그러 므로 반응을은 작으며 체 류시 간도 짧다. 이러한 효과는 S 아제거 효울을 감소시킨다. NASA 연소로 모사로부터 얻은 S02 농도분포를 그림 3. 34 에 보여 주고 있다. 그림에서 보듯이 석탄 주입접에서 휘발분 연소에 의하여 많은 양의 S02 가 에 밀존상에 배 출된다. 이 S02 기 체 는 유동충 높이 에 따라 석회석에 흡수되어서 그 농도가 감소한다. 유동충을 떠나는 기체는 분말의 석회석과 fr eeboard 에서 접촉하브 로 유황분의 제 거 가 free board 에 서 크다. 유동충 온도가 NO 베 출 에 미치는 영향울 그립 3.35 에 보여주고 있 다. 여기에 평군 탄소농도가 온도에 따라 감소하는 것을 같이 도시 하였다. 그림에서 보듯이 배출기체 중의 NO 의 농도는 온도의 증가 에 따라 증가한다. 낮은 온도에서는 유동충 내의 많은 양의 좌가 NO 생성을 감소시키나, 높은 온도에서는좌의 함량이 낮으므로 NO 배출을 증가시킨다. 온도가 820VC 이상에서 최고접을 보이고 일정해진다. 이는 이 온도 이상에서 좌에 의한 NO의 환원이 빠르고 충 내의 좌함 량이 감소하기 때문이다.
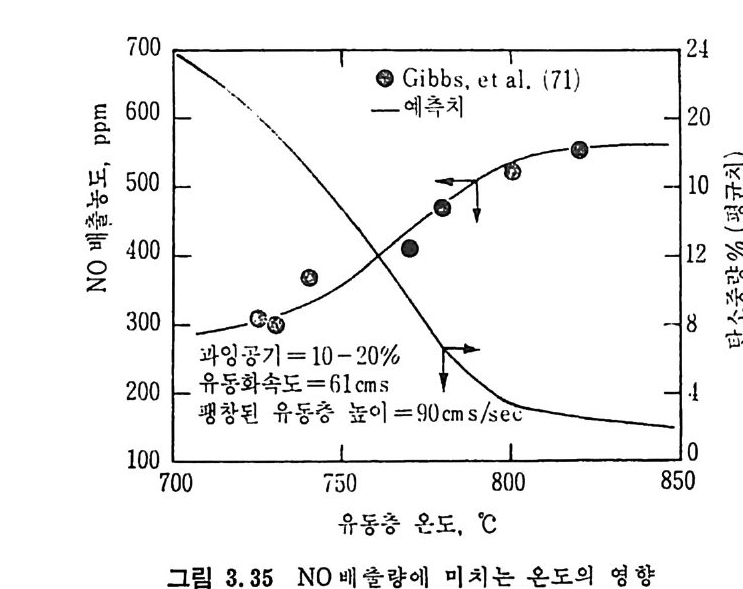 E움 670000 ,\ `\ ` \` ―&예 G i측 b:b 치s , eft al. ·(71 ) -」 1204 률20
E움 670000 ,\ `\ ` \` ―&예 G i측 b:b 치s , eft al. ·(71 ) -」 1204 률20
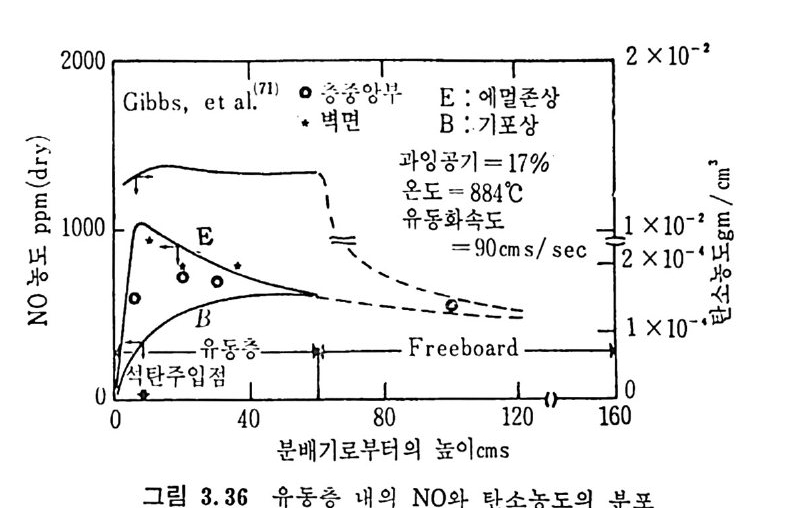 2000 2 X 10-2
2000 2 X 10-2
기포와 에텔촌상에서의 NO의 농도분포를 그림 3.36 에 보여주고 있다. 그립에서 실험전과 71) 는 유동충 중앙과 벽에서 측정한 값의 평 군이며 벽면의 농도가 중앙보다 높다. 이는에멀촌상에서의 NO 생성이 그곳에서의 휘발분 연소로 인하여 높음을 의미한다. 석탄 주입접에서 에밀촌상의 NO 의 농도가 높은 것은 석탄에서의 휘발분 배출과 이의 연소가 이 지접에서 높기 때문이다. 기포상에서의 NO 농도 중가는 좌
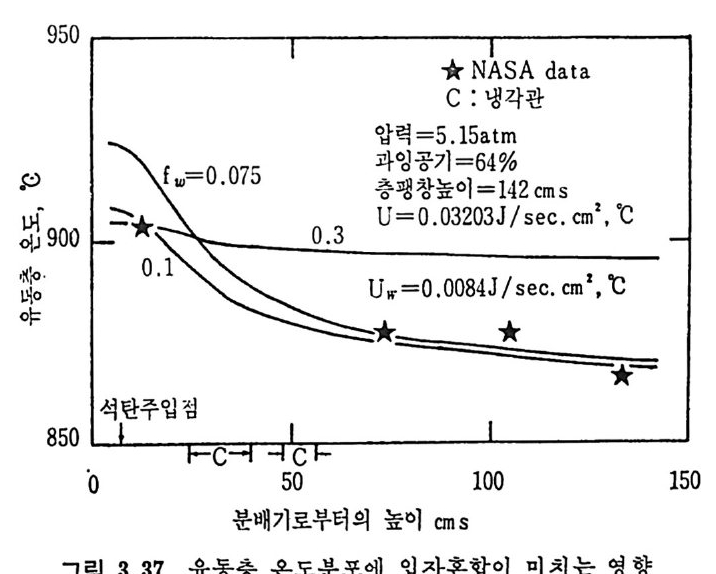 950 * NASA dat a
950 * NASA dat a
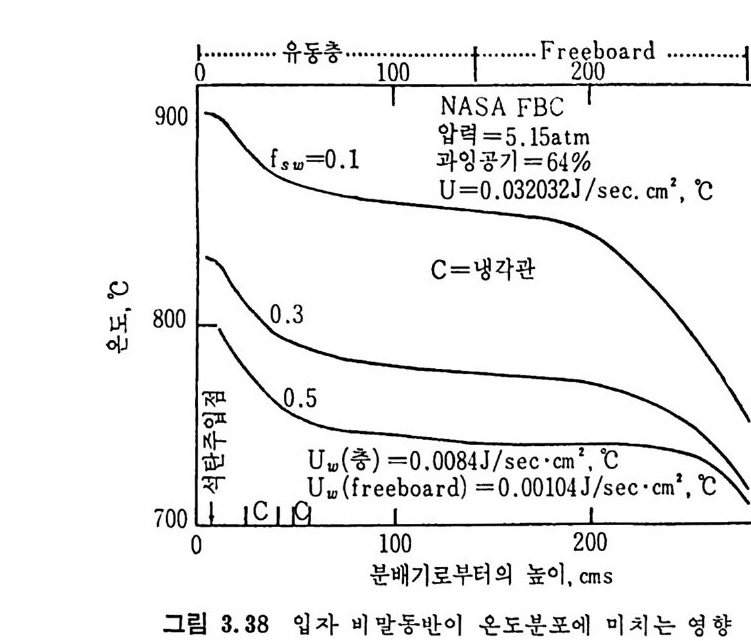 b... ......... 유동충 ..... 100… …, ••• t ..... … .Fr 앙 b8oard . … ..... . .. 1 :300
b... ......... 유동충 ..... 100… …, ••• t ..... … .Fr 앙 b8oard . … ..... . .. 1 :300
와 휘발분의 연소에 기인한다. Freeboard 에서는 좌 연소와 NO 의 환 원이 일어난다. 이 두 가지 경쟁반웅 결과에 따라 배기가스 중의 NO 양이 결정된다. 상기 모델에서의 두 가지 주요 변수는 입자 혼합변수 f, ’ 와 fre e· board 에 뿌리 는 기 포와류 속의 입 자분율, f,” 이 다. 이 변수들이 유 동충 온도에 미치는 영향을 그립 3.37 과 3.38 에 보여주고 있다. 그립 3.38 에서 f'의 낮은 값은 입자 혼합이 낮음을 의미하며 낮은 f'에서는 대부분의 휘발분배출은 석탄주입구 부근에서 일어난다. 그 러므로 이 지접에서의 휘발분 연소로 온도가 상승한다 . 그 반면 f 값 이 증가하면 입자의 혼합이 잘 일어나서 온도분포가 균일하게 된다. Freeboard 에서의 반옹 정도는 입자의 체유량에 달려 있다〔식 (3. 45)). 주어진 조업조건에서 f,'의 증가는 유동 입자충표면에서의 free board 에 뿌리 는 입 자의 양에 달려 있 다. 만일 많은 양의 입 자를 뿌리 면 좌의 elutr i a t i on 은 증가한다. 그 결과 연소효율과 온도는 감 소한다. 또한 f“ 가 증가하면 free board 의 연소가 증가하므로 여 기 서 의 온도 강하는 감소한다 . 기포크기 를 comp a rtm ent 크기 와 같다고 가정하고 기 포크기 가 유
동충 온도분포에 미치는 영향을 그림 3.39 에 보여주고 있다 .
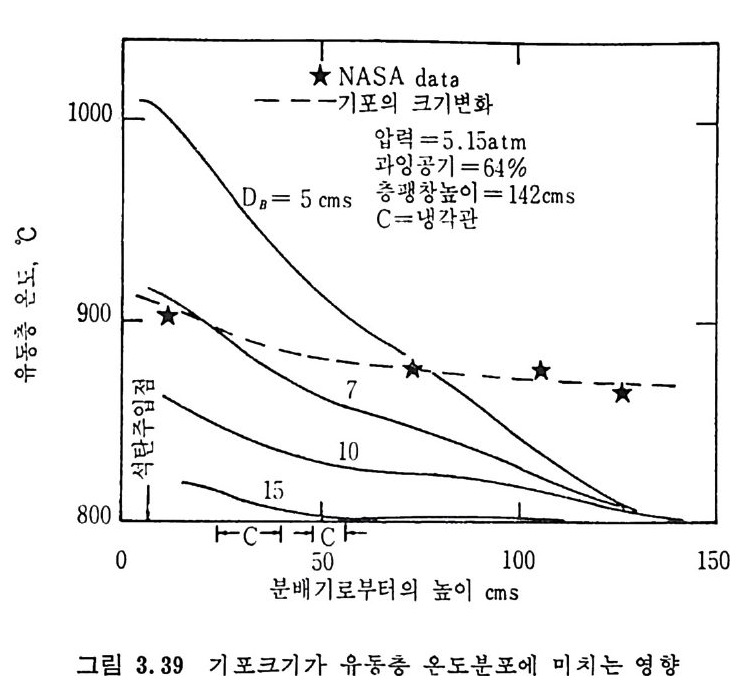 1000 —-*一 기 N포AS의A 크da기t a변 화
1000 —-*一 기 N포AS의A 크da기t a변 화
단일 기포크기를 조철변수로 할 때 기포 직경이 작으면 유동충 내 의 연소울은 크게 예측되는 경향이 있다. 그림에서 보듯이 기포 직 경이 증가하면 충 높이에 따른 충 온도 감소가 작다. 또한 평군온도 는 연소울이 감소하여 낮아진다. 여기서 보듯이 기포크기는 중요한 변수로서 기포의 합체 현상을 유동총 연소로 모델에서 고려하여야만 한다. 유동충과 냉각관 사이의 열전달계수가 충의 온도에 미치는 영향을 그림 3.40 에 보여주고 있다. 열전달계수 변화에 따른, 높이에 따른 온도분포에는 벌 영향이 없 으나 온도크기에는 영향이 있다. 그립에서 보듯이 열전달계수가 O.032 에서 o.0263]/seccm2°C 변화시 온도 차이는 40°c 가 되므로 유동충 연소로 설계시 열전달계수의 정확한 예측이 충 온도분포를 예측하는 중요한 인자아다.
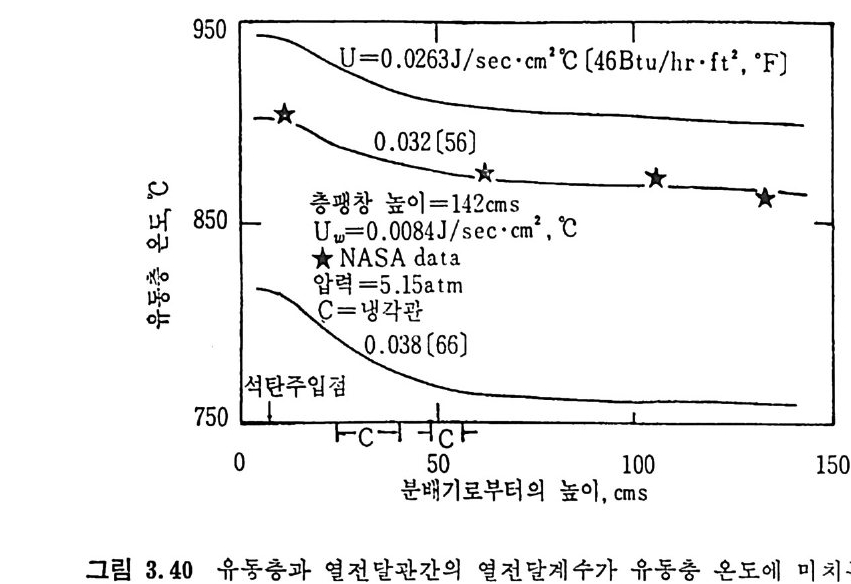 950
950
c) 분란연 소 (pu lveriz e d coal combusti on ) 분란연소 장치는 그린 3.14 에 보여주었다. 최근에 작은 입자들의 내부반응 독성에 대한 연구둔이 진행중이며 74-77) 이에서 얻은 내부반 옹 결과로부터 통일된 이론식을 구하려는 노력이 진행중이다 . 일반적 반응큘식 반응률을 결정하기 위하여 분탄을 불꽃에 주입시킨 후 회분을 추적 자로 사용하여 질량감소로서 연소울을 결정한다. 이때 불꽃은 1 차원 p lu g흐름이 요구된다. 여기서 회분이 벽에 붙음 없이 흐르게 되면 fur nace 내 의 회분흐름은 일정하다. 그러므로 연소물질 1 회분비 로부터 연소물질의 질량흐름 또는 연소울을 구할 수 있다. 만일 입자가 반경 ro 를 가진 일정한 크기로 그 밀도가 Po, 연소질량률- J라 하고 주입 량을 ]o, 초기 단일입자의 질량, m 。의 질량분율을 m 이라고 하면 다 음의 관계가 성립된다. j。I =m-m 。 = 규r8 pp。 (3. 71)
불 꽃 (fl ame) 실험결과 룬 평가하기 위하여 m 을 시간이나 거리의 함 수 로 도시 하여 미 분하여 서 dm/ d t 값 을 구한다. 78 ) 단위 표면적당 총반응률 RT 는 (dm/ d t)/ 4 rrr2 이 되고 7 대신에 m 을 대입하면 RT= ,J r .:( mdm/4I dnpt ) 2 /a (3.72) 실험 결 과 들은 착산조전 이나 화학반응 조 절 인 가 믈 평 가하게 된다. 일 반 적 인 전 체 반옹 물 은 RT= 」m_ .쓰d쁘t :로 표시하며 m 과 p값을 적절 하게 선 덱 하여 산소농도와 은도 의 함수관계 를 다음과 같이 표현할 수 있다 . ( 습) ’'( 톰 )= k 군 )c ~ ' J (T) (3. 73) 여기서 Co 는 산소의 농도이고 n= 경1- 일 때는확산조절이며, n=-;;23 - 일 때는 화 학반응 조절이다. 또한 n'=1.o 일 때는 확산과 흡착이 조절하 고 ,1l' = T1 또는 0 이면 탈착 이 반응을 조절하여서 내부 반웅 정도에 의 존 한다. TO . 75 일 때는 확 산조절이 되고, T 가 Arrhen i us 형 e-E/RT 로 표 시 되 면 화학반응이 조절하게 된다. 보통 식 (3. 73) 의 바른쪽 항 의 밀도 변 화는 무시하고 산소농도와 온도의 함수만으로 표시한다. 이 는 의부 반응만운 고려하는 것이며, 또한 반응을 1 차라고 가정하면 Co 와 p는 일정한 값이 되므로 불 타는 시간 (burn i ng tim e), le 는 초기 입 자의 직경, 아의 함수로서 확 산과 1 차 화학반응을 가전 연소시간 온 다음과 같이 표시할 수 있다 . 7 9) lc=Kc d 。 +Ko dJ . (3. 74) 여기서 Kc 는 화학연소 상수이고 KD 는 확산연소 상수이다. 실험결 과와 상기식과의 비교치를 그림 3.41 에 보여주고 있다. 입자 직경이 lOOµm 이상에서는 잘 일치하나 그 이하에서는 차이를 보이고 있다 .7) 반응차수 및 반응률 조절 메카니즘 반응 메카니즘 해석의 오차는 반응 차수와 반응위치(내부 또는 의 부)의 가정 이 정 확치 못한 데 서 유발된다. Arrheniu s 형 도표로부터
활성화 에너지는 대략 20~40kcal 를 보여주고 있다 . 여기서 만일 반 옹아 홍착에 의 하여 조절된다면 76) 식 (3. 73) 에 서 1l’ 은 :_이 나 0 이 된 다. 그러나 반응차수에 대하여는 아직도 뚜렷한 정의논 없다 .75 - 80) 그 이유 중의 하나는 반응온도 측정이 반응기 자체의 평균 온도이지 입
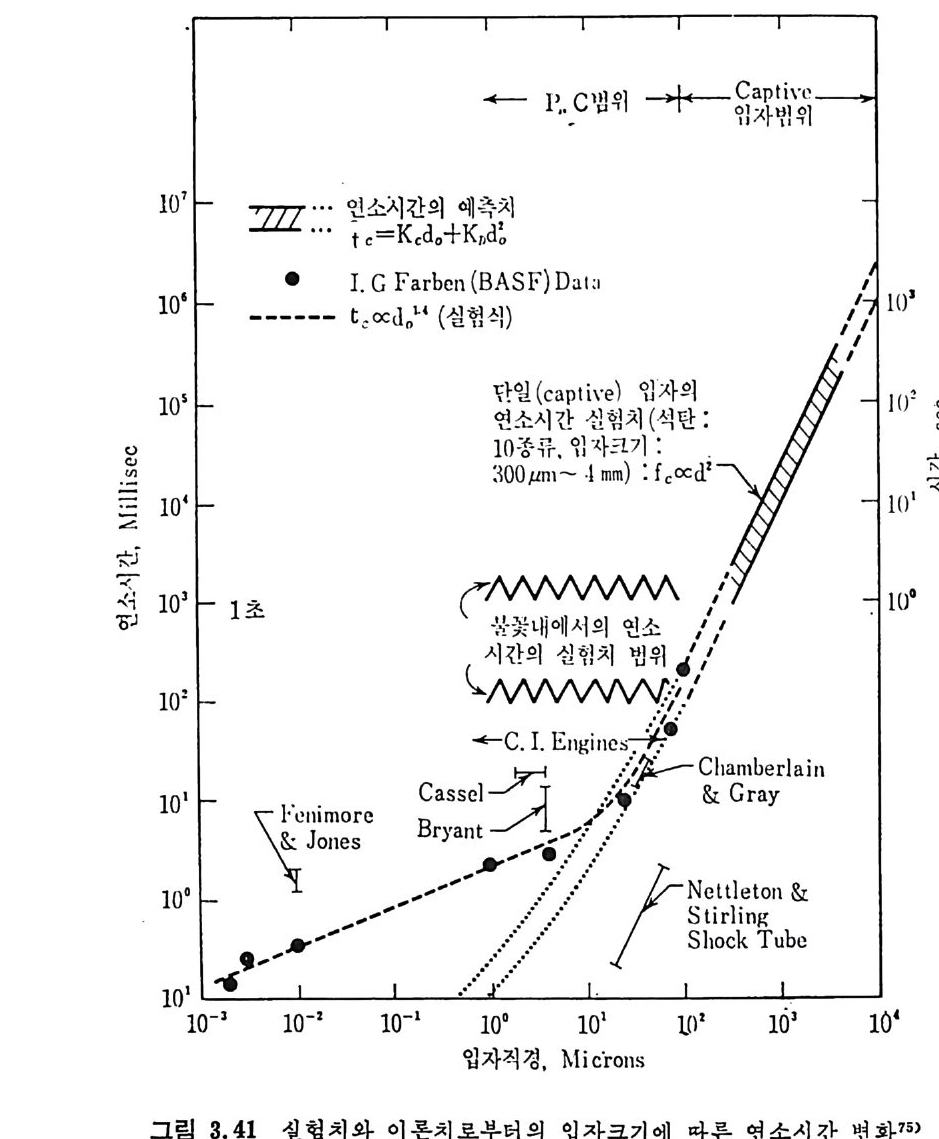 _一 I'.. C 법위 ―나 +_Ca pti v c
_一 I'.. C 법위 ―나 +_Ca pti v c
자표면의 온도가 아니기 때문이다. 실제 반응률은반응온도에는매우민감하나산소의 농도에는 큰영향 윤 받지 않는다. 만일 0 차반응이 라고 가정 하여 서 Beer8D 실험 결과를 온도와 반응률로 도시 하면 그립 3. 42 와 같다. 7) 그립 에 서 보듯이 실험 결 과는 두 그룹으로 나누어진다. 실험결과 I,2,5 와 6 은 기울기가 22kcal 가 되고 7,s,9 번은 기운기가 4 1 i kcal 에 해당된다. 1 번은 반응중에 활 성화 에너지가 변화하는 것으로 나타난다. 여기서 낮은 활성화 에너 지의 겅우는 기공확산이 반응을 조절하는 반면 ,75) 높은 활성화 에너지 의 경우는 입자표면반응이 입자 전체에서 균일하게 일어난다고 해석 할 수 있다. 즉 본 실험결과가 무연탄을 사용한 경우이므로 입자의 기공은 매우 낮다 .16) 그러나 부분적인 기공침두가 있을 경우에는 반 응시간에 따른 입자의 밀도면화를 고려하여야 하겠다. 입자 내부 반응을 직접 측 정하는 방법은 없으나, 표면적이냐 내부 기 공변화에 따른 이론식으로부터 추론하는 방법은 발표되어져 있다 .77, 84- 86 ) 전체 반응률식 (3. 72) 는 내부 반응이 있을 때도 식 (3. 24) 또는 (3. 26) 과 밀도변화를 고려하여 적용할 수 있다. 일반적으로 주어진 시료의 전체 표면적은 반응시간이 증가함에 따라 증가하다가 기공이 합쳐 지 기 시 작하면 감소한다. 만일 0 가 gr 당 표면적 이 고 burn-o ff에 마른 변화를 b=I-(m/m 。)라 하면, ::::z.. 관계를 다음과 같이 표시할
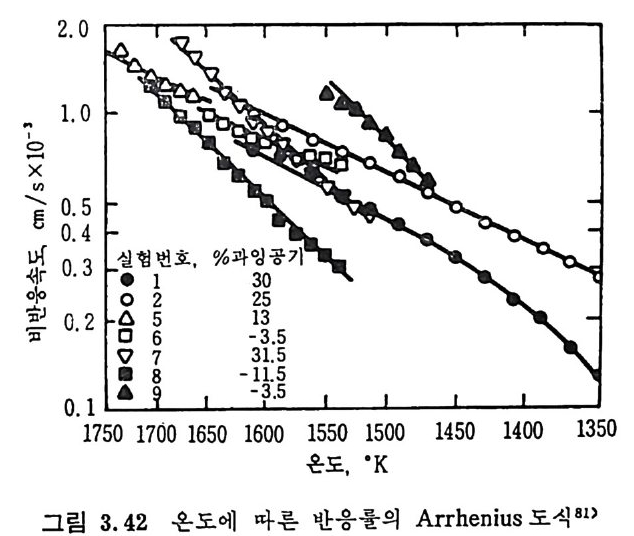 2.0
2.0
수 있다. O=O 。 (1+ab) (3. 75) 주어전 밀도에서 체적당 표면적 A; 는 A,= p 0= (극 )m 서 1+a (1-- 물)〕 (3. 76) 반응률식 (3.73) 과 비교하여 표시하면 (]。 m[(1 +dma)/ d-ta m/m 니 (¼)K,11 C 。 ”I (3. 77) 일정 온도와 반응기 체 (Oz, CO2 또는 H20) 농도를 일정하다고 하고 식 (3. 77) 을 적분하면 b=l-—mm — 。 -= 11+-aee- lr // rr (3. 78) 여기서 T 는 독성 반응시간으로 1/ i- =(8 。 (I+a) 〕(¾1r: r5s)K,11C0’ 로 표시된다. 상기 식을 Walker77-86' 둥의 실험결과에 적용하여 burn-o ff분율과 시료를 50% 대 운 시 간, i-o. s 를 표준 인자로 사용하여 그립 3. 43 에 보 여주고 있다. 상기 석 (3.78) 에서 1/i- 또는 1/ i- o.s 는 C jj에 비례하고 실험결과 77) 에 서 7l’ 은 대략 o.5 로 나타났다. 이는 0 차반옹에서도 기공확산이 중요 하거나, 반웅이 0 차와 1 차반응 사이에 있음을 의미한다. 그러나 내부 반응률에 대한 실험결과는 아직 충분하지 못하며 반응 중의 내부 기공의 특성이 변화하므로, 이에 대한 자세한 실험결과가 구하여져야 이론식이 정립될 수 있겠다. 그러므로 이러한 방향의 연 구가 더 많이 이루어져야 하겠으며, 최근의 갈탄좌의 연소실험 87) 에서 도 To.s 로부터 반옹차수와 활성화 에너지를 구하였다. 국내 무연탄의 회분조성이 연소울과 산소의 회분충 확산에 미치는 영향 88) 과 무연탄의 연소울석이 제시되었고 ,89) 최근에 국내 무연탄의 연소 수석 모델 이 shri nk in g core 를 가정 하여 제 시 되 었 다. 90-92) 또
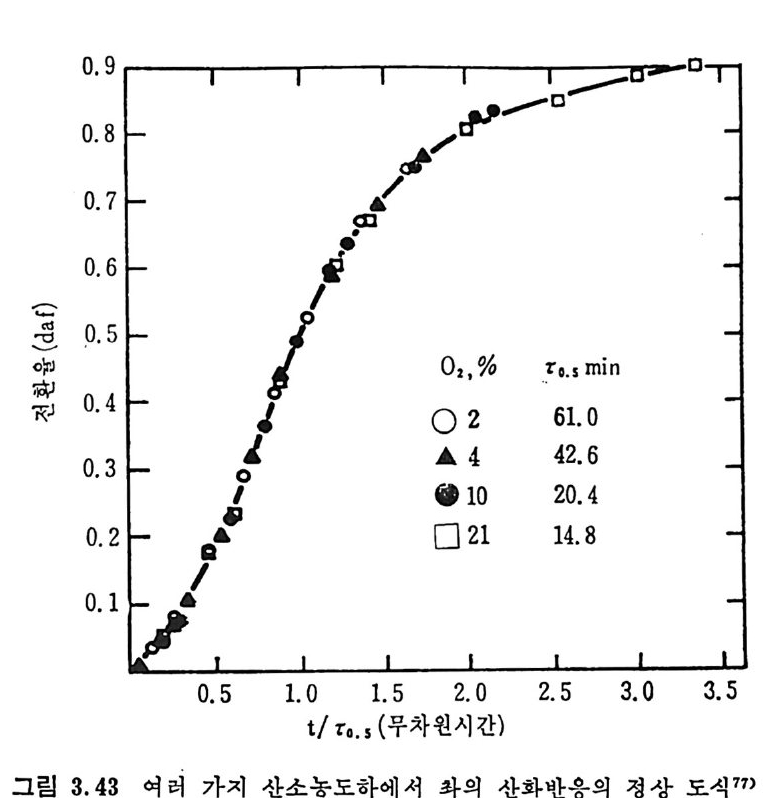 O.9.O8.O7O6O5 432P / 1 Ne
O.9.O8.O7O6O5 432P / 1 Ne
한 석탄을 단열하에서 연소시 2 차반응 (co+ 끔-0 2-CO) 이 연소울 에 미치는 영향을 규명하였다 .93-94) 참고문헌 1) Thrin g , M. W. and Essenhig h , R. H. , Chemi st y of Coal Ut iliz a ti on , H. H. Lowry Ed. , Sup pl. vol. , Wi ley , N. Y. , (1963). 2) Essenhig h , R. H. , Pratt , D. T. , Shull, H. E. and Smoot, L. D. , Current Sta t u s of Fluid Mechanic s in Practi ca l Hetr o g e nous Com- busto r s, Presente d at th e Sp ring Meeti ng, Centr al Sta t e Secti on Combustio n Insti tute, Celeveland. 1977. 3) Fr yling , G. R. (Ed) . Combusti on Eng ine eerin g , Combusti on Eng i• neerin g , Inc. , New York, 1967, 4) Thrin g , M. W. , The Scie n ce of Flames and Furnaces, Joh n Wi ley
& Sons, New York, 1962. 5) Trin k s, W. and Mawhin n ey, M. , I11d11str i a l Furnaces, Vol. I & II, Joh n Wi le y & Sons, New York, 1955, 1961. 6) Ste a m, Babcoke & Wi lc ox Co. , New York, 1963. 7) Essenhig h , R. H. , Coal Combusti on •, Coal Conversio n Teclmolag y, C. Y. Wen and E. S. Lee Eds. , Addis o n-Wesley Pub. Co. , Inc. , Read i喝 Mass. , 1979. 8) Yerushalmi , J. , Turner, D. H. , and Sq u ir e s, A. M. , bzd. Eng . Chem. Process Des. Dev. , 15, 47(1976). 9) Lee, G.S., Han, G.Y. and Kim , S.D., K]ClzE, 1, 71 (19 84) . 10) Shin , B. C. , Koh, Y. B. and Kim , S. D. , HwaHak Kong li a k , 22, 253 (1984). 11) Grego ry, D. R. , and Lit tlej o h n, R. F. , BC URA Montl y Bull. , 29, 2536, 173 (1965) . 12) Hurley, T. F. , Inst. Fuel, 4, 243 (1931) . 13) Hurley, T. F. and Cook, R. J. , Inst. Fuel, 11, 195 (1938) . 14) Essenhig h , R. H. , Fuel, 38, 543 (1 959). 15) Mahaja n , 0. P. and Walker, P. L. , Jr. , Porosit y of Coals :i.n :l Coal Prod~cts • , in Analyt ica l Meth o ds for Coal Product s, C. Karr Ed. , Academi c Press, New York (1978) . 16) Ng , S. H. , Fung, D. P. C. and Kim , S. D. , Fvel, 63, 1564 (1984) . 17) Beest'> n, G. and Essenhig h , R. H. , ]. Plzy . Chem. , 67, 1349 (1963). 18) Essenhig h , R. H. , ]. Eng . Power, 85, 183 (1965) . 19) Ivanova, G, P. and Babii , V. , Thermal Eng . , 13, 70 (1966) . 20) Brookes, F. R. , Fuel, 48, 139 (1969) . 21) Clark, A. H. and Wheeler, R. V. , Trans. Chem. Soc. , 103, 1754 (1913). 22) Hort on , L. , Fuel, 341 (1952) . 23) Fie l d, M. A. , Gil l, D. W. , Morga n , B. B. and Hawksley, P. G. W. , Combusti on of Pulveriz e d Coal, BCURA, Leath erhead, 1967. 24) Ar thu r, J. R. , Trans. Faraday Soc. , 47, 165 (1951). 25) Pata i , S. , Hoff m ann, E. and Rajb e nbach, L. , ]. Ap pl. Chem. , 2, 306 (1952) . 26) Fung, D. P. C. , and Kim , S. D. , Fuel, 63, 1197 (1984) . 27) Mulcahy , M. F. R. and Smi th, I. W. , Rev. Pure Ap pl. Chem. , 19, 61 (1969) . • 28) Walker, P. L. , Jr. , Rusin k o, F. and Austi n, L. G. , Advances in Cata l ys i s , Vol. 11, Academi c Press, New York, 1959.
29) Essenhig h , R. H. , Froberg, R. , and Howard, J. B. , Ind. Eng . Chem. , 57. 33 (1968). 30) Gray, D. , Cog o li , J. G. and Essenhig h , R. H. , in Coal Gasif icat i on , Adv. in Chemi st r y Ser. , 131, Americ a n Chemi ca l Soc iet y , Wash· ing ton , D. C. , 1976. 31) Eap en , T. , Blackadar, R. and Essenhig h , R. H. , Proc. of 16th Sy m p . on Combusti on , Combusti on Instit ute, Pit tsb urg, Pa. , 515, 1977 32) Joh nson, M. L. M. , and Essenhig h , R. H. , AICHE Sy m p . Ser. 126, 68, 311 (19 72). 33) Bir d , R. B. , Ste w art, W. E. and Ligh tf oo t, E. N. , Transp or t Phenomena, Joh n Wi ley & Sons, New York, 1960. 34) Rohsenow, W. M. and Choi, H. V. , Heat, Mass and Momentu m Transfe r , Prenti ce Hall, Eng le wood Cl iffs, N. J. , 1961. 35) Kunii , D. and Levenspi el , 0. , F/uid iz a ti on Eng ine erin g , Joh n Wi le y , New York, 1969. 36) Ross, L B. and D1vid s on, J. F. , Trans. I. chem. E. 59, 108 (1981) . 37) Avedesia n , M. M. , and D1 v id s o:1 , J. F . , Trans. Inst. Chem. Eng r s. , 51, 121 (19 73). 38) Essenhig h , R. H. and Yorke, G. C. , Fuel, 44, 177 (19 65). 39) Raja n , R. R. and Wen, C. Y. , AIChE ]. , 26, 642 (1980) . 40) Becker, H. A. , Beer, J. M. and Gib b s, B. M. , Inst, Fuel Sy m p . Serie s , Pap e r Al (19 75). 41) Camp b ell, E. K. and David s on, J. F. , Inst. Fuel Sy m p . Serie s , Pap e r A2 (1975) . 42) Chen, T. P. and Saxena, S. C. , AIChE Sy m p . Ser, 116, 74, 149 (1978), 43) Gordon, A. L. , and Amundson, N. R. , Chem. Eng . Sc i. , 31, 1163 (1976). 44) Park, D. , Levenspi el , 0. , and Fit zg e rald, T. J. , Presente d at 72nd Annual AIChE Meeti ng , San Fr.1n ci sc o, 1979 45) Sarofi m , A. F. , and Beer, J. M. , Co/ lo1 uim on Coal Combusti on 189, (1979) 46) Fin e , D. H. , Slate r , S. M. , Sarofi m , A. F. and Wi llam s, G. C. , Ftl q/, 53, 120 (1974) 47) Greg o ry, D. R. and Lit tlej o h n, R. F. , BC URA Montl y Bull. , 29, 6, 173 (1965) . 48) Lois o n, R. and Chauvin , R. , Chemi e et. lndustr i e , 91, 269 (1964). 49) Beer, J. M. , Presente d at 16th Int. Sy m p . on Combusti on , Com-
busti on Insti tut e , 439 (1977). 50) Hott el , H. C. , Wi llam s, G. C. , Nerheim , N. M. , and Schneid e r, G. R. , Presente d at lOt /1 I nt. Sy m p . on Combusti on , 111 (1 965). 51) Wen, C. Y. and Chen, L. H. , Div. of Fuel Chemi st r y ACS Prepe r in t 24, 141 (1979) . 52) Caram, H. S. and Amundson, N. R. , J11 d. Eng . Chem. F1111d. , 16, 171 (1977) . .53 ) Borgw ardt, R. H. , Envir on . Sc i. Tech. , 4, 59 (1970) . 54) Wen, C. Y. , and Ishid a , M. , Envir on . Sc i. Tech. , 1, 103, (1 973). 55) Ishid a , M. , and Wen, C. Y. , AIChE Sy m p . Ser. No. 128, 69, 1 (1973). 56) Raja n , R. , Kris h nan, R. , and Wen, C. Y. , A/ChE Sy m p . Ser. , No. 176, 74, 112 (1978) . 57) Og u ma, A. , Yamada, N. , Purus'.lw a, T. , and Kunii , D. , Pre· Prin t for lltlt Fall Meeti ng of Soc. of Chem. Eng . , Jap a n, 121 (1971). 58) Horio , M. , Mori, S. and Muchi, I. , Proc. of 5th FBC Conf. , Washin g ton , D. C. , (1977) . 59) Merric k , D. and High ley , J. , AIC! tE Sy m p . Ser. , No. 137, 70, 366 (1974). 60) Yate s , J. G. and Rowe, P. N. , Trans. Inst. Chem. Eng r s. , 55, 137 (1977). 61) Zenz, F. A. and Weil , N. A. , AIC/z E ]. , 4, 472 (1958) . 62) Fournol, A. B. , Bergo u g no u, M. A. and Baker, C. G. J. , Can. ]. Chem. Eng ,, 51, 401 (1973) . 63) Nazemi , A. , Bergo ug n ou, M. A. and Baker, C. G. J. , AIChE Sy m p . Ser. No. 141, 70, 98 (19 74) . 64) Yun, Y. S. , Park, W. H. and Kim , S. D. , to be pu bli sh ed. 65) Ami tin, A. V. , Mart yus hin , I. G. and Gurevic h , D. A. , Chem. Technol. Fuels Oi ls , 3, 181 (1968) . 66) Wen, C. Y. and Fan, L. T. , Model for Flow Sy st e m s and Chemi · cal Reacto r s, Dekker, N. Y (1975) . 67) Wen, C. Y. , and Yu, Y. H. , AIChE ], 12. 610 (1966) . 68) Mori, S. and Wen, C. Y. , AIChE ]. , 21, 109 (1975) . 69) D:i vi d s on, J. F. , and Harriso n, D. , Fluid is e d Parti cle s, Cambrid g e Univ . Press (1963) . 70) Kobaya shi, H. , Arai, F. and Sunakawa, T. , Kag a ku Kog a ku, 31, 365 (1967) .
71) Gib b s, B. M. , Perei r a , F. J. and Beer, J. M. , Inst. Fuel Sy m p . Ser. , Pap e r D6 (19 75) . 72) Nati on al Coal Board, Reducti on of At m osp he ric Polluti on , EPA- PB-210-673, London, Eng la nd (1971). 73) Exxon Research and Eng ine erin g Co. , St u die s of the Pressuriz e d Flauid iz e d Bed Coal Combusti on Process, EPA-600/7-76-011, Lin d en, N. J. (19 76) . 74) Cog o li, J. G. and Essen h ig h , R. H. , Prep ri n ts , Am. Soc. Di v. Fuel Chem. , 20, 134 (19 75) . 75) Essenhig h , R. H. , Proc. of 16th . Sy m p . on Combusti on , Combus· tion Inst. , Pit tsb urgh , Pa. 353 (19 77) . 76) Sim ons, G. A. and Lewi s, P. F. , Presente d at the Sp ri n g Tech. Mee ti ng , Centr a l St at e Sec. , Combusti o n Insti tut e , Cleveland, OH. , 1979. 77) Walker, P. L. , Jr. , Ma h aja n , 0. P. , and Yarzab, R. , Prep ri n ts , Am. Chem. Soc. Di v. Fuel Chem. , 22, 7 (19 77) . 78) Lee, K. B. , Thrin g , M. W. and Beer, J. M. , Combust. Flame, 6, 137 (19 62) . 79) Essenhig h , R. H. , ]. Inst. Fuel, 34, 239 (1961). 80) Essen h ig h , R. H. , ASME Pap e r 70-WA/Fu-2 (1970). 81) Frobe rg , R. W. and Essenhig h , R. H. , Proc. of 17th . Sy m p , on Combusti on , Combusti on Insti tute, Pit tsb urg, Pa. (1979) . 82) Beer, J. M. , Ph. D. the sis , Dep t, of Fuel Technolog y and Che· mi ca l Eng ine erin g , Univ . of Sheff iel d, Eng la nd, 1960. 83) Beer, J, M. and Lee, K. B. , Proc. of 10th . Sy m p . on Combusti on , Combustt on Insti tut e , Pit tsb urg, Pa. , 1187 (1965) . 84) Chornet, E. , Baldasano, J. M. and Tarki, H. T. , Fuel, 58, 395 (1979). 85) Sim ons, G. A. , Fuel, 59, 112 (1980). 86) Mahaja n , 0. P. , Yarzab, R. and Walker, P. L. , Jr. , Fuel, 51, 643 (1978) . 87) Ts~ng , H. P. and Edg a r, T. F. , Fuel, 63, 385 (1984) . 88) NamKoong , S. and Yoo, C. K. , Hwahak Kong ltak , 3, 166 (1965). 89) Hwang -B o, H. , Lee, W. K. and Kim , S. Y. , Hwahak Kong h ak, 4, 129 (1966) . 90) Park, W. H. and Hong , S. A. , Hwahak Kong ltak , 16, 389 (1978) . 91) Chang , Y. H. and Kan g, W. K. , Hwahak Kong h ak, 17, 389 (1979) . 92) Lee, I. C. , Rhee, H. K. , Park, W. H. and Park, W. H. , Hwahak
Kong h ak, 19, 259 (1981). 93) Jun , K. S. , Park, J. Y. and W. H. Park, Hwa/z a k Kong h ak, 18, 31 (1980). 94) Jun , K. S. , Park, J. Y. and W . H. Park, Hwalzak Kong h ak, 18, 351 (1980).
제 4 장 석탄 가스화 석탄의 가장 간단한 가스화는 석탄을 공기가 없는 상태에서 가열할 때 발생되는 가연성 기체이다. 이때 찬류물질은 코크스 (cokes) 나 거 의 순수한 탄소분이 남게 된다. 이때 배출된 기체를 석탄가스 (coal g as) 라고 한다. 이는 주로 석탄의 휘발분이 배출되는 것이다 (<10%). 그러므로 코크스를 얻는 것이 목적이 아니고 가연성 기체를 얻는 것이 목적 인 것 이 석 탄 가스화 (Coal Gas ifi ca ti on) 라고 할 수 있 으며 , 석 탄 내의 모든 유기물질을 기체로 바꾸는 것으로서 석탄의 등급 (rank) 과 반응온도가 가스화율을 조절하며 주로 CO,C02 와 H2 를 생성한다. 석탄은 매우 복잡한 혼합물로서 금속성분이 불균일한 불포화 탄화 수소의 다핵방향족(p ol y nuclear) 구조를 이루고 있다. 일반적인 탄 화수소의 수소와 탄소비 (H/C) 의 상관관계에서 수소와 순수단소의 화 학적 결합울 증가시킴에 따라 몰리적 구조는 고체상태로부터 액체상 태를· 거쳐서 기체상태로 변화한다(표 4.1). 그러므로 석 탄 액 화나 가스화반웅이 란 탄소에 수소를 첨가하는 반 웅이라고 할 수 있겠다. 4.1 석탄 가스화의 원리 대부분의 연소성 물질은 다음과 같은 방법으로 가스화할 수 있다. (1) 가열에 의한 증발, (2) 열분해 (pyro lys is ) , (3) 공기나 산소와의 연소, (4) 수중기 와의 반응, (5) 수소와의 반옹, (6) CO2 와의 반웅
 표 4.1 탄화수소의 수소/한소 원소미 I)
표 4.1 탄화수소의 수소/한소 원소미 I)
등으로 대별된다. 석탄가스화 반웅은 상기한 (1) 및 (2) 보다 (3)-(6) 의 반응이 중요 한 반응이다. 상기한 반웅들은 상온, 상압하에서보다 온도가 증가하떤 반응률은 증가한다. 즉 반웅률은 주어진 반응조건에서 화학평형에 의하여 결정 되므로 화학평형조건을 알아야만 한다 . 그러나 석탄은 탄화수소와 금 속성분의 화합물이므로 석탄 자체의 복잡한 조성에 대한 평형상태 예 축은 불가능하다. 그러나 석탄구조와 흑연(g ra ph it e) 의 구조가 매우 유사하고 이에 대한 열역학적 정보는 쉽게 얻을 수 있으므로 흑연의
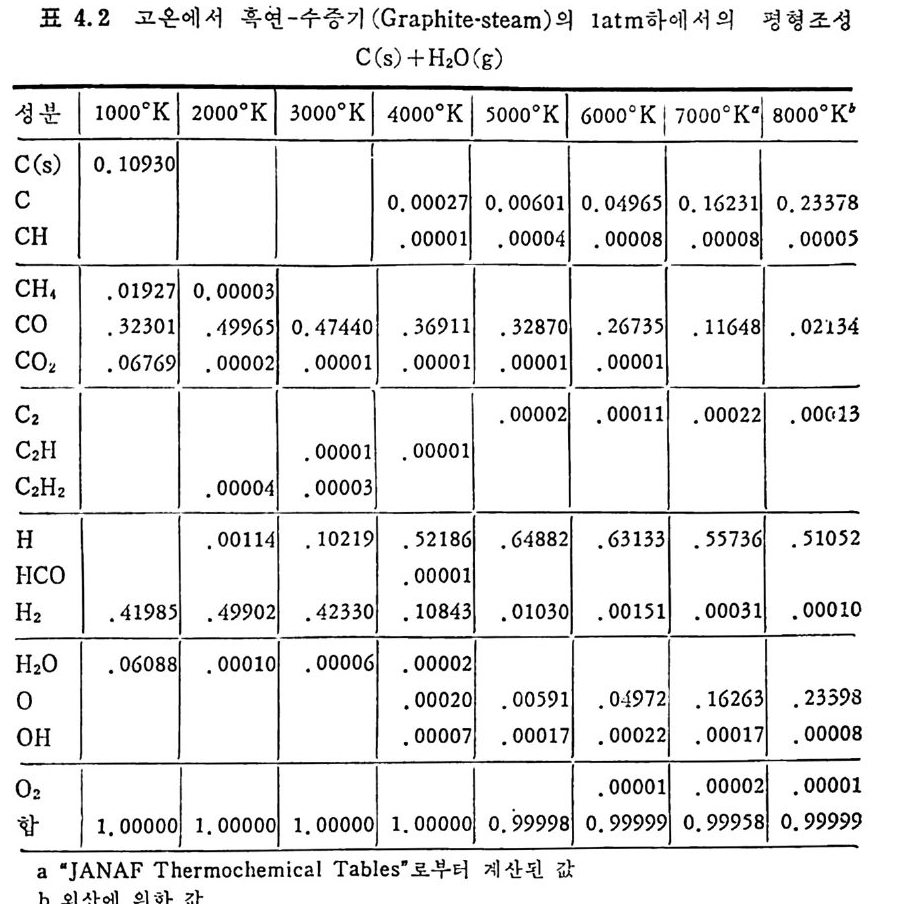 표 4.2 고온에서 흑연-수중기C (( Gs)r a+ p Hh 2it0 e ·(sg t) e am ) 의 la t m 하에서의 평 형조성
표 4.2 고온에서 흑연-수중기C (( Gs)r a+ p Hh 2it0 e ·(sg t) e am ) 의 la t m 하에서의 평 형조성
경우를 예로 하여서 석탄에 대한 정성적 해석은 가능하다고 하겠다. 탄소물질의 가스화반응에 많이 사용하는 수증기와 흑연의 반응평형 조성을 1 기압하에서 1000~8000°K 사이의 온도변화에 따른 생성가스 의 물분율을 그림 4.1 과 표 4.2 에 보여주고 있다. 그림 에 서 보듯이 온도가 상승함에 따라 CH4, CO2 와 H20 가 3000°K 이상에서는 거의 완전히 소멀된다. 그 반면 H2 는 2000°K 에서부터 생 성 되 기 시작하여 서 온도가 상승함에 따라 그 양이 증가하여 서 5000°K 에서는 60% 까지 증가한다. 원소 탄소와 산소기체는 4000°K 이상에서 많은 양이 생성되며 수 소분자의 농도는 3000°K 이상에서는 급격히 감소한다 . 그러나 co,
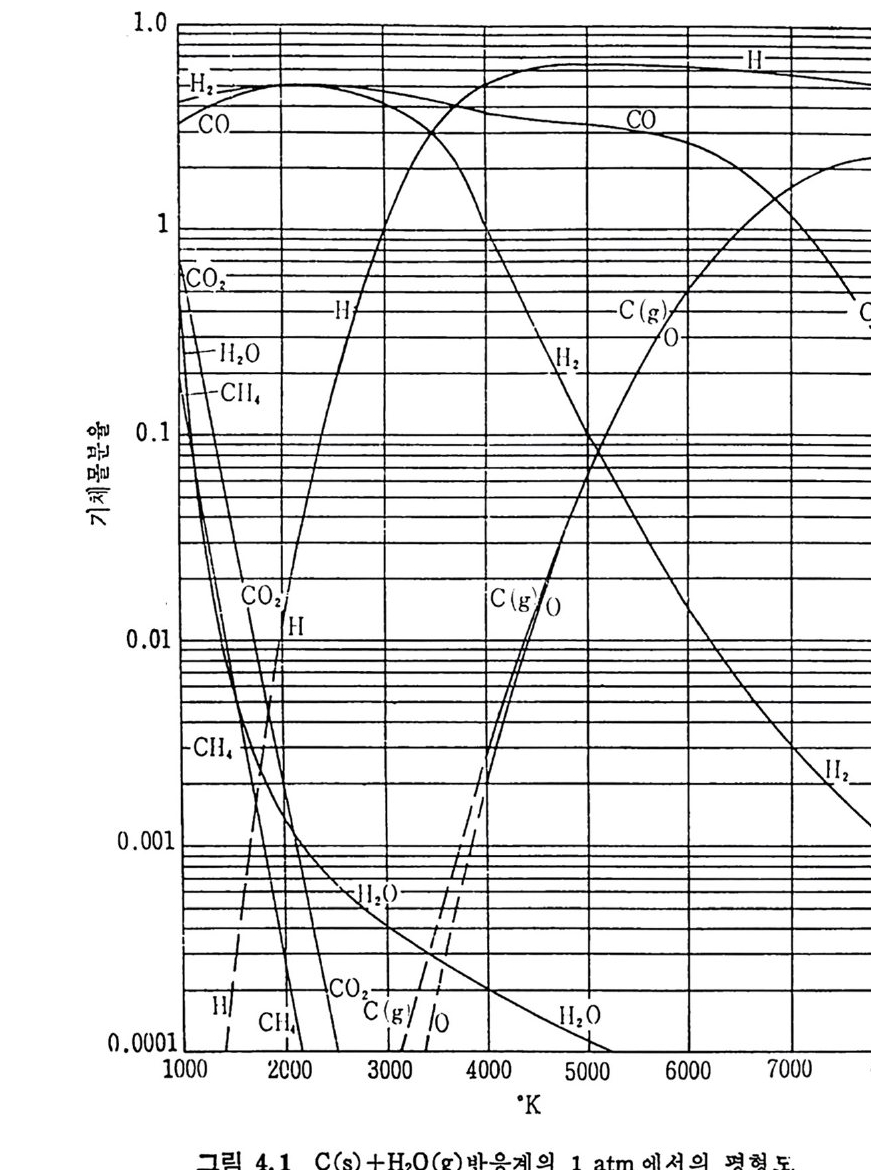 1.0
1.0
원소 탄소기체, 원소산소 및 수 소는 3000°K 이상에서 가장 안정된 조 성을 가진다. 대부분의 가스화 장치는 800~950°C(1033~1230°K) 범위에서 조업 되며 가압하에서 반응률이 중가됨과 아울러 반응용적아 작아질 수 있 어서 보통 가압하 (~lOOa t m) 에서 조업된다 . 탄소-수증기 반응에서 온도 (92 3 ~1223°K) 압력 (34~68 at m ) 및 H20/ C ~문비의 영향을표 4.3(H20+C) 과표 4.4(2H20+C) 에 보여주고 있다. 표 4 .3 에서 보듯이 H20/C 비가 1.0 이 넘지 않는한 주어전 모 돈 조전에서 탄소 (s) 가 남는다 . 그러나 온도가 증가함에 따라 탄소의 가스화가 증가한다. 그 반면 압력이 증가하면 감소한다 . 표 4 . 3 과 4.4 에서부터 보면 최대 CH4 가스생성 (19.5% )을 얻기 위 하여서는 압력과 H20/C 비가 높아야 하고 온도는 낮아야 하며, 최대 co 나 H 2 믈 생성하는 것이 목적 이면 압력과 H20/C 비는 낮고 온도 는 높 아서 C 야생성을 저하시켜야 한다. 그러므로 최대 CH4 생성 (19. 5% )은 온도가 923° K , 68atm 및 H20/C=2.o 일 때이고(표 4.4)
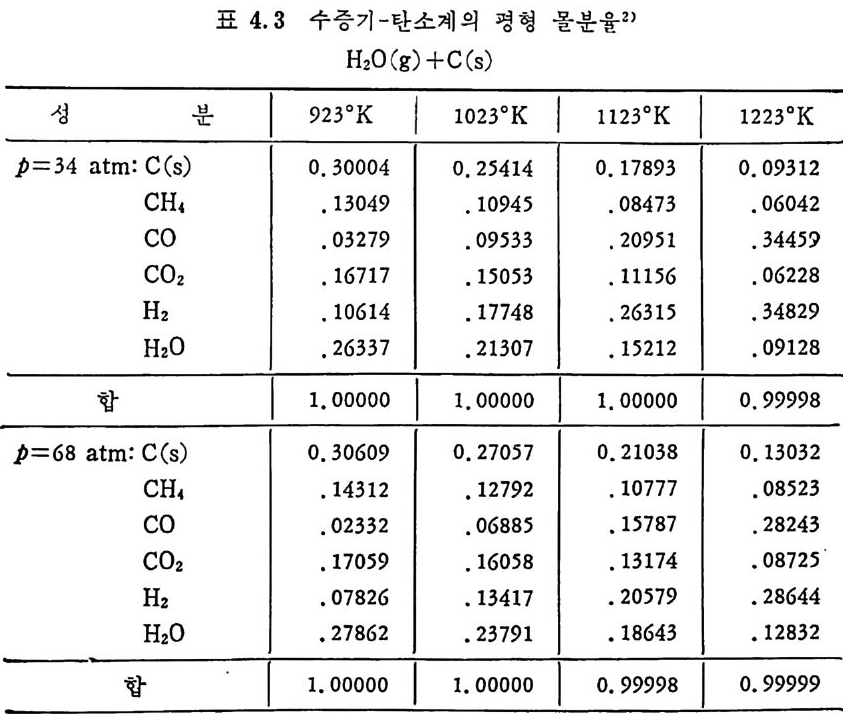 표 4. 3 수증기 -탄소계 의 평 형 물분율 2)
표 4. 3 수증기 -탄소계 의 평 형 물분율 2)
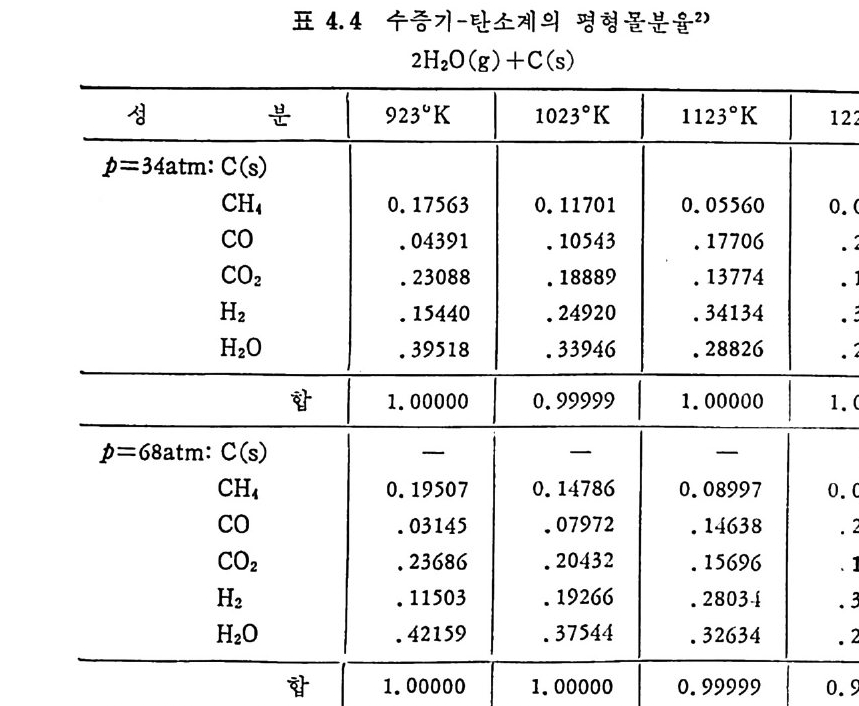 표 4.4 수증기-단소계의 평형문분융 2)
표 4.4 수증기-단소계의 평형문분융 2)
(CO+H2) 의 생성이 최대가 되는 조전은 (69%) 온도가 1223° K , 압력이 34 at m , H20/C= 1. o( 표 4. 3) 일 때 이 나 반응은 탄소를 완전히 전환하지 못한다. 그러나 압력을 낮추고 (1 at m ) 온도를 올리면 (CO+H2) 생성이 1000°K 에 서 74. 3% 이 고 2000°K 에 서 는 거 의 99% 가 된다 . 화학평형이란 실제 공정에 대한 반웅전환율의 가능 한도룬 나타내 나, 얻을 수 있는 값은 아니므로 적절한 공정 선맥에서 고려할 사항 중의 하나이다. 4. 2 열 화학 (Thermochem i s t r y) 연소에 의한 탄소의 가스화반응은 발열반응이다(표 4.5). 또한 반 응열은 탄소와 산소가 반응하여서 CO2 와 CO 를 생성할 때 온도에 거 의 무관하다. 그러나 이 반웅들은 실제 반응기에서 동시에 일어나며 기화된 탄소가 CO 와 C 아에 나뉘게 되며 평형을 이룰 때까지는 반응 속도에 의하여 조철된다. 낮은 온도에서의 탄소의 산화는 매우 느려
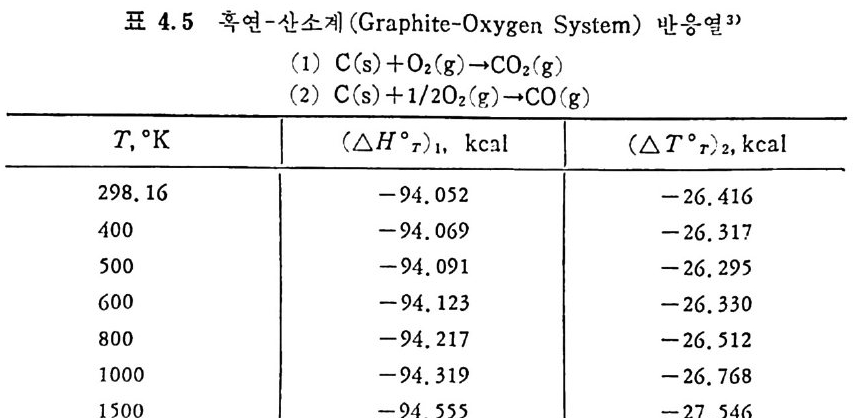 표 4. 5 흑연-산소계 (G rap h it e- Oxy ge n Sy s te m ) 반응열J)
표 4. 5 흑연-산소계 (G rap h it e- Oxy ge n Sy s te m ) 반응열J)
서 감지하기가 힘들다. 그러나 매우 느리계 산화반응은일어나며 이때 의 발열량은 표 4.5 에 보여주고 있다. 만일 표면적이 크고 이 산화반 응에서 열전도가 없다면 열이 축적되어서 온도가 증가하므로 산화율 이 중가된다. 이 런 과정 을 auto t h ermi c 이 라 하고 매 우 작은 분말문질 이 산화를 시 작하여 서 완전히 대 기 중에 서 산화되 는 것 을 pyro p h oric 이라 부른다. 탄소와 수증기반응에 의한 CO 와 H 2 생성 가스호R 즌 매우 높은 홉열 반응으로 I g r 물의 탄소를 가스화하기 위하여 32kcal 의 에너지가 필 요하다(표 4.6). 이는 I g r 몰의 탄소가 부분연소하여 CO 를 생성할 때 발생하는 발 열량보다 21% 만큼 크다. 그러므로 탄소의 산화반응과 탄소와 수증기
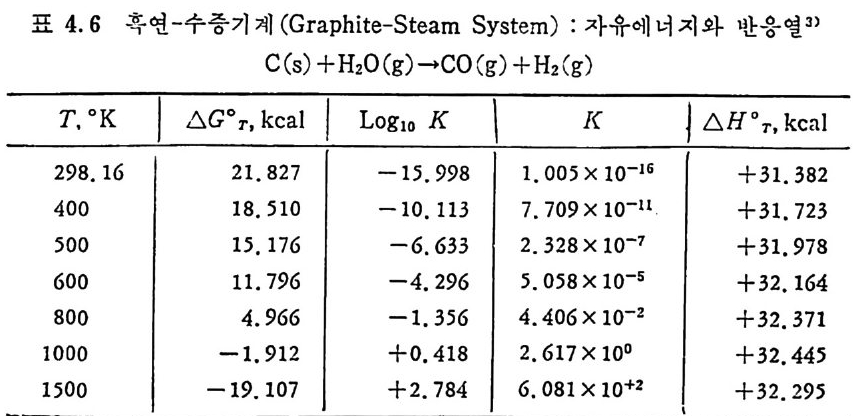 표 4. 6 흑연-수증기 계 (Grap h it e- St ea m Sy st e m ) : 자유에 너 지 와 반웅연 3)
표 4. 6 흑연-수증기 계 (Grap h it e- St ea m Sy st e m ) : 자유에 너 지 와 반웅연 3)
반응의 발열과 홉열량을 같게 하여서 이상적으로 두 반응을 수행하기 위하여는 다음과 같은 반응이 팔요하다. 1. 2 C(s) +o. 6 02( g)一1. 2 CO(g) 6H=-32 kcal C(s) +H20( g)一 CO( g) +H2(g) 색 =32 kcal 죽 상기 반응을 합하면 다음과 같다. 2. 2 C(s) +o. 6 Oz (g) +H20( g)一 2. 2 CO(g) +Hz (g) 6H=o. okca 1 만일 실제 계에서 모든 탄소가 군일한 특성과 반응성을 가지고 상기 두 반응이 동일하다면 열평형반응을 수행할 수 있다. 실제 가스화 반응기도 비교적 열평형을 이룰 수 있으나 반응기 주 위로의 열손실, 과잉 수중기사용, CO2 의 부가반응 또는 CH4 의 생성 둥으로 쉽게 에너지수지가 성립되지는 않는다. 또한 신제 경우에서 논 상기한 반응만이 일어나는 것도 아니다. 흑연-수증기의 같은 몰반응의 자유에너지 변화로부터 주어전 온도와 압력에서의 평형 전환율을 계산하여서 온도, 압력이 전환윤에 미치는 영향을 정량화할 수 있다. 죽 가압하에서 반응기의 용적을 작게 하 여 상대적으로 낮은 온도에서 반응시키거나 낮은 압력하에서 고온으 로 반응시키면 높은 반응률을 얻을 수 있다. 탄소와 CO2 의 가스화반응은 탄소 -H20 반응과 유사하다. 죽 1 몰씩 의 기체가 반응하여서 두 몰의 CO 를 생성하므로 (C+C02->2CO) C- H20 반응시의 온도, 압력이 반응열에 미치는 영향은 유사하다(표 4. 7).
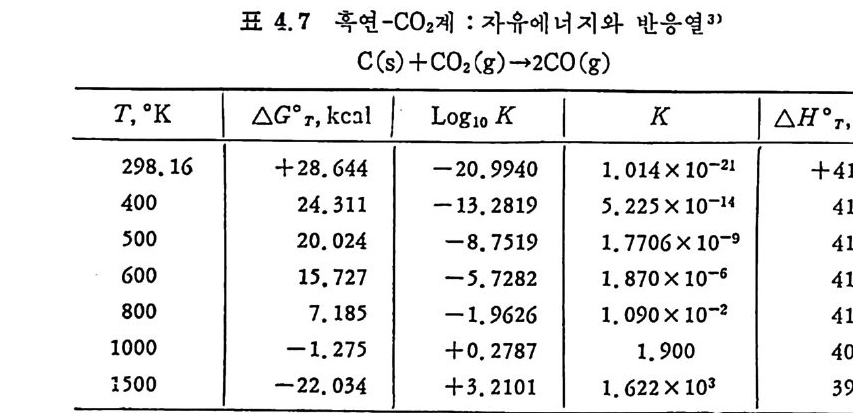 표 4.7 흑연 -CO2 계 : 자유에너지와 반웅영 3)
표 4.7 흑연 -CO2 계 : 자유에너지와 반웅영 3)
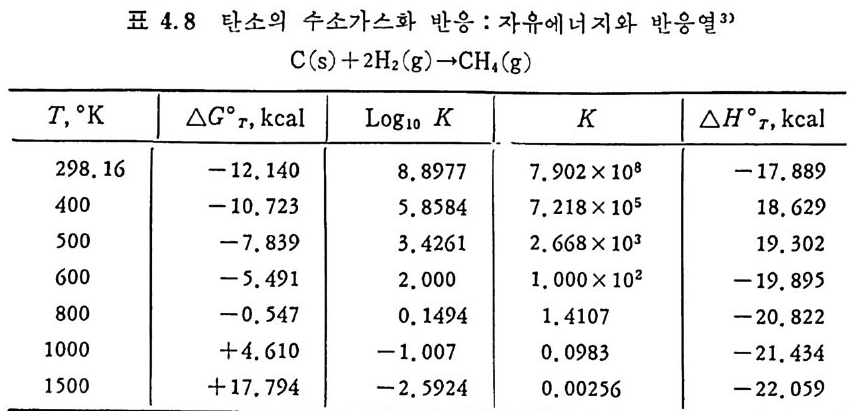 표 4.8 탄소의 수소가스화 반응 : 자유에너지와 반응열 3)
표 4.8 탄소의 수소가스화 반응 : 자유에너지와 반응열 3)
수소화 가스반응 (h y drog as ifi ca ti on) 은 탄소와 수소가 반응하여 서 직 접 CH4 울 생 성 하는 발열 반응이 다 (C+ 2H2-.CH4). 또한 표 4. 8 로부터 온도가 증가하면 CH4 생성이 안정하지 못하며,이 영향은압력울증가시 키므로 보완될 수 있음을 알 수 있다. 그 예로서 평형상수로부터 계산 된 전환율은 1 at m , soo°K 에서 60% 전환윤이 되지만, 34atm ,soo°K 에서의 전환율은 93% 가 된다(표 4.8). 즉 가압하에서의 전환율이 매우 높다. 그 반면 온도의 작은 상승도 전환울을 저하시킨다. 즉 1 a t m 하에서 온도를 800°K 에서 1000°K 로 상승시킨 경우 전환율이 15. 3% 감소하나 34 at m 에서는 73. 6% 가 감소한다 . 탄소-수증기 홈열반응 (C+H20-.CO+H2) 에서 얻은수소를 사용하여 C+2H2-.CH4 발열반응에서 CH4 을 생성하며 이 두 홉열 및 발열 반 응의 에너지 수지를 계산하여서 가스화 반응기의 에너지 수요를 줄 일 수 있겠다. 그러나 1 물의 H2 를 생성하기 위한 홉열량은 수소화 반응에 서 1 몰의 H2 가 반응하여 서 발열하는 양의 3 배 가량이 필요하 다 . C (s) + H20 (g) 一 CO (g) + H2 (g) 6H ° =3 2 kcal ~2C (s) + H2 (g) 一 ~2C H4 (g) 虛 = 一 10 kcal 상기한 CH4 생성반응은 온도에는 매우 민감하나 압력은 두 배로 증 가하여도 CH4 농도증가는 크지 않다. 그 예로서 1023°K 에서 압력을 34a t m 에서 68a t m 으로 증가시켰을 때 CH4 의 몰분율은 o.117 에서
o. 148 로 단지 3 물% 증가하나 이 에 따른 고압의 반옹기 제 작비 와 조 업비는 상당히 크게 된다. 가스화 반응기 내에는 COx 와 H2 가 촌재하므로 이의 상호 열역학적 관계를 인지할 팔요가 있다. 이의 메탄화 (me t hana ti on) 반응이라고 불리는 유사한 반응들은 CO(g) +3H2( g)一 CH4( g) +H20(g) C02(g ) +4H2( g)一 CH4( g) +2H20(g) 이 반응들에 서 의 수소 소모량은 상이 하여 수증기 생 성 량도 다르다. 그러나 두 반응은 발열반응이고 열역학적 목성도 유사하다. 상기 두 반응에서 co 의 반응이 C 아반응보다 8~10kcal 정도 더 큰 발열반응 이며 평형상수도 온도변화에 따라 더 큰 영향을 받는다(표 4.9,4 .1 0).
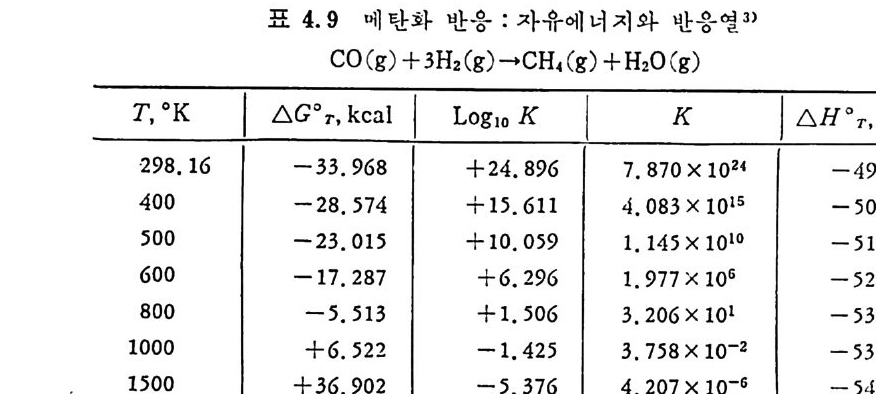 표 4.9 메탄화 반응 : 자유에너지와 만옹연 3 》
표 4.9 메탄화 반응 : 자유에너지와 만옹연 3 》
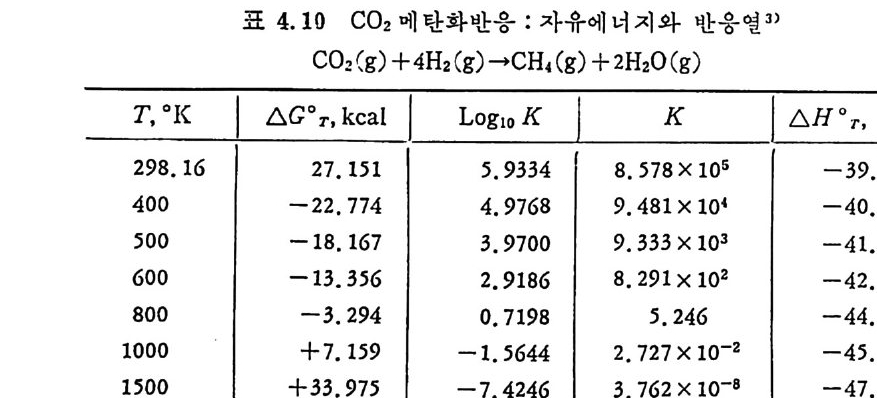 표 4.10 C 아메탄화반응:자유에너지와 반웅열 3)
표 4.10 C 아메탄화반응:자유에너지와 반웅열 3)
평형상수의 차이가 콤에도 불구하고 CO 와 C 아가 수소와 반응하여 CH4 을 34a t m 에서 10~90% 법위에서 전환될 때 팔요한 온도차이는 벨로 크지 않다. 수소와 co 반응으로부터 CH4 합성 시 반응기 내 의 촉매 표면에 탄소 의 되저울 없게 함으로써 co 의 완전반응을 이루도록 하여야 한다. 또 한 메탄 제조를 위하여 주입되는 기체의 조성이 순환기체와 온도조 절 을 위한 기체 사용 등으로 다양하므로 이 주입 기체조성의 영향도 예 측 하여야 한다 . 주 어전 기체조성에 대한 온도, 압력에 대한 평형조성에 대한 계산 은 임든 문제는 아니다 . 다음과 같은 반응들을 고려하여 보면 co + 3H2 ~ CH4 + H20 (1) co+ H 20 .= H2+C02 (2) 2CO~ C02+ C (3) CH4~ C+ 2 H2 (4) 상기 반응 들 의 평 형 상수 둘 은 다음과 같다. Kl= aaCcHo‘ a야3,1 1°, ' -K-.2 = aaHco, aacHo,, o KJ =프a2노c o , , -K-4, = 으ac노,r, 반응 (3) 에서 acoJ a2 co
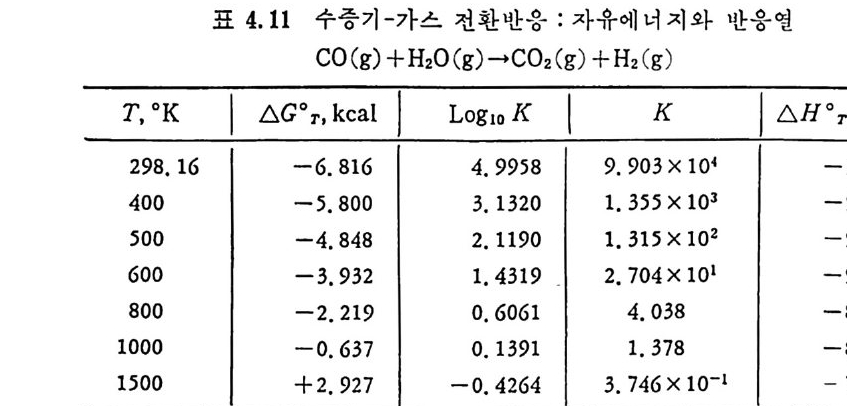 표 4.11 수증기 -가스 전환반옹 : 자유에 너 지 와 반응연
표 4.11 수증기 -가스 전환반옹 : 자유에 너 지 와 반응연
로 (3H2+CO->CH4+H20) 조철하여 야 한다. 이 는 수증기 _가스 전환반 웅 (CO+H20--C02+H2) 으로부터의 H2 생성으로 수행할 수 있다 . 죽 수중기 -가스 전환반응 (wa t er- g as shif t reac ti on) 은 작은 발열 반응이 므로 온도를 낮추면 H2 전환이 증가한다(표 4. 11). 석 탄가스화의 주산물이 CH4 이 며 수중기 로부터 H2 를 공급한다면 그 반응은 아래와 같다. 2C(s) + 2H20 (g) 一 CH4 (g) + C02 (g) 이 반응에서 반응된탄소의 철반은연료가치가 없는 CO2 로 배출된다. 그러나 표 4.12 에서 보듯이 이 공정에 필요한 에너지롤 공급하여야 한다. 죽 이 반응은 낮은 홉열반응으로 100% 의 열효율을 얻기 위해 서는 단지 1. 7% 의 탄소를 더 연소시켜야 할 것이다.
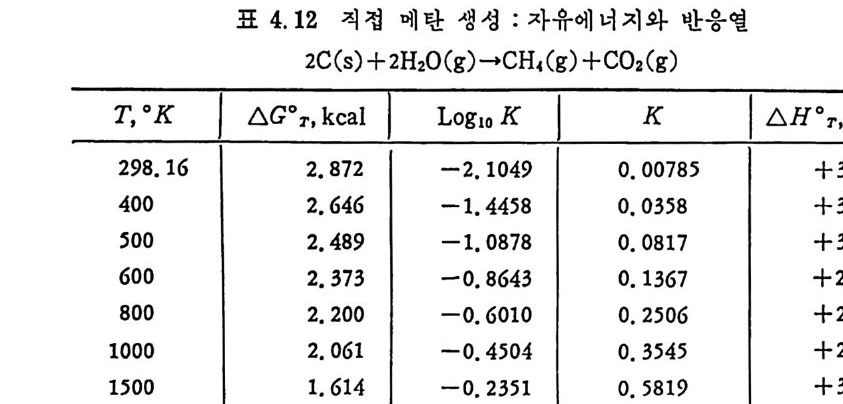 표 4. 12 칙 겹 메 탄 생 성 : 자유에 너 지 와 반응열
표 4. 12 칙 겹 메 탄 생 성 : 자유에 너 지 와 반응열
그러나 실제 반응공정에서는 아래의 여러 다른 부반응이 동시에 일어나므로 표 4.3 들에 보여준평형상대 값대로적은 몰분율의 CH4 과 CO2 밖에 얻지 못한다. CH4( g)一 C(s) +2H2(g) C(s) +H20( g)一 CO( g) +Hz(g) CH4 (g) + H20 (g) 一 CO (g) + 3Hz (g) CO(g) +H20( g)一 COz( g) +Hz(g) 2CO (g) 一 C (s) + C02 (g) C02( g)一 CO( g) ++아(g) H20( g)一 Hz( g) ++아(g) 2CH4(g )— ,C2Hs(g) +Hz(g) 그러므로 효율적인 촉매를 사용하여 반응률을 높이려는 노력이 계 속중이다. 한 가지 촉매를 사용하는 것보다 여러 가지 촉매를 혼합하여 사 용하는 것 이 더 효과적 이 라고 발표되 었 다. 6) 죽 알카리 carbonate 룬 nic k el 에 담체 시 켜 서 전자는 탄소의 가스화를, 후자는 COx 의 메 탄 생성을 증진시킨다. 그러나 IOO g의 석탄에 20 g의 K2C 아와 115 g의 N i촉매 사용시 최대의 전환율을 얻었다. 이는 석탄 주입량의 60% 정 도의 촉매가 요구되고 있으므로 보다 좋은 촉매로 석탄과 수중기 반응으로부터 CH4 생성을 이물 수 있는 연구가 필요하다고 하겠다. 이 제 까지 석 탄에 대 한 반응보다 흑연 (g ra p h it e) 에 대 한 반응의 열 역학적 결과를 해석하였다. 이는 석탄의 물리 • 화학적 특성이 순수탄 소와는 상이하나 정성적인 추론은 가능하기 때문이다. 이는 실제 가 스화 반웅기 내에서는 석탄은 열분해에 의하여 좌로 변한 후 반응하 므로 순수 탄소(g ra ph it e) 에 가까운 상태 이 기 때 문이 다. 4. 3 반응속도 (Reac ti on Kin e ti cs ) 반응열역학 평형상수가 크면 전환율이 크며, 작으면 반응산물의 전 환이 작다는 의미이다. 발열반웅의 경우는 자연적으로 반응이 조철된
다. 죽 탄소와 산소와의 산화반옹은 은도문 상승시키 면 산화반응물은 급격 히 증가한다. 그러 나 발열온도는 안정 화되 어 서 aut o, ::h ermi c 반응 이 이루어진다. 그 반면 홉열반응은 열을 계속 공급하여야 반응률이 증가한다. 죽 탄소가 CO 로 전환될 때 온도상승은 평형전환이 중가하 여 서 전환율이 증가한다. 이제까지 많은 연구자들이 석탄가스화에 대한 많은 연구를 수행하 여 왔고 7-9) 일반적 으로 석 탄과 H20, H2 의 반응은 첫 단계 반응(석 탄) 온 빠르고 그 후의 생성된 좌와의 반응은 느리다고 알려져 있다(그립 4.2). J ohnson” 은 전체 가스화반응은 세 단계를 거쳐서 일어난다고 가정하였다. 죽 첫단계는 탈휘발화 (devola tili za ti on), 두번째는 빠른 CH¢성 성, 세번째는 낮은 가스화운로 각 반응이 독립적으로 전행된
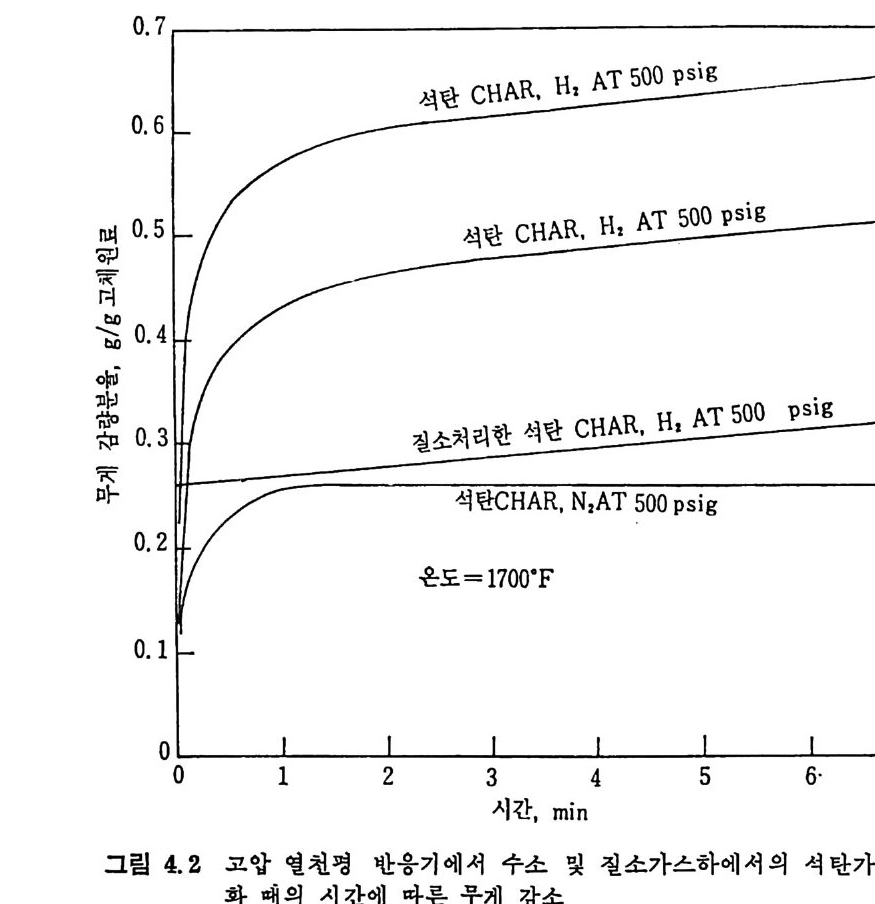 0.7
0.7
다고 가정하였다. 또한 탄소는 기처 탄소와 휘발분 중의 탄소성분으 로 이루어져 있다고 가정하였다 . 휘발분 탄소는 기체 종류에 상관없 이 열에 의하여서 발생되며 기처 단소는연분해 후에 좌에 남아서 빠른 CH4 생 성 반응에 사용되 거 나 낮은 가스화 단계 에 활용된다. 석 탄의 탄소분이 CH4 으로 가스화될 때 수소의 분압을 증가시키 떤 반웅물은 크게 증가한다 .5,10) 이는 높은 수소분압은 연분해시 방출되 지 않은 탄소를 급속히 CH4 으로 전환하게 하기 때 문이 다. Il) 탈휘 발 (devolati liza ti on ) 반응은 대 략 360°.C 에 서 시 작하여 700°C 까 지 온도가 증가함에 따라 증가한다. 또한 반웅률은 온도, 압력, 기체
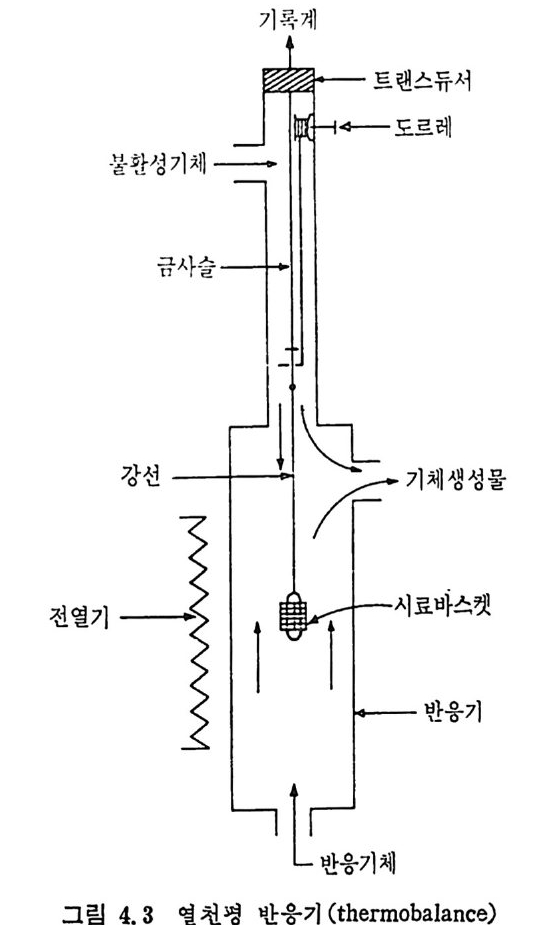 기록계
기록계
조성에 의하여 결정된다. 탈휘발과 빠른 CH4 생성반응 후의 좌의 가스화반응은 상대적으로 매우 느리며 이 반응률은 온도, 압력, 기체조성, 탄소의 전환율 및 탈휘발 때의 온도 둥이 좌우한다. J ohnson 은 보고되어진 실험결과 12 - 14) 와 Insti tut e of Gas Technolog y 의 고압력 열천평 (t hermobalance) 과 유동충 15) 반응기로부터 의 석 탄가 스화 반응시 의 빠른 CH/성 성 단계 와 느란 좌가스화단계 에 대 하여 다 음과 같은 상관식을 제시하였다.7) 빠른 CH4 생 성 반응률은 시 간에 따른 탄소의 무게 감량으로부터 결 정하였다. 즉 시료를 영천평(그립 4,3) 에 넣고 2 분 후의 무게 감량을 시간에 따라측정하였다. 여기서 탄소의 전환율 Xr 을 수소분압 PII , 의 함수로 상관식을 제시하였다.
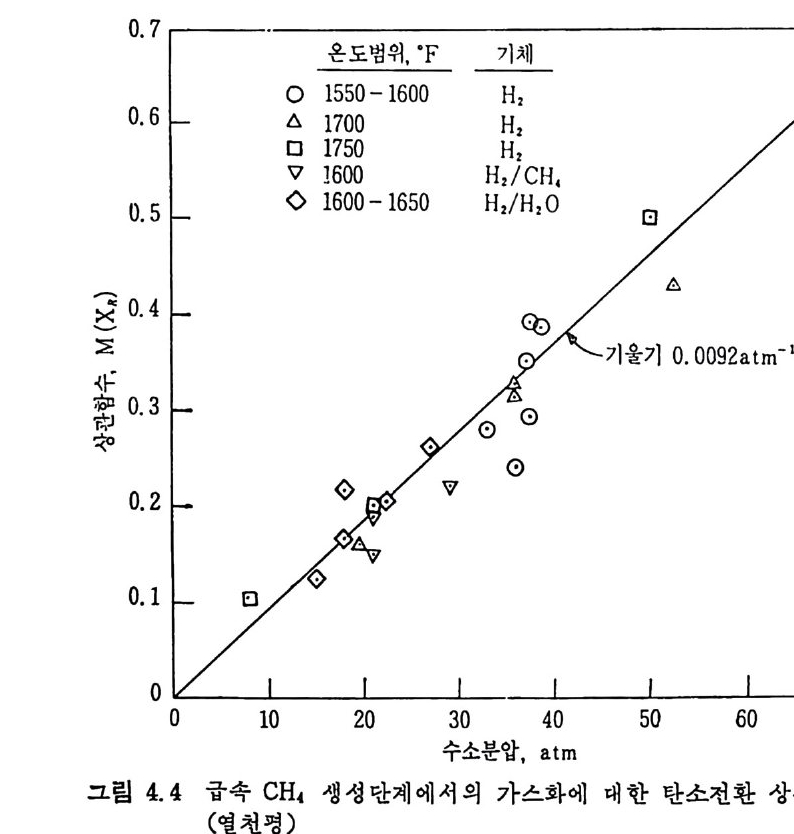 0.7
0.7
M(Xr) = [~모) 2 판 = o. 0092 f, PH, (4. 1) 여기서 PH2 는 수소의 분압 f『온 상대 반응성 인자로 공기로 전처리 한 Ireland mi ne coal char 를 I.0 으로 정의한 값이며, a 는 기체조성 에 따른 반응 속 도 변수이고 X 는 탄소의 전환율이다. 여기서 a 값 온 순수수소 또는 H2 ― CH4 혼합기체를 사용시는 대략 o.97 이고 H20 와 H2 를 함유한 기체조성시는 I. 7 이다. 상기식 (4.I) 에서 M(x,) 과 PH, 에 대한 Ireland mi ne coal char 에 대한 결과는 그림 4. 4 와 같다. 그림에서 보듯이 수소의 분압이 주요 함수로서 다론 기체분압의 영 향은 받지 않는다 . 비교적 낮은 온도에서의 전환율(그립 4.5) 에 대한 모델은 다음과 같은 가정으로 설명할 수 있다 .11) A 。 -A* (4.2) A*-.B (4. 3)
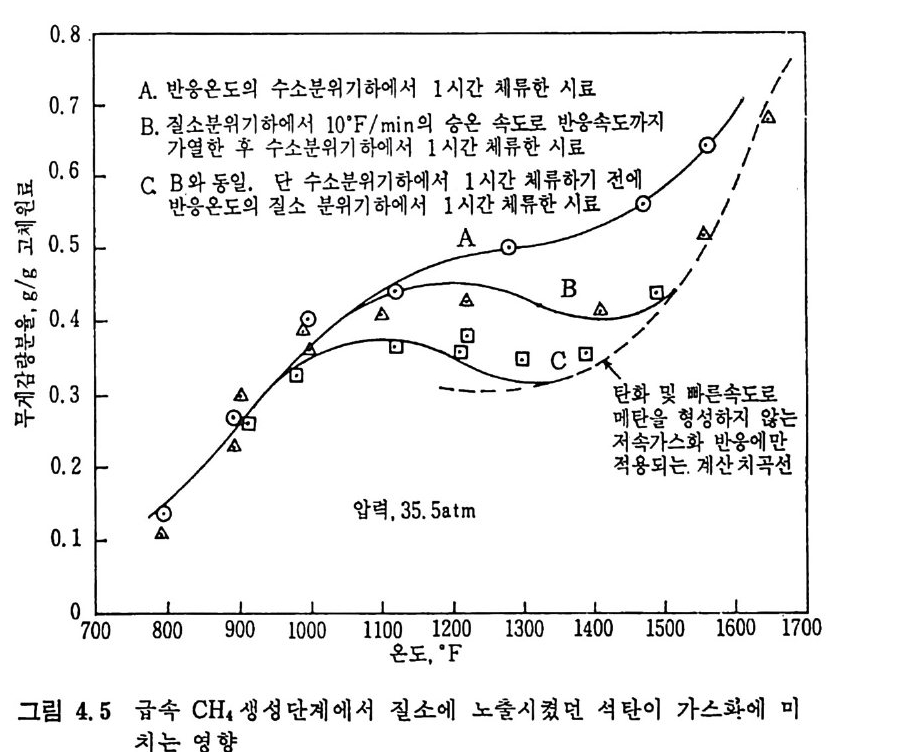 0. 8 —l//^
0. 8 —l//^
기 처 단소 (base carbon) +수소―A* - >CH. (4. 4) 죽 좌는 처음에 활성화된 중간체 A* 를 형성하고 이것이 탄소와 수소 반응의 촉매역할울 한다. 그러나 이 반응은 A* 가 비활성화되어서 B 물질이 되는 반응과 경쟁한다. 수소와 탄소가 반응하여 서 CH4 생 성 반응의 반응률은 움=f, K J (T)PH,(1-x)2/3 exp ( -ax2)N,1 * (4. 5) 여 기 .,{-j K3(T) 는 온도함수인 반응률상수이 고 NA* 는 A 물질의 농도, mole/mole of base carbon, t 는 시 간이 다. 상기식 (4.2) 에서 (1-x)2/3 항은 가스화 중의 석탄입자의 비표면적 에 비례하며 ex p (-ax 이 항은 전환율이 증가함에 따라 감소하는 표면 적의 상대반응성을 나타낸다. 상기 반응률식 ( 4 .2) 와 (4.3) 을 1 차반 옹이라고 가정하면 다음과 같이 표시할 수 있다. d(NA*+NA,)/dt= -kz( T ) ,NA* (4.6) 여기서 k2(T) 는 온도에 의촌하는 반응률상수이고 NAo 는 A 。물질의 농도이다. 식 (4. 5) 와 (4. 6) 을 합치면 d(NA~=- f,선유 Pn,(1-x)2/3 ex p(국) (4. 7) 여기서 k3(T)/k i( T) 가 온도에 독립적이라고 가정하고이를 /3라고하 떤 식 (4.7) 은 Ao 가 모두 B 로 전환된 조건에 대한 적분을 할 수 있 다. M(x,) = \。 [(후1 -年.x) : 2 L/3d] 츠 =f,/3• NA~ PH, (4. 8) 식 (4. 1) 과 (4. 8) 을 비 교하면 {3N i ,=o . 0092 가 된다. 식 (4. 8) 의 표 현은 온도의 영향이 정의되지 않았으므로 중간체 A* 가 완전히 비활성 화된 때에는 빠른 CH4 생성단계에서 가열률이나 온도의 영향이 없다 고 가정할 수 있다. 낮은 가스화단계에서의 좌의 기화반응은 H20 와 H2 를 함유한 기
체 조건일 때 다음과 같다고 가정한다. H20+C.=:!CO+H2 (I) 2H2+C .=:! CH4 (2) Hz + HzO + 2C .=:! CO + CH4 (3) 이 세 가지 반응은 독립적으로 일어난다고 가정한다. 그 예로 반응 (1) 은 순수수증기와 반응, (2) 는 순수수소와의 반응이고 반응, (3) 은 실험결과와 상관시키기 위하여 임의로 일어나는 반응으로 가정한다. 반응 (1) 은 높은 온도에서 수행되므로 바교적 높은 수중기 전환에 서는 열역학적 가역반응의 영향을 받는다 . 그러나 이 반응은 H2 와 co 에 의 한 반응의 저 항을 받아서 H20 의 전환율이 낮아진다. Joh nson 이 제 시 한 상관식 은 —dd—xt =!L kT(1-x)2/3 exp ( -ax2) (4. 9) 여기서 kT=k1+k2+k3 이고 f L= f。 ex p (8467/To) 이며 x= 공급기 화석탄된적 기적처=탄기소저 탄소 이다. 또한 exp (9 . 0201-31, 705/ T)(i-~깁 kl= [1+ e x p(~)(국;:;-+ 16. 35 같 ~+43 . 51 祠 2 PJ , exp (2 . 6741 一 33, 076/T)(i- -H}r ) (4. 10) 두k2=` 二[1 +P? nPH, ,eoxep x( p- 1(012. .44542603+-1494,, 957464//TT))]( l - 念鬪 )( 4.11) [+exp( -6. 6696+15, 198/T)(Pk?+0. 85 Pco+18. 62: 탄-)〕 2 (4. 12) a= 1+525.4 7. P3 nP,H , -+, 1+0. 7070 .P 5n2.1oP+h0 ;. P5n0 ,oP J :2_p E, o (4. 13) 여기서 k f ,k f,짜는 반웅 (1)-(3) 에서 탄소를 흑연이라고가정했을때
의 반응평형 상수이고, T 는 반응은도 (°K), T0 는 가스화전에 석탄이 좌가 될 메 의 최 대 온도 (OK) 이 며 P11,, P11,o, Pea, Pc11‘ 는 H2, H20, CO 및 CH• 의 분압 (a t m) 이며 fo 는 탄소물질에 따른 낮은 가스반응률일 때의 상대 반응성 인자이며 좌의 종류에 따라 fo 는 o.88~I.05 범위에 있다. 문헌상의 탄소의 전환율에 대 한 정 의 는 그 사용목적 에 따라 다음과 같이 정의되고 있다 .8) x= 가스화된 고정단소의 무게, gr 초기 고정란소 무게, gr X= CH4 으로의 탄소 무게 , gr 초기의 탄소 무게, gr x= 가스화된 탄소의 무게, gr 초기 탄소의 무게, gr x= 가스화된 석탄 무게, gr 초기 석탄의 무게, gr 또한식 (4.9) 의 dx/d t /(I 一 x)2/3 와 았을 도시하면(그립 4.6) IL 써
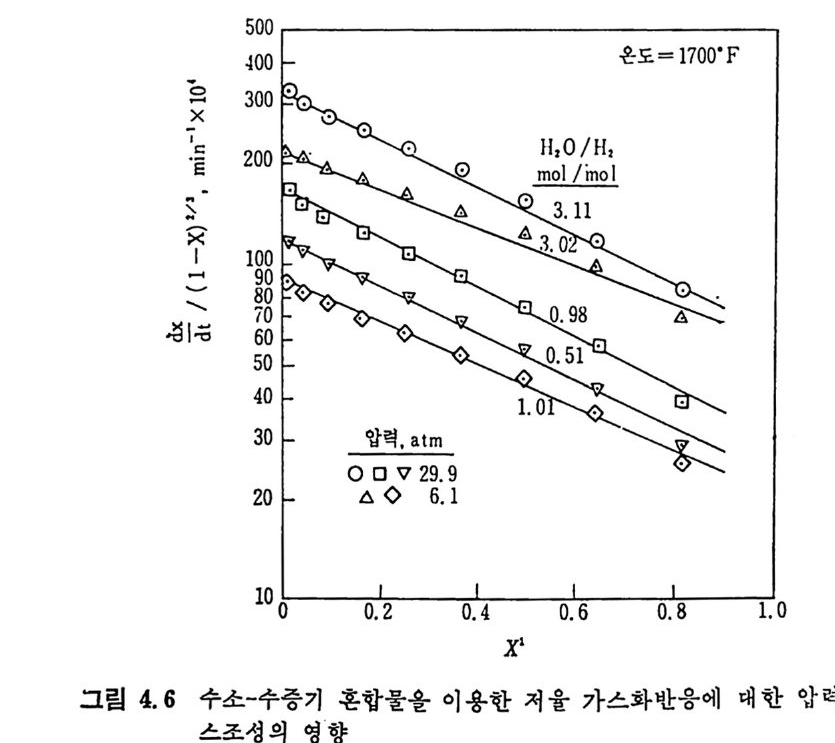 500
500
값을 얻을 수 있다. 즉 x=O 일 ttll 〔 (dx/d t )/(1-x)2/ 汀=f L kT 가 되고 기울기는 a 이다. 여러 종류의 좌로 실험한 반응률과 상관식은 잘 일 치한다 .7) 일반적으로 휘발분 내의 탄소성분은 고정단소 내의 것보다 더 반응 성이 크다 . 열분해 후의 좌는 수소 및 수증기와 직접 반응하여서 좌 표면에서 수증기-가스 전환반응 (wa t er- g as shif t reac ti on) 이 주로 일 어난다. 또한 석탄회분 중의 금속성분이 반응의 촉매역할울 한다. 더 자세한 석탄열분해 및 가스화 반응률은 2 장에서 다루었다. 4. 4 촉매 (Cata l ys i s ) 탄소와 수증기반응에서 CH4 과 CO2 생성의 열역학적 평형에서의 좋 은 촉매는 다른 물질이 형성됨이 없이 CH4 와 CO2 만을 직접 생성하 는 촉매일 것이다. 그러나 촉매가 불균일한 여러 물질로 이루어쳐 있 으면 석탄 내의 여러 금속성분과 탄화수소에 의해 쉽게 피독을 받기 쉽 고, 균일한 성분의 촉매는 피독의 영향은 적으나 산물에서의 분리 회 수가 힘들다. 죽 촉매의 경바가 크게 늘어난다. 석 탄가스화 반응에 40 종류의 물질을 첨 가하여 서 촉매 의 여 할을 Ha y nes 둥 16) 이 연구하였다. 실험은 sso°C, 300 p s ig에서 석탄 무게의 5% 되는 촉매물질을 첨가하여서 실험하였다. 실험결과 알카리금속 화 합물이 탄소가스화를 31~66% 증가시키며 20 종류의 금속산화물은 탄 소가스화를 20~30% 정도 중가시켰다. Rane y닉첼로 도포한 촉매는 매 우 활성 이 크나 그 활성은 급격 히 감소한다 . 또한 Sy n th a ne 가스로 에서 40 atm , 907~945°C 조건에서의 실험결과 5% 의 백운석 (dolomi te) 이나 석회석을 첨가하면 CH4,CO 및 H2 의 생성이 현격히 중가하였다. 촉매 종류에 따른 전체 기체 생성물을 표 4.13 에 보여주고 있다. 또한 각 촉매 물질에 따른 bench scale 실험 장치 (A) 와 sy ntha ne 가 스로 (B) 에서의 가스화 실험시의 co 의 생성증가와 가스화 증가%를 표 4.14 에 CH4 과 H2 생성 증가%를 표 4.15 에 보여주고 있다 . 표에서 보듯이 비활성화된 Raney 닉켈 촉매는 CH4 생성에, KCI 은 H2 생성에, K2C 아는 co 생성에 가장 효과적으로 나타났다. 그러나 Raney 닉 첼 의 활성 은 급속히 감소하므로 LiC O ~ 가 CH~ 생 성 에 두
 표 4.13 각 촉매에 마른 가스 생성문
표 4.13 각 촉매에 마른 가스 생성문
번째로 활성이 크고 다론 기체, 죽 H2 오l- co 의 생성도 비교적 큰 값을 보이고 있다. 이들의 실험결과는 다음과 같은 결론을 제시하 였다. 1) 알카리금속 화합물과 Fe, Ca, Mg 및 Zn 산화물은 탄소의 가스화 를 증가시키며 CH4,H2 및 co 의 생성을 증가시킨다.
 표 4.14 단소가스화와 co 생성량 중가
표 4.14 단소가스화와 co 생성량 중가
2) CH4 의 최대 생성은 Raney n i ckel 촉매하에서 일어나나 활성화 시 간은 길지 않다. LiC0 3, Pb304, Mg O 등을 5 Wt . % 첨 가하면 CH 김 성이 크게 중가한다. 3) 석탄 가스화 정도가 크거나 작거나간에 촉매의 첨가는 가스화 를 촉진시킨다.
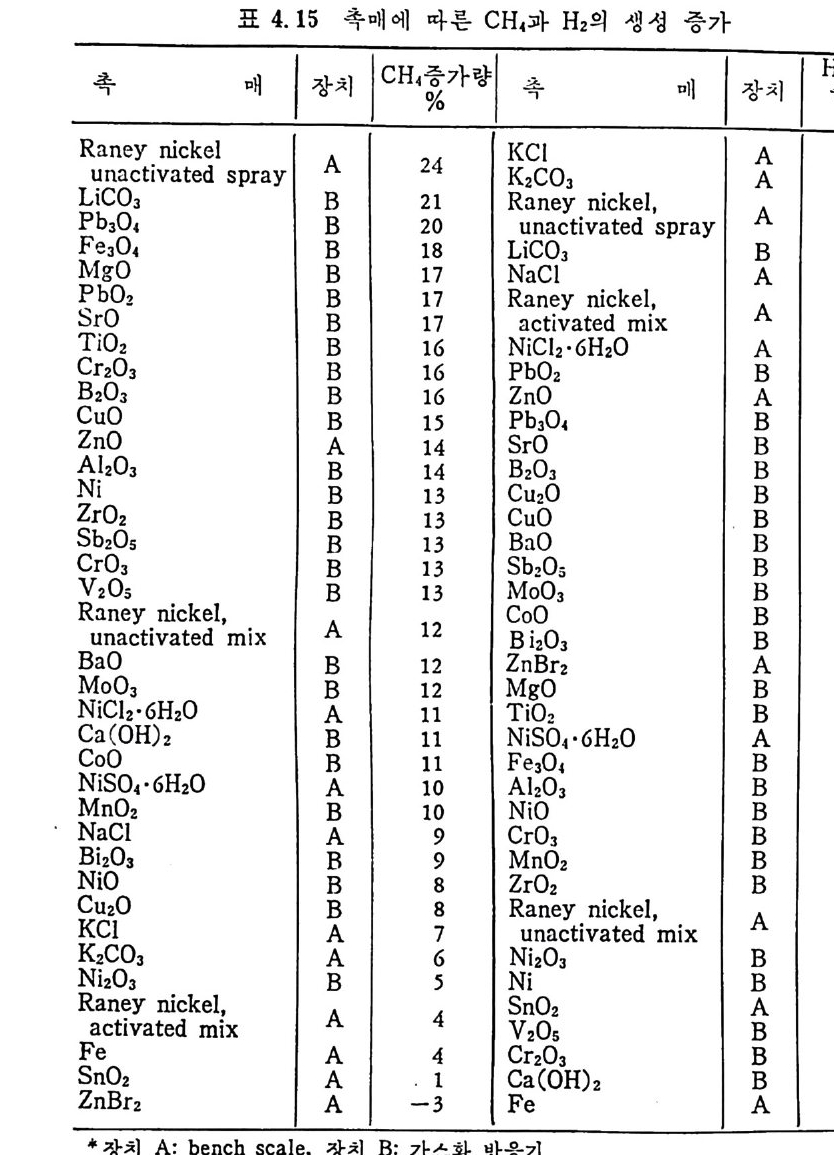 표 4.15 촉매에 따른 CH4 과 H2 의 생성 증가
표 4.15 촉매에 따른 CH4 과 H2 의 생성 증가
4) 반응온도가 750°C 이상에서는 온도가 증가함에 따라 촉매의 효 능은감소한다. 5) S y n t hane 가스로에서의 백운석이나 석회석을 5 wt . % 첨가하였을 때 (CO+H2+CH4) 생성물은 현저히 증가하였고, I045°C 의 고온에서 도 회분의 용융 없이 조업이 가능하였다.
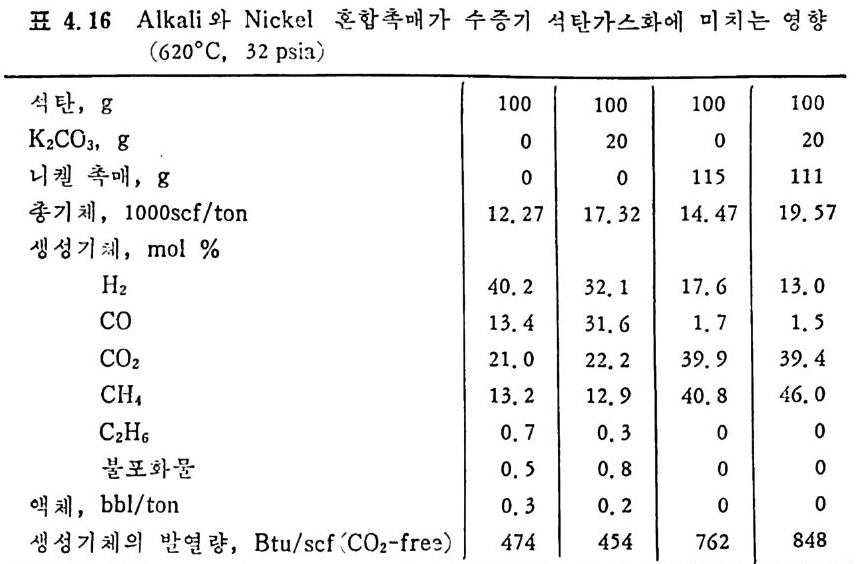 표 4. 16 Alka li와 Ni ck e l 혼 합 촉 매가 수층기 석탄가스화에 미 치 는 영 향
표 4. 16 Alka li와 Ni ck e l 혼 합 촉 매가 수층기 석탄가스화에 미 치 는 영 향
석 탄의 가스화, 죽 탄소와 수중기반응 (C+H 2 0->CO+H 2 , C+2H20 ->C0 2 +2H2) 에 K2C03 와 Ni와 (K 2 C03+N i)의 촉 매기능을 실험한 결 과 가스화율과 석 탄전환율이 알카리 탄산영 에 의 하여 증가되 며 Ni 은 CH 4 생성을 촉진시키며 K 2 C03 의 2ow t%가 츠]대 가스화율을 얻을 수 있었다. 석탄의 유황화합물이 N i촉매에 해독작용을 하며 (K2C03+N i)촉매 는 CH4 과 CO2 를 직접 생성시켰다. 또한 반응조건이 650°C 2 a t m 하 에서 석탄전환율이 60% 정도에서 C 아가 없는 가스생성물의 열량은 ~850B t u/sc f가 되었다. 각각의 촉매와 두 촉매를 같이 사용하여서 가스 생성에 대한 실험결과 를 표 4. 16 에 보여주고 있다. 위의 표에서 N i의 양은 유황분이 해독시키고도 남는 충분한 양이 다. 연 천평 (the rmobalance) 에 서 의 석 탄의 수소화반응 (h y dro g as ifi ca- tion ) 에 KHC03, K2C03 및 ZnCl2 촉매 를 5 wt. % 첨 가하여 서 이 들의 촉 매역할을 실험하여 이 반웅의 반응식을 Gardner 둥이 제시하였다 .17) 상기 촉매 의 효능은 KHC 아::::::: K2C03>ZnCl2 순이 다. 전자현미 경 으 로 촉매의 분산을 조사하여서 상기한 촉매용액을 석탄입자에 담지 시킨 분포가 매우 균일함을 확인하였다 . 특히 KHC03 촉매의 사용
경우 촉매륜 사용하지 않은 경우와 비교하면 가스화운이 대략 2 배가 증가하였다. 또한 반응률은 활성화 엔탈피가 전환 정도에 비례한다고 가정하여서 다음과 같이 제시하였다. Tdtx = k P,~(I-x) exp [-6.H *IRT] (4. 14) 여 기 서 x 는 좌의 전환분율, k 는 빈도인자, 1t 은 반응차수, p,,’ 는 수 소분압, 6H*=H0+ax= 전환율 x 때의 활성화 엔탈피, kcal/g -m ole, 6Ho 는 초기 활성화 엔탈피 a 는 6H 가 X 의 감도결정 인자, R 은 기체상수 (1.987 cal/ g-m ole°K), T 는 온도 ( ~ K) 이다. 상기석 (4.14) 를 다시 정리하여서 적분하면 [~dx=Lkdt= kt (4. 15) 여기서 k=kP,;,ex p(一 6H0/RT) 아고 b=a/RT 이다. 식 (4.15) 에서 『 ex p (bx)/(I-x)dx 를 시간에 대하여 도시하면 직 선을 얻는다. 실험 결과로부터 b 값은 수소분압에 무관하며 수소화반 웅의 차수는 1.5 이고 촉매가 없는 좌에 대하여 6H' = 29.3+2.43X, (kcal/mole) 로 나타났으며 KHC03 촉매화시킨 좌의 경우는 6H 드 =29. 3 ― 2.43X 로 나타났다. 그러므로 실제 촉매의 역할은 반응이 증가함에 따라 활성화 엔탈피가 감소하여서 전환이 진행됨에 따라 반응이 쉽게 일어남을의미하며, 이는 촉매를 첨가하지 않은좌의 경우와는 반대 현 상이 라고 하겠다. 자세한 석 탄가스화 반응의 촉매는 Cusumano 가 정 리하였다 .18) 4. 5 수소화 가스반응 (H y dro g as ifi ca ti on) 탄소와 수소가 직접 반응하여서 CH4 울 생성하는 반응(표 4.8) 에서 열여학적 평형상수와 이의 온도에 따른 변화를 보면 온도가 상승하떤 CH4 은 분해된다. 방향족 탄화수소 (benzene) 는 H2 에 대 하여 파라핀계 탄화수소 (he xane) 보다 안정하다. 또 이 영향은 보통 가스화 온도인 1000~1500°F 범위에서 나타나지만 반응의 엔탈피 변화는 벌로 차이가 없다.
수소와 단화수소의 발열 반응은 대 략 수소가 CH4 으로 전환될 때 15 kcal/ g-m ole 이 다. 이 는 온도 상승을 가져 와 반응물울 증가시 킨다. 또 한 파라핀계 탄화수소를 높은 수소 압력하에서 반응시키기는 쉬우나 수소분압이 조절되지 않는 상대에서 반응을 수행하기는 쉽지 않다. 합성 가스 (CO+H2) 를 수증기 로 전환반응시 켜 서 수소를 산업 적으로 생산한다 . CO + H20 一 C02+ H2 그리고 여기서 CO2 를 쉽게 제거할 수 있다. 즉 여기서 얻은 H2 를 석탄의 수소화 가스반응에 활용할 수 있겠다. 다른 수소 제조반응은 철이나 산화철을 수증기와 반응시켜서 산화적主 원반응을 순환시켜 수소를 생성하는 방법이다. 환원반응 ; Fe304+H2 一 3FeO+H20 (1) FFFeeeO3O 0++4 HC+2OC—O— 一->•FF e3e + +F HCeO200+2 C 02 (((243))) 산화반응 ; Fe+H20 ―냐 eO+H2 (5) 3Fe0+H20 一 Fe304+H2 (6) 여기서 반응 (5), (6) 은 반응 (3), (1) 의 가역반응이다. 이 반응은 대 략 800°C 정도에서 수행된다. 만일 환원반응을 930°c 에서, 산화반응 윤 710°C 에서 수행하면 각각 80 과 60% 의 평형 전환율에 가까운 값을 얻는다. 이는 두 개의 반응영역을 만들어서 고칭충 반웅기에서 수행 할 수 있으나 더 좋은 방법은 유동충을 사용하여서 고체 물질을 이동 하여 반응시키는 것이다. 다론 방법의 수소 생성은 물의 전기분해가 있으나 매우 생산비가 크 며 최근에 원자력 발전소의 페열을 이용하여 물을 열화학적으로 분리 하는 방법도 연구되고 있다 .19) 석탄은 고압의 수소와 고온하에서 마론 열분해와 수소화반응이 일 어난다. 반응시간이 짧으면 액체산물이 생성되고 반응시간이 길면 기 제산물이 생성된다 .19) 수소가 탄소에 첨가되는 과정은 다음과같다.
\/c H\=/_\/ _/\ H /c\= /\ H2 I 〉c=H : 스HH )=Hc 〈 /-l- +※H 2 2CH4+> c= \H = c< ’ >c= ~
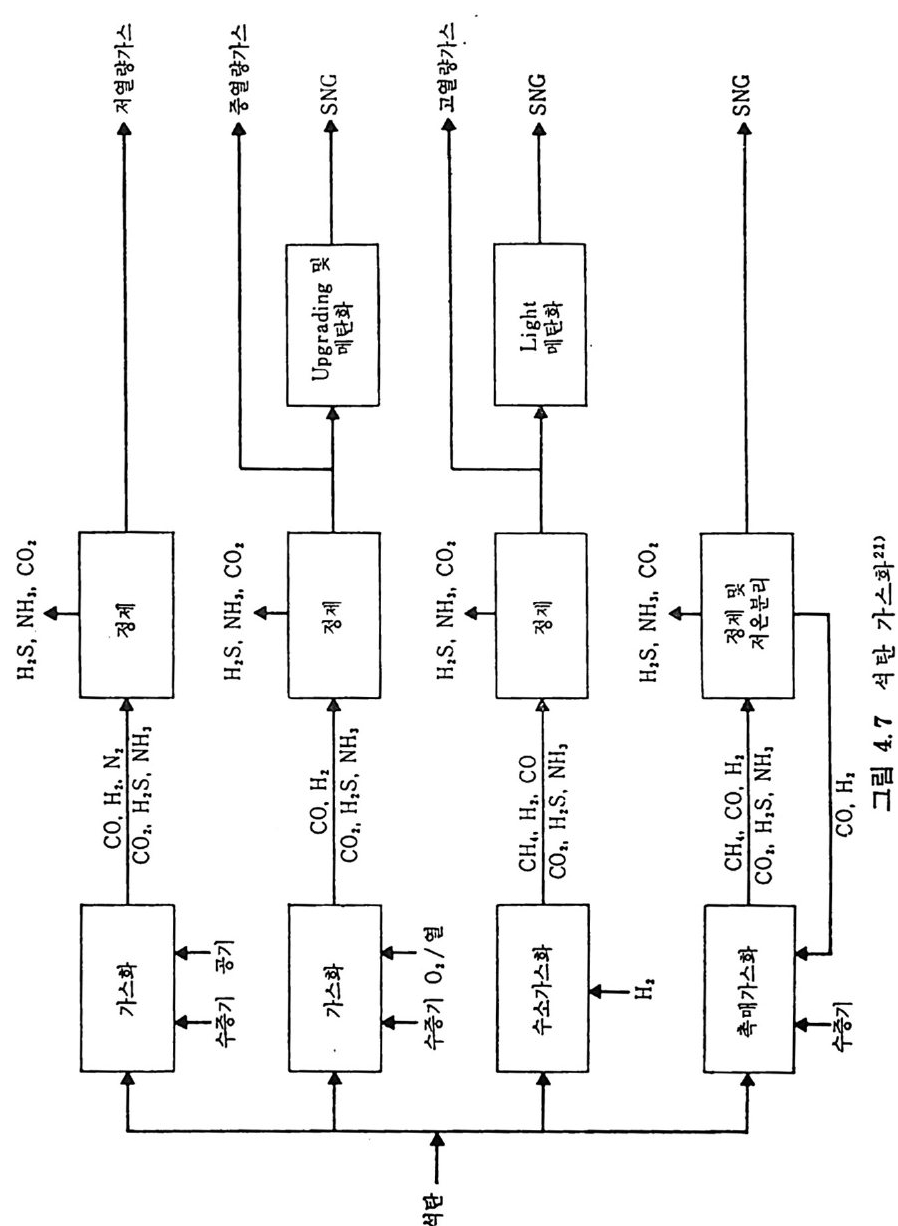
체 (liqu id or molte n mediu m ) 가스로로서 나눌 수 있 다. 반응기 종류에 따라 온도 분포가 다르므로 기체와 잔류물의 분포가 다르다. 반응온도는 815~1925°C 범위에서 반웅기 종류에 따라 법위 가 다르다. 다론 하나의 방법은 채광하지 않은 석탄광에서 직접 가스 화하는 방법으로, 반웅가스를 직접 석탄광에 주입하여서 생성된 기체 를 석탄광에 구멍을 내어서 채취하는 것이다. 상이한 가스로를 목성 화하는 방법은 독립적인 목성과 종속적인 독성으로 나눌 수 있다. 독 립적인 특성은 가열방법, 가스화의 매개체와 반응기의 종류이며 종속 적인 목성온 고체 찬류물이 회분, sla g인지의 여부, 반옹온도, 기체 의 조성 및 열량 등으로 특성지울 수 있다. 표 4.17 에 이의 특성을 구분하였다 .21) 일반적으로 높은 온도에서는 합성가스를 생성하고 낮은 온도에서는 CH4 을 생성한다. 또한 높은 온도 가스로에서는 용융된 회분이 배출되므로 sla ggi n g가스로타 하고 낮은 온도 가스로는 회분이 용융되 지 않으므로 dry bott om 가스로 라고한다. 회분의 용융접은 회분의 조성에 달려 있으나 대부분의 석탄은 1200 ~1800°C 이면 회분이 용융된다.
 표 4.17 가스화 반응기의 주요 독립 및 종속 특성
표 4.17 가스화 반응기의 주요 독립 및 종속 특성
4. 6. 1 고정 총 가스로 (Fixe d Bed Gasif ier ) 석탄을 gra t e 위에 장입시켜서 고정충을 만들고 반응가스를 믿에서 주입하여서 입자충 사이를 동과하면서 반응하며, 고체입자는 중력 에 의하여 밑으로 흘러내리게 된다. 그러므로 이를 이동충 (mov i n g bed) 이라고도 한다. 석탄은 상부에서 주입되어져서 건조되고 이동하 면서 열분해 (devola ti li za ti on) 된 후 가스화 반응을 하며, 반응기 하단 에서는 밑에서 주입되는 (02+ 수증기) 또는 (공기 +수중기)와 산화반 옹을 하여 상부의 가스화반응에 필요한 열을 공급하게 된다. 상부 에서 주입되는 석탄입자의 크기는 3~50mm 범위에서 공정에 따라 변 화시키나 최저 크기는 3mm 보다 커야 기체흐름에 의한 비말동반 (en t ra i nmen t)을 방지할 수 있다. 입자의 하향속도는 대기압하에서의 공기/수중기 주입시에는 o.5m/h 청도이고 고압에서 수증기/산소 주입시에는 5 m/h 정도이다• 그러므로 석탄입자의 체류시간은 반응기에서는 o.5~I.Ohr 가 되나 대기압 조업에서는 5~10hr 정도가 된다. 반응기 하부의 산화영 역 에 서 의 주된 반웅들은 다음과 같다. C+0 2 一 CO2 c+ ―2 - 02 一 co C+C02 一 2CO C+H20 一 CO+H2 가스화 영역에서는 밑에서 공급되는 수증기와 CO2 가 좌와 다음과 칼은 반응을 일으킨다. C+H20 一 CO+H2 C+C02 一 2CO 여기서 상승하는 기체는 가스화반응이 홉열반응이므로 온도가 낮으 나 열분해온도 이상이므로 석탄을 연분해한 후 남는 온도로 주입되는 석탄을 건조시킨다. 이 고정충 가스로의 한계접은 입자크기가 작으면 비말동반이 커서 효율이 저하되므로 작은 입자를 사용할 수 없다는 것이나 입자와 기 체가 향류로 흐르므로 좋은 열전달에 의한 열효율이 크고 주위로의
연손실이 작다는 장접이 있다. 건조회분 가스로 (dr y ash g as ifi ers) 에 서 는 회 분의 용융온도보다 낮 게 조업하기 위하여 많은 양의 수증기물 주입하며 이는 탄소-수중기 홉열반응에 열을 공급한다. 그러나과잉수증기는반옹에 소모되지 않으므로반응기의 처리용량이 중가하여야 하는 문제와 응축된 수중기와 같이 배출되는 유독물질인 ph enol 과 cy a nid e s 둥을 제 거 하여 야 하는 문제 가 유발된다. 또한 반 응기의 온도를 일정하게 유지하지 못하여서 온도가 산화반응영역에 서 낮으면 회분에 미연소 탄소가 많이 배출되며, 온도가 너무 높아서 회분이 용융되면 g ra t e 의 회분제거 기계작용이 기능을 하지 못한다. 그러므로 온도조철을 적철히 하여서 회분의 용융접 온도에서 회분을 제거함으로써 미연소 탄소함량을 최소화하여야 전체 효율을 최대화할 수 있겠다. 그러므로 고정충 반웅기 내의 온도분포에 대한 정보가 필 요하다. 그림 4. 8 에서 보듯이 반응성 (reac ti v ity)이 낮은 석탄은 연소
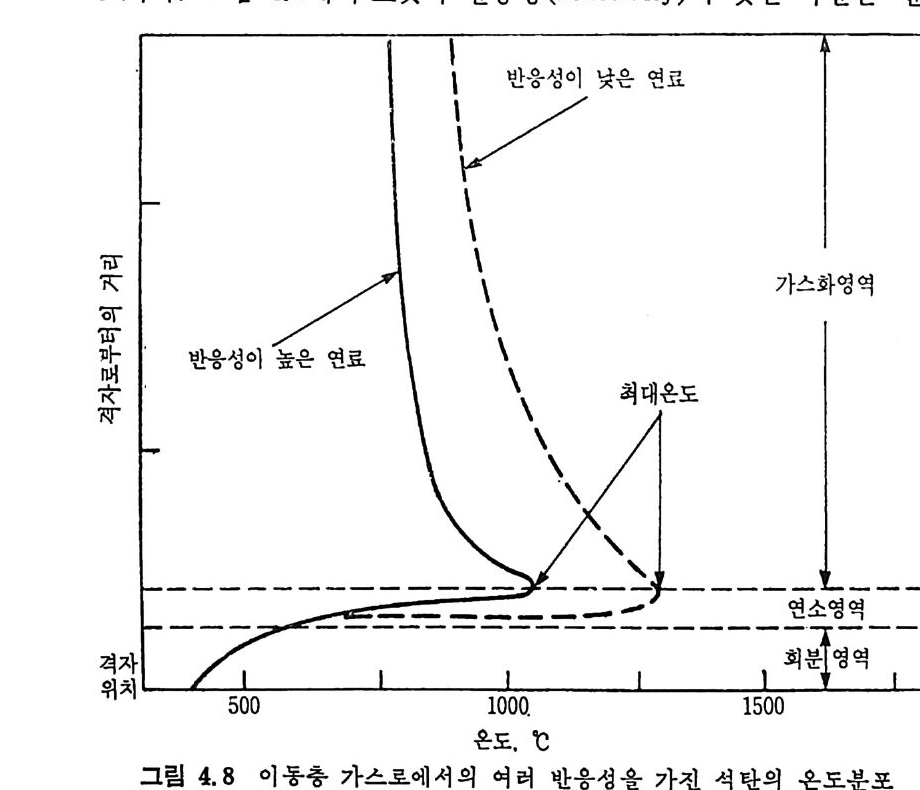 IIV\\\\,\
IIV\\\\,\
영역에서 높은 온도가 요구되므로 회분의 용융을 막기 위하여 많은 양의 수증기가 요구된다. 그러므로 온도의 한계접에 따른 석탄 종류 선덱에 제한접이 있다. 또한 괭윤 (swe lli n g)이나 cak i n g성질을 가전 석탄은 표면을 산화시키는 전처리 없이는 사용하기 힘 들 다. 그 반떤 slag ging bott om 가스로의 경 우는 연소영 역 의 온도를 높게 하여서 (1927°C) 회분을 용융시켜 제거하므로 과잉의 수증기 주입 이 요구되 지 않으며 , 탄소-수증기 반응률이 고온에 서 증가하여 서 수 증기의 활 용도가 커서 생성가스 중의 미반응 수증기의 양이 적으므로 co 근] 생성함량이 감소된다. 또한 sla ggi n g가스화의 장점은 열효율 과구되 처지리 않용고량 이생 성크가고스 의석 탄c o종 함류량에이 무커관서하 며열 량기이계 크적 고g r응a t축i n된 g 장액치체가생 성요 률이 작으며 탄소의 연소가 거의 완벽하다. 그러나 이 반응기 조업조 건은 고온, 고압하에서 일어나므로 이에 대한설계상의 문제를고려하 여야 한다. 이동충 가스로에서의 조업 목 성과 생성기체 조성을 표 4.18
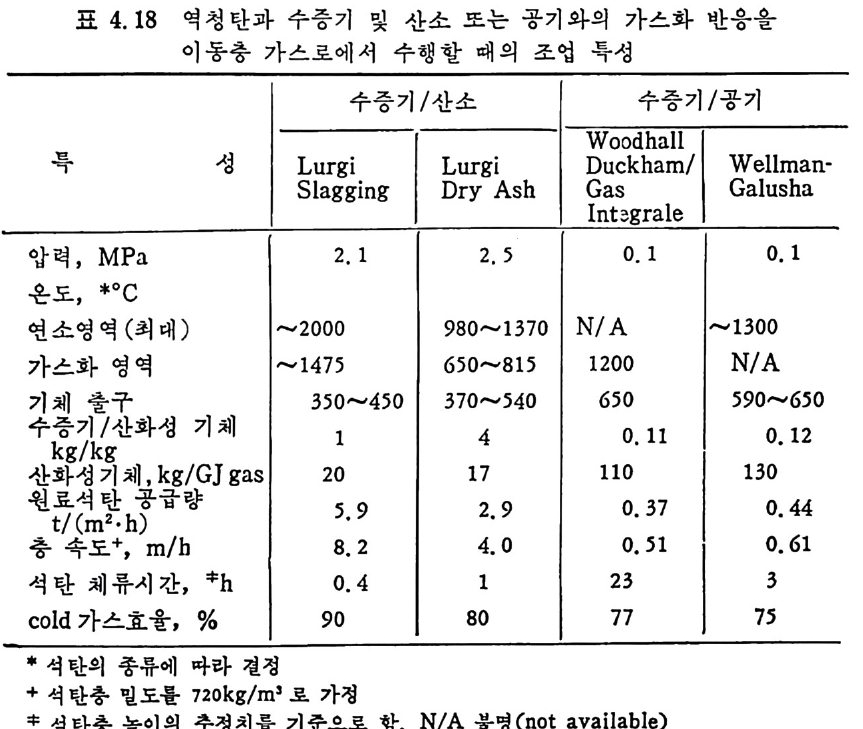 표 4. 18 역 청 란과 수 증기 및 산소 또는 공기와의 가스화 반응 을
표 4. 18 역 청 란과 수 증기 및 산소 또는 공기와의 가스화 반응 을
 표 4.19 이동충 가스로에서 역청란과 수증기 및 산소 또는 공기와의
표 4.19 이동충 가스로에서 역청란과 수증기 및 산소 또는 공기와의
과 4.19 에 각각 보여주고 있다. 21 ) 4. 6. 2 유동총 가스로 (Fluid i z e d Bed Gasif ier ) 유등충 가스로에 마세한 석탄입자를 향류나 병류로 산소 또는 공기 와 수증기를 주입하여 반응시킵과 동시에 유동화 매체로 사용한다. 유동화 기체속도는 15~45cm/s 범위로 사용하여서 초기 장입석탄충 높이의 두 배가 되는 충팽창 높이를 유지한다 . 일반적으로 석탄 내의 금속성분의 비중(p >2.3) 은 탄화수소의 비중 (p =1.3) 보다 크므로 미세한 금속성분입자만 비말동반되고, 큰 입자 금속성분과 좌입자들은 밑으로 누적되어서 유동화를 방해하므로 계속 져으로 회분을 제거해 주어야 한다. 죽 석탄의 회분은 다 비말동반되 어서 제거되지 않으며 그 이유는 물질의 바중 차이분만 아니라 입자 크기와 바중의 분포가 다양하기 때문이다. 유등충은 입자의 격렬한 혼합에 의하여 균일한 온도분포를 유지하 므로 가스화반응중의 발열 및 홉열반응간의 좋은 열전달 효과를 가 져서 열평형이 빨리 일어나므로 상대적으로 높은 처리용량을 가지 며 부분적 가열접 (ho t s p o t)이 없으므로 원하지 않는 회분의 용융물이 없다. 그 반면 유동충 가스화 반응기에는 괭윤 (swe lli n g)이나 cakin g
석탄을 사용할 수 없는 단접 이 있다 . 만일 석탄이 펭 윤되면 입자가 서 로 녹아 붙어 서 점 접 입 자크기 가 증가하여 비 유동화 (defl ui d i z a ti on ) 되며 반응기 벽이나 분산판에 되적되어서 조업이 불가능하게 된다. 그러므로 이러한 cak i n g석탄은 표면을 산화시키는 전처리가 팔요하 다. 이 전처 리 과정 을 Gasio r 둥 2 2) 은 약 7m 높이 의 자유낙하 반응기 룬 사용하여 서 31 0~43 0 ° c 및 250~33 0p s i g 조건에 서 5. 5 몰% 산소룹 함유한 수증기 로 산화반응을 수 행 하여 석 탄입 자가 6. 4~9. 5mm 이 고 팽윤계수 (FSI) 가 8.0 인 시료가 전처리 후 FSI 가 1. 5~2.0 으로 감 소되었고, 이 룬 6 00 ° C 에서 수소화반응시킨 경우 cak i n g이 일어나지 않 았 다. 그 반면 전처리과정중 석탄 내의 휘발분은 35.6% 에서 25.0 %로 감소되었고 입자의 밀도도 50% 정도 감소되었다. 이는 수소가 많은 휘발분함량의 1/3 정도를 제거시키므로 생성가스의 열량을 감소 시 킨 다 . 유사한 결 과 를 유동 충 반응기 에 서 latm , 385~400° C 반응조 전 을 이용하여 1lb 석 탄당 1.0~ 1. 5 f선의 산소를 공급하여서 석탄체류 시 간 을 1~2 시간 범위 내에서 전처리한 석탄의 경우에서도 얻을 수 있 었다 . 23) 이 전처리된 석탄 표면의 산화피막은 비교적 군일하며 피 막 내부는 기공이 연결되지 않은 균열된 기공으로 이루어져 있다 .24) 석 탄과 좌를 혼합하여 cak i n g문제 를 해결하려는 방안이 제안되었 고 차 와 석 탄의 비 가 2. 0 보다 크면 540 ° C 및 500 ps i 이 상의 유동충 반웅기에서 수소화반응이 가능하였다 . 그러나 석탄이 열분해하여서 좌 표 면에 붙어서 입자크기가 커지나 가스화에 의하여 입자 크기가 감소하므로 서로 상쇄될 수 있다. 그러나.초}/석탄 비가 크면 반응 기의 크기가 커져야 하는 문제접이 있다 . 유동충 가스화 반응기의 최 적 입 자크기 는 8~200 mesh (o. 074 ~ 2. 36mm) 범 위 이 다 . 입 자가 너 무 작으면 쉽게 용융되기 쉽고 비말동반이 크며, 너무 입자가 크면 입자 표면에 열분해시 피막이 형성되고 내부의 분해는 계속되어서 입 자 내부의 압력이 상승되어 매우 작은 입자로 깨어지므로 비말동반의 손실을 유발한다 . 최 초의 가스화 반응기 는 1921 년에 개 발된 W ink ler 유동층 가스로로 서 1926 년에 상업화되었다. 이 가스로는 대기압하에서 조업되며 주로 수증기와 산소를 주입하여서 합성가스 제조에 이용되었다 . 최근에 연 구되 고 있 는 U-Gas ga sif ier (Insti tut e of Gas Technolog y) 와 Westi ng -
 표 4.20 유동충 가스로에서 역청란운 수증기와 산소 또는 공기로
표 4.20 유동충 가스로에서 역청란운 수증기와 산소 또는 공기로
 표 4.21 칙정 가열 유동충 가스로에서 수증기와 산소 또는 공기로
표 4.21 칙정 가열 유동충 가스로에서 수증기와 산소 또는 공기로
house 사의 가스로는 가압하에 서 조업 하는 장치 로, 공기 와 수증기 를 주 입하여 저열량 가스를 얻는 목적으로 개발한 것이며 고열량 가스로 개발은 Hy ga s gas if ier (Insti tut e of Gas Technolo gy)가 있다. 상기한 반응기들의 조업조건과 생성기체의 조성을 표 4.20 과 4.21 에 보여주고
있다 .21) 4. 6. 3 비 말등반 가스로 (Entr a in e d Flow Gasif ier ) 비 말동반 또는 수송(t rans p or t) 반응기 에 서 의 석 탄 또는 좌의 입 자 크기 는 75 µm 정 도이 며 이 분탄은 수증기 -산소, 수증기 -공기 또는 H2 중의 하나로 수송되면서 가스화반응이 일어난다. 높은 온도에서 반응 이 진행되므로 전환율은 매우 높다. 석탄을 급속으로 고온에서 가스화하므로 체류시간은 수초에 불과하 나 가스화가 거의 완전히 이루어져서 CO,CO2,H2,H2S 및 전환되지 않 은 수증기를 배출한다 .25) 석탄 내의 휘발분은 고온에 의하여 모두 산 화되므로 산소의 소모가 비교적 크다. 또한 고온에서의 CH4 생성은 적 고, CO/CO2 비는 높으며 탄소의 전환율은 90~100% 의 높은 값을 보 인다. 이 반응기에서 2 단계로 가스화하는 방법은 석탄입자를 수증기 로 비말동반시켜 1650°C 반응기를통과하여 열분해시킨 후 원료 석탄 으로 배기가스를 냉각시키고, 생성된 좌는 연소로에서 수증기-산소로 써 연소시키는 것이다 .26) 이 두 단계 방법은 휘발분이 연소영역의 높 은 온도 범위를 거치지 않으므로 생성기체의 열량이 휘발분에 의하여 높아지며 좌믈 연소시키므로 고정탄소에 대한 산소 소모가 석탄에 대 한 것보다 작으며 생성 기체가 반응로를 나가는 온도가 낮으므로 공 정에 팔요한 열소모가 적고 동시에 산소 소모가 작다. 또한 석탄입자 를 액상으로 비말동반시켜서 증발시킵과 동시에 칙접 반응시킬 수 있 다. 죽 석 탄을 물과 혼합하여 서 고온 (1480~1920°C) 하에 서 산소와 같 이 수송하면서 반응시킨다 (Texaco 공정). 이 방법은 공정이나 장치 는 간단하나 산소의 소모가 크며 수증기 는 물의 증발에 의 하여 공급 된다. 고압하에서의 수송 반응기는 처리용량이 크고 어떤 석탄이나 사 용할 수 있는 장점이 있으나 병류로 반응물이 흐르므로 열효율이 좋 은 공정은 아니며, 배기가스의 온도가 높으므로 급속히 냉각시켜야하 논문제와고온조업이므로 회분을 sla g상태로 제거해야 하는 문제 둥 이 있다. 그 반면, cak i n g석탄에 대한 전처리는 필요하지 않다. 이러 한 반응기의 대표적인 것이 1950 년 초에 개발된 Ko pp ers-To t zek 가스 로와 근래 의 Combuti on Eng ine erin g 과 Foste r Wheeler 사의 가스로 이며 이 장치들의 조업조건과 생성가스의 조성둘을 표 4.22, 4.23 에
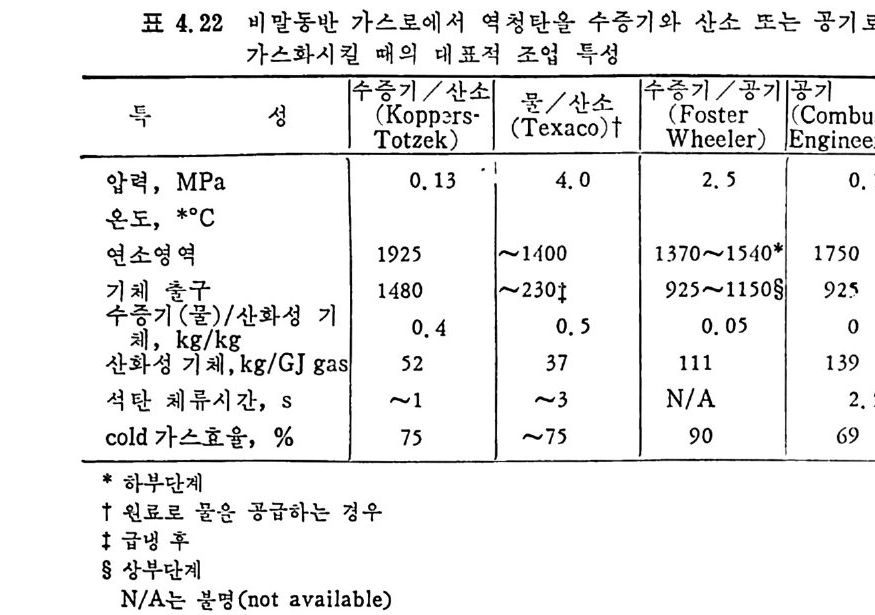 표 4.22 비말동반 가스로에서 역청란운 수증기와 산소 또는 꽁기로
표 4.22 비말동반 가스로에서 역청란운 수증기와 산소 또는 꽁기로
 표 4.23 비말동반 가스로에서 역정란운 수증기와 산소 또는 공기 룬
표 4.23 비말동반 가스로에서 역정란운 수증기와 산소 또는 공기 룬
보여주고 있다 .2 1) 4. 6. 4 액 체 매 체 (Liq u id Mediu m ) 가스로 조업온도에 따라 두 가지로 대벌할 수 있다. 죽 용융 Na2C 아를 사 용하여 980°C 에서 조업하는 것과 용융철을 사용하여 14so ° C 에서 가
스화반응을 수행하는 것이다. 반응온도가 높으므로 (~1400°C) 탄화 수소 물질은 거의 완전히 분해된다. 용융영 (molte n sal t)을 반응 매개체로 사용하면 영 자체가 H20+C 一, CO+H2 반응에 촉매역할을 하여서 반응률을 높인다 .25,2 분말의 반응 물질인 석탄은 공기 또는 수중기-산소에 의하여 용융영에 주입되면 이때의 반응압력은 10~80atm 범위에서 조철되며 고체-기체가 병류 로 흐르므로 cakin g 석 탄의 전처 리 는 필요하지 않다. 석 탄 내 의 금속 성분은 용융영에 부분적으로 용해되므로 용융영과 회분을 연속적으로 배출시켜서 회분을 용융영에서 제거한다. 이 분리 공정이 장치비의 콘 몫을 차지한다. 용융영은 부식이 십한 물질이므로 반응로벽을 냉 각시켜서 냉동영 충을 형성시켜 부식을 방지한다. 이 용융영은 높은 연전달률을 가지므로 발열 산화반응의 열을 흡수하여서 홉열가스화 반응에 공급하며 석 탄 중의 유황분을 흡수한다. 용융철 (mol t en i ron) 을 매개체로 사용하는 경우는 미분석탄을 수증 기로 비말동반시켜 용융철에 주입시켜서 석탄은 열분해를 거쳐 수 증 기와 반응한다. 좌는 용웅철에 녹아서 수증기, H2 또는 아와 반응 한다. 석탄 내의 유황성분은 처음에 용융철에 녹고 sla g에 전달되어 서 제거된다. 반응온도가 매우 높으므로 모든 탄화수소와 유기물질은 완전히 분 해되어서 CO,CO2,H2,H20 및 H2S 를 생성한다. 4. 6. 5 지 하 가스화 (Undergr o und Gasif ica ti on ) 이제까지 석탄을 반응기 내에 주입시켜서 가스화시키는 방법을 다 루었으나 석탄을 탄광에서 채탄하지 않은 상태에서 광맥에 직접 반응 기체를 주입하여서 가스화할 수 있겠다. 이는 석탄의 채광이 필요치 않으므로 이에 따른 경비철감은 지대하다고 할 수 있겠다. 최초의 지 하 가스화는 1933 년에 소련에서 시작되었고 여기서 발생되는 가스를 발전하는 데 사용하였 다. 28 선) 그러 나 현존하는 상업 적 지하 가스화 조 업은 없는 상태이다. 이는 이제까지의 기술로서는 처열량 가스생산이 가능하나 경제성이 없으므로 앞으로의 개발과제라고 할 수 있겠다. 기본적인 지하 가스화 조업을 그림 4.9 에 보여주고 있다 .29) 그릭에서 보듯이 두 개의 구멍을 뚫어서 한쪽에서 꽁기 또는 산소
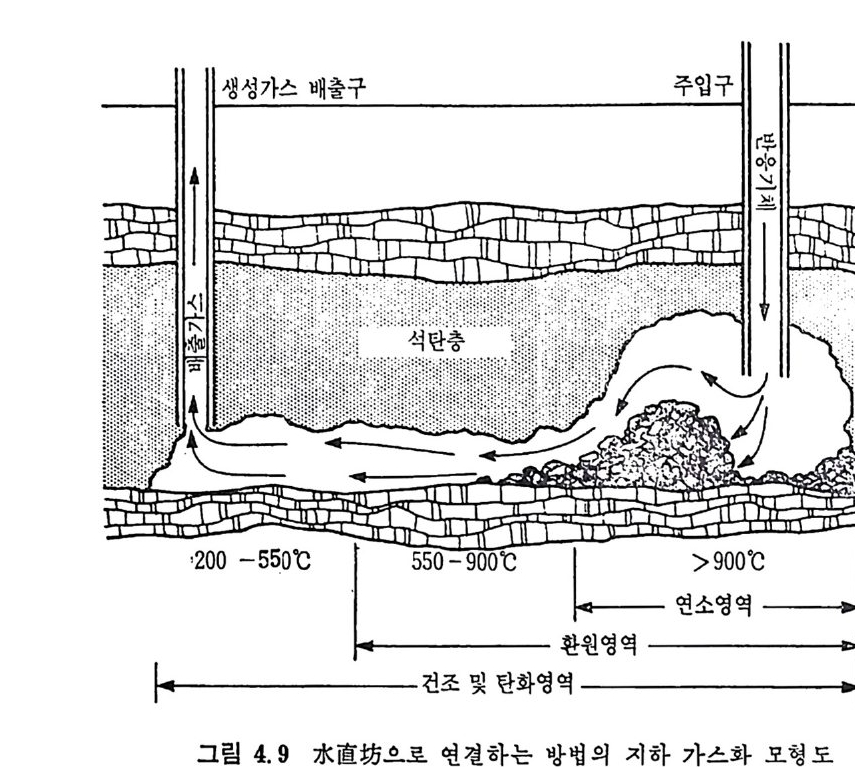 생성가스 배출구 주입구
생성가스 배출구 주입구
몰 수증기와 같이 석탄 광맥에 주입한다. 석탄은 처음에 연소되어서 계속적인 산소공급으로 연소가 진행되면서 주입되는 가스에 의해 반 응은 옆으로 진행되면서 가스화 반응영 역 (reduc ing zone) 으로 가고 거기서 생성되는 가스는 반대편의 구멍으로 배출된다. 그러나 두 구 멍 사이의 석탄충 자체가 충분히 큰 두과성을 지니지 못하므로 반응 방향으로의 연소를 시켜서 작은 두과성이 높은 길을 만들어 주어야 한다. 반응되어서 생성되는 기체는 이동 고정충 반응기의 산물과 유사하 다. 이 지하 가스화 공정은 개발중이므로 자세한 내용은 이제까지 발표되어진 문헌을 참고하기 바라며 29,33) 국내 석탄광의 경우에는 적 용이 적합하지 않으므로 간략히 다루었다.
4. 7 가스로의 열 공급방법 가스화반응 중 탄소와 수증기 , 탄소와 C 아 반응 둥의 홈열 반응에 어떻게 필요한 열을 공급하는가에 따라 가스로를 구밀할 수 있다. 대 부분의 가스로는 석탄 또는 좌를 연소시켜서 여기서 발생되는 열을 공급하나, 이때 산소 대신에 공기를 사용하여 연소시키면 질소가 생 성가스의 농도를 낮추는 역할을 하므로 저열량 가스 (5~10M J /m3) 룬 생성하게 된다. 그 반면 공기륜 사용함으로써 장치비와 조업비를 절 감할 수 있다. 가스화의 목적이 천연가스를 대체하는 CH4 생산이 목적이면 거의 순수한 CH 너끌 생산하여야 하며 이때 산소 대신에 공기를 사용하면 연료가치가 없는 N2 가 전체의 연료가치를 떨어뜨란다. 그러므로 순 수산소를 공급하여야 하며 공기로부터 산소를 분리하는 장치비가 CH4 생산비의 25~35% 를차지한다 . 또한 CH4 의 순도를 높이기 위하여서 생성가스 중의 C 아를 제거하여야 한다. 열을 공급하는 적합한 방법 중의 하나는 두 개의 유동충을 사용하 여 서 하나는 가스화 반응기 (홈열반응)로, 다른 하나는 연소로(발열반
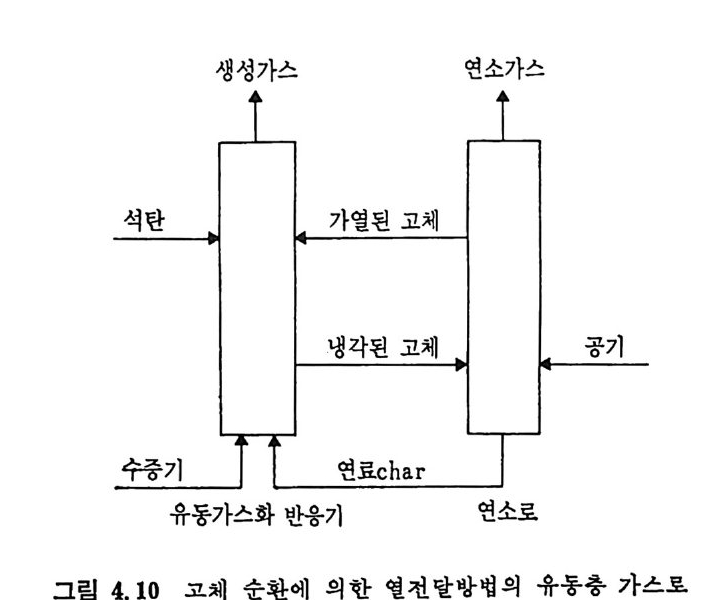 생성가스 연소가스
생성가스 연소가스
응)로 조업하여서 연소로에서 가연된 비활성입자 (Al203, 회분입자) 나 활성입자(석회석, 좌)들을 가스화로에 순환시켜 열윤 공급하는 방법이라고 하겠다. 그 대략적인 공정도를 그립 4 .10 에 보여주고 있 다.1) 순환 고체물질로 비활성 내화물질윤 사용하는 경우에는 이 물질이 물리적으로 강하고 마모되지 않으며, 산화나 환원되지 않고 높은 바열 울 가전 물질로서, 구형으로 제작이 가능한 저렴한 것이어야 하겠다. 또한 좌와 쉽게 분리되어야 한다. 화학적 활성이 있는 열전달매체는 보통석회석을사용한다. 석회석은연소로에서 소성되어서 석회가되고 가스로에 서 탄화되 면서 [C aO+C02->CaC03,6H~9s= -183 KJ /m ole] 연을 발생하면서 입자의 순환율을 감소시킨다. 이 탄화반응은 CO2 를 소모하므로 생성기체 중의 CO2 함량을 감소시켜서 가스정제 공정에서 의 C 아 제 거 에 도움을 준다. 34) 그러 나 CaC03, CaS 및 CaS04 가 낮은 융해 액체를 형성하여서 석탄을 싸거나 기공을 막게 되므로 이 조전을 피하여서 조업하여야 한다. 또한 Ca(OH)2 ― CaO 도 석탄의 외피를 싸 므로 석회석을 열매체로사용시에는 수증기 분압은 9a t m 이하이고 온 도는 815°C 이하로 유지시켜야 한다. 그러므로 반응성이 큰 준역청란 이나 갈탄의 경우 낮은 온도에서 기화되므로 적합하나 고온에서 가스 화되는 역청란의 경우에는적합치 않다. 잔류좌를 열매체로 순환시키 는 경우에는 상기한 문제접을 배제할 수 있고 비활성 물질이 아니므 로 분리할 필요가 없을 분만 아니라 비열과 열전도도가 좋은 장접이 있다. 그 반면 순환되는좌의 일부는연로로사용되고 일부는 열매체로 사용된다. 또한 좌를 가스로의 열매체로 사용한 결과, 좌의 반응성도 증가하였다. 그러나 배기가스와 좌의 접촉시간은 짧고 기체-고체간 의 혼합은 빨라서 탄소성분이 CO2 로 전환되는 것을 최소화하여야 한 다. 연소로에서 보내는 열매체 입자 수송시 질소 성분이 가스로에 입 자와 같이 주입되고, 가스로에서 연소로로 보내지는 입자 수송에는 가 스로의 산물인 (CO+H2) 가 연소로에 주입되므로 가스로의 생성물의 손실을 수반한다. 그러므로 입자 수송시 주입되는 질소성분이 생성 가스의 열량을 감소시키므로 질소성분을 제거하여야 고열량 가스를 생성할 수 있다• 이러한 문제를 배제하기 위하여 전기로써 가열하는 방법도 연구되었으나 전기값의 상승으로 경제성이 없고, 최근에 원자
력 발전시의 페열로 가열하는 방법도 제시되고 있다. 4.8 저열량 가스 상업 적 으로 저 열 량 가스 생 산공정 은 Lurgi , Wi nk ler 및 Wellman-Galusha 공정이 있다 35-36) 그 반면 이제까지 개발중이거나 개발된 공정은 40 여개에 이른다. 36) 그 대표적인 공정의 특성을 표 4.24 에 종합하였다 .37) 여기서 보듯 이 앞에서 기술한 고정충(전조, slag ging ) 가스로, 비말동반(건조, slag ging ) 반응기 , 유동충 및 용융열 반응기 로서 가스로가 대 별된다. 38) 각 공정의 열량치와 기체산물의 조성은 석탄의 종류와 조업조건에 따 라 년화한다. 여기서 제시된 공정들은 저열량 가스를 생성하는 것이므로 공기와 수증기를 반응기체로 공급하여서, 반응된 연료가스 생성물 중의 N2 조성 이 높다 (37~63%). 두 가지 대표적인 고정충 가스로의 조업상의 장접과 단접은 다음과 같다. a) Lur gi공정 Lurgi Mi ne rolte c hik GMBH 사에 서 개 발된 이 래 가장 많이 산업
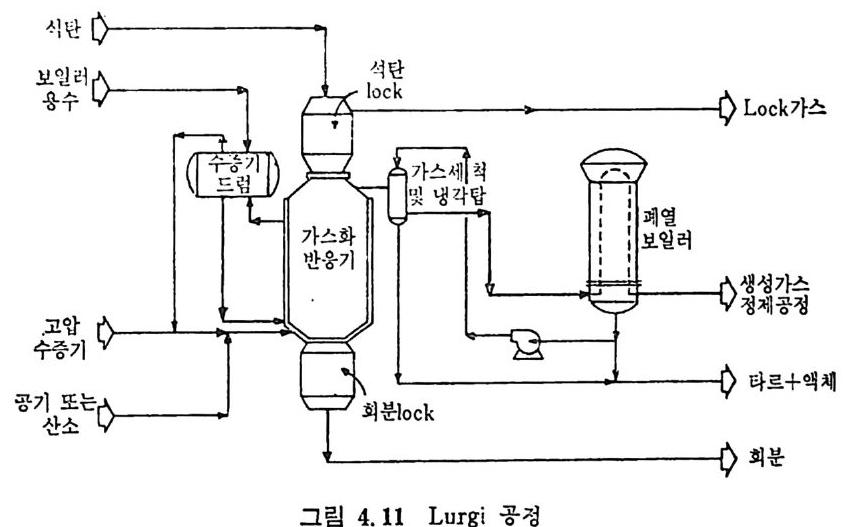 석단
석단
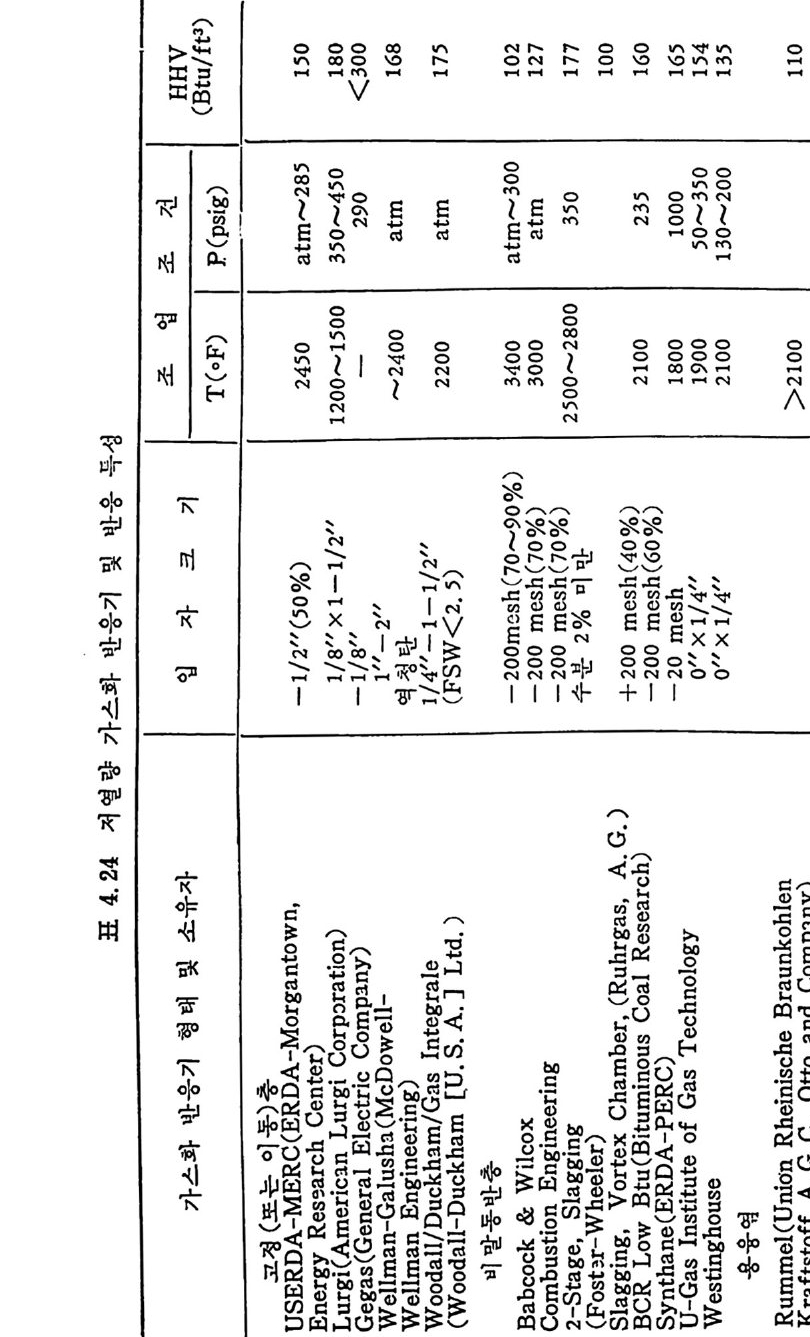 )
)
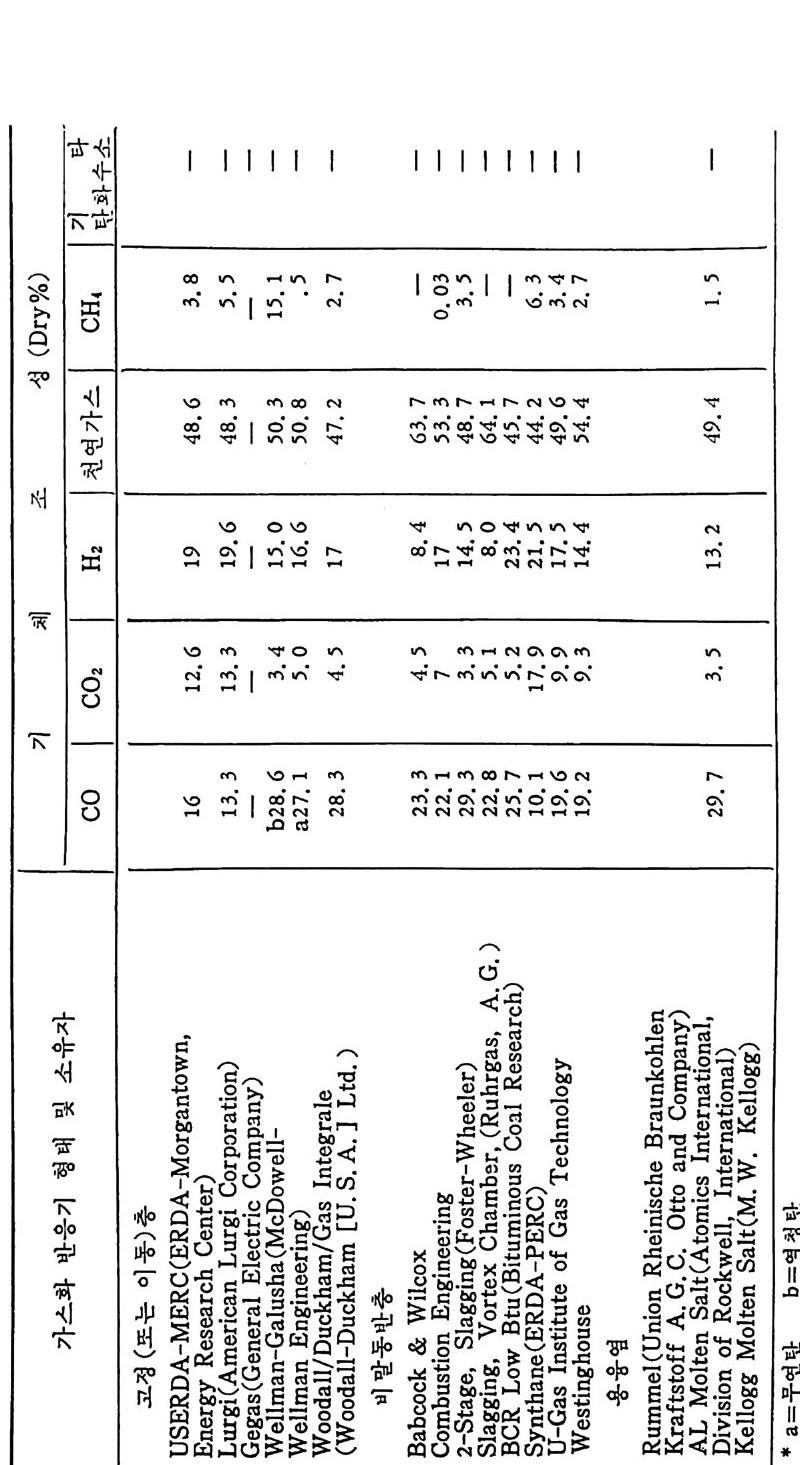
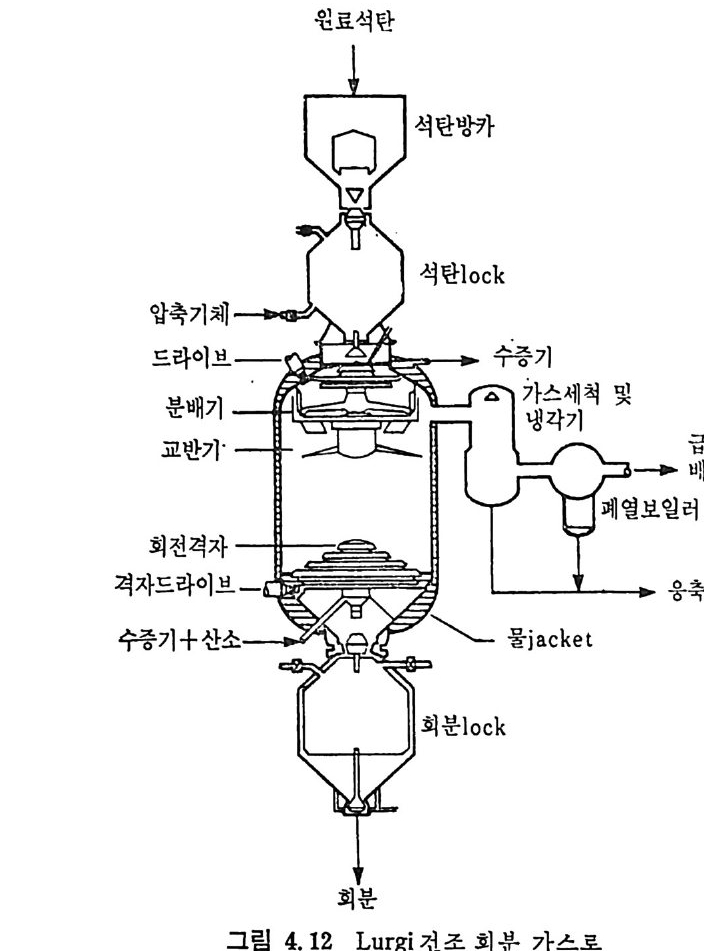 원료석탄
원료석탄
적으로 활용되고 있는 공정이다. 가스화는 석탄을 상부 ho pp er 에서 주입하여서 2oatm 정도에서 반응시킨다. 가스로는 내화 벅돌로 만들 어지고, 그 외벽은 물로 냉각시키며 회분은 하부에서 gra t e 를 회전 시켜서 배출시킨다. 전체적인 공정도를 그림 4.11 에, 가스로의 상세도를 그림 4.12 에 보 여주고 있다. 이 공정 에 는 cakin g 석 탄을 사용하지 못하며 gra te 의 기 계 적 조업 의 제한성으로 반응기의 크기는 내경이 3.6m 크기 정도로 석탄의 처 리 용량은 300 ton s/day 정 도이 며 , 부산물인 ph enol 과 tar 를 제 거 하는
장치 가 팔요하며 ag glo merati on 과 clin k erin g 을 방지하기 위하여 많 은 양의 수중기가 팔요한 것이 단접이다. b) Wellman-Galusha 공정 이 장치는 미국에서 널리 사용되는 가스로이며 규모가 작고 대기업 하에서 조업하므로 조업과 유지비가 작은 장접이 있다 이 장치는 석
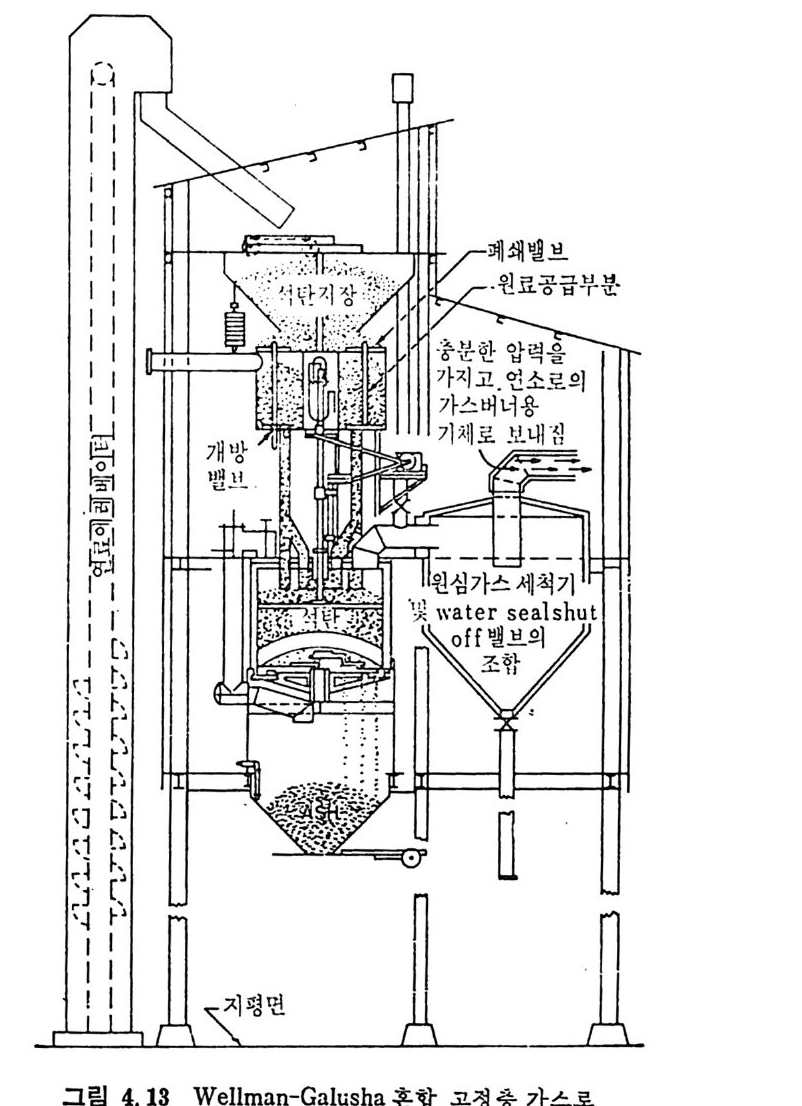 I._I,t T-'II_`_II|[卜~t卜tI IItIIII1IIIII II II lIl l1 _1 4]1
I._I,t T-'II_`_II|[卜~t卜tI IItIIII1IIIII II II lIl l1 _1 4]1
탄충윤 혼합하는 장치 (그림 4. 13) 와 혼합하지 않는 두 가지 형 대 가 있다 . 혼합형이 비혼합형보다 처리용량이 25% 정도 크며 cak i n g성질 을 가진 역청란도 처리가 가능하다. 반응기 내부에 내화물질을 사용 하지 않고 의벽에 냉각 자켓을 설치하였다. 그립 4.13 에서 보듯이 석 탄충 내에 수평날개 교반기가 회전되면서 기체의 편류를 막고 균인한 석탄충을 유지시킨다. 석탄의 입자크기는 무연탄의 경우 I. 4 cm 이며 역청란의 경우 50mm 정도이다. 이 석탄은 석탄 수송 승강기로 석탄저 장조에 보내전 후 중력에 의해 가스로에 공급된다. 공기와 수중기가 송풍기로 주입되어 연소되며, 이때 온도는 I300°C 정도이다. 반응기 의 크기는 내경이 3.3m 이며 처리용량은 30~84 t ons/da y로 원료 석 탄의 종류에 의존한다. 즉 반응성이 큰 역청란의 경우 처리용량이 크 다. 또한 부산물인 p henol 이나 타르의 양은 비교적 적으며 석탄 1lb 당 o.4lb 의 수증기와 3.5lb 의 공기가 소요된다.
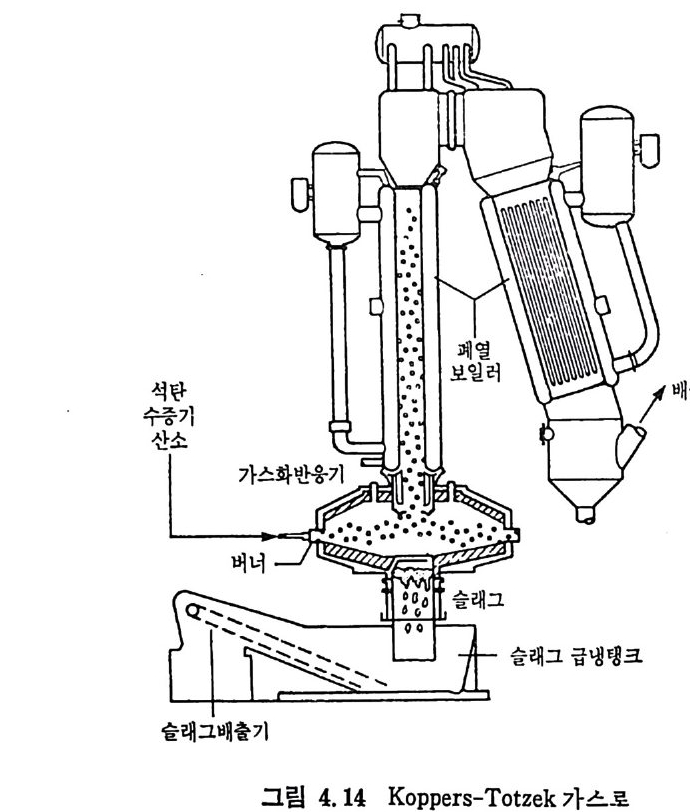 슬래그배출기
슬래그배출기
c) 수송 가스화 공정 (Transpo rt or Entr a in e d Flow Gasif ier ) 석탄입자를 공기/수중기 또는 산소/수증기로 비말동반시키면서 가스 화하는 가스로의 대 표적 인 것 은 Kop pe r-Totz e k (K-T) 반응기 와 Texaco 공정이 있다 . Kop pe r-Totz e k 가스로는 상업 화된 공정으로 대 기 압 부근에 서 고온에 서 조업되며 여러 종류의 석탄을 처리할 수 있다. 가스로는 내화벽돌로 내장되고 외부는 수증기 자켓으로 이루어쳐 있 다(그립 4. 14). 그립에서 보듯이 양쪽에 버너가 설치되었고 가스로의 내겅이 3.5m, 높이가 7.5m 로서 350 t ons/da y의 처리용량이 되며 90° 떨어쳐서 4 개 의 버너몰 설치한 경우 처리용량은 750 t ons/da y가 된다 . 탄소는 산화되면서 고온의 불꽃영역의 온도는 1900°C 정도가 되며 가스화되는 데 걷리는 시간은 1 초 정도이다. 또한 탄소의 전환율은 96 ~98% 정 도나 된다. 또한 석 탄과 기 체 가 고속 병 류로 흐르므로 cakin g 석탄도 사용할 수 있으며 타르나 p henols 의 생성이 없다.
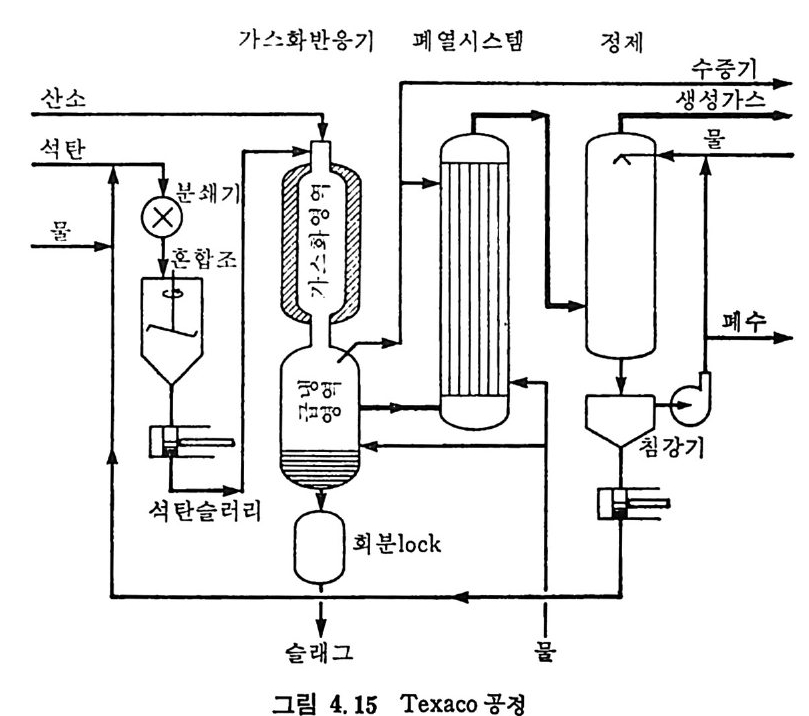 석탄 가스 화반응기 폐열시스템 정제 -날`크
석탄 가스 화반응기 폐열시스템 정제 -날`크
d) Texaco 가스로 이 공정은 석탄을 물에 혼합하여서 스러리 상태로 비말동반시켜서 고온, 고압하에서 가스화하는 것이다. 개괄적인 공정도를 그림 4.15 에 보여주고 있다. 석탄스러리는 가스로 상부에 산소와 같이 주입하여서 석탄을 부분 산화시켜서 가스로에 열을 공급한다. 가스로에서는 주로 산소-수증기 반응으로부터 CO 와 H2 를 생 성 하며 탄소 -C 아 반응도 병 행 한다. 반옹 온도가 상승되면 생성기체 중의 CO 와 H2 함량이 증가하나 반응이 중 가하면 CO, Ha 양은 감소하는 대 신 CH4 와 co근] 함량이 증가한다. 또한 부산물로서의 타르와 p henol 의 생성은 거의 없다 . 수증기 1 석탄비 는 적게 하여서 스러리의 입자농도는 최대 70% 까지 만들어서 pist o n
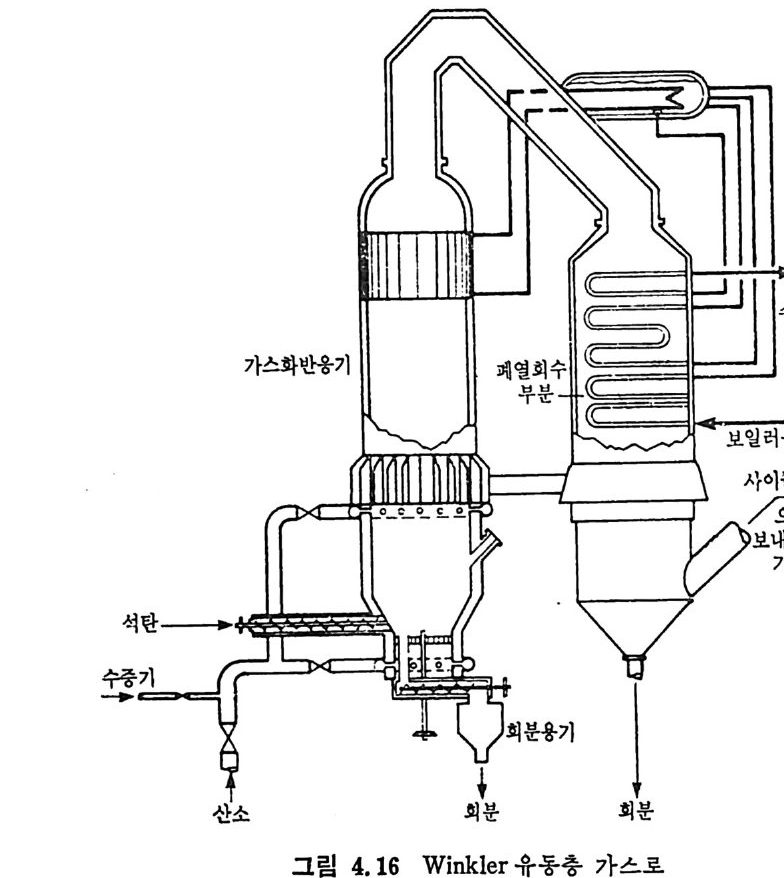 산소
산소
펌프로 주입한다. 반응 압력은 최대 8MPa 이고 온도는 14oo ~ c 이다. 병류로 흐르는 가스로이모로 열회수울은 낮다. 또한 석탄스러리와 산 소는 예 열을 하여 서 공급하여 야 한다. 이 장치는 Lurgi 가스로보다 설 계가 간편하고 cak i n g석탄도 사용할 수 있는 장접이 있다. 그러나 열 효율은 Lurgi 가스로에 비 해 낮다. e) Wi nk ler 유동충 가스로 최 초로 개 발된 유동충 가스로이 며 분란을 산소-수증기 로 유동화시 켜서 대기압하에서 950° C 정도에서 석탄을 가스화한다 . 낮은 압력 에서 조입되므로 CH4 생성은 낮고 열분해시 생성된 t ar 와 o il 은 유 동 충 내에서 분해되며 반응 압력이나 온도는 낮으므로 가스화율도 낮고 체류시간은 3 시간 정도 필 요하다. 도한 탄소전환율은최저 60% 정 도이 다. 이 가스로에는 직 접 cakin g 석 탄을 사용하지 못하는 단접 이 있으며 그 개략도를 그립 4.16 에 보여주고 있다. f) 복합 순환발전 (Combin e d Cy cl e Power Generati on ) 처열량 가스연료는 발전용 가스 터빈에 활용하기에 적합하다 . 가스 터빈은 높은 공기/연료비를사용하며 그비는 100 정도가된다. 이 조 업은 회전공기 압축기와 동력 터빈 및 전기발전기의 축이 같이 연결되 어져 있다(그림 4.17). 공기를 압축하여 연소로에 주입하고 공기를 터빈(t urb i ne) 주입온 도인 700°C 정도까지 가열한 후, 이 고온 • 고압의 기체를 터빈을 통하 여 팽창시켜서 공기압축기와 전기발전기의 축을 회전시킨다. 비교적 고온의 이 배기가스는 열교환기를 거쳐서 연소로에 공급된 후 배출 된다. 또 다른 방법은 고온의 배기가스로 수증기를 생산하여서 수증 기 터빈을 회전시키는 데 사용함으로써 기체 터빈과 수증기 터빈을 돌려 전기를 생산하므로 복합 순환 전기발전소라고 칭한다. 가스로에 서는 공기와 수증기로 석탄을 가스화하므로처열량 가스가 생성되며, 이를 냉각 후입자를제거하여서 연소로에 공급한다. 연소르에서 배출 되는 가스는 가스 터빈을 동해 팽창시켜서 터빈을 돌리고, 여기서 나오는 고온의 가스는 열교환기에서 수증기를 만들어 수증기 터빈 에 공급한다. 죽 가스 터빈은 op e n cy c le 로 조업 되고 수증기 터빈은 closed c y cle 로 조업된다. 이 복합 c y cle 의 열효울은 31.4% 이고 수 증기 터빈만의 열효율은 20% 이다 .39)
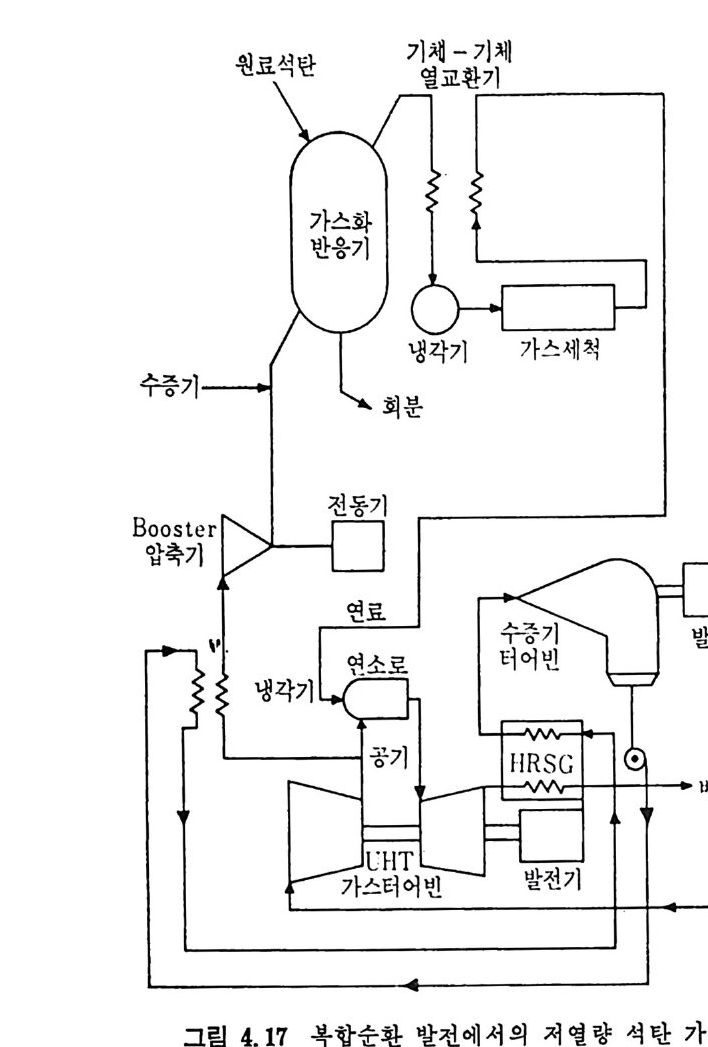 원료석탄
원료석탄
4.9 중열량 가스화 중열량 가스 제조시의 화학반응이나 가스로는 처열량 가스의 경우 와 같다. 주 생성가스는 CO 와 H2 로 이루어져 있다. 차이접은 공기 대신에 산소를 수증기와 같이 가스로에 주입하여서 석탄울가스화하는 것이다. 저열량 가스는 수송하여 사용할 경우 경제성이 없으므로 주로 석탄 생산지에서 활용하여야 하나, 중열량 가스의 경우에는 24~30
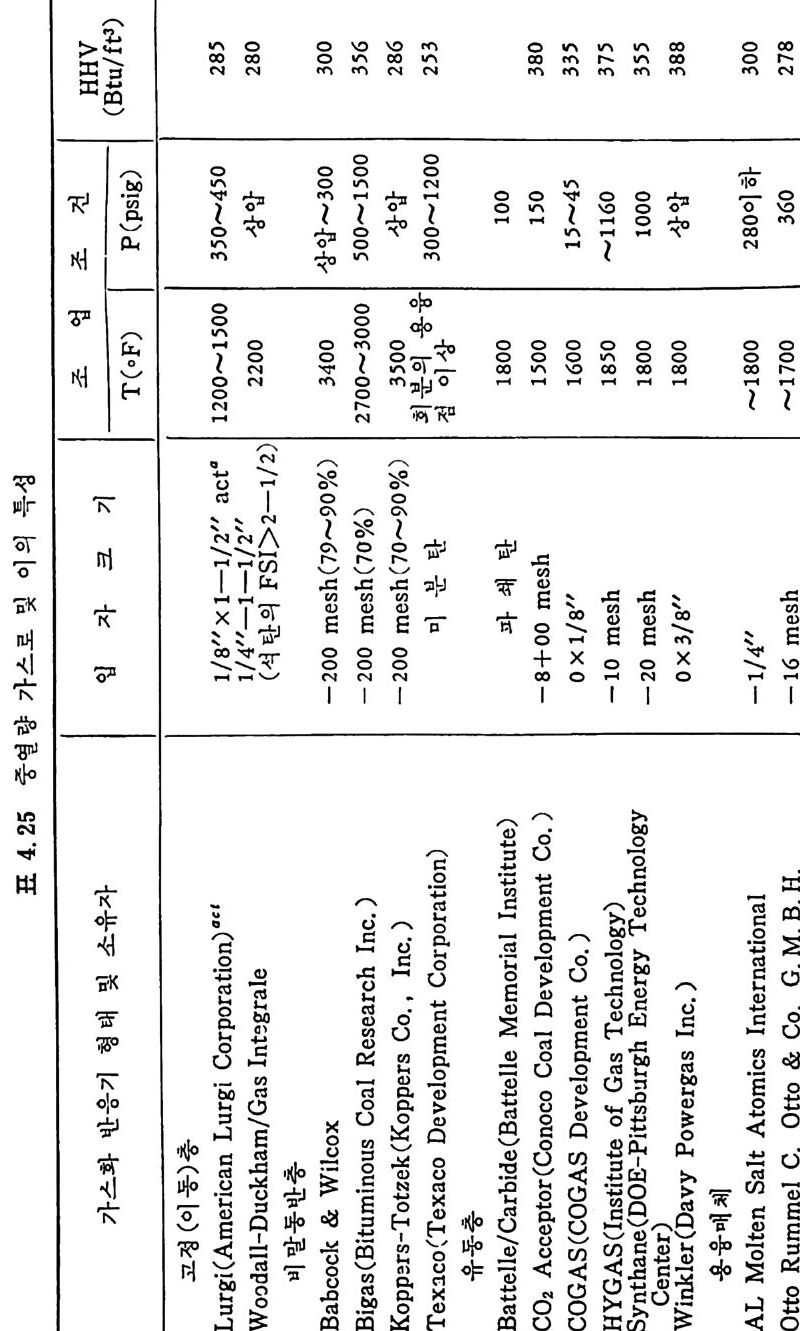 HV Ht(B /)u선f 825802 300 635 826 3520 385 335 37 535 838 030 287
HV Ht(B /)u선f 825802 300 635 826 3520 385 335 37 535 838 030 287
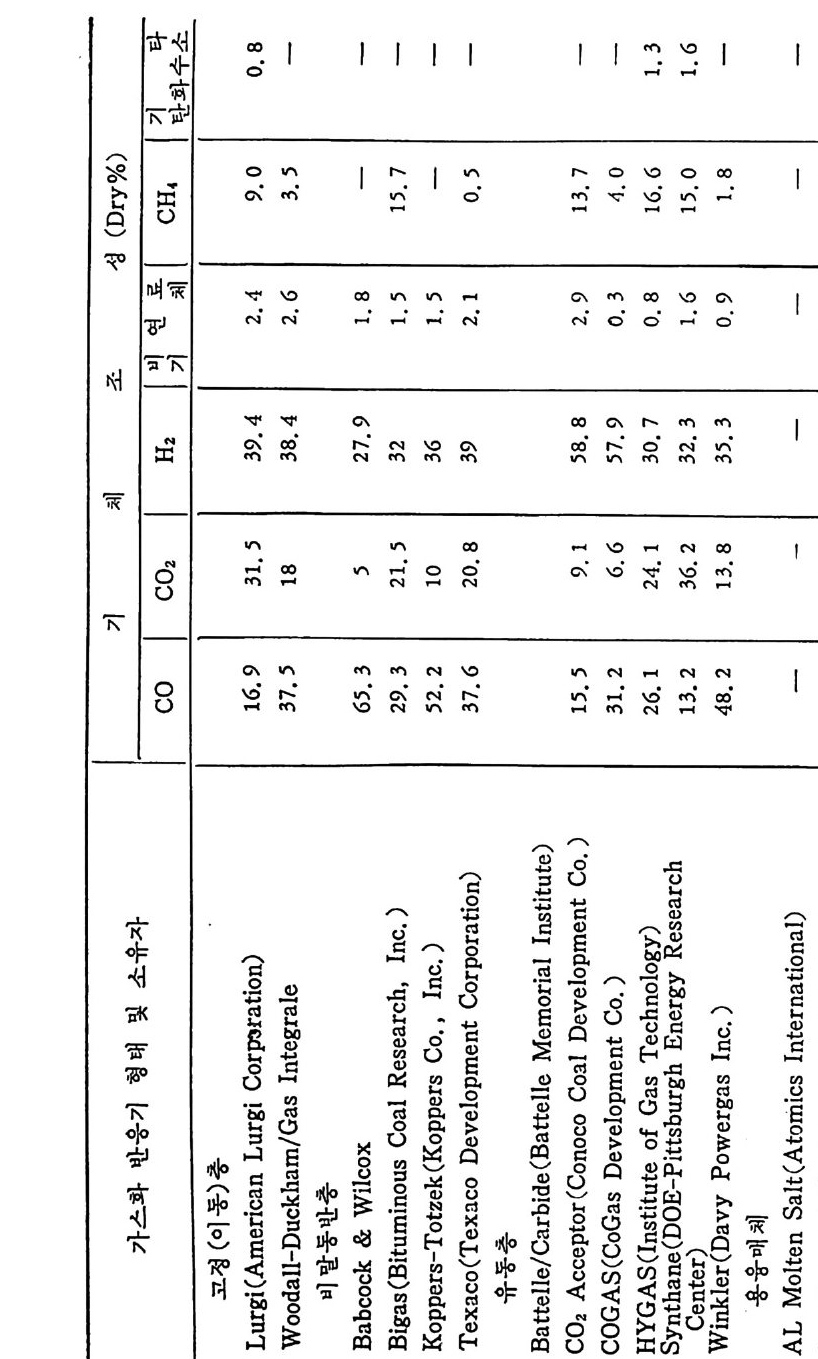
km 정도까지는 수송하여 사용하는 데 경제성이 있다. 중열량 가스 생산가스로의 종류와 생성가스 조성의 독성을 표 4.25 에 보여주고 있다. 여기서 보듯이 공기 대산에 산소를 공급하면 비연 료 가스 (non fu el ga ses), N2 , H 2 S, COS, Ar 의 양은 보통 3% 미 만이 다. 중열량 가스 생성시의 반응온도는 815~I930° C 범위에서 공정에 따 라 변화하며, 이 온도 빔위에서의 안정된 주산물은 CO 와 H2 로 반응 은 강한 홉 열반응이다. 표 4.25 에서 보 듯 이 대표적인 상업적 공정은 Wi nk ler, Lur gi와 Kop pe rs-T otz e k 로서 이 미 장치 도를 보여 주었 다 . 중열량 가스는 저열량 가스와 마찬가지로수증기 생산, 전력 생산에 활 용되 며 또한 CH4 생 산의 합성 가스와 다른 용도의 반응가스로로 활 용할 수 있다. 4.10 고열량 가스화 합성가스 또는 중열량 가스 제조는고열량가스 또는 천연가스를대 체하고자 하는 일차단계이다. 앞에서 언급한중열량 가스 제조반응로 들 은 적절한 CH4 생성 반응조전을 만들어주면 천연가스의 대체가스 (substi tut e natu ral ga s, SNG) 를 생 산할 수 있 다. 고열 량 가스는 중 열량 가스몰 원료 가스로 사용하므로 이 중열량 가스의 조성이 고열량
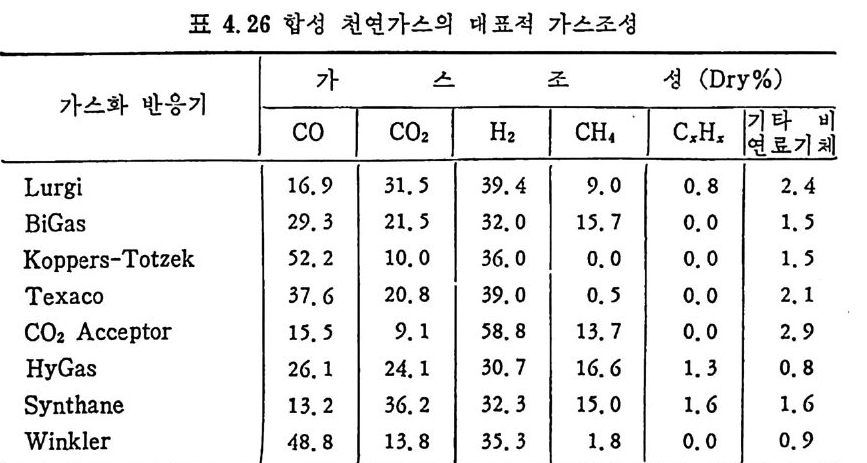 표 4.2I6 합성가 천|연 가스의스| 대표적 |조가 스조성 | 성 (Dry% )
표 4.2I6 합성가 천|연 가스의스| 대표적 |조가 스조성 | 성 (Dry% )
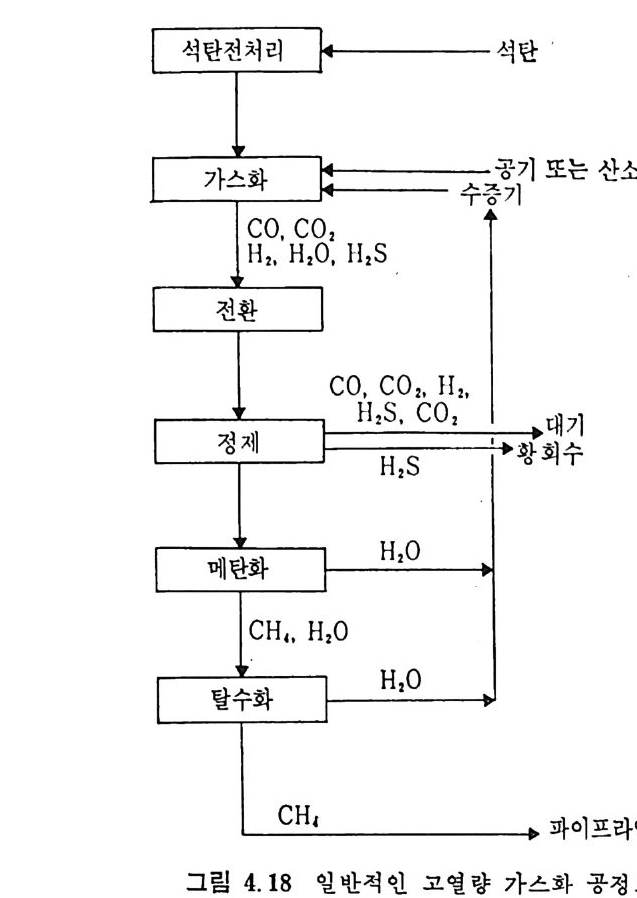 석탄전처리 석 탄 ’
석탄전처리 석 탄 ’
가스 생산에 중요한 인자가 된다. 그 대표적인 공정의 중열량 가스조 성을 표 4.26 에 보여주고 있다. 여기서 보듯이 CH4 의 조성은 o.0~ 16.6% 범위에서 비연료가스 조성은 o.8~2.9% 법위에서 생성된다. 모돈 고열량 가스 생산 공정은 그립 4.18 로 나타낼 수 있겠다. 각 공정 단계를 자세히 도시하지 않았으나, 반응기 종류에 따라 적철한 입자크기를 가스로에 공급한 후 산소와 수증기를 공급하여 반응시킨 생 성 가스는 주로 CO, CO2, H2, H20 와 소량의 H2S 와 CH4 이 함유되 어 진다 . 이 가스는 전환반응기 로 보내 져 서 CO 와 수증기 반응이 Co-molyb - deum 과 N i -mol y bdeum 촉매하에서 290~400°C 의 반응 조건에서 일어 나 주로 H2 와 CO2 를 생성한다. 이 가스들은 가스 정제공정으로 보내
져서 CO2 와 H2S 를 제거하며 여기서 나오는 가스를 H2/C0=3 으로 조 절하여서 메탄화 (me t hana ti on) 시킨다. 이 메탄화반응은 발열반응이 고 열에 민감한 n ic kel 촉 매를 사용하므로 열을 제거하는 것이 중요한 섣 계요소 중의 하나이다. 보통 열제거는 수증기를 생산하여서 제거하 며 이 수중기 는 다른 공정 에 활용하게 된다. Meth anato r 에 서 생 성 된 CH4 과 H20 중 물은 거 의 순수하므로 다시 수증기 생 산에 활용하고 CH 4 가스 중의 수분을 제거한 후 가압하여서 수송한다 . 상기한 대로 가스화 반응기는 고정충, 유동충 및 비말동반충등이 고열량 가스생산 에 환 용되고 있으며 그 상세한 장치도는 이미 기술하였다. 가스로에서 배출되는 고온의 가스 (320~1soo°C) 에는 먼지, 가스불 순 물 , 응축된 타르, 저 분 자 탄화수소 둥이 같이 배출되며 이를 제거 하여야 한다. 이 고온 가스는 물을 분사시켜서 급속 냉각시켜 물은 증발시키며 동시에 물방울에 불 순물이 충돌하면서 제거된다 . 주로사용 하는 장치 는 ventu ri- s c rubber 를 사용한다. 여 기 서 세 척 된 가스는 다 시 가열한 후 H2/C0 =: 3.o 으로 조철하여서 메탄화 반응로에 보내서 co + H 2 0~H2+C 아 반응에서 얻은 H2 오} co 의 비를 3.0 으로 조절하 여 사용하며 이 co 전환반응은 14 ~ 70 atm 하에 서 수행 되 며 낮은 압 력에서는 촉매의 활성이 저하된다. 가스화 반응시 순수산소를 사용한 경우 많은 양의 C 아를 생성한 다. 이를 가스정제 부분에서 제거하게 된다 . 연소반응에 사용된 탄소 이 외의 것은 수중기와 반응하여서 (2C+2H20-+C02+CH4) CO2 오} CH4 을 생성한다. 산소 대신에 공기를 사용하여 연소열을 가스로에 공급한 겅우는 N2 로 회석된 CO2 가스가 되므로 정제단계를 거치지 않고 대 기 중에 방출시킨다. 가스정제에서는 주로 H2S 와 C 아를 제거하는 목적이 있으나 소량의 독성 가스인 COS, NH3, HCN, ph enols 및 탄화수소도 제 거 하여 야 한다. 또한 탄화수소 제거는 연료물질을 제거하는 것이며 대기 중에 방출하 떤 대기오영을 유발시킨다 . 득히 유황분은 N i촉매에 해독을 끼치므로 1pp m 이하로 유지시켜야 한다. 가스 중의 H2S 와 C 아를 제거하는간단한 흐름도는 그림 4.20 와 같 다 . 죽 상기 가스를 용매에 녹여서 가스 흐름과 향류로 . 흘려보내며 다시 용매를 재생하여서 흡수탑으로 보낸다 . 액체 흡수공정은 물리적
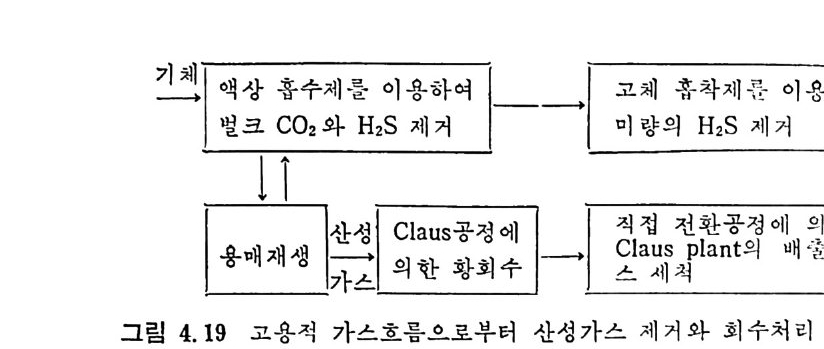 므 二—0 :: :0言:::20二sl:l? 1一\ 스고미C l체 a량새u 의s치 홍 p 착 Hla2재nS t 의훈재 거이매 용물한가
므 二—0 :: :0言:::20二sl:l? 1一\ 스고미C l체 a량새u 의s치 홍 p 착 Hla2재nS t 의훈재 거이매 용물한가
용매와 화학적 용매 공정으로 대별된다. 물리적 공정은 유기용매에 휴 수시 키 는 공정 으로 Recti so l 공정 과 Selexol 공정 아 있고 화학적 용매 공정은 K2C03 에 CO2 와 H20 가 반응 (K 2 C03+C02+H 2 0~2KHC03) 되 어서 CO2 를 제거하는 Benfi eld 공정이 알려져 있다 .2 1) 배 출가 스 중의 유황성 분인 H2S 가스는 Claus 공정으르 제 거 한다. 이 공정은 누 단계 로 1) H2S 를 산화시켜서 S02 가스로 만들고 (H2S+1.50 2-. H 2 0 + S02), 2) 나머지 H2S 를 S02 와 반응시켜서 원소유황으로 치환한다 (2H2S+ S02-.2H20+3S). 이 반응은 bauxit e 촉 매하에서 수행한다. 메 탄화 (Me t hana ti on) 는 천연가스 대 체 가스로의 고열 량 가스 제 조의 최종 단계이다. 메탄가스합성을 CO 와 H2 반응으로부터 얻으려는 많 은 연구가 이루어지고 있다. 그러나 아직도 상업적인 크기의 메탄화 공정은 없는 상황이다. 실제로 메탄화 반응기 내에는 co+3H2~CH4 +H20 반응 이외에 COx 와 수소간의 다른 반응들과 유기질 물질인 alcohol, aldehy d e 및 keto n e 등이 소량 생 성 된다. 다음과 같은 주요 반응둘이 메탄 반응기에서 일어나고 있다. (1) CO(g) +3Hz (g) -.H20(g) +CH4(g) 6H= -49. 2skcal/ g-m ole (2) COz (g) +4H2(g) -.2H20(g) +CH4(g) 6H= 一 39. 44kcal/ g-m ole (3) CO(g) +H20(g) -.C02(g) +H2(g) 6H= -9. 83kcal/ g-m ole (4) 2CO(g) +2H2(g) - .COz (g) +CH4(g) 6H=-59. 11kcal/ g-m ole (5) 2CO(g) -.C(s) +COz (g) 6H= -41. 22kcal/ g-m ole 상기한 메탄화반웅들은 발열반응이며 이 열을 제거하는 것이 주요 설계 인자이다• 반응 (1) 과 (2) 가 원하는 주반응이며 가능한 한 (3) ~(5) 반옹은 처지시켜야 한다. 반웅 (3) 과 (4) 는 원치 않는 C 아를 생성하여서 SNG 가스의 열량을 낮추며, 이 C 아를 제거하는 단계가
필요하게 된다. 반응 (5) 는 Boudouard 반응이타 하며 탄소몰 생성하 여서 촉매를 비활성화시키고 반응기를 막히게 하는 문제접을 유발한 다. 그러나 적절한 조업조전에서 H2/CO 비를 3 보다 크게 유지시켜서 반 응하면 주반응 (I) 과 (2) 를 주로 얻을 수 있다. 쇠 근에 CO2 와 H2 반응으로부터 CH4 을 생 성 하는 반응 (C02+4ll2~ CH4+2H20) 을 Ni, lanth anid e ox i de(La203) 와 소량의 ruth e niu m 촉매 하에 서 270~300°C 에 서 CO 와 CO2 가 H2 와 반응하여 서 CH4 생 성 의 중은 수율을 얻었다 .40) 이러한 방향의 연구가 찰 이루어지면 앞에서 언급한 CO2 가스 제거의 노력을 절감시킬 수 있겠다. 더 자세한 메탄 화 공정 에 대 한 기 술은 Sir o hi 의 보고서 룹 참조하기 바란다. 41) 대체천연가스 SNG 의 최종 단계는 CH4 과 같이 생성되는 물을 제 거하는 것이다. CH4 가스가 함유된 수분윤 탈수시킨 산물은 고체 수 화물들을 (CH4 • 7H20, C2Hu • 8H20, C3H8 • 1 sH20, CO2 • 7H20) 형 성 할 가 능성이 있으므로 이 수화물 생성웅 억제하는 조건에서 탈수시켜야 한다. 탈수방법은 1) 액체전조제에 흡수하는 방법, 2) 고체 건조제에 흡수 시 키 는 방법 , 3) 수화접 (hy d rate p o i n t)을 낮추는 물질을 주입 하는 방법, 4) 팽창 냉동에 의한 탈수방법 둥이 있다. 그러나 가장 경제적 인 방법 은 액 체 전조제 로서 tri e t h y le ne gly c ol (TEG) , die t h y le ne gly c ol (DEG) 또는 eth y le ne gly c ol (EG) 등을 흡수탑 상부에 주입 하고 수분 윤 함유한 CH4 가스를 하부에 주입시켜 향류로 홀려서 탈수시키는 방 법이다. 4.11 가스화 반응기 재질 석탄가스화 반응은 높은 온도, 높은 압력, 부식성 기체 및 액체와 마모성 고체가 촌재하는 공정이므로 각각의 기체, 액체 및 고체물질 이 금속, 도기 물질 (ceram i cs) 과 내 화물질 (refr ac to rie s ) 에 어 떠 한 부 식 및 마모를 미치는가에 대한 지식이 반응기 재질을 선멕하는 데 필 요하다. 이 제까지 보고되 어 전 결과 42-4” 를 요약하면 1) 가스로의 십 한 부식 성 에 견디 는 금속물질은 고함량의 nic k el-chromi um 합금이 다.
2) 연소로의 부식성에 견디는 금속은 alumi ni z e d hig h chromi um - n~ckel 합금이며, 3) 기공이 작은 초기 내화물질이 마모에 처항이 크 며, 4) 내화물질의 초기 기공이 증가함에 따라 가스화반응에 대한 마모 저항 변화도 증가한다. 5) 수화가스 (a q ueous- g aseous) 의 계면의 부석은 매우 십하며 CO 와 CO2 의 농도에 직선적으로 비례한다. 구리 합금은 부식 률이 높은 반면 sta i n l ess ste e l, haste l loy , hig h nic k el alloy 와 titan iu m 둥은 부식 에 저 항이 큰 합금들이 다. 또한 온도도 부식에 대한 영향이 크며, 압력, pH , 수소와 방향족 화합물의 농도가 증가하면 부식률이 증가한다. CO 는 탄소강에 부식이 십하며 H2S 는 co 의 부식을 방지하는 역할을 한다. 6) 입자에 의한 부식과 마모에 저항이 큰 물질은 a!umi ni z e d sta i n l ess 31o 과 IN soo(,J7 Fe, 3INi , 21Cr) 이 알려져 있다 . 그러나 보다 많은 정보가 필요하며 반응기, 배관 및 부속장치들에 대한부식-마모에 대한많은 연구가필요하다. 이제까지 여러 가지 가스화 공칭에 대하여 알아 보았다. 모든 공정 은 복잡하고 경비가 많이 요구되고 있다. 죽 석탄가스화의·상업화는 기술적 문제, 경제성 문제, 및 정치적인 문제를 내포하고 있다. 특히 석탄가스화 공정으로부터의 공해문제가 하냐의 큰 고려대상이다. 또 한 경제성에서는 석탄으로의 유류 대체라는 측면에서 볼 때 직접적으 로 원유의 가격에 따라 경제성이 좌우된다. 특히 국내에는 석탄을 가 스화할 저등급(l ow rankin g) 석탄 매장량도 없으며, 연료로 산업체에 서 사용되는 석탄도 거의 전량 수입에 의촌하고 있다. 앞에서 언급하 였듯이 석유에 비하여 석탄은 비교적 세계 도처에 고루 분포되어 있 으므로 이 자원을 확보하는 데는 석유보다 수월하며, 요사이 국내 기 업들이 의국의 탄광개발에 참여함으로써 석탄 도입의 문제는 앞으로 큰 문제가 되지 않을 것이다. 선전국의 기술보호에 따른 기술 도입은 많은 경비를 요구하고 있다. 그러므로 상기한 석탄 활용기술에 대한 연구도 꾸준히 수행하여서 앞으로의 에너지 위기에 대처할 수 있는 기술 축적이 요구되고 있으나, 이제까지 국내에서 수행된 석탄가스화에 대한 연구들 48-50) 은 매우 적은 상황이므로 이 분야에 대한 산업체와 학계의 연구가 절실히 요구되고 있다.
참고문현 1) Massey, L. G. , Chap ter 3 in Coal Conversio n Technolog y, C. Y. Wen and E. S. Lee Ed. , Addis o n-Wesley Pub. Co. , Readin g Mass. , 1979. 2) Stu l l, D. R. and Prop h et, H. , JA NAF Thermochemi ca l Tables, NSRDS·NBS 37, 2nd Ed. , U. S. Goverment Prin t i ng Of fice , Wash· ing ton , D. C. , 1971. 3) Houg en , D. A. , Wats o n, K. M. and Rag a tz , R. A. , Chemi ca l Pro· ces s Prin c ip le s, Part II; Thermody n ami cs, 2nd Ed. , Joh n Wi le y & So ns , New York, 1964. 4) Gruber , G. , Chap ter 2, in Meth a nati on of Sy n th e sis Gas, L. Seg lin Ed. , Adv. in Chemi st r y Ser. , 146, ACS, Washin gton , D. C. , 1975. 5) Whit e, G. A. , Roszkowski, T. R. and Sta n brid g e , D. W. , Ch1p t~r 8 in Meth a nati on of Sy n th e sis Gas, L. Seg li n, Ed. , Adv. in Che· mi st r y Ser. , 146, ACS, Washin g ton , D. C. , 1975. 6) Wi lls on, W. G. , Sea lo ck, L. J. , Hoodmaker, F. C. , Hof fm an, R. W. , Sti ns on, D. L. and Cox, J. L. , Chap ter 12 in Coal Gasif icat i on, L. G. Massey Ed. , Adv. in Ch~mi st r y Ser. 131, ACS, Washin g ton , D. C. , 1974 . 7) Joh nson, J. L. , Ki ne ti cs of Coal Gasif icat i on , Joh n Wi ley & Sons, New York, 1979. 8) Anth o ny , D. B. and Howard, J. B . , AIChE ]. , 22, 625 (1976). 9) Wen, C. Y. , B1il ie , R. C. , Lin, C. Y. and O'Br ien , W. S. , Chap ter 2 in Coal Gasif icat i on , L. G. Massey Ed. , Adv. in Chemi st r y Ser. 131, Washin gton , D. C. , 1974. 10) Feldman, H. F. , Mi m a, J. A. and Yavorsky , P. M. , Chap ter 8 in Coal Gasif icat i on , L. G. Massey, Ed. , Adv. in Chemi st r y _ Ser. 131, ACS, Washin gton , D. C. , 1974. 11) Mosely, F. and Patt er son, D. J. , Inst. Fuel, 38, 378 (1965). 12) Zie l ke, C. W. and Gorin , E. , Ind. Eng . Chem. , 47, 820 (1955). 13) Zie l ke, C. W. and Gor in, E. , Ind. End. Chem. , 49, 396 (1957). 14) Gori ng, G. E. , Ind. Eng . Chem. , 45, 2586 (1952). 15) Lin d en, H. R. , Producti on of Pip el i ne Gas by Hy d rog a stft c ati on of Coal, Insti tut e of Gas Technolog y, Research Bull. No. 39, Vol. 1, (1972). 16) Hay n es, W. P. , Gasio r , S. J. and Forney, A. J. , Chapt er 11 in Coal Gasif icat i on , L. Massey, Ed. , Adv. in Chemi st r y Ser. , 146, ACS, Washin gton , D. C. , 1974.
17) G1rdn~r, N. , S1muels, E. and Wi lk s, K. , Chap ter 13, in Coal Gasif icat i on , L. Massey, Ed. , Adv. in Chemi st r y Ser. , 146, ACS, Washin gton , D. C. , 1974. 18) Cusumano, J. A. , Cata l ys is in Coal Conversio n , Academi c Press, New York, 1978. 19) Chao, R. E. , Ind. Eng . Chem. , Prod. Des. Dev. , 13, 94 (1974). 20) Rosen, B. H. , Pelofs k y , A. H. and Hreene, M. U. S. Pate n t 3, 960, 700, Jun e 1, 1976. 21) Probste i n , R. F. and Hick s, R. E. , Sy 11 t ltet i c Fuels, McGraw-Hi ll, New York, 1982. 22) Gasio r , S. J. , Forney, A. J. and Fie l d, J. H . , Ch :ipter 1 in Fuel Gasif icat i on , Adv. in Chemi st r y Ser. 69, ACS, Washin gton , D. C. , 1967. 23) Kavli ck , V. J. and Lee, B. S. , Chap ter 2 in Fuel Gasif icat i on , Adv. in Chemi st r y Ser. 69, ACS, Washin g ton D. C. , 1967. 24) Mason, D. M. and Schora, F. C. , Chap ter 3 in Fuel ga sif ciat i on , Adv. in Chemi st r y Ser. 69, ACS, Washin gton , D. C. , 1967. 25) Bodle, W. W. and Vy a s, K. C. , Chap ter 2 in Clean Fuels fro m Coal, Sy m p . II pipe rs, Insti tut e of G1s Technolog y, Chic a go , Ill. (197.5 ). 26) Grace, R. J. , Chap ter 13 in Clean Fuels fro m Coal, Sy m p . II pa p e rs, Insti tut e of Gas Technolog y, Chic a go , Ill. (1975). 27) Cover, A. E. , Schrein e r, W. C. and Skap e rdas, G. T. , Chem. Eng . Prag. 69, 31 (1973). 28) Elder, J. L. , The undergr ound ga sif icat i on of coal in Chemi st r y of Co:z l Ut ilizat i on, Sup ple m~nta r y Vol. , H. H. Lowry Ed. , 1023, Wi ley , New York, 1963. 29) Gregg , D. W. abd Edg a rd, T. F. , AIChE ]. , 24, 753 (1978). 30) Goddin , L. S. , Hi l l, D. E. and M1son, R. Z. , Hy d rocarbon Pro· cessin g , 55, 109 (1976). 31) Nadkarni , R. M. , Bli ss , C. and Wats o n, W. I. , Chap ter 33 in Clean Fuels fro m Coal, Sy m p . II pa p e rs, Insti tut e of Gas Tech- nolog , Chic a go , Ill. (1975) . 32) Deul, M. , Fie l ds, H. H. and Elder, C. H. , in Chap ter 37 in Clean Fuel fro m Coal, Sy m p . II pa p e rs, Insti tute of Gas Technolog y, Ch ica go , Ill. (1975). 33) Bloomstr an , M. A. and Davis , B. E. ; Energy Prog r ess, 4, 74 (1984). 34) Fin k , C. , Curran, G. and Sudbury, J. , Chap ter 15 in Clean Fuels
Jro m Coal, Sy m p . II pa p e rs Insti tut e of Gas Technolog y, Chic a g o , Ill. , (19 75) . 35) Sq u ir e s, A. M. , Sc ien ce, 184, 4132, 340 (1974). 36) Smi th, I. H. and Werner, G. J. , Coal Conversio n Technolog y, Noy es Data Corp. , Park Rid g e, NJ , (1976). 37) Anderso n , L. L. and Ti llm an, D. A. , Sy n th eti c Fuels fro m Coal, Joh n W ile y & Sons, Ne w York, (1979). 38) Rudolph , P. F. H. , Oi l and Gas J. , 71, 90 (1973). 39) Frei, D. , Gas Turbin e Int. , 17, 38 (1976) 40) Jnu i, T. , Funabik i , M. and Takeg a mi , Y. , Ind. Eng . Chem. Prod. Res. De v. , 19, 385 (1980) 41) Sir o hi, V. P. , Meth n ati on Processes, Preli m i na ry Rep o rt to ERDA IAGA, C. F. Braun & Co. , Proje c t 4568-NW, (1975). 42 ) Abstr a ct on Mate r ia l s Prog r am, Con!. on Mate r ia l s for Coal Conversio n and Ut iliza ti on , Energy Research and Develop m ent Admi ni s t r a ti on , Elec t r ic Power Insti tut e and the Americ a n Gas Assoc iat i on (I 976) . 43) •Mate r ia l s and Comp o nents in Fossil Energy Ap pli c a ti on s•, ERDA Ne w s!. , 4, Ap ri l, (1976). 4-1) Mi ur a, K. and Hashim oto , K. , Ind. Eng . Chem. Process Des. Dev. , 23, 138, (1984) . '15 ) Rey es , S. and Jen sen, K. F. , Ind. Eng . Chem. Fundam. 23, 223, (19 84), 46) de V! ieg e r, J. J . , Kie b oom, A. P. G. , and van Bekkum, H. , Fuel, 63, 334, (1984) . 47) Ouchi, K. , lbarag i, S. , Kobay a shi, A. , Makin o , K. , and Ito h , H. , Fuel, 63, 427, (1984) . 48) Cho, D. N. and Yoo, C. K. , Hwalzak Kong h ak, 4, 193, (1966). 49) Lee, H. W. , Ki m , J. W. , Ki m , S. D. and Lee, W, K. , Hwahak Kong h ak, 18, 489, (1980). 50) Ki m , M. J. , Ry u , H. I. and Lee, W. K. , Hwahak Kong h ak, 21, ?.7, (1983).
제 5 장 석탄 액화 5.1 서론 석탄 액화 (Coal Liq ue fa c ti on) 는 석탄을 공해가 없는 에너지 자원으 로 전환하는 방법 중 열효울 및 경제적인 측면에서 유리한 공정이다. 묵히 액체연료로서 기체연료보다 에너지 밀도가 크고 저장이나 수송 비가 처령한 장접이 있으며 석탄을 기화하는 것보다 액화하는 화학반 웅은 더 간편하다고 할 수 있겠다• 석탄으로부터 액체연료를 제조하는 방법은 크게 4 가지로 대별할 수 있 다. 즉 용매 추출범 (solvent extr a cti on ) , 촉매 수소화 (cata l yt ic by · drog e nati on ) , Fis c her-Trop sc h 형 촉매 합성 법 및 열 분해 (pyro lys i s ) 방 법이다. 열분해방법은 이미 기술하였으므로 여기서는 주로 용매추출범과 촉 매수소화방법을 다루기로 하겠다. 석탄액화공정 개발은주로 독일에서 시작되었다. 이는 1920 년 말부 터 석유자원의 고갈로 인하여서 이에 대처하는 제일 중요한 공정개발 이었다. 그 결과 1943 년 독일에 12 개의 석탄 액화공장을 가동하여 서 98% 의 항공휘발유와 47% 의 탄화수소 산물의 수요에 충당하였다. 그러나 2 차세계대전 후 독일의 모든 공장은 경제적인 이유로 페쇄되 었다. 그 반면 2 차대전 동안의 석유개발도 없고 미국에서의 계속적 인 유류 소비량의 증가로 이에 대처하기 위하여 1944 년 미국은 합성 액체연료법을 제정하여서 1946 년에서 1953 년 사이에 미국 정부연구기
관 (U.S. Burean of M i nes) 과 개인기업에서 많 은 연구가 독일의 석탄 액화공정을 근거로 이루어졌으나 1950 년 초의 중동의 유전발견 후 석 유개발이 계속되어서 1953 년 미국 정부는 석탄 액화공정의 상업화 연 구를 중단하였다. 주된 이유는 당시의 석탄으로부터 가솔린 생산비는 원유로부터의 가솔란 생산비의 2~3 배 이상이므로 경제성이 없었다. 그 러나 최근의 유류파동 이후 다시 석탄의 엑화 및 기화반응에 대한 연구 o가f C전oa세l 계Re적se인ar ch연 의구 대연상구이개 발되비고 지있원다.에 특힘 히 입 어19 62후 년에에 E미RD국A의 와 O fu fi.c se Dep a rtm ent of Ener gy의 계속적인 지원으로 산업체에서의 연구개발 이 활발히 진행되었다. 그러나 궁극적인 개 발 의 성패는 국제 원유가 격에 달려 있다고 할 수 있겠다. 현존하는 상업 적 크기 의 석 탄 액 화공정 은 South Af rica 의 Sasol 공 정이 있다 . 초기의 연구목적은 석탄으로부터 욱단가가 높은 휘발류를 생산하는 것이었고 이는 경비가 많이 드는 공정이다. 그러나 최근의 석탄 액화의 목적은 수소를 첨가하여 유황과 금속성분이 적은 수송 이 가능한 액체산물을 얻어서 산업체의 난방이나 전력생산의 목적으 로 활용하고자 하는 데 있다 . 묵히 석탄의 액화전환율은 석탄의 종류 에 따라 변화하므로 석탄의 목성과 공해물질과 회분의 제거에 대하여 이의 특성을 인지하여야 한다. 5.2 석 탄의 화학적 조성 석탄 액화란 석탄에 수소를 첨가하여서 고체상태로부터 액체상대 로 변화시키는 것이라고 할 수 있겠다. 죽 수소/탄소비를 증가시키는 공정 이 다. 그 예 로써 여 러 석 탄과 asph alte n e, tol uene, pet r o leum crude, ga solin e 및 meth anol 의 조성을 표 5. I 에 보여주고 있다. 석 탄은 주로 방향족고리 (aromati c r i n g)로 구성 되 었 으므로 tol uene 과 비교하면 고체석탄과 액체 t oluene 의 수소함량을 알 수 있겠다. 특히 고열량 가스인 CH4 울 비교하여 보면 수소첨가량의 크기를 비 교할 수 있다. 그러므로 H/C 비를 증가하기 위하여서는 수소를 첨 가하돈가 탄소를 감소시켜야 한다. 그 예로서 역청란과 갈탄의 CHo.6-1.o 을 CH1 . 2-2 . o 으로 수소함량울 증가시켜서 액화할 수 있다.
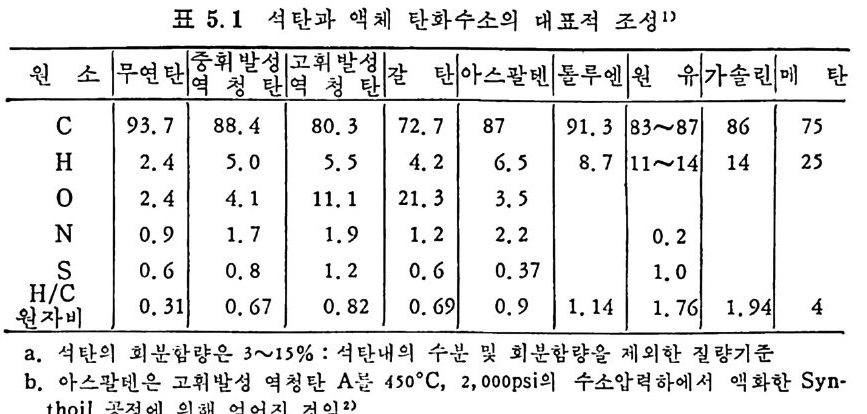 표 5. 1 석 탄과 액 체 탄화수소의 대 표적 조성 I)
표 5. 1 석 탄과 액 체 탄화수소의 대 표적 조성 I)
앞에서 언급한 석탄의 네 가지 액화방법을 그립 5.I 에 종합하였 다. 3) 5. 3 직 접 액 화 (D i rec t Liq u efa c t ion ) 수소를 직접 첨가하는 방법은 그림 5,1 에서의 수소증여 용매용해 (hy d rog e n-donor solvent d i ssolu ti on) 와 촉매 수소화 (ca t al yti c hy d ro- g ena ti on) 방법 이 다. 이 를 직 접 수소화 또는 수소화 (h y dro gena ti on) 라 고 한다. 석탄에 증여용매 (donor - solven t)로서 수소를 첨가하는 반응 윤표시하면 CH0. 8 + 0. 4H2 一 CH1. 5 또는 실제 석탄의 경우는 CHo.s So. 2 Oo .1 No.01+H2 一 (RCH%) +CO2, H2S, NH3, H20 로 표시할 수 있고 이 반응은 촉매 유무에 상관없이 수행된다. 상기 반응에서 화학식은 대략적인 표현이며 득히 °서상으로 표시된 (RCH) 는 수소화의 정도, 죽 조업 조건, 용매 의 독성 , 촉매 의 유무 및 수소의 압력 둥의 영향을 받으떤서 변화한다.
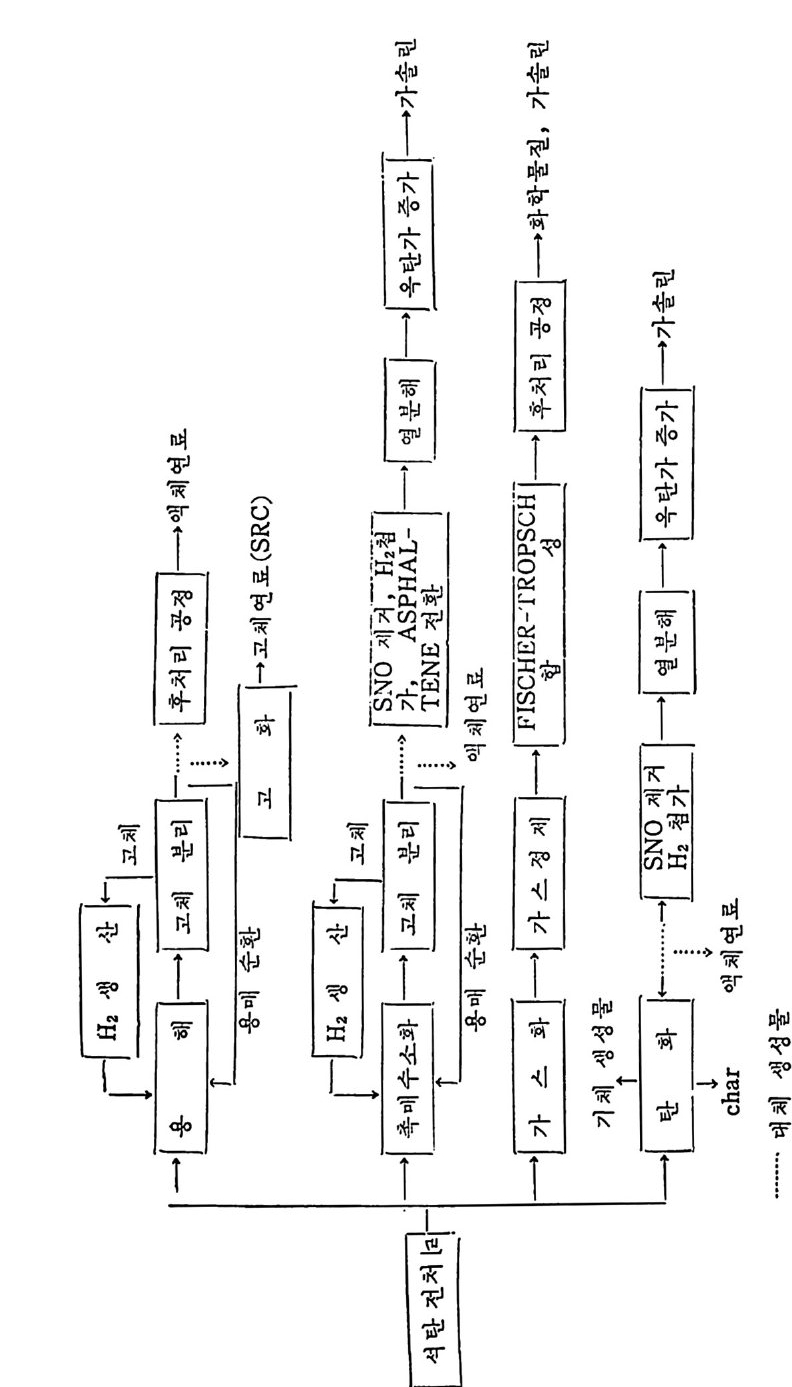
5. 3. 1 용매 추출 (Solvent Extr a cti on ) 공정 수소화반응에 촉매 를 사용하지 않는 경 우를 용매 추출 또는 액 상용 해라고 표현한다. 수소첨가 정도는 낮으나 최소한의 처리로 비교적 깨끗한 연료를 얻을 수 있다. 처리된 석탄은 고체상태의 용매 정제석 탄 (Solvent Refi ne d Coal : SRC) 또는 액 체 상태 의 연료가 된다. 이 는 주로 산업용이나 발전용 연료로 사용된다. 수소화는 수소의 함량울 증가시킬 분만 아니타 석탄내의 S,N,O 둥이 수소와 결합되어서 제거시키는 역할을 하며, 이 원하지 않는 여 러 원소의 제거울은 수소화 정도에 의존한다. 일반적으로 용매로 정제 된 석탄 (SRC) 의 유황함량은 I% 미만이 된다. 용매용해에 의한 수소첩가반응은 수소첩가율이 낮으므로 비교적 많 은 양의 고체물질이 배출물에 남는다. 또한 용매 추출의 근본 목적은 회분이나 금속성분을 석탄으로부터 제거하여 깨끗한 연료를 얻는 것 이므로 용액과 고체간의 분리가 거의 완전히 일어나야 한다. 그러나 입자크기가 마이크론 크기 범위이고 액상은 접도가 매우 크므로 분리 가 힘들어서 이 분리공정이 전체 공정의 성패를 좌우한다. 이 용매 추 출공정의 주요 인자는 증여용매의 성질과 수소압력이다. 이 SRC 공정 중 일단계공정인 SRC-I 은 수소화 정도는 낮고주산 물은 회분이 없고 유황성 분이 낮은 pitch 와 같은 추출물로 상온에 서 는 고체이다. 이를 촉매를 가하여서 수소분해를 하여 2 차단계에서 액 체 산물을 얻는 것이다. 4) SRC-1 공정 의 시 초는 Po tt -Broche 와 Uhde -Pf i rrm an 공정으로 독일 에서 개발된 것이며 석탄을 수소증여용매에 IO~I5MPa 압력과 415 ~430°c 에서 1 시간 가량 용해시켜서 생성물을 여과한 후 증류한다 (Pott -B roche). 그 반면 Uhde-P fi rrman 공정은 석탄국벼 혼합물에 기체수소를 3oMPa 과 410°C 에서 첨가하여서 용해한다. 이때 산물은 수소함량이 높고 앞의 공정보다 산물의 연화접이 60~120°c 낮다. SRC-1 공정 (그림 5. 2) 은 석탄을 건조시켜서 수분함량이 1~2% 정 도되게 하고, 입자 크기를 3mm 보다 작게 하여 공정에서 순환되는 용매를 여과한 후 석탄과 혼합하여 290~425°C 에서 끓여서 용매 1 석 탄 비를 I.5 로 조철하여 이 석탄스러리를 수소와 함께 10~I4MPa 압력과 400~450°c 의 예열기에 주입한다. 예열기를 거쳐서 나온 석
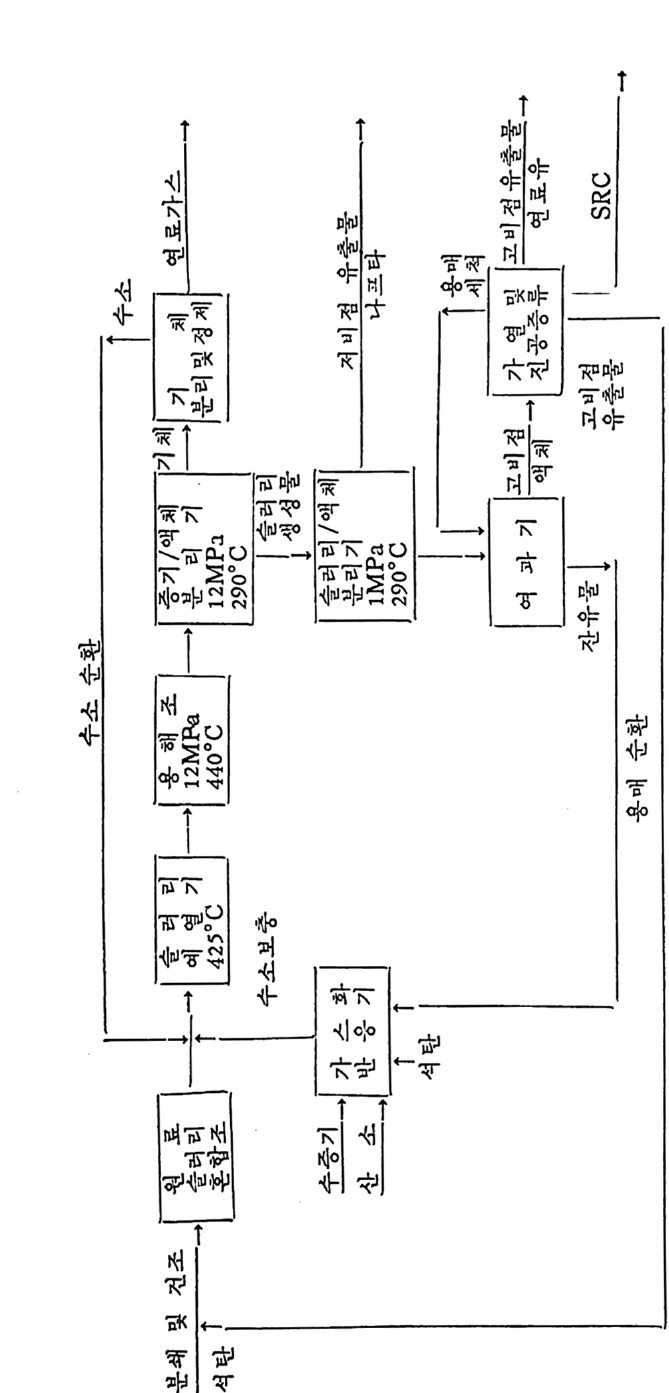 ; 천수순: [:[|수소정 체 디! _.-[1도雪 釣체+릅걸」-나액/ 기저 리 u:L_ 소기p및 iP 3 러ct1 ll| 성l리술 생i뭉액/i비1―t:「::二 己M_ 물 접출마저 유7||l나 프타寧PJ|| f f aM「_麟 석탄 __o 12麟 ―c V9 .|.. .. ~ 몽1苗麟 __4과기l0T액 체 1 '07 여 1찬비 정고SR 뭉 출 물유 +- 환순 매용 -C IRS .25 개 의정 공략도 는하급-릅소수 터부로화가 단석그 립
; 천수순: [:[|수소정 체 디! _.-[1도雪 釣체+릅걸」-나액/ 기저 리 u:L_ 소기p및 iP 3 러ct1 ll| 성l리술 생i뭉액/i비1―t:「::二 己M_ 물 접출마저 유7||l나 프타寧PJ|| f f aM「_麟 석탄 __o 12麟 ―c V9 .|.. .. ~ 몽1苗麟 __4과기l0T액 체 1 '07 여 1찬비 정고SR 뭉 출 물유 +- 환순 매용 -C IRS .25 개 의정 공략도 는하급-릅소수 터부로화가 단석그 립
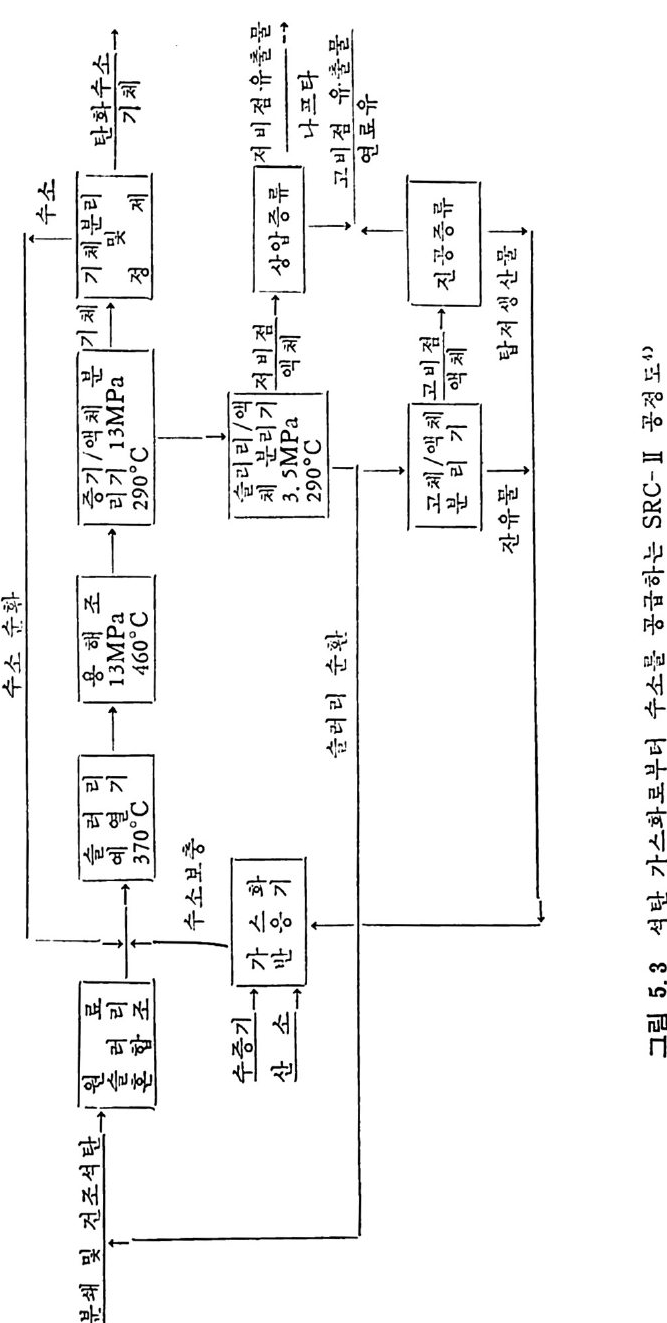 수「소i 1一z소 广:」lE |므巴::말I;l 슬리엑 / 리1미유言접훈· 石출I」I!l;盆吉1 타나프C °902 i| 출물유비고 정i 로연유 I | 〔話]1fI7°석r,므L철(1 1설~ 생물저유탑산 -RCS11 )1도 정공
수「소i 1一z소 广:」lE |므巴::말I;l 슬리엑 / 리1미유言접훈· 石출I」I!l;盆吉1 타나프C °902 i| 출물유비고 정i 로연유 I | 〔話]1fI7°석r,므L철(1 1설~ 생물저유탑산 -RCS11 )1도 정공
탄스러 리 와 수소는 수직 비 말동반 흐름 용해 반웅기 (dis s olver) 에 서 3 相이 향류로 흐르면서 반응한다 . 이 반응은 발열반응으로 온도가 약 15°C 상승하여 440°C 가 된다. 여기서의 체류시간은 대략 30 분이 며 대부분의 탄소물질은 용해되어서 91~93% 가 용해된다. 용해반응 기에서 나온 혼합물은 중기/액체 분리기에서 냉각시켜서 290C 가 되 고 미반응수소는 탄화수소가스, 수증기 및 H2S 와 분리한다 . 용해되 지 않은 고체 와 석 탄용액 의 압력 을 1MPa 로 낮추어 서 경 유 (lig h t oil s ) 논 회수하고 스러리논 여과한다. 그러나 스러리의 높은 접도와 고체 의 농도가 높으므로 여과가 쉽게 이루어지지 않는다. 득히 온도가 250~300°C 이므로 용매를 액체상태로 유지하기 위하여는 1MPa 이상 의 압력을 가해 주어야 한다. 순환되는 용매와 SRC 추 출 물은 전공중 류에 의해 분리시켜서 연료기름을 얻는다. 용매정제석탄 (SRC) 의 고 화온도는 175~200°c 이 므로 냉 각시 켜 서 고체 산물을 얻는다. SRC-Il 공정 은 SRC 기 공정 을 개 량하여 액 체 산물과 부산물 가스를 얻는다(그립 5. 3). 이는 용해된 것과 되지 않은 석탄을 가전 스러리 산물의 일부를 스 러리 혼합조에 순환시켜서 수행한다. 스러리의 순환은 체류시간을 증 가시켜서 전환율을 높이며, 순환은 석탄의 금속성분을 농축시켜 용 해로 (d i ssolver) 내에서 반응의 촉매역할을 시켜서 전환율을 높인다. 그러므로 SRC-Il 에서는 같은 체류시간에서도 수소의 소모윤이 증 가하며, 용해로의 온도와 압력이 SRC-I 경우보다 높고 체류시간은 약 1 시간 정도가 된다. 특히 SRC- JI의 특칭은 찬류스러리를 가스로 에 보내서 합성가스가 수소를 생성하므로 여과과정이 필요없다는 것 이 다. 상기 한 SRC 공정 은 Gulf O il의 자회 사인 Pit tsb urgh & Mi dw ay Coal Mi ni n g 사에 서 미 국정 부 (Dep a rtm ent of Energy ) 의 후원으로 45to ns/day 의 시 험 공장을 건설하였 다. 또한 Exxon 사도 미 국 정 부의 지원하에 Exxon Donor Solvent (EDS) 공정 5-7) 을 개발하여서 1979 년 에 225t on s/day 의 시 험 공장을 건설하였 다. 이 공정 의 특색 은 사용한 용매를 다시 고정충 촉매 반응기에서 수소화시켜서 수소증여용매로 다시 활용한다는 것이다(그림 5.4). 여기서 수소는 고온 가스로에 증 류탑의 배출물을 수증기와 산소로 가스화시켜서 공급한다. 그림 5.4 에서 보듯이 석탄은 순환되는 용매와 혼합하여서 이 석탄스러리를
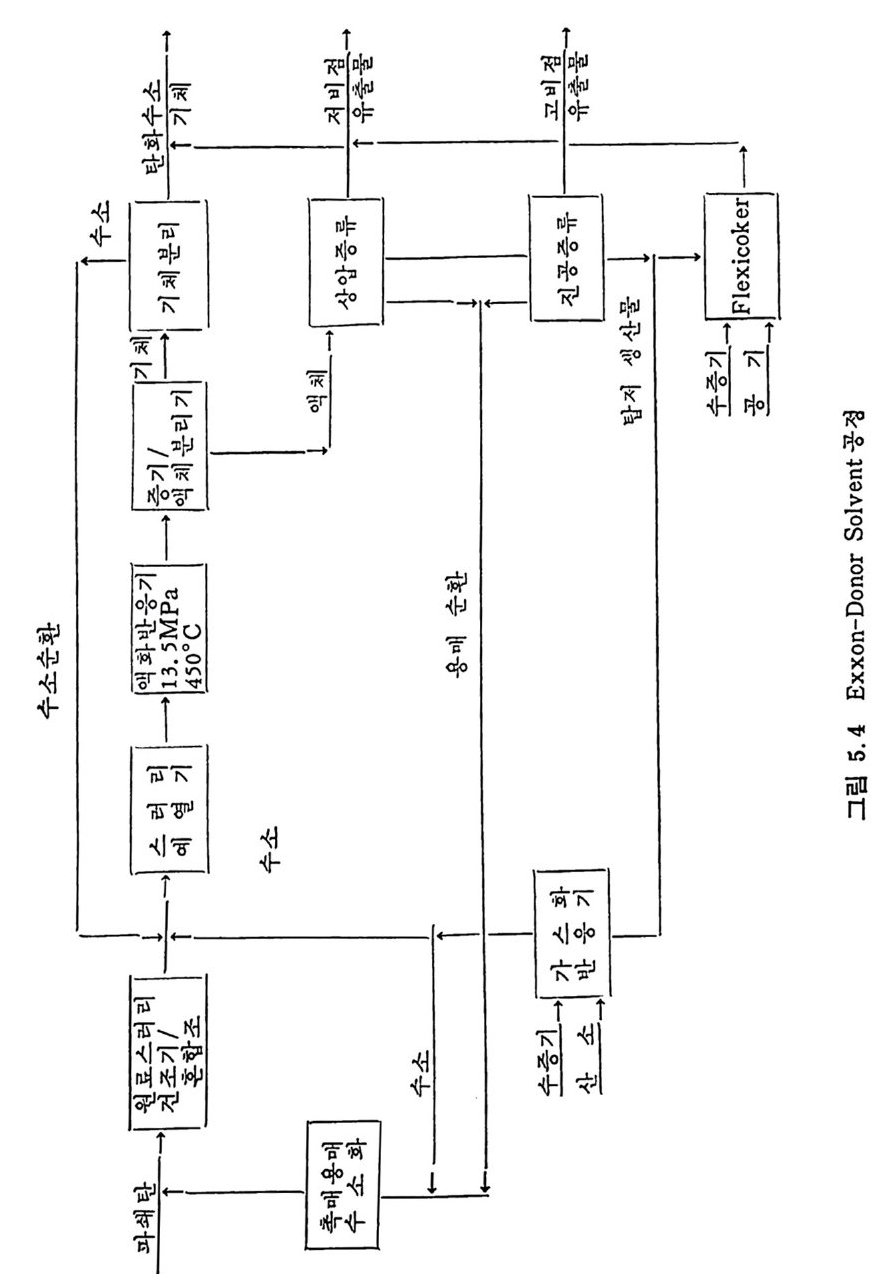
수칙 상향 향류로 수소와 같이 주입하여 예열기를 봉하여 액화 반웅 기에 들어가서 수소-석탄스러리가 비말동반되는 과정에서 액화 반응 이 425~480°C 와 13.5~17MPa 범위에서 일어난다. 최적 반응시간은 40 분 정도이며 여기서의 산물은 액체/중기 분리기 를 거쳐서 대기압하에서의 증류와 전공증류를 거쳐서 분리한다. 증류 로부터 200~425°C 에서의 C4-540°C 의 증류물 분율을 재순환용매로 사용한다. 전체 공정의 열효율은 43% 가 액체연료로 전환될 때 63% 이었다. 5. 3. 2 촉매 수소화 (Ca t al yti c H y dro g ena ti on) 공정 석탄-용매스러리에 촉매를 가하여서 반응시키면 이를 촉매 수소화, 수소액 화 (hy d roli qu efa c ti on ) 또는 °석 상수소화 (liqu id ph ase hy d rog e na ti on) 라고 칭한다. 촉매 중에 서 제 일 좋은 것 중의 하나가 cobalt molyb date 이 며 tun g s te n , molyb denum sulfi de 또는 불순 철산화물 (Bay e rmasse) 둥이 촉매로 사용되나 높은 압력이 필요하다. 보통의 조업조건은 450°c 와 135~270atm 이다. 최근의 반응기 개발은 유동 충, 비말동반충 및 고정충 반응기에 촉매를 가하여서 수행되고 있다. 이 촉매 수소화공정은 용매 추출공정보다 수소화가 잘 이루어져서 고체의 분리가 용매 추출공정보다 쉽고 석탄내의 유황성분은 H2S 로, 산소성분은 H20, CO2 로, 질소성 분은 NH3 로 전환된다. 그러 므로 SRC 보다 깨끗한 산물을 얻을 수 있다. 여기서 석탄은 경유에서 중유까 지, 。석상으로 전환되고 가스 산물도 얻는다. 그러나 주산물은 엑체연 료이며 이 액체 산물은 더 처리하여서 가솔린을 생산한다. 대 표적 인 촉매 수소화공정 은 H-Coal8-9) 공정 으로 Hy d rocarbon Resea- rch Inc. 에서 개발하여서 530 t ons/da y의 석탄을 처리하는 시험공장을 건설하였다. 그 대략적인 H-Coal 공정의 개념도를 그림 5.5 에 보여주 고 있다. 석탄을 분쇄하여서 0.2mm 보다 작은 입자를 건조한 후 순 환되는 기름과 섞어 2~3 대 1 로 비울을 만들어서 예열기에서 340~ 370°c 로 예열한 후 유동충 반응기에 주입한다. 죽 예열된 석탄스러 리, 순환기름과 수소가 유동충 반응기 하부의 분산통에 주입되고 분 산판을 통하여서 이 三相 혼합물이 반웅기 내의 촉매를 유동화시키면 서 반응한다. 이때 반웅기의 온도는 455°c 와 압력 20MPa 조건에서
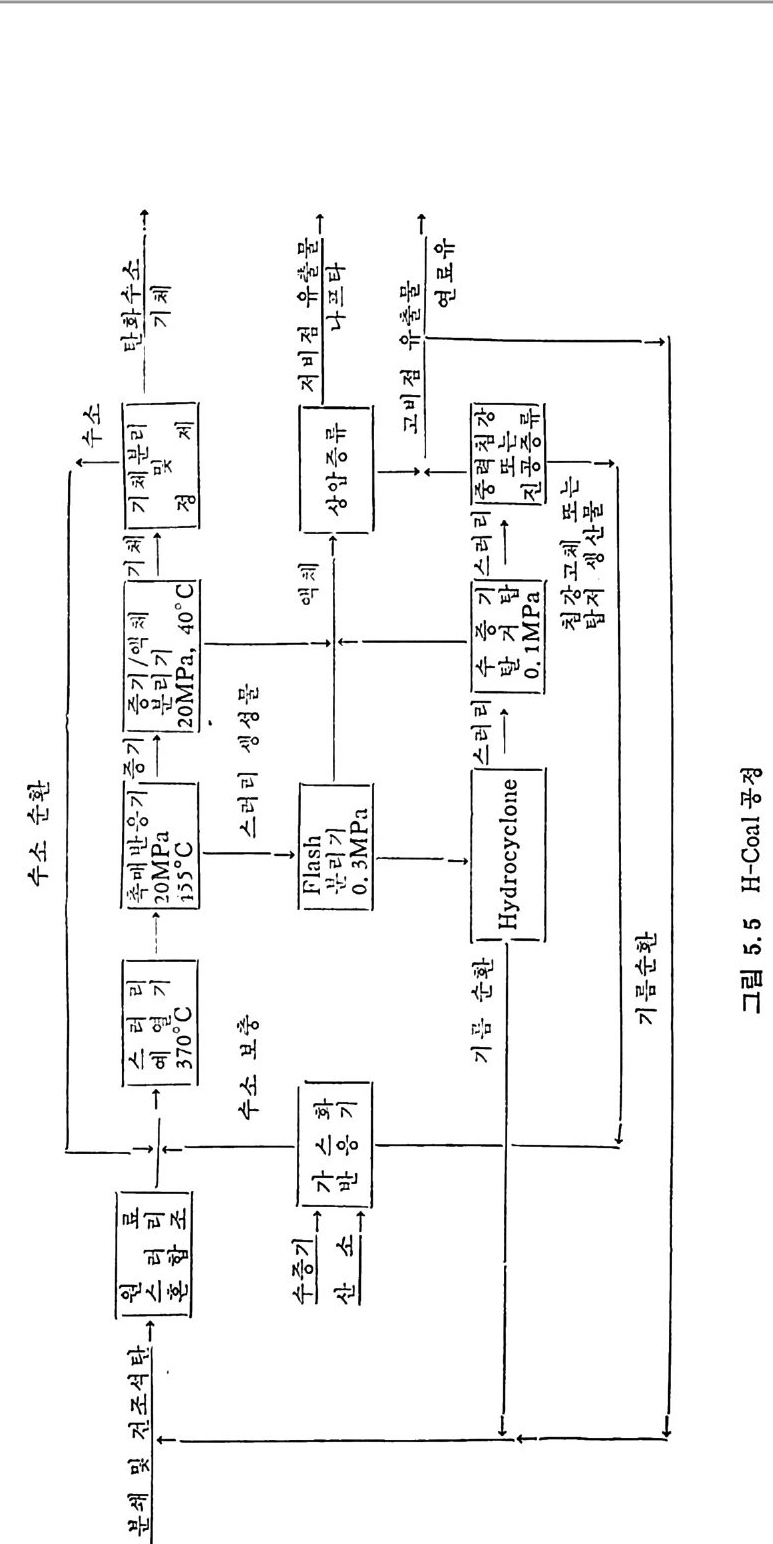 I수 순소 환 「 소수. ... :석言巴-\훈;?소-조f广]:I: ;1― utC저〔I: 』I行°21»고:나三。〔-\미 수리소;j러스뭉보 생충 1I~: Ltt : 비 증 술 :류나갑:드상저 정曰 릅압广1 I +-l !eI] ;; ! I I 물바접출유 고 I I:| l l:eI크Iol: yocryd}Hc 尸환n 순급기鬱냐틀i , ii : 또고체강칭丁 _ _ _l 산물 생저탑 冬 L 환 순름기 5.5 정공laoC-H림 그
I수 순소 환 「 소수. ... :석言巴-\훈;?소-조f广]:I: ;1― utC저〔I: 』I行°21»고:나三。〔-\미 수리소;j러스뭉보 생충 1I~: Ltt : 비 증 술 :류나갑:드상저 정曰 릅압广1 I +-l !eI] ;; ! I I 물바접출유 고 I I:| l l:eI크Iol: yocryd}Hc 尸환n 순급기鬱냐틀i , ii : 또고체강칭丁 _ _ _l 산물 생저탑 冬 L 환 순름기 5.5 정공laoC-H림 그
반응된다. 유동충의 스러리 흐름 높이는 내부의 석탄스러리 순환관으 로 순환시켜서 일정하게 유지하고 촉매충의 팽창 높이는 스러리의 순 환율로서 일정하게 유지시킨다. 이때 사용되는 촉 매는 석유정제에 사 용하는 cobalt- m olyb date 를 사용한다 . 촉매 는 상부에 서 계 속적 으로 공급하고 비활성화된 촉매는 하부로 배출시키면서 일정한 촉 매충 높 이 를 유지시 킨다. 촉매 의 비 활성 화는 촉매 의 sin t e r in g , 금속성 분과 탄 소의 되적 둥에 의하여 일어나며 I t on 의 석탄 처리시 o.5k g의 촉 매 가 요구된다. 반응물의 체류시간은 30 분에서 1 시간 이상으로 번화시 켜서 원하는 산물에 따라 반응시간이 길면 합성원유를 생성하고 반 웅시 간이 짧으면 유황분이 낮은 경 유와 고열 량가스를 생 성 하게 된 다. 이 생성가스, 오일, 회분 및 미반응 석탄은 반응기 상부로 배출
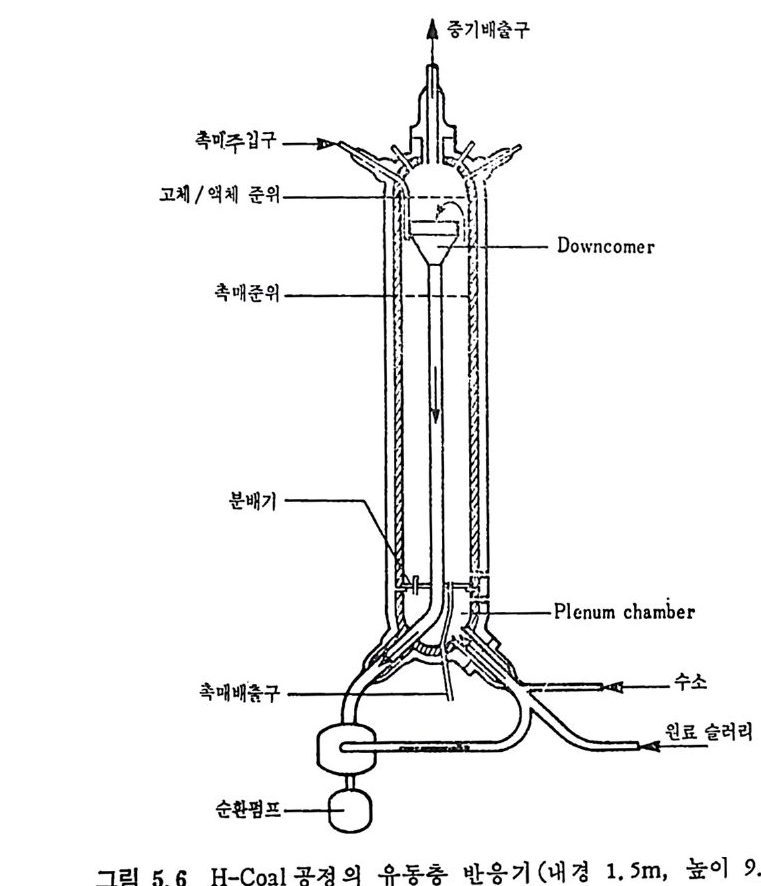 촉마주김구
촉마주김구
되어서 기체는 냉각시켜서 과잉수소와 탄화수소로부터 기름을 분리한 다. 또한 스러리는 반응기에서 배출된 후 fl ash 분리기를 거쳐서 hy - drocy c lone 에 서 분리 된 후 순환오일은 스러 리 혼합조로 보내 고 무거 운 스러 리 는 수증기 로 str r i ping 한 후 중력 침 강법 으로 분리 하여 서 가스로 로 보내져서 수소를 생성한다. H-Coal 반응기를 그림 5.6 에 보여주고 있다 .9) 그 이 의 의 촉매 수소화 반응공정 은 Conoco 사의 Zin c Chlorid e 공정 과 Bergb an-Forsehung Kohleoel 공정 이 개 발중이 나 H-Coal 공정 크 기만큼 개발되지 못한 상황이다 .4) 이제까지 기술한 용매 추출공정과 수소 액화공정들의 조업조건과 생성수율을 표 5.2 에 종합하였다.
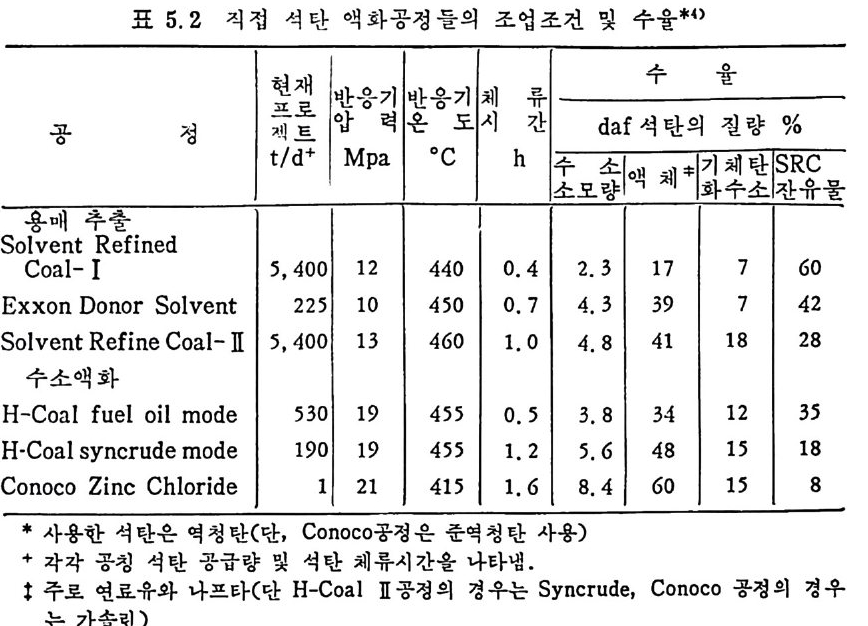 표 5.2 직접 석 탄 액화공정들의 조업조건 및 수울 *4)
표 5.2 직접 석 탄 액화공정들의 조업조건 및 수울 *4)
5. 4 열 분해 (Py ro lys i s ) 그립 5.1 의 마지막 공정이 열분해방법으로 H/C 비를 증가시키는 데 있어서 C 를 고체상태로 감소시킵으로써 H/C 비를 증가시키는 방 법 이다. 죽 열분해시 생성되는 액체산물은 coal t ar 로서 이를 수소
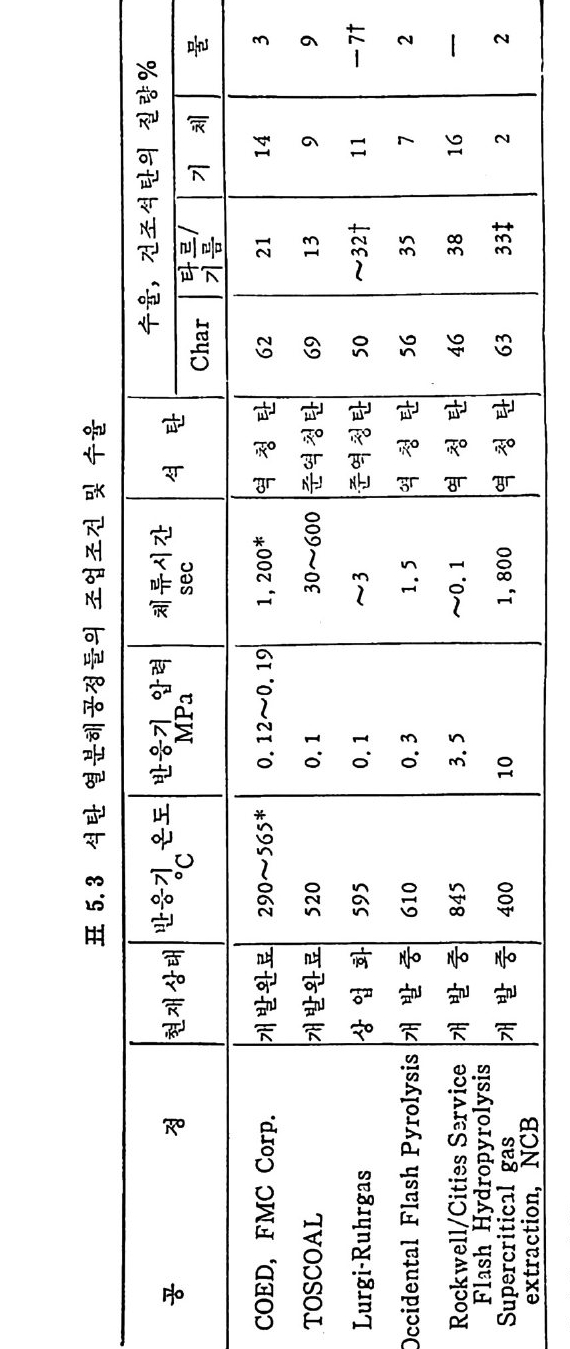 % 물 39 -7t 2 2
% 물 39 -7t 2 2
화반응, 탈황반응시켜서 정제함으로써 가소린을 만들든가 정제과정윤 줄여서 액체연료를 생성한다. 열분해는 제 2 장에서 자세히 다루었다. 여기서는 개발되어 있는 공정들을 간략히 소개하고자 한다. 앞에서 기술하였듯이 열분해는저속열분해와급속열분해로대벌된다. 표 5.3 에 현촌하는 열분해공정의 조업조건과 이의 생성수울율 표 5.3 에 보 여주고 있다 .4) 표 5.3 에서 COED 와 TOSCOAL 공정은저속 연분해공정이며 Lurg i- Ruhrga s 와 Occid e nta l 공정 은 중속 열 분해 Rockwell Hy d rop yro lys is 공정은 고속 연분해공정으로 나눌 수 있다. COED(Char-O i l-Ener gy -Develo p men t)공정은 다단 유동충을 이 용하 여서 카와 합성 엑체연료 를 생산하는 공정이며 COGAS 공정은 합성천 연가스와 합성엑체연료를 생산하는 공정이다 .10) 고속 열분해공정들은 아직 개발 단계이므로 자세한 내용은 생략하였다. 5. 5 수소화 또는 액 화율 (De g ree of Hy dr og en ati on or Liq u efa c ti on ) 각 공정의 효율성은 수소화 또는 액화 정도로 표시되나 수소화율의 일정한 정의는 없다. 초기 연구에서는 용매 추출방법으로 분석하였 다. 죽 ...4. 단추출물이 주어전용매에 녹는 양을 가지고 수소화 정도를 나타낸다. 표 5.4 에 석탄으로부터 생성된 액체들의 칭의를 보여주고 있다. 전환율 (convers i on) 은 초기 석탄 무게와 용매에 녹지 않는 찬류물 의 무게 차이로 보통 계산한다. 반응기에서 나온 반응혼합물에서 기 체 산물을 제 거 하고 이 를 처 음에 벤첸 (benzene) 으로 추출한다. 벤 젠에 녹지 않는 물질은 수소화되 지 않은 찬류물로 간주한다. 추출 물에서 벤젠을 제거한 후 hexane 을 사용하여서 두 가지 분율로 나누어 서 벤젠에 . 녹고 hexane 에 안 녹는 분율을 asph alte n e 이라 하고 hexane 에 녹는 분울을 o i l 이라고 부른다. 그러나 전 체 벤젠에 녹는 액체를 o il이라고 부르기도 한다. 또한 벤젠에 녹 지 않는 물질은 미 반응석 탄만이 함유된 것 이 아니 므로 이 를 pyridi n e 에 녹여 서 pyridin e 에 녹고 벤젠에 녹지 않는 분울을 pre asph al-
 표 5.4 석탄으로부터 생성된 액체둘의 용어 정의
표 5.4 석탄으로부터 생성된 액체둘의 용어 정의
t enes11) 이 나 as p hal t o!s12) 이 라고 부르며 접 도 차이로써 oil 과 구벌할 수있다. 수소화 정 도 (de g ree of hy d rog e nati on ) 를 표현하는 다른 방법 은 반 옹기에서 나온 산물에서 기체를 제거한 후 여과(filt ra ti on) 하여서 용 액으로부터 입자를 분리한 후 여과액을 유기용매로 추출하고 증류, chromagr a ph ic tec hniq u es, 원십 분리 둥의 처 리 를 하여 서 초기 석 탄 과 건조 여과 cake 의 무게 차이로서 전환율을 계산한다. 그러나 정 확한 수소화율을 얻기 위해서는 filt ra t e 나 벤젠 추출물의 수소함량 울 결정하여야 한다. 5. 6 간접 액 화(I nd i rec t Liqu efa c ti on ) 수소와 CO 를 촉매하에서 반응시켜서 탄화수소를 생산하는 것을 간
접 액 화타고 한다 . 대 표적 인 공정은 산화탄화수소를 생 산하는 Fis c her- Tro p sch 공정으로 2 차세계대전중 독일에서 상업적 규모의 공장을 가 동하였 고 현재 가동중인 남아프리 카의 Sasol 공정 이 있 고 Mobil 사 의 meth a nol 로부터 가솔란 합성 공정 이 있 다. 이 공정 들의 장접 은 초기 석 탄구조가 완전히 분해되고 초기 석탄내의 금속성분이 완전히 분리되 어서 매우 낮은 유황분과 회분을 가진 깨끗한 연료를 얻을 수 있다는 접이다. 그러나 초기 석탄구조를 완전히 분해시키는 많은 과정과 화 학적 면화가 일어나는 공정이므로 전체 열효율은 좋지 않다. 실제 공정에서는 H2 오} co 를 함유한 중열량 가스를 원로물질로 사 용한다. 그러므로 전체 공정 중에 석탄의 가스화 반응기가 포함되어서 Sasol 공정 에 서 는 Lurgi 가스로가 사용되 고 있 다. 이러한 반응기의 설계에 있어서 중요한 인자는 촉매의 선댁과 반응 중에 생성되는 많은 열을 제거하는 방법이다. 촉매의 해독이 큰 문제 이므로 반응기 원료를 잘 정제하여서 공급하여야 하겠다. 여기서 정 제된 가스의 조성을 머 2/(2CO+3C02) 〕=I. 03 을 조절하여서 반응기에 공급한다. 한 가지 장접은 촉매의 조성, H/CO 의 비 및 조업조건을 적철히 조 절하면 LPG, 가소란, 등유, 디젤오일, 연료오일 동의 여러 종류의 산물을 생 성 할 수 있 다는 접 이 다. 또한 촉매 종류에 따라 meth a nol 과 aceto n e 둥도 생산할 수 있다. 대표적으로 사용되는 촉매는 Fe, CO, Ni, Ru, Zn02 및 Th02 둥이 다. 촉매 의 영 기 를 변화시 켜 서 가스의 조성과 생성물의 선댁도를 실험한 결과 13) 메탄의 조성은 1~70% 까지 경질 왁스는 0~50% 범위에서 변화하였고, 최대 가소린 분율은 40% 까 지 언을 수 있었다. 산물의 선택도 (selec ti v ity)는 촉매조성과 가스조 성에 의해 좌우되며 H2/CO 비가 낮은 온도의 고정충 반응기에서 CO2 의 분압이 높은 온도의 비말동반 반응기에서 중요한 변수로 작용하 였다. 5. 6.1 탄화수소 합성 합성 액체연료 생산은 F i scher-Tro p sch 반응에 의한 South Af rica 의 Sasol 공장에서 1955 년에 시작되어서 석탄으로부터 자동차연료, 액 체 부산물 및 산업용 연료가스를 계속 생산하고 있다. 이 공정에서
Lurgi 가스로를 사용하여 서 107m3/day 의 원료가스를 만들어 서 850 to ns/day 의 액 체 연료와 I9MJ /m 3 의 중열 량 가스 1. 7 x 106m3/day 를 Sasol 기공정에서 생산하고 있고, 최근의 Sasol-II 공정에서는 대략 8XI06L/da y (50,ooobbl/da y)의 자동차연료를 생산하고 있다. 이는 48M J /k g연료를 60K g /s 의 가솔린 생산울 하는 공정으로 36 개의 Lurgi 가스로를 가지고 있 다. Sasol-I 공정 과의 차이 는 Sy n th o l 순환 유동 충(그림 5.7) 반웅기 7 개를 첨가하여서 주로 가솔린 생산울 목적으로 개발된 것이다. Sasol 내공정을 간략하게 도시하떤 그림 5.8 과 같다. Sy n th o l 순환 유동충에는 원료가스와 순환가스를 혼합시 켜 서 160~ 200°c 와 2. 2MPa 조건에 서 주입 된다. 이 가스가 촉매 를 유동화시 키 면 서 315~330°c 에 서 Fis c her-Trop s ch 반응과 가스 전환반응이 수행 된다• 반응에서 나오는 열은 내부의 냉각관에 물을 동과시켜서 수증기를 생 성하여서 그 일부는 주입 가스의 예열에 활용한다.
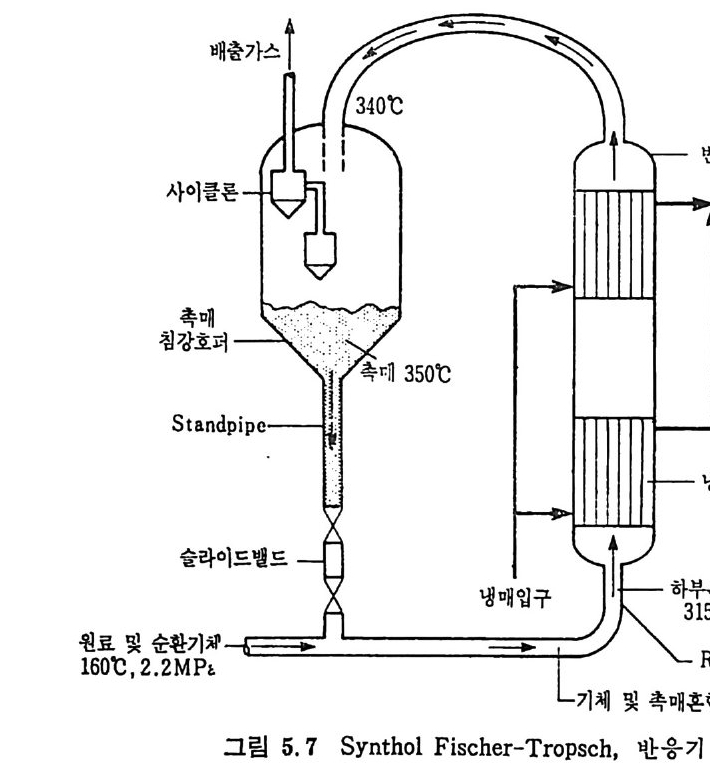 반응 7 J
반응 7 J
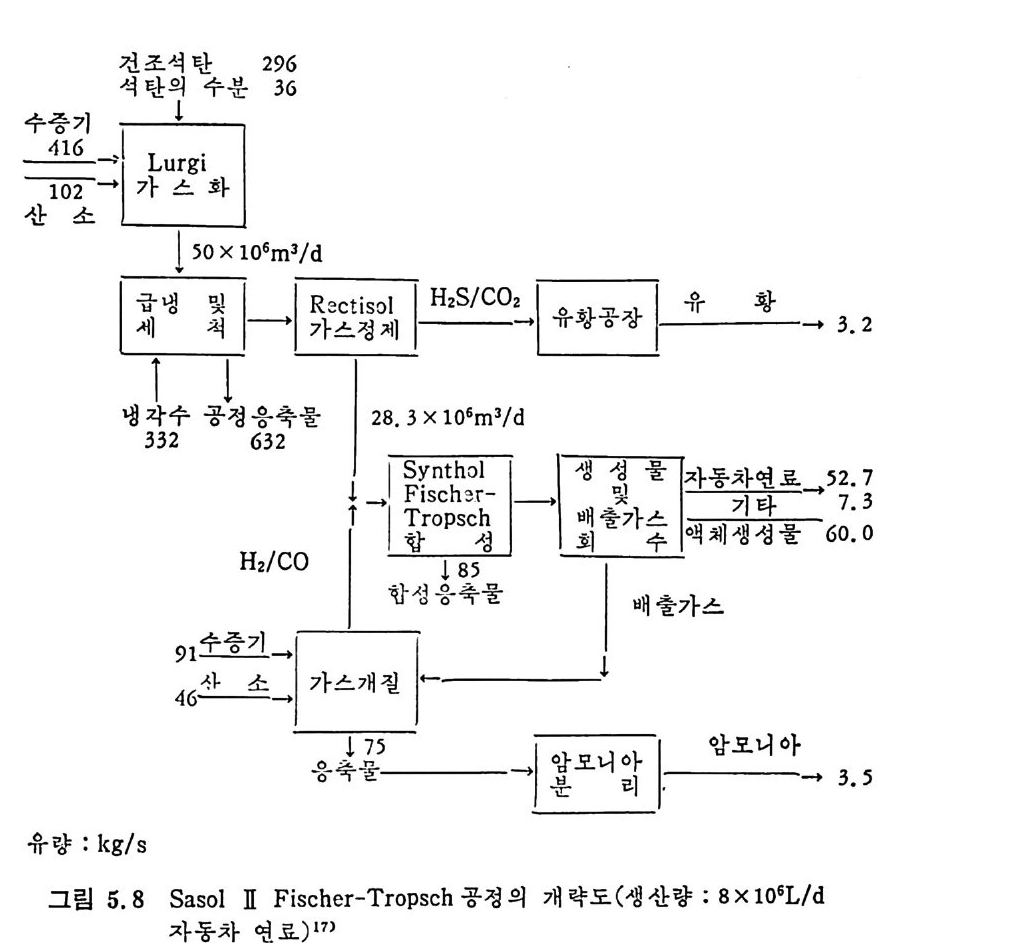 건석조탄의석 탄수 분 29366
건석조탄의석 탄수 분 29366
반응기를 나오는 반응물질, 생산물 및 촉매는 촉매 ho pp er 에 들어 가서 c y clones 에서 기체와 입자가분리되며 여기서 배출되는 기체는 세 척 하고 냉 각시 켜 서 탄화수소 산물을 얻는다 . Sy n th o l 반응기 에 서 생 성 되는 기체와 액체조성율 표 5.5 에 보여주고 있다. 실제의 Fis c her- T가r o아 p s닌ch C반0응+은2. 1이2H상2적— 인-+ (H양 C론, 반alc응oh식ol인s, accoi d+) 2+Ho2. 9--5- H+2( 0-C 로H 2일-어)+ 난H다2.0 F i scher-Tro p sch 공정에 대한 연구 결과들은 많고, 이를 종합한 것 은 문헌 14-16) 을 참조하기 바란다. 간접 액화의 또하나의 방법 은 석 탄으로부터 meth a nol 을 합성한 후 이 를 zeoli te 촉 매 하에 서 가솔린으로 전환하는 Mobil M(meth a nol-to -
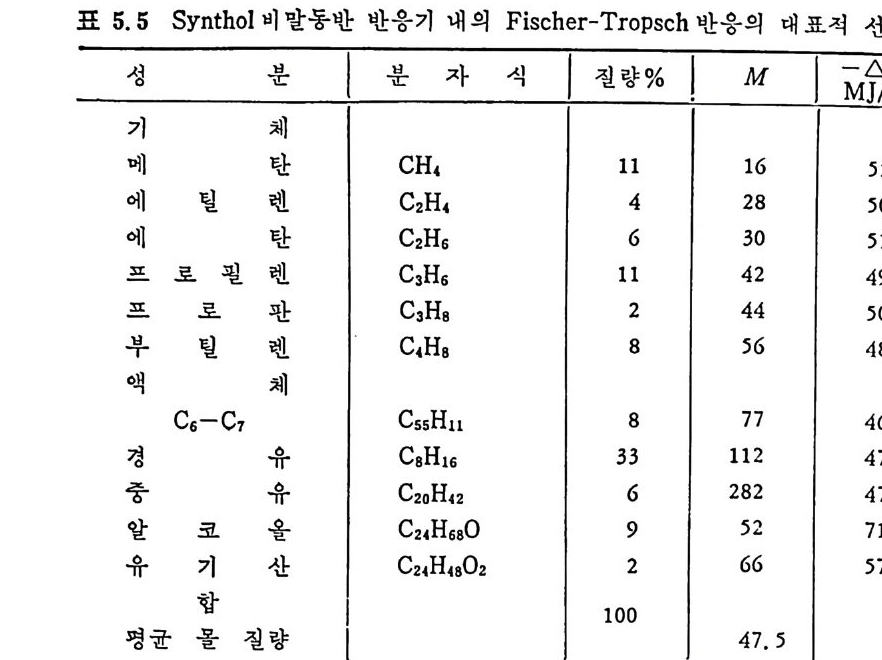 표 5. 5 Sy n th o l 비 말동반 반응기 내 의 Fis c her-Trop sc h 반웅의 대 표적 선택 도
표 5. 5 Sy n th o l 비 말동반 반응기 내 의 Fis c her-Trop sc h 반웅의 대 표적 선택 도
g aso li ne) 공정 이 다. 18} 이 공정 의 주요 개 발은 ZSM-5 모양선택 zeoli te 촉매 에 있 다. Zeoli te 는 alumi no -sil ica te 결정 으로 촉매 의 기 공구조를 만들어 원하는 크기 법위 내의 탄화수소 분자를 선택적으로 반응시킨 다. 죽 ZSM5 촉매는 C5~C10 의 중간크기 분자는 내 보내 고 C10 보다 큰 분자는 나가지 못하게 하는 역할을 한다. 이 선덱도 (selec ti v ity)에 의하여서 me t hanol 을 고급휘발유 규격의 옥란가와 비 동접 등을 갖는 탄화수소 혼합물을 만들 수 있다. 18-19) 전 체 공정은 석 탄의 가스화, meth a nol 합성 및 meth a nol 로부터 의 가솔 란 전환으로 대별된다. 가스로에서 생성된 생성가스를 5~10MPa 로 가압하여서 순환되 는 가스와 혼합 가열하여 고정충 반응기 상부에 주입한다. 이때 반응기 온도는 250~270°C 에 서 조철하고 반웅기 하부에 서 나가는 meth a nol 중기는 열교환기 에서 원료주입 가스를 예 열시 킨다. 여 기 서 나온 배 출물은 meth a nol 분리 기 로 들어 가 고압에 서 분리 된다. meth - anol 속에 녹아 있는 가스들은 팽창기에서 압력을 감소시켜서 제거 한다. 메탄올의 가솔린으로의 전환반응은
xCH30H 一 (CH3)~+xH20 로 표시할 수 있다. 이 반응은 매우 큰 발열반응이고 이 발열을 제거 하는 것이 설계의 주요 인자가 된다. Mob il 사는 고정충 반응기와 유 동충 반응기를 개발하였다. 고정충 반응기에서는 반응열 조철을두단 계 반응을 시 켜 서 수행 한다. 첫 째 단계 는 dim eth y le th er (DME) 를 형 성하여서 20% 의 열을 방출한다. 이때의 산물은 dim eth y le th e r, 물 및 메탄올이 평형 혼합물을 이루고 있는 것이다. 반응로의 주입온도 는 300°C 정도이고 출구온도는 410°C 이며 조업압력은 2.3MPa 이 다. 두번째 단계는 탄화수소의 전환반응으로 반응로 입 구온도가 330°c
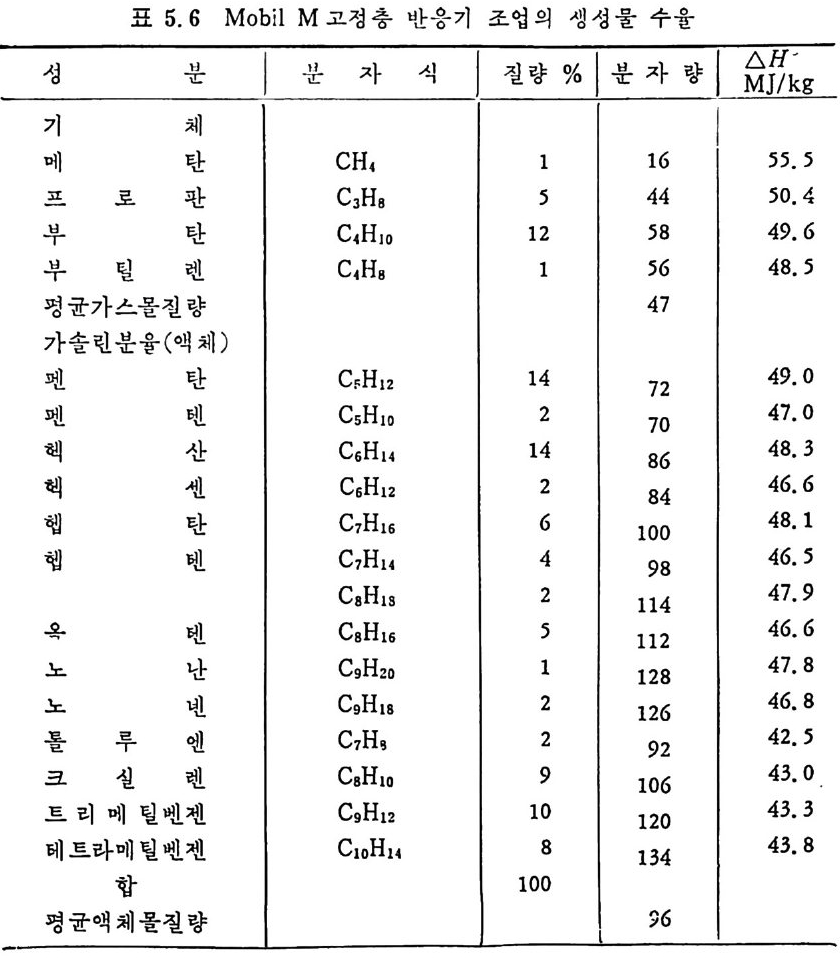 표 5.6 Mobil M 고정충 반옹기 조업의 생성을 수운
표 5.6 Mobil M 고정충 반옹기 조업의 생성을 수운
와 출구온도는 400°C 에 서 2. 2MPa 압력 하에 서 반응된다. 대 략 50,ooobb l/ da y의 연료유를 생산하는 데는 DME 반응기 2 개와 5 개의 M- 가솔린 반응기 가 뭘요하다. 그 반면 유동충 반응기 를 사용하는 겅 우는 반웅기 하나로 400° C , o. ,1M Pa 조업 조건에 서 같은 양을 생 산할 수있다. 표 5.6 에 고정충 Mobil M 공정으로부터의 생성률을 표시하였다. 5.7 석탄성질이 액화에 미치는 영향 석탄을 액화하는 데 있어서 석탄의 종류에 따라서 수소화 또는 액 화의 정도가 다르므로 주어전 공정에서 수소화반응의 수율이 높은 석 탄을 사용하여서 액체연료를 많이 생산하는 것이 전반적인 경제성을 최적화하는 것이타 할 수 있겠다. 그러므로 석탄의 동급, 조성 및 구조가 액화에 미치는 영향을 규명 할 필요가 있다. 5. 7.1 석탄의 등급 (rank) 과 조성 (comp os it ion ) 석탄은 같은 등급의 석탄이라도 광물의 종류가 지역에 따라 다르므 로 액화반응의 독성이 상이하다. 또한 석탄 내의 금속성분의 종류와 함량에 따라 어떤 금속성분은 액화반응의 촉매역할을 하므로 전체 반 웅률을 해석하기는 쉽지 않다. 석 탄 액 화의 특성 은 석 탄의 동급과 이 의 광물조성 (pe tr o g r aph ic com· p os iti on) 에 의 존한다. 석 탄 조성 중의 fus ain 은 수소화에 적 합치 않으 나 an t hrax y lon 은 수소화를 증진시키며 s p li n t석탄은 엑화수율을 감 소시킨다. 벤젠에 녹지 않은 찬류물을 근거로 한 결과와 석탄의 성분 분석치를 표 5.7 에 보여주고 있다 .20) 여기서 보면 fu sa i n 은 액화에 불활성 목성을 보인다. 석탄의 마제랄 (macerals) 을 제 가지 군으로 나누어서 vit rin i t e, exin i t e 와 ine rt ini t e 로 분류하면 vit rin ite 와 exin i t e 는 액 화되 기 쉬 운 조성인 반면 i ne r'd ni n t e 는 저항이 큰 물질이다. 석탄의 마세탈이 액 화에 미치는 영향을 Giv e n 둥 21-22) 이 연구하였다. 석탄 마제랄은 마 도울(gri ndab ility)의 차이로 구별된다. 다론 마제랄 군의 준역청란의
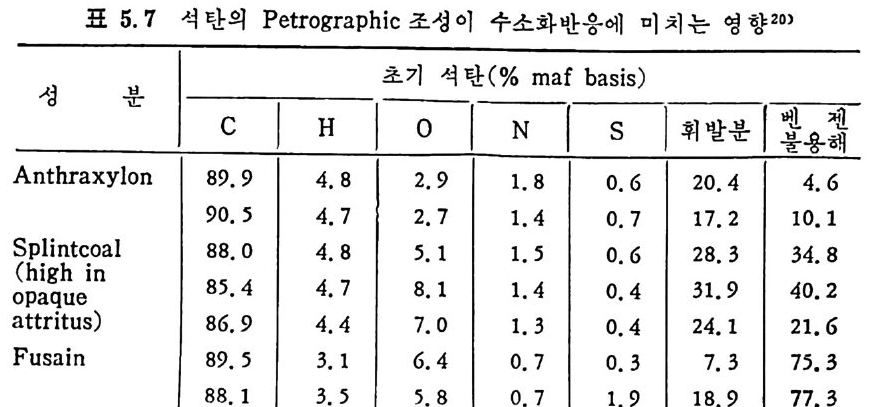 표 5. 7 석 탄의 Petr og ra p h ic 조성 이 수소화반응에 미 치 는 영 향 20)
표 5. 7 석 탄의 Petr og ra p h ic 조성 이 수소화반응에 미 치 는 영 향 20)
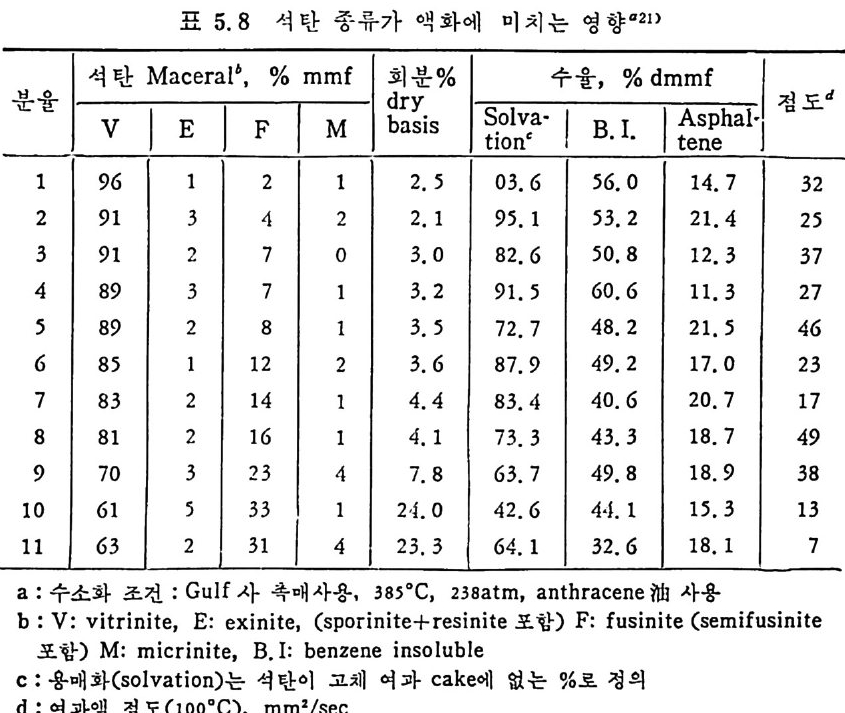 표 5. 8 석 탄 종 류 가 액 화에 미 치 는 영 향 •2 1)
표 5. 8 석 탄 종 류 가 액 화에 미 치 는 영 향 •2 1)
조성과 수율을 여과 cake 에 남지 않은 분율 (solva ti on) 로 표시하여서 표 5. 8 에 보여 주고 있 다. 이 석 탄시 료 중의 exin ite 와 mic ri n i te 의 양 이 적 어 서 solvati on 또는 수소화수울은 fus in i te 양 이 중가함에 따라 감소하였다. 또한 (v it r i n it e+ex i n it e) 양이 증가함에 따라 solva ti on 은·
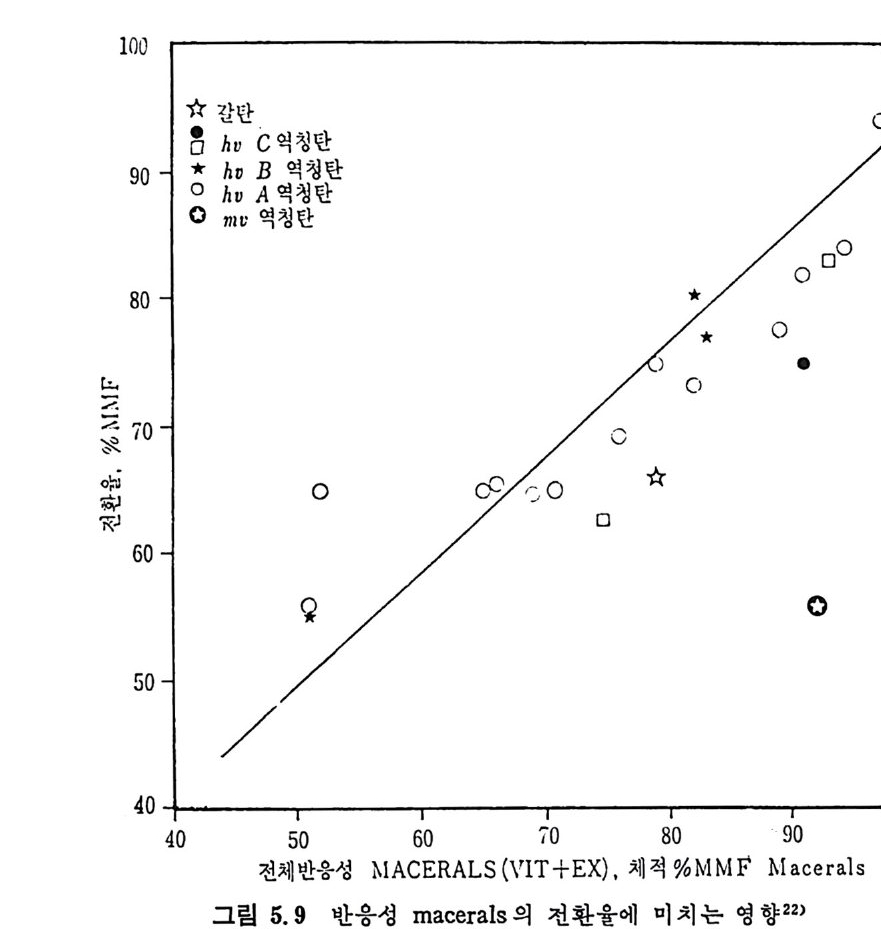 l00
l00
증가하였다. E xinit e 의 액화에 대한 높은 반응성을그림 5.9 에 보여주고 있다 .21) 여 기 서 전환율 (convers i on) 은 초기 석 탄무게 를 무금속 성 분을 기 준 으로 하여서 벤첸에 녹지 않는 잔류분 무게의 차이로 정의한 것이 다. 또한 m i c ri n it e 성분의 일부도 액화에 활성이 있으며 semi fusi n i t e 는 수소와 반웅하여서 액체 산물을 생성한다 .24) 석탄의 등급 (rank) 이 전환율에 미치는 영향을 Fis h er 동 20) 이 연구 한 결과 탄소함량이 89% 이상인 석탄은 수소화반응에 적합하지 못 하여 액체생성 수율이 낮고, 고휘발분 역청란이 가장 액화가 찰되
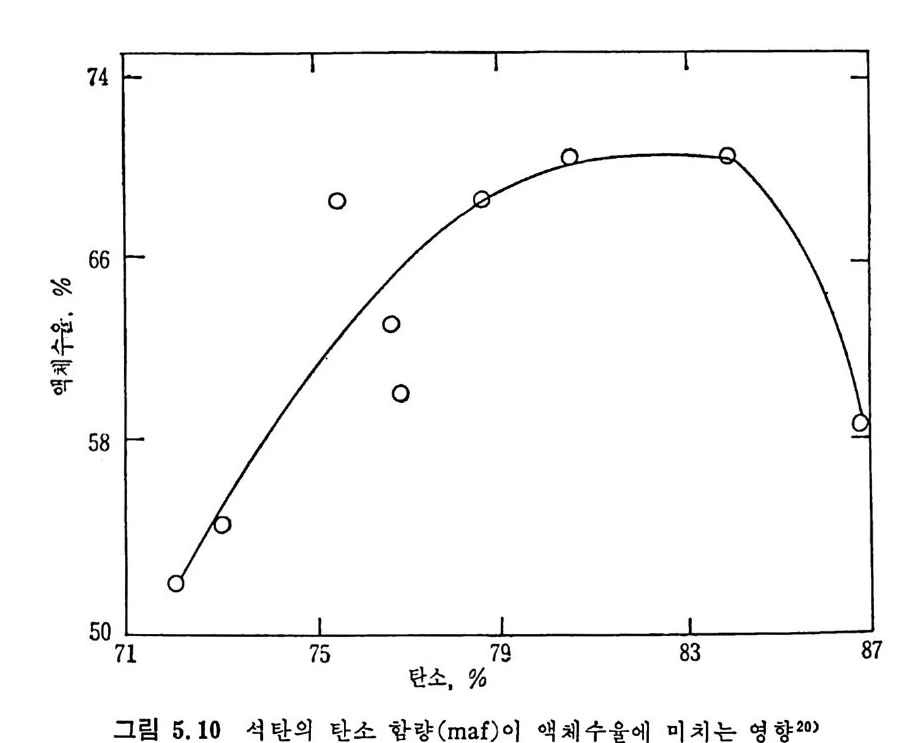 74
74
며, 낮은 등급 석탄(갈탄, 준역청란)도 역청란보다 액체수울이 낮으 나 저등급 석탄은 고온, 고압하에서 수율이 중가하였다. 석탄의 탄소 합 량과 액체수율의 관계를 그립 5.10 에 보여주고 있다 .21) 여기서 액 체오일은 20% 의 가소린과 70% 의 오일로서 200~330°c 에서 증류한 것이다 . 그립 5.10 에서 보듯이 오일수율은 탄소함량이 81% 가 될 때 까지 증가하다가 감소하는 경 향을 보인다. 죽 87% 의 탄소함량을 가 진 석탄의 경우 fusa i n 의 양이 많은 석탄이다. 석탄의 등급은 액체수울과 전환울에 영향을 미찬다. 일반적으로 전환윤 (convers i on) 은 석 탄의 등급이 낮아지면 증가한다. 석 탄의 전환율을 벤첸에 녹지 않는 분율로 정의하여서 creosote 기름을 수소증여용매로 사용하여 400°C, I 기압에서 반응시켰을 때 여러 석탄의 전환율을 체류시간의 함수로 그림 5.11 에 도시하여서 석 탄등급이 전환율에 미치는 영향을 알아보았다 .24) 반응률은 처휘발분 역청란에서 갈탄으로 석탄의 둥급이 낮아지면 증가하였다. 무연탄은
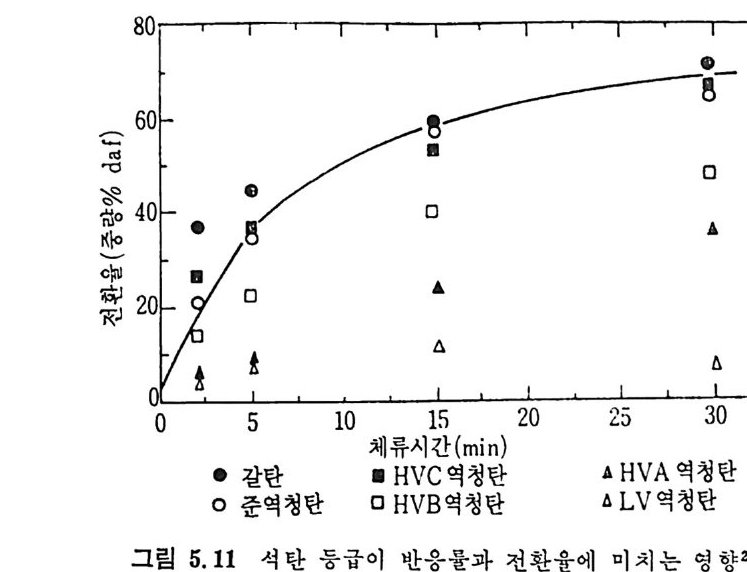 80
80
제일 높은 탄소함량과 적은 함량의 회분, 탄소 및 유황분을 가지고 있으므로 직접 연소에 활용되며 구조상 쉽게 액화할 수가 없으므로 무 연탄은 석탄 액화에 사용하지 않는다. 또한 저동급 석탄인 갈탄은 많 온 양의 수분과 산소를 함유하고 있어서 액화시의 수소의 소모가 크 다. 그러므로 역청란과의 구조적 차이로 액화시 상이한 공청이나 처 리가필요하다. 석탄 액화시 석탄 본래의 분자구조가 완전히 파괴되는 것은 아니므 로 이 구조에 대한 이해는 액화의 물리화학적 공정을 이해하는 데 도 웅이 된다. 석탄은 2 차원 방향족 결정으로 구성되어져 있다. 각각의 결정구조는 평군 분자량이 230~250 인 일중, 이중, 삼중 또는 사중 c y cl i c 방향족 단량체로 구성되어 me t h y lene 에 의하여 연결되어서 일반적으로 0-C 와 S-0 분자간이 가교된 적 선 풀리 머 (p ol y mer) 로 구 성되어져 있다 .25-26) 석탄 풀리머의 평군 분자량은 2,000~3,000 정도 이다. 석탄 액화는 me t h y lene 의 연결과 C-0, C-N, C-C 결합의 균열에 상관된다고할수있다. 여러 종류 석탄(처휘발분 역청란~갈탄)의 구조를 그림 5.12 에 보
 저 휘발분 역청단
저 휘발분 역청단
여주고 있다 .2l) 5.8 용매 추출 앞의 5.2. I 절에서는 용매추출공정윤 다루었고 여기서는 용매의 성 질 및 추출반응 메카니즘 둥을 소개하고자 한다.
용매를 이용하여서 석탄을 분해하기 위해서는 용매는 수소증여 (hy drog e n donor) 성질을 가지고 있어야 한다. 죽 용매는 석탄에 수소 를 더 하여 줌으로써 석 탄이 용매 에 녹아야 한다. 그 예 로서 tet r a li n (1. 2. 3. 4- t e t rah y drona p h t halene) 을 용매 로 사용한 경 우 4 개 의 수소 를증여할수있다.
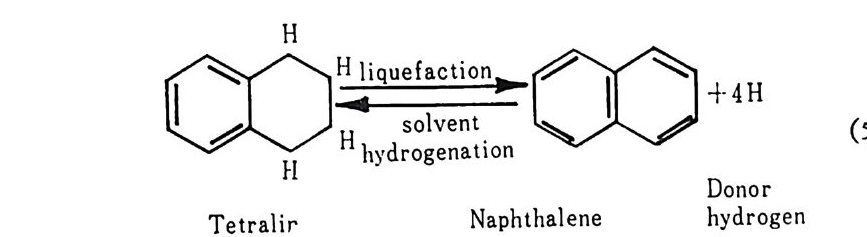 cTetro a liIH r-I 토hyd r og en aNti aopn h t ch aleone -+4hDyHod n roor g en (5.1)
cTetro a liIH r-I 토hyd r og en aNti aopn h t ch aleone -+4hDyHod n roor g en (5.1)
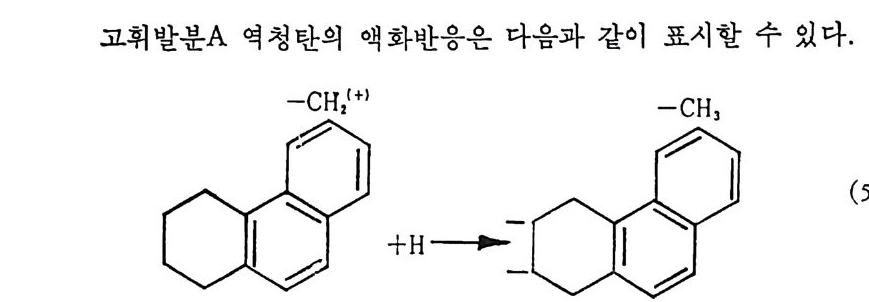 고휘발분 A 역청탄의 액화반응은 다음과 같이 표시할 수 있다.
고휘발분 A 역청탄의 액화반응은 다음과 같이 표시할 수 있다.
여 기 서 tet r al in 은 용매 에 서 의 증여 분자이 고 nap h th a lene 은 소모분자 이다. 또한 na p h t halene 은 수소를 줄 수 없으므로 nondonor 용매로 간주한다. par aff in 油도 nondonor 용매 이 며 decalin 은 tet r a li n 과 pa raff in 油 중간의 증여 (donor) 능력 이 있 는 용매 이 다. 일반적으로 높은 비동접을 가전 용매로서 수소방향족 (h y droaroma ti c) 과 국성 (p olar ity)을 가전 용매는 좋은 수소중여 능력을 가지고 있 다. 석탄 액화에 사용되는 여러 용매를 구별하는 것은 중요하다. 죽 벤 첸과 pyri d i n e 은 solvati on 또는 전환을 정 의 하는 데 사용된다. 벤젠 을 사용하여 서 석 탄을 녹일 때 (d i ssolu ti on) 는 수소증여 용매 를 사용 하여서 수소화할 때보다 낮은 온도에서 수행된다. 석 탄에 대 한 용매 의 영 향을 4 가지로 Oele 둥 28) 이 분류하였 다. 낮은 온도 (<200°C) 에서 석탄의 많은 양을 녹일 수 있는 용매는 수소를증
여할 수 있는 능력이 있다 . 이는 물리적 용액으로 용매도 초기 물질 과 같은 성질을 가지며 벤젠과 pyr id i n e 둥이 그 예이다. 그 반면 화 학적 용매는 석탄과 화학반웅울 하여서 녹이는 것이며 고온에서 반응 되어서 추출물질의 화학조성은 초기 물질의 조성과는 다르며 수소 증 여 능력을 가전 용매로서 tet r a lin 이 대표적인 용매이다. 그러므로 많은 연구자들이 수소증여 성질을 가전 용매에 대하여 연 구하였 고 tet r a lin - ph enol-nap h t he ne 의 세 가지 성 분 혼합물에 대 한 연구 29) 와 400°C, 1 기압하에서 여러 가지 용매를, 수소가스하에서 수 소화반응시켜서 반응성이 큰 것, 중간 것 및 작은 것으로 구별하였 다 . 석 탄의 조성 이 63% 의 anth raxy !o n, 22% 의 tra nslucent att ritus , 12 % 의 op a q u e at trit us 와 3 % 의 fus ain 을 가진 것 을 벤젠으로 o. 5 시간 동안 촉매를 사용한 경우와 사용하지 않은 경우를 실험하여서 표 5.9 에 보인 결과를 얻었다 .30) 여기서 효과가 작은 용매는 높은 비접을 가전 방향족 화합물이거나 400 ° C 에서 천천히 탈수소화 되는 수소방향족 화합물이다. 그 예로
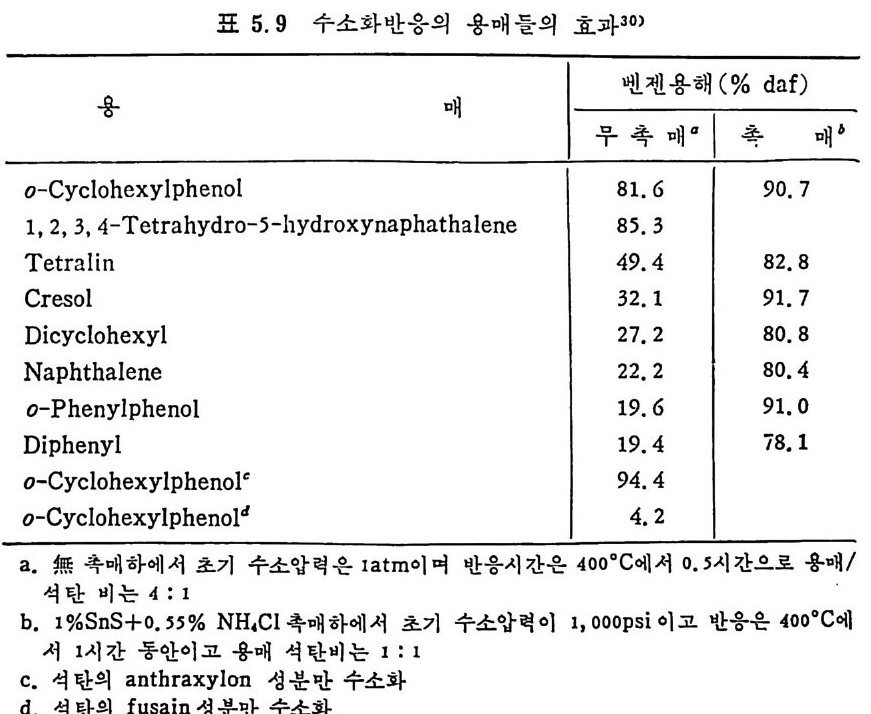 표 5. 9 수 소화 반응의 용매 들 의 효과 30)
표 5. 9 수 소화 반응의 용매 들 의 효과 30)
dic ycl ohexy l, nap h th alene, o-ph eny lp h enol, dip h eny l nKJ cresol 온 활성이 낮은 용매이다. 수소방향족 (h y droaroma ti c) 에 방향족 (h y drox y l) 그룹윤 가진용매 가 석탄을 찰 액화시킨다. 산업적으로 활용되는 용매는 보통 coal 타르 제조시에 얻는 creosote 와 anth r acene 오일 이 다. 여 기 에 수소증여 활성 이 콘 tet r a li n 을 가 하면 그 활성 이 현격 히 증가한다. 죽 creosote 에 tet r a lin 을 혼합한 용 매와 석탄의 비를 4:1 로 하여서 400°C 에서 실험한 결과 tet r a lin 의 소량 첨가는 벤첸 용해수율 또는 전환율이 중가하였다(그립 5. 13). 그림 에 서 보돗이 tet r a lin 과 creosote 가 같은 양이 촌재 할 때 가 전환 울%가 최대를 보여서 순수 용매만 사용한 경우보다 전환율이 증가됨 울 알 수 있 다. 30-32) Guin 둥 33) 이 creosote o il과 tet r a lin , decali n 및 pa raff in oil 둥을 가지고 석탄용해실험을 하여서 얻은 결과는 석 탄용해 (diss oluti on ) 또는 전환에 온도, 용매 의 성 질, 수소가스의 촌재 유무, 수소의 분압 둥이 중요한 역 할을 한다고 발표하였다. 용매와 석탄간의 반응은 산-영기반응이 일어나며 용매는 Lewi s 영 기로 작용하여서 석탄의 찬기에 반응하므로 용매의 Lew i s 염의 강도
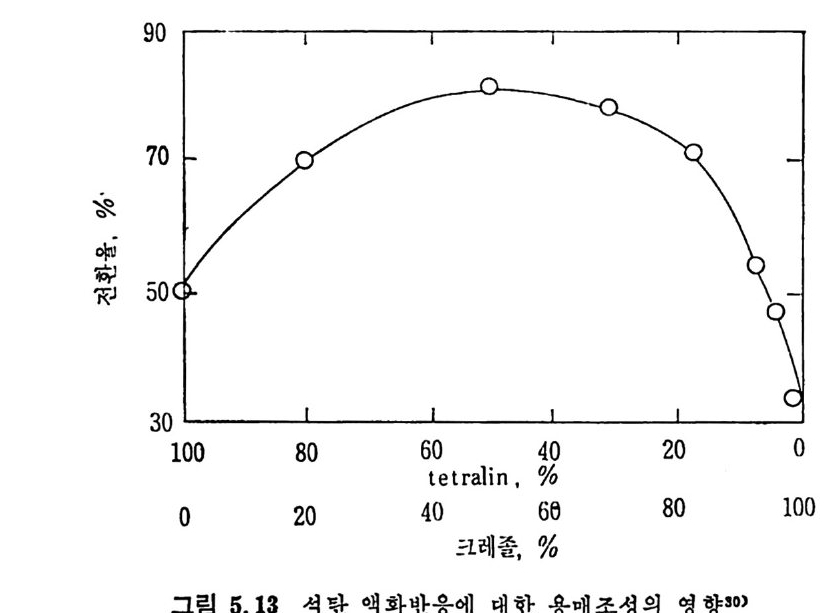 90
90
가 석탄 추출의 중요 인자가 된다 . 25 ) 또한 용매의 비극성 용해도 (non· po lar solubil it y pa ramete r : NSP) 를 근거 로 하여 서 NSP 가 9. 5 (cal/ cm3) !/2 인 용매가 석탄용액에 제일 적합한 용매로 발표되었으며 제 일 좋은 수소증여용매로 알려진 t e t ra li n 의 NSP 치는 25°C 에서 9.4 (cal/ cm 3) !/2 이 다. 31) 석 탄-용매 간의 용해 반응은 열 전환율에 의 하여 조절된다. 32-33) 고휘발분 역청란을 t e t ral i n 용매로 400°C 에서 전환율을 측정한 결과 24) 대략 10% 의 석탄은 20 초 내에 가스와 벤젠에 녹는 물질로 전 환되고 90% 의 무회분 석탄은 2 분 내에 py r i d i ne 에 용해되었다. 여기 서 석탄의 3% 가 미반응 fu s i n it e 이고, 93% 의 용해성 물질은 2 분 내 에 pyr id i n e 에 용해 되 었 고 모든 반응성 물질들은 10 분 내 에 py r i d i ne 에 용해되었다(그립 5.1 1) . 석탄과 t e t ral i n 간의 수소전달은 석탄분자가 열에 의하여 군열되어 자유라디칼로서 반응하여서 수소원자가 전달되어 이 자유라디칼을 안 정시키는 반응으로 설명하며 수소전달 메카니즘은 충분한 수소 증여 용매 촌재하에서는 석탄이 열분해되어서 자유라디칼이 되는 반응이라 고 하였다 .33) 수소중여 용매 (t e t ra li n) 와 무수소증여 용매 (dodecane, nap h th a lene)
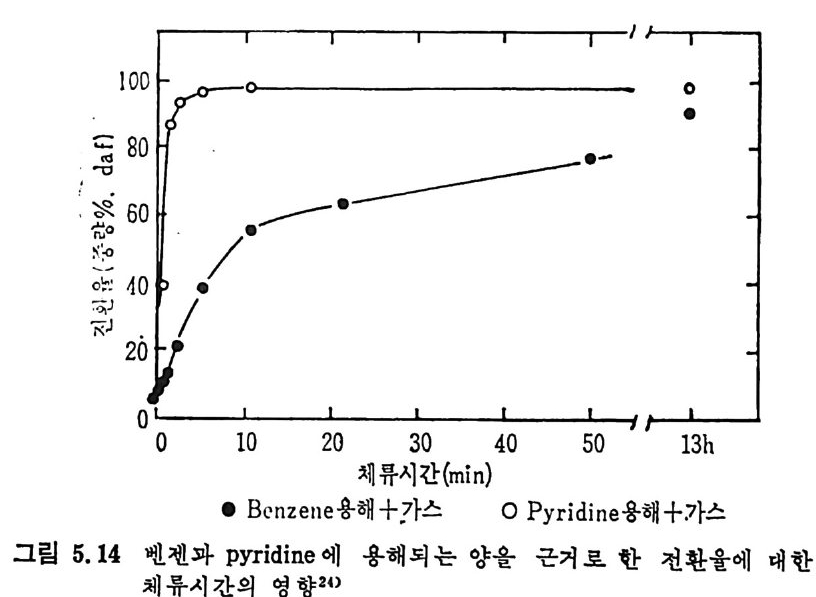 100 O•
100 O•
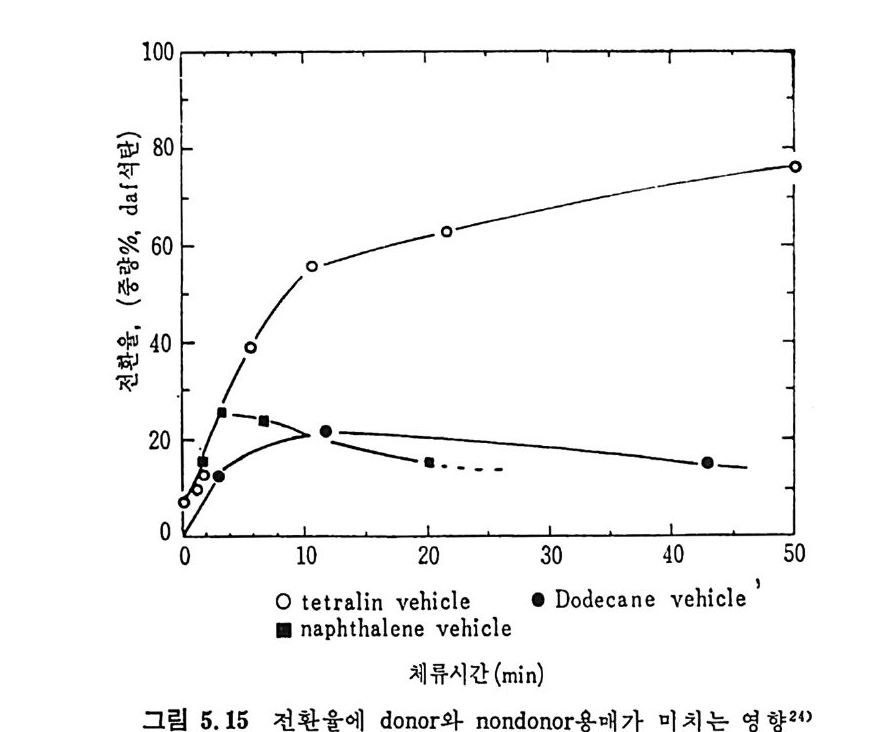 100 '|- 『-
100 '|- 『-
를 사용하여 고휘발분 역청란을 400°C 에서 반응시켜서 이의 전환 울을 체류시간의 함수로 그림 5.15 에 보여주고 있다 .24) 무수소 증 여용매의 경우에는 석탄의 25% 가 벤젠에 용해되는 석탄 및 가스로 전환되나 반응이 계속되면 벤젠 용해물질이 재결합되어서 고분자량 물질이 되어 그 수울이 감소한다. 또한 전조석탄을 400°C 에서 2 시간 동안 전공열분해하면 27% 의 무게감소를 가쳐온다. 그러므로 수소의 첨가 없이도 석탄의 25~30% 의 저분자량 물질을 생성할 수 있다. 즉 석단 추출은 석탄의 화학적 결합이 열에 의하여 깨어져서 반응성이 큰 자유라디칼을 형성하며 수소 증여용매가 없을 때는 주 위의 분자와 결합하여서 고분자량의 물질이 된 후에는 pyr id i n e 또 는 벤젠에 녹지 않는다. 그 반면 수소증여용매가 촌재하면 수소를 용매로부터 받아서 안정된 자유라디 칼을 형 성 한다. 24> SRC 공정 에 서 의 용매의 역할을 연구한 결과 34) 수소증여용매가 충분히 없으면 코크스 형성이 증진되었고 이 자유라디칼 반응을 표시하면 다음과 같다.
석탄—열 >2R H +R 一 RH (증여 수소) (자유타디 칼) (낮은 분자량 산물) 또한 충분한 증여수소가 없으떤 석탄은 재결합되어서 코크스가 된 다. n(R) 一 (R)n (자유라디 칼) (코크스) 석탄 용해가 열분해 후의 수소의 안정화로 이루어진다면 수소 소모 량과 용해량은 직접적인 관계가 있을 것이다. 여러 가지 용매에서의 전환율을 수소전달 %의 함수로 그림 5.16 에 보여주고 있다 .33) 여기 서 전환율은 xy lenol 에 녹지 않는 물질을 근거로 한 것이다. 여기서
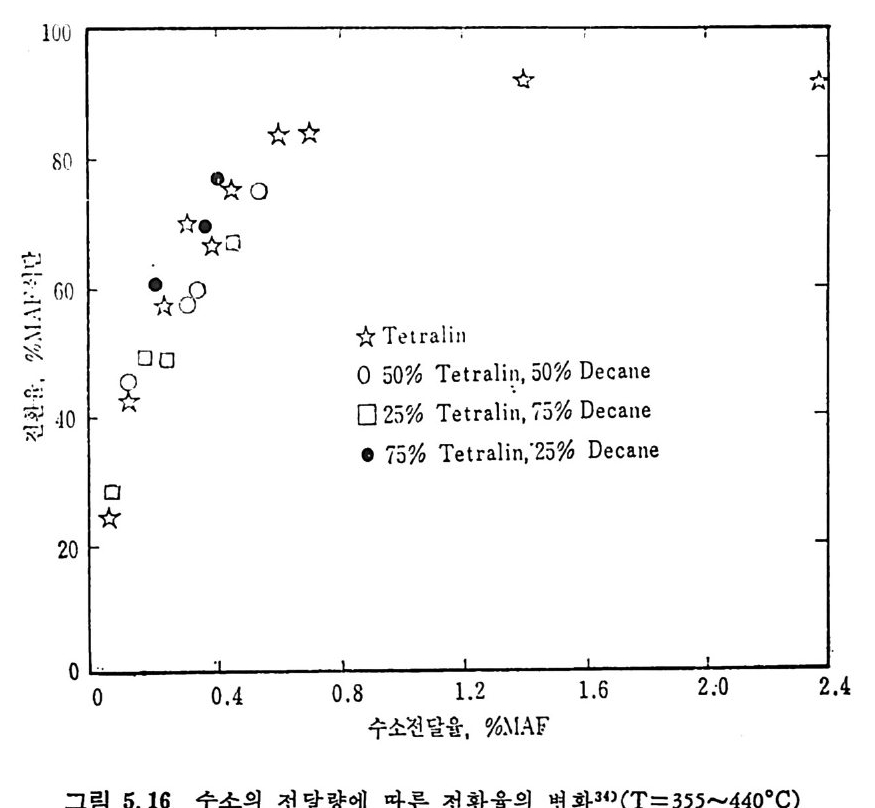 1(JO I
1(JO I
보면 용매의 종류나 반응 온도 (355~440°C) 가 전환율에 미치는 영향 은 거의 무시할 만하다. 그러나 수소의 소모율은 석탄의 전환율에 따 라 급격히 상승한다. 그러나 석탄의 50% 가 전환되는 데 팔요한 수소 는 o. 2% 에 불과하며 92% 가 전환될 때 는 1. 4% 의 수소가 필요하다. 그러 므로 그 이 상의 수소가 소모되 어 도 전환윤은 중가하지 않는다. 죽 촉매가 없는 상대에서의 수소 소모의 최적치는 건조, 무회분 석탄 울 근거로 하였을 때 2.6~2.7% 로 알려쳐 있다 .24,33) 수소증여용매와 석탄반응은 초기 단계에서는 급속히 진행되어서 수 소압력의 영향은 적다. 초기 단계의 생성물은 고분자량 (>2,00 이 물질 이 되었다가 시간이 경과함에 따라 저분자량 (300~900) 물질로 전환 된다 .24'35) 실험은 430°c 에서 수행하여서 그 결과를 표 5.10 에 보여 주고있다.
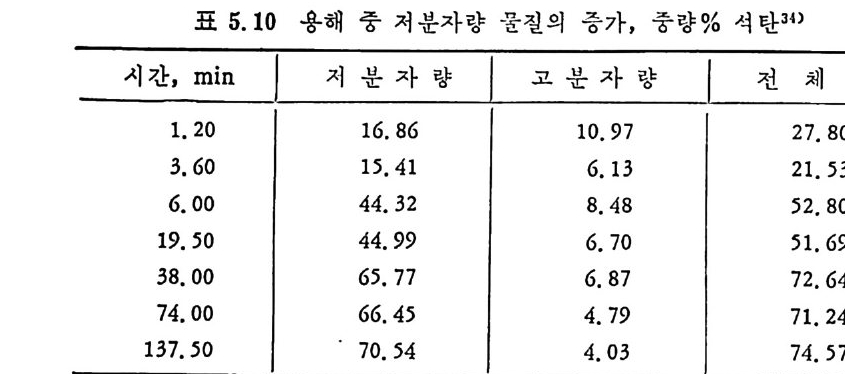 표 5.10 용해 중 저분자량 문 질의 증가, 중량% 석탄미)
표 5.10 용해 중 저분자량 문 질의 증가, 중량% 석탄미)
5. 8.1 용매 추출 반응속도 석탄의 용해 메카니즘을 이해하기 위하여서는 수소의 용해 반응속 도를 알아야하겠다. 석탄 용해시의 수소전달 메카니즘은 일차반응으로 표시되지 않으며 용매 1 석탄 비가 크면 일차반웅의 연속으로 일어난다고 Curran 둥 33) 이 보고하였다. 즉 두 개의 동시반응을 표시하면 Hx-H=a Hx e-K,t+ (1-a)Hx e-K,t (5. 3) 이다. 여기서 HT= 최대 수소전달량 c~2.6%ma f석탄) Ki =반응뮬 상수
H= 전달된 수소양, % maf 석탄 상기 모델은 석탄은 강한 결합과 약한 결합으로 이루어졌다고 가정하 여서 약한 결합이 분열되었을 때는 수소 요구량이 적고 전달을이 낮 으며 이는 초기 반응단계에서 일어난다. 그 반면 강한 결합이 분열 되면 수소전달률이 빠르며 전환율이 50~90% 법위에서 일어난다. 죽 마론 수소전달률은 석탄전환율이 낮음을 의미한다. 그 반면 용매 1 석 단비가 작으면 석탄 또는 추출물은 수소 증여구조를 갖는다고 가정하 여서 자유라디칼은 수소를 용매나 석탄으로부터 얻게 된다. K 。 RC 一+T —2K R1 >RH +T* R+C~K>2 RH+C* RR++CT**—— K J > >RR HH ++ ((CT--HH22)) (5. 4) K4 여기서 C 와 T 는 추출된 석탄과 t e t ral i n 이고 R 은 자유라디칼이며, C*, T* 는 석 탄이 나 tet r a lin 으로부터 수소원자를 얻어 서 생 성 된 라디 칼이고 (T-H2) 와 (C ― H2) 는 d i h y drona p h t halene 과 석탄이나 추출 물로부터 얻은 deh y dro gena t ed 구조를 가전 물질이다. 수소의 creosote 오일에 서 의 용해도와 creosote 오일을 용매 로 사용하 여 서 역 청 탄에 수소의 용해 반응속도를 연구한 결과 32) 석 탄 액 화용액 에 수소의 용해도는 매우 커서 Hen ry법칙으로 표현된다고 발표하였 다. 또한 석탄 액화용액은 고체석탄, 용매 및 수소가스가 촌재하는 三相系이므로 물질전달의 영향이 중요할 것이다. 그러나 1 차 군일 화 학반응으로 실험결과가 찰 표현되었다. 이 용액내에서의 확산저항은 기 -0석 계면을 통한 수소전달과 석탄표면과 기공내로의 반응물과 용매 의 전달이다. 석탄은 수소증여용매하에서 쉽게 분해되어서 석탄입자 크기가 용해시 미치는 영향은 작아서 기 -o. lj 계면에서의 물질전달이 주요 인자가 된다. 0석 상에 수소 용해를 1 차 반웅으로 가정하여서 수소 용해 반응식을
 표 5.11 Creoso t e 油의 Gas Chromato g r ap h ic 분석
표 5.11 Creoso t e 油의 Gas Chromato g r ap h ic 분석
 호 } 합물 무 게
호 } 합물 무 게
표시하면 다음과 같다. -HH= LL— o —HH—CeO = _HH—TTo — =e -aKt (5. 5) 여기서 a 는 수소용해도에 대한 변수이고, H 는 수소의 무게 g r 이며, K 는 1 차반응 상수, t는 시간이며 아래에 쓴 글자 L,G, T 는 액체, 기체 및 전체를 표시하며, 0 은 t =O 때의 양을 의미한다. 실험결과는 상기 식으로찰 표현되며 활성화에너지는 21 Kca l/ mol 이었다. 여기서 사용된 creoso t e 오일의 특성을 표 5.11 에 보여주고 있다. 대표적인 용매인 t e t ra li n 의 전환율을 조사하기 위하여 400°C 에서 30 분 동안 tet r a li n 과 charcoal 혼합물과 tet r al i n 만 을 각각 가열하였 다 . 그 결과 탈수소 또는 분해반응이 일어나지 않았다. 그러므로 석 탄 자체 가 tet r a lin 의 탈수소반응을 일으킨다고 할 수 있 겠다. 고휘 발 분 역 청 탄과 tet r a li n 을 1 : 2 로 혼합하여 서 400°C 에 서 반응시 켜 tet r a lin 의 전환율을 구하였 다. 24) 그 결과 주요 반응산물은 naph th a lene, dih yd ronap h th a lene 및 de· cahy d ronap h th a lene (decalin ) 이 었 고, 90% 전환 때 반응기 용량의 35 %는 t e t ra li n 이고 30% 는 na p h t halene 이었다. 그 실험결과를 그림 5.17 에 보여 주고 있다. 여러 연구자들이 석탄의 용해 (d i ssolu ti on of coal) 에 대한 연구를 수행하였으나 반응계가 복잡하고 여러 반웅단계를 거치므로 이론적 반응 메카니즘을 제시할 수 없다 . 널리 사용되는 반응식은 Oele 등 28) 이 제시 한 전전반응은 0 차반웅이 고 후진반웅은 1 차반웅으로 가정한 반
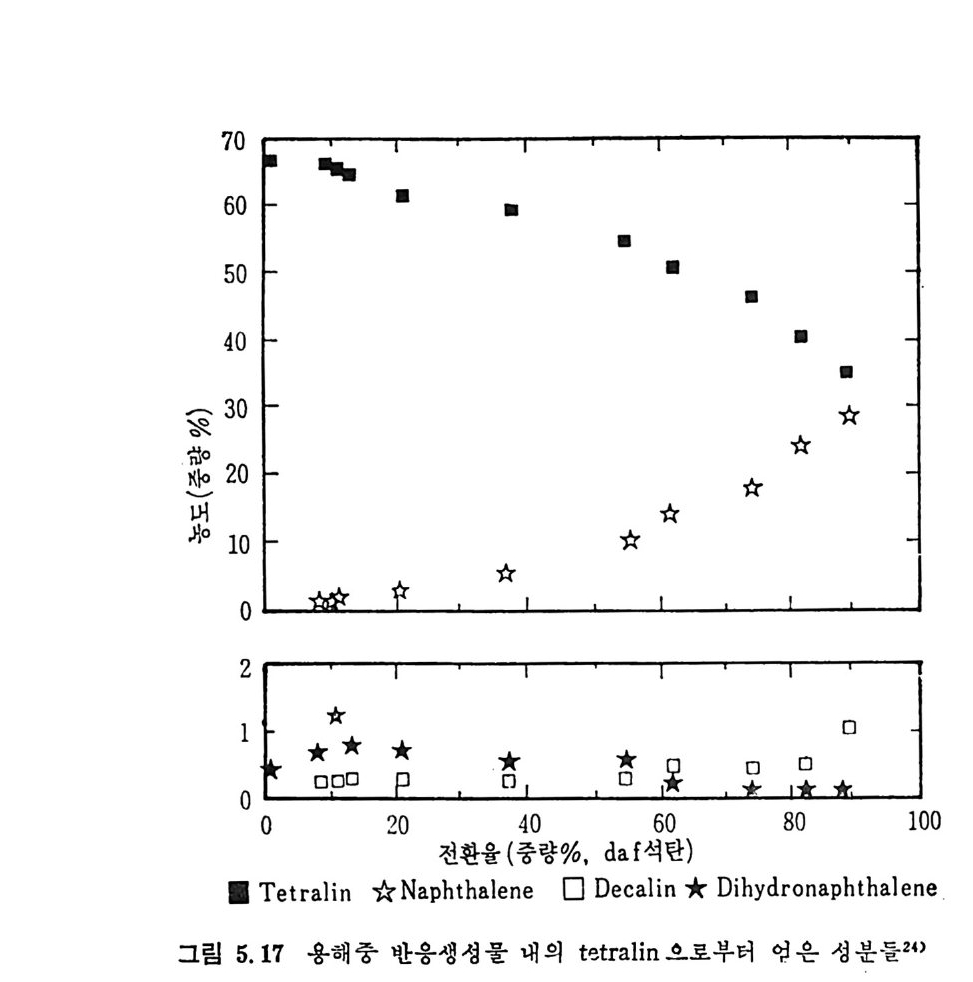 70 ... •
70 ... •
옹뮬식이다. 겅dx =K1-Kbx (5. 6) 여기서 x 는 석탄의 전환분율, t는 반응시간, K t와 K i는 전진 및 후 전반응 성수이다. 석탄의 유기물질의 용해를 석탄과 용매에 대하여 1 차반응으로 가정 하고 tet r a lin 으로부터 석 탄으로의 수소전달을 2 차반응으로 가정하여 Hill 등 35) 은 반응속도식을 다음과 같이 제 안하였 다. 움 =K1(a-x) +Kla-x) (b-x) (5. 7)
여기서 a 와 b 는 석탄과 t e t ral i n 의 초기 농도이며, K1 은 연속적인 화학반응의 평군반응률 상수이다. 반응 초기의 반응물질은 석탄기공에 들어간 액체이며, 이를 녹이 기 위해서는낮은활성화에너지가 팔요하나 나머지 석탄을 녹이기 위 해서는 화학 결합이 분해하여야 하므로 많은 활성화 에너지가 필요하 다. 그러므로 이 연속적인 반응을 다음과 같이 제안하였다. K1 석Rl탄+ +용용매매 — 一'-:> __R_ 2'.+_L>R21++GL12+ G1 K2 R2+ 용매 一K2 _ :>R3+L3+G3 ; Kn R 국용매 __> Rn+)+Ln+ J+ Gn+J (5. 8) 여기서 R, 는 고체석탄 잔류문이고 L i는 용액의 추출물이며, G, · 논 기 제 산물이 고 K1>K2>K3… … >Kn 이 다. 초기 용해공정에서 처음 반응 K 려 주반응이다가 반응이 진행되면 서 주반응이 차례로 바뀌어서 진행된다고 본다. 이 가정윤 근거로 1 차 반응률식에 변화하는 반응상수 Kv 를 도입하 여서 표시하면 아태와 같다. 겅dx =Kv(I-x) (5. 9) 여기서 Kv 는 전환울 x 에 직선적으로 변화하므로 Kv=C1-C2 x=K 。 (1-ax) (5. 10) 로 표시되므로 석 (5. 9) 는 식 (5.11) 이 된다. · ddxt:_ =K0(1-ax) (1-x) (5. 11) 여기서 a 는 최대 가능 전환율의 역수이다. 그러므로 식 (5.11) 은 식 (5.12) 가 된다. ?dfx- =K (x,.-x)(I-x) (5. 12)
그러므로 의사(p seudo) 2 차 반응룹석윤 얻게 된다. 식 (5.12) 는 높은 전환율을 제 외 하고는 전환윤을 잘 표현하며 높은 전환율은 1 차 반응률 식 표현에 더 찰 적용된다. ’ 용해되지 않은 고체 유기물과 석탄/용매 비로써 석탄 용해율윤 나 타내는 실험식을 Wen 과 Han 이 36) 제시하였다. 반응문식은 다음과 같다. ddxt =r= KC,.(1-x)yC (5. 13) 여기서 x 는 전환율로서 용해된 고체 유기문 · 운 초기 석탄의 고체 유 기물로 나눈 값이며 r 은 용해울, K 는 반응뮬 상수, c,o 는 초기 석 란의 유기질 무거 1 분율, CIS 는 석탄/용매 비이다. 식 (5. 13) 을 적분하면 식 (5. 14) 가 되고 l(1-x)=-Ko (5. 14) 여기서 O 는 회분식 반응기에 대하여는 O=C,.(t/C ao) (C/S) 가 되고 p lu g흐름 반응기에서는 8= C,0 ( V/F) (C/S) 가 된다. 여기서 Cao 는 무회분 석탄의 농도, g /cm3 이고 t는 반응시 간, V 는 p lu g흐름 반응기 체적, 그리고 F 는 고체 유기물의 질량유 량이다. 반응속도 상수 K 가 수소분압의 지수함수라고 가정하여서 실험결 과를 대입한 결과 다음과 같이 표현되었다. K=K。 exp ( -E/RT)exp (O . 000684 PH,) (5. 15) 상기 식 (5.14) 와 (5.15) 를 이용하여 계산한 전환울 X 와 실험치는 찰 일치하였고(그림 5.18), 활성화 에너지 E 값은 회분식 반응기에서는 11 Kcal/ mo l 이 고 plu g 흐름 반응기 에 서 는 4. 5 Kcal/mol 이 었 다. 석탄 액화과정을 Weller 등 37-40) 은 asph alt en e 추출분율로 설명하였 다. 죽 석탄이 연료오일로 전환되는 중간체가 as p hal t enes 이라고 (coal 一K1 ~ as ph alt enes ―K2 ➔ o il) 하었으나 이 는 전환공정 을 너 무 단순화
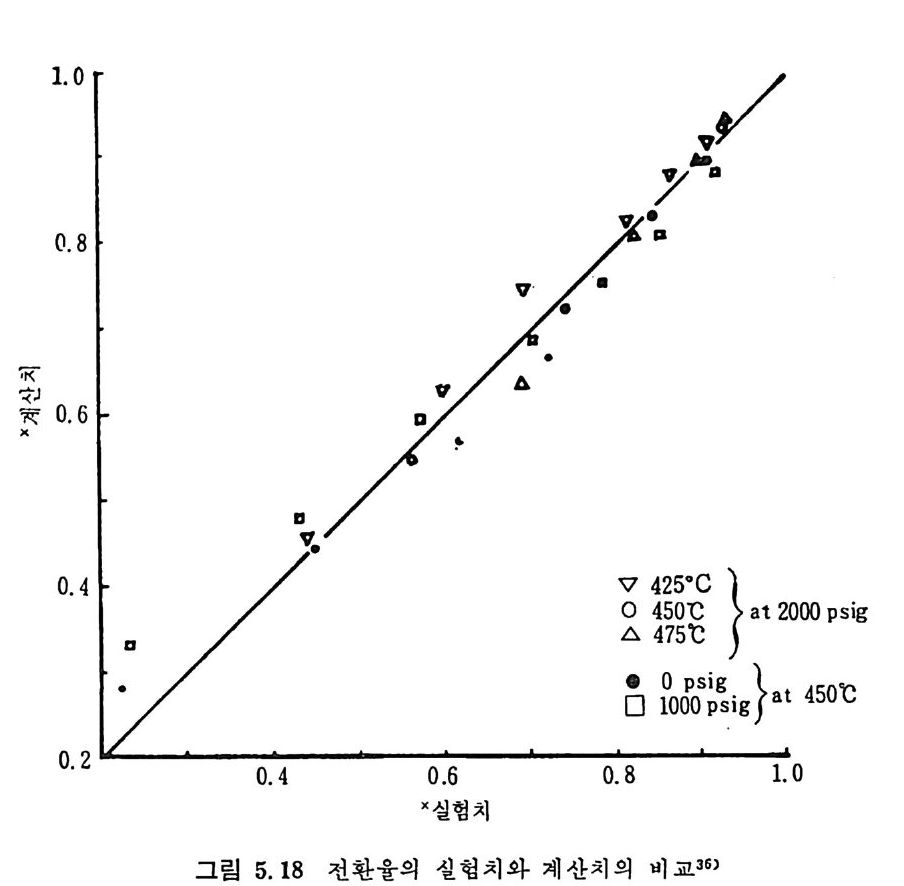 1. 0
1. 0
한 것으로 생각된다. 석탄전환율과 그 때의 조성과의 관계를 그립 5.19 에 도시하였다• 여기서 보듯이 처음에 as p hal t ene 의 생성이 급 격 히 증가하다가 최 대접을 보이 고 전환율 증가에 따라 감소한다. 상기 한 석 탄 전환과정 을 Lieb enberg 와 Po tgi e t er41) 는 아래 와 같이 좀더 복잡한 전환단계로 설명하였다. coal —K1> as p h. al. t. enes 一K2 o i l coal —K3> asph a lte n es (5. 16) K4 coal 一> o il 또한 Yoshid a 등 42) 은 다음과 같은 반웅 메카니즘으로 석 탄 액 화과정
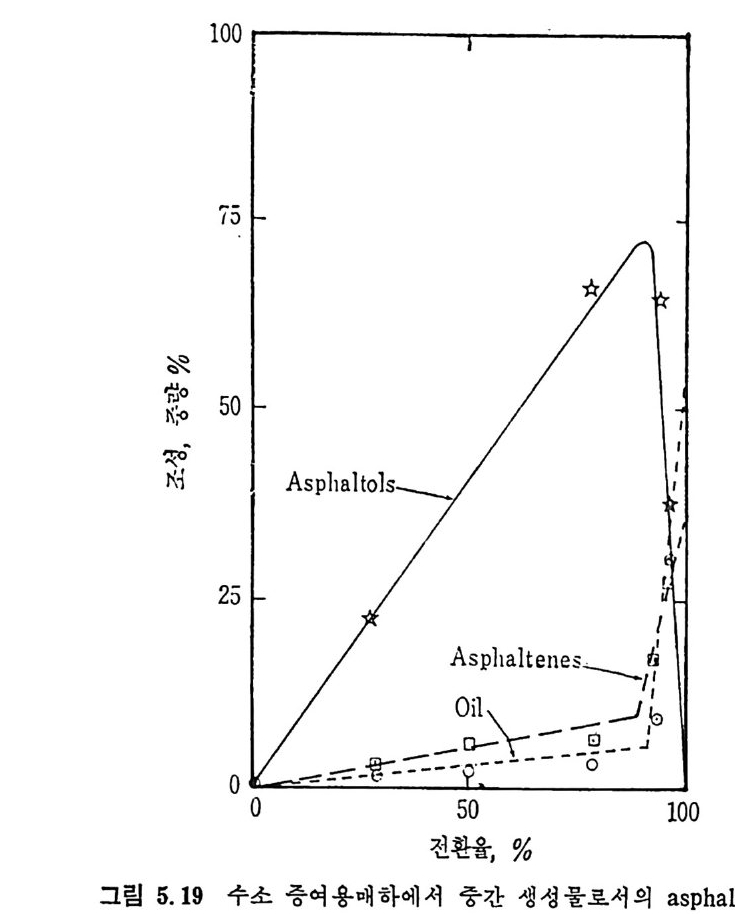 100
100
울 제시하여서 400°>C 에<서 1 차 반응을 가정하여 실험결과와 찰 일치 한다고하였다c。 . a Asiip · 1 O alt en e KI , 。ii (5. 17) 여 러 연구결과는 석 탄의 asph alt en e 의 전환은 매 우 빠르고 asph al- ten e 으로부터 oil 의 전환은 매우 느린 반응이 라고 발표하였다. 죽 석 탄이 asph alte n e 으로의 전환에 따른 분자량의 감소는 약한 화학적 결합의 분해로 이루어지는 반면 o il의 형성은 강한 C- C 결합이 분해
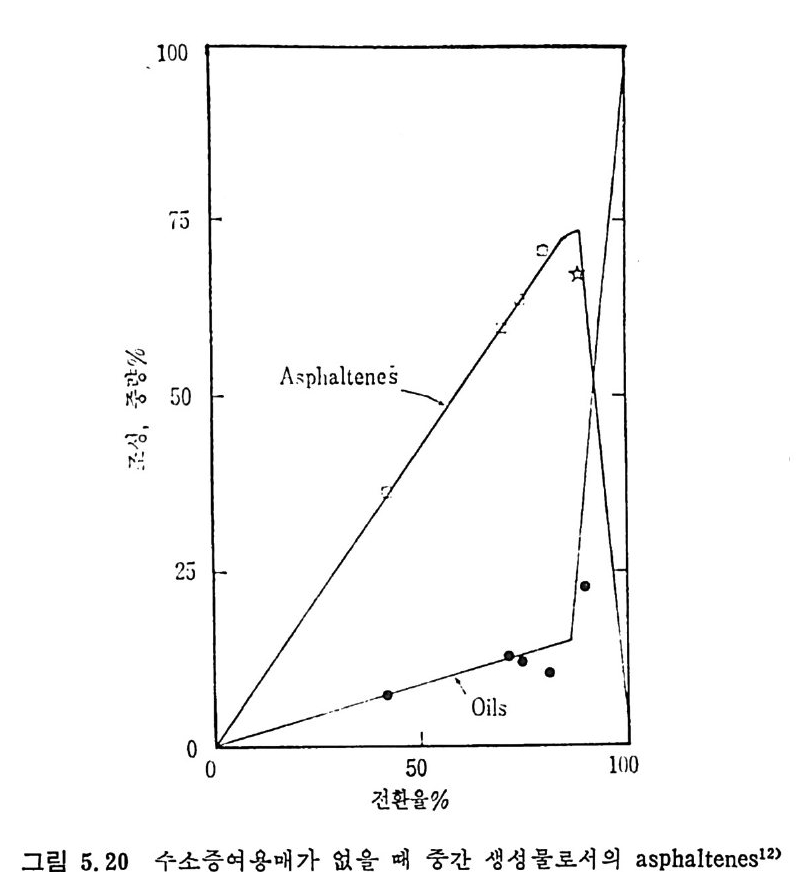 100
100
되어서 이루어진다. 석탄의 as p hal t ene 으로의 전환은 주로 열전달에 의하여 일어나는 열반응이고 반응성이 큰 자유라디칼은중합되거나 반응성아 큰 수소가 있으면 이 라디칼에 가하여쳐서 안정화된다. 죽 석탄으로부터 o il생 성 과Co정al 을— 더 세분,화 A하sp여 h a I표te n 시e 하<면 37:-3:8:)c 다 음과 같다. tive .\終多交 亡。z tun b1e Frag m ent IN, (5. lB) Oil
용매 정제석탄 (SRC) 내의 벤젠 비용해 물질의 성질을 연구하여서 수소증여용매가 있는 경우에는 석탄 ->as p hal t enes-+o il 변환과정에서 asph alte n es 대 신에 as p hal t ols( 표 5. 4) 가 형 성 되 었 다• 12) 그 결과륜 그림 5. 20 에 보여 주고 있 다. 여 기 서 보듯이 asph alto l s 는 전환율이 증 가함에 따라 급격히 증가하여서 전환율이 90% 이상이 되면서 급격 히 감소함과 동시에 oil 생성이 급격히 중가함을 알 수 있다. 5. 9 촉매 수소화 (Ca t al yti c Hy d rog e nati on ) 촉매 수소화공정은 5.3.2 절에 이미 기술하였다. 여기서는 축매의 목 성 및 촉매 수소화반응 특성을 다루고자 한다. 수소화반응에 촉매를 첨가하면 유황성분이 0.6% 이하인 석탄을 액화할 때 촉매 없이 반응할 때보다 수소 소바량이 감소하며 낮은 온 도에 서 같은 전환율을 얻을 수 있 고 가스와 asph a lte n es 의 생 성 은 감 소하고 중질유 생성은 증가한다. 그 반면 반응계가 복잡해지고 촉매 비용이 드는 단접이 있으나 선택성이 높은 촉매개발이 앞으로의 석탄 액화공정 개발의 중요 인자가 되고 있다. 석탄 액화공정에서의 촉매 활용은 석탄이 다중핵 방향족 물질로 이 루어처서 유황, 질소 및 산소를 함유하고 있으므로 이를 최소한의 수 소 소모와 최대한의 유황분을 제거하여서 액체연료를 얻는 데 있다고 하겠다. 초기에 독일에서 사용한 촉매는 철촉매이었고 석탄 수소화반 옹에 활성 이 큰 금속촉매 들은, Co, Ni, Mo, Sn 둥이 다. 석 탄의 수소화 및 수소화탈황 (h y drodesulfu r i za t: en) 반응에 여 러 가 지 입자촉매를 사용하여서 촉매의 활성을 시험하여 본 결과 수소화 및 탈황반응에 활성 이 제 일 큰 촉매는 alumi na 에 Co-Mo 를 S i li ca 로 지지한 촉매가 제일 활성이 크며 이 촉매의 조성은 3%Co0, I5%Mo03, 5%S i아 및 77% Al2 아이었다 .44) 또한 molybda t e 촉매가 유황분 제거 에는 최적 촉매로 표면적이 커야 하나 석탄을 액체연료로 전환하는 데는 tin촉매가 제일 좋고 촉매의 표면적이 커야 하는 것이 절대 요 소는 아니다. 석 탄 수소화반응을 tet r a li n 용 매 하에 서 수행 할 때 sta n nous chlorid e 촉매가 수소화반응을 증진시키나 t e t ra li n 을 수소화시켜서 수소증여
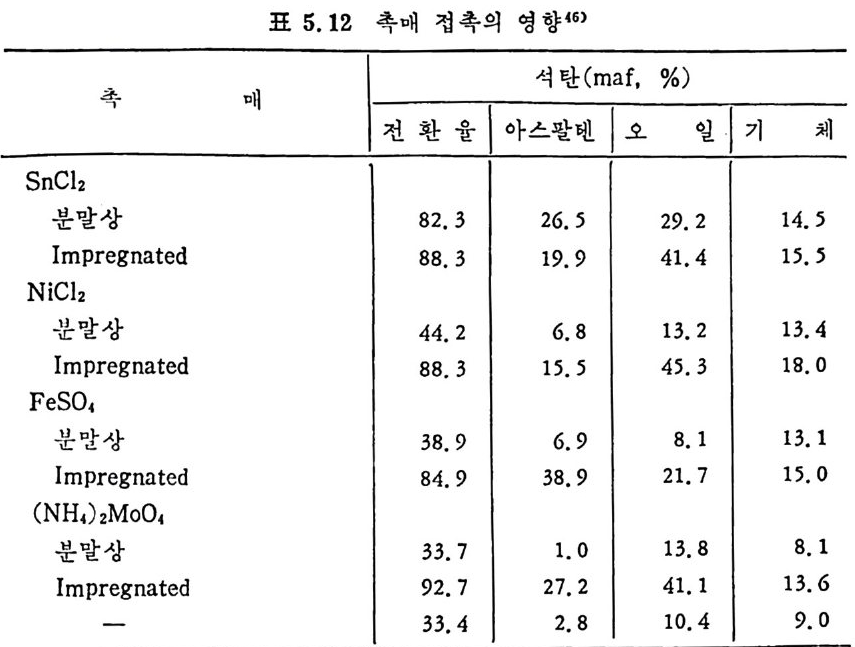 표 5.12 촉매 접촉의 영향 16)
표 5.12 촉매 접촉의 영향 16)
능력이 적은 decah y drona p h t alenes 으로 변화시키므로 수소증여 능 력 을 감소시 킨다. 45) 촉매와 반응물의 접 촉 또는 분포는 전체 반응률에 중요한 영 향을 미 찬다. 그러 므로 석 탄반응물에 촉매 를 담지 (i m p re g na ti on) 시 키 는 것이 가장 좋은 접촉반응이고 용매 없이 촉매와 석탄을 기계적으로 혼합하는 것이 가장 좋지 않은 접촉방법이다. 고휘발분 역청란을 450°C, I,OOOp si 압력하에서 용매를 가하지 않고 반응시킨 결과를 표 5.12 에 보여주고 있다. 여기서 전환율 (convers i on) 은 벤젠에 용해되는 물질과 가스생성물로 정의한 것이다. 석탄에 촉 매를 담지한 경우의 전환율이, 하지 않는 경우보다 훨씬 큰 것을 알 수 있으나 SnCl2 경우에는 그 영향이 크지 않았다. 석탄내의 회분성분 중의 금속성분들이 석탄 액화반응시 촉매여할을 하는 것은 석탄 가스화 경우와 마찬가지이다 .47) 석탄의 금속성분은 용매의 수소화를 증진시키는 촉매역할을 한다. 그러므로 이 금속성분들의 촉매역할은 수소증여용매와 석탄간의 수 소전달물을 증가시키 는 간접 촉매 역 할이 다. 48) 여 러 가지 금속성분과
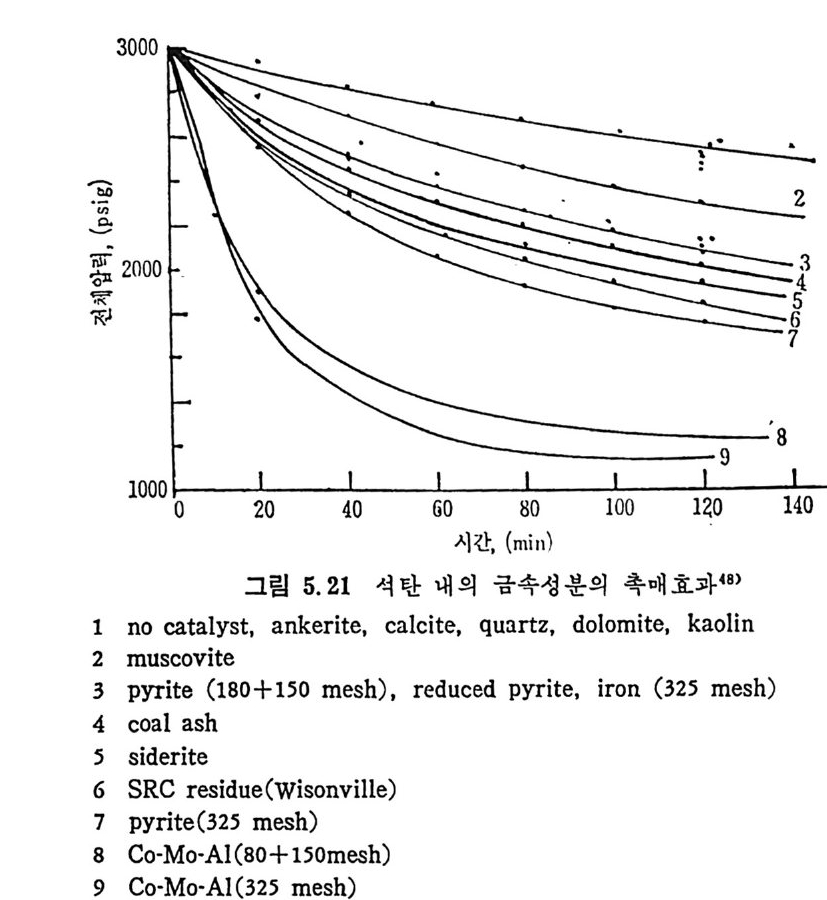 3000
3000
creosote 油를 425°C, 3, OOOp si g 수소압력 하에 서 반응시 켜 서 촉매 의 활 성도를 반응 중의 압력강하로 나타낸 것을 그립 5.21 에 도시하였다. 그립에서 보듯이 촉매가 없을 때가 활성이 제일 작고 Co-Mo-Al 촉 매가 제일 활성이 크게 나타났다. 또한 석 탄 내 의 금속성 분 중의 iro n 과 tit an i um49) 이 수소화반응에 촉매 역 할을 하며 (그림 5. 22) 전체 금속성분의 양이 증가함에 따라 전 환율(벤젠에 비용해물질)은 중가하였다(그립 5.23). 석탄 액화반응에 사용되는 촉매의 농도가 전환율에 미치는 영향을 여러 연구자들이 연구하였다. 용매를 사용하지 않은 조건에서 역청란 올 450°C, 1, OOOp s ig 수소압력 하에 서 tin 촉매 를 사용하여 서 1 시 간 동 안 반웅시켰을 때와(그림 5. 24) 같은 온도, 압력하에서 고휘발분 역
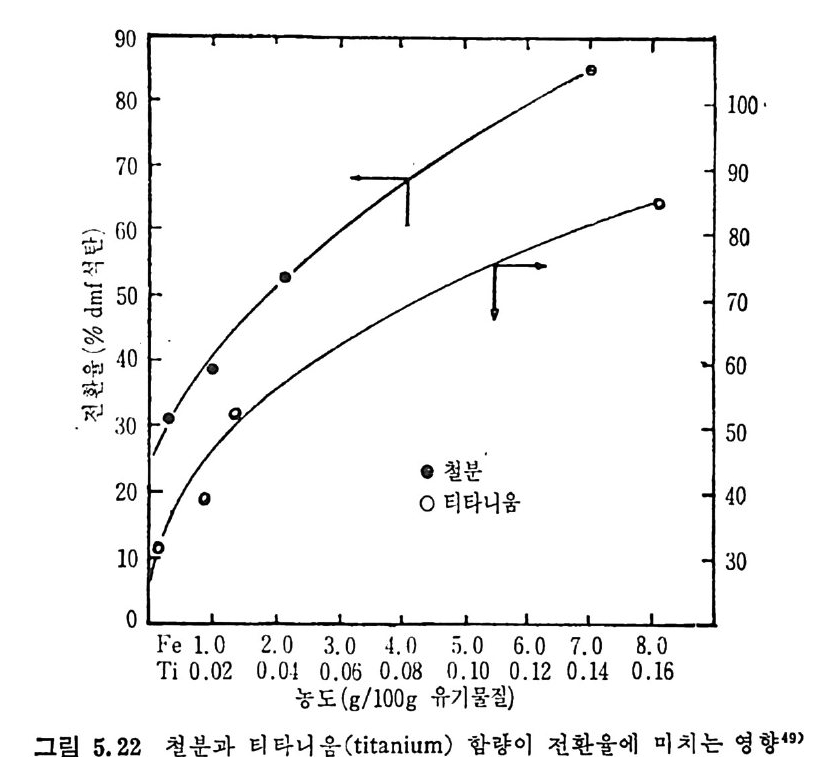 90
90
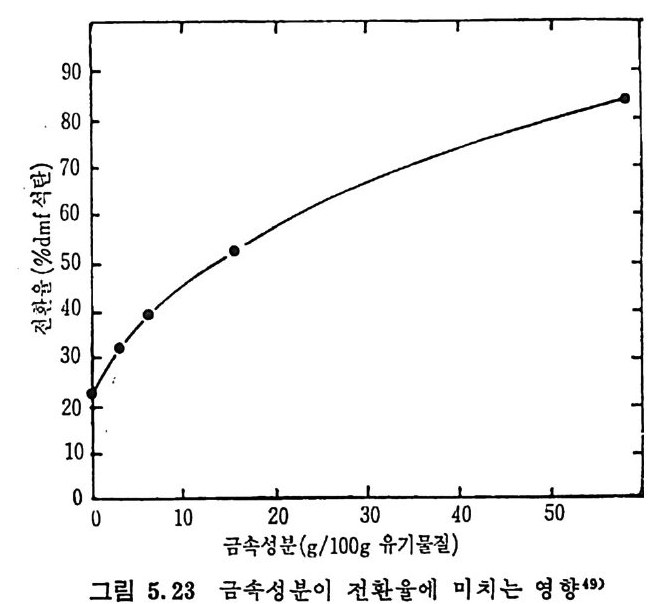 90807060504030
90807060504030
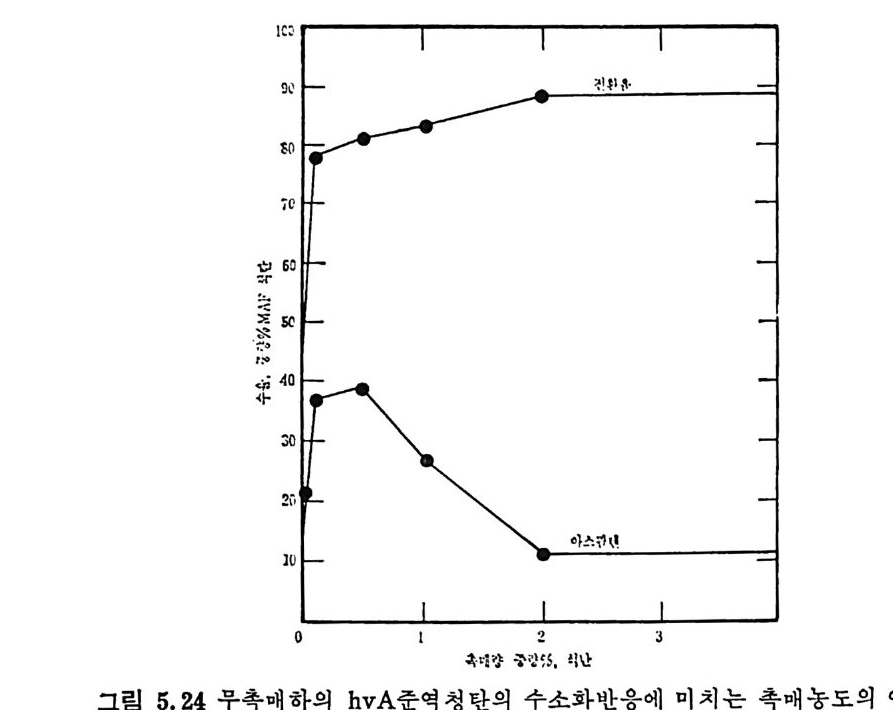 Ic:i
Ic:i
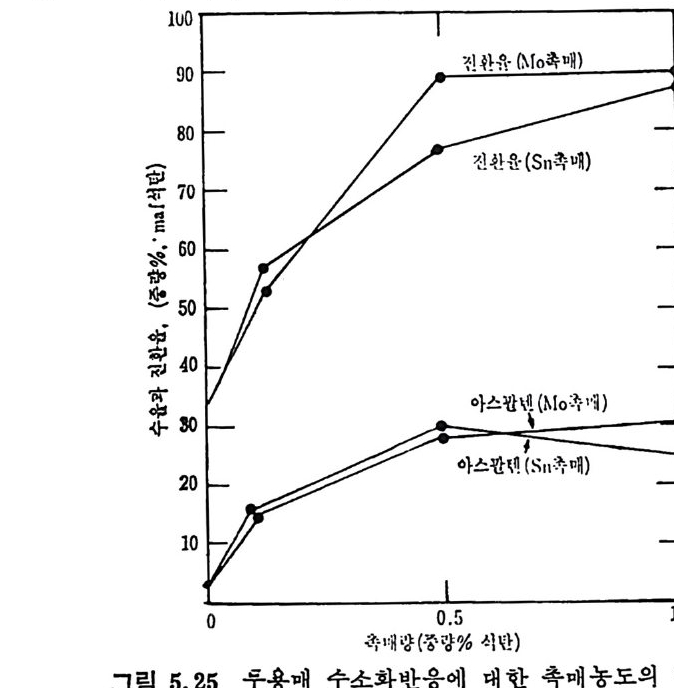 lUO
lUO
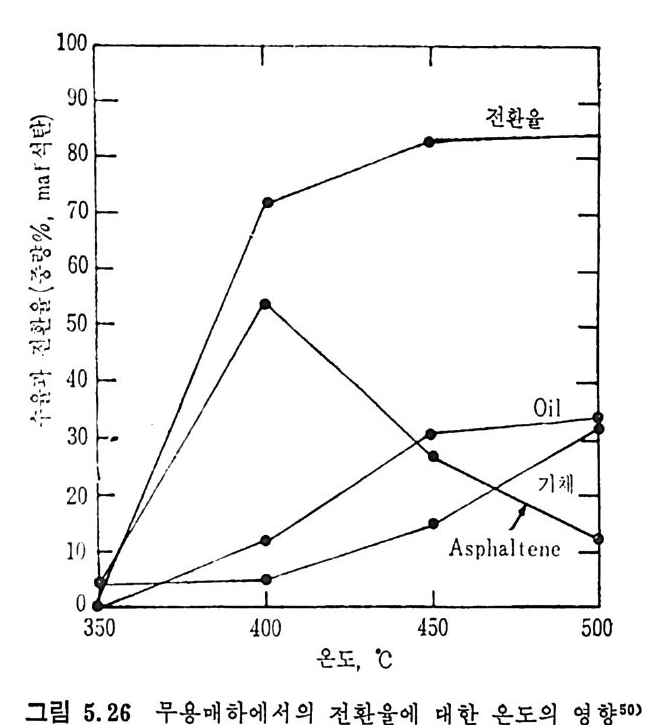 100
100
청란을 액화시킨 경우를 그림 5.25 에 보여주고 있다. 고휘발분 역청란을 용매를 사용치 않고 1% 의 ti n 촉매하에서 수소 압력 이 1, ooop si g 로 유지하고 온도를 변화하면서 수소화반응하여 서 온도가 전환율에 미치는 영향을 그립 5.26 에 도시하였다. 온도가 증 가함에 따라 벤젠에 용해되는 양을 근거로 한 전환율은 증가하나 반 웅온도가 450~500°c 법위에서의 전환울 증가는 없는 반떤 원치 않 는 가스생성은 증가한다 .50) 또한 고정충 반응기에서 고휘발분 역청란 에 고온에서의 t ar 를 용매로 사용하여서 Co-Mo 촉매하에서 액화할 때 반응온도가 전환울에 미치는 영향을 그립 5.27 에 보여주고 있다. 온도를 450°c 에서 470°C 로 증가시키면 전환율은 감소하여서 oil 생 성은 감소하며 액체 생성물 내의 S 와 N 은 증가한다. 또한 반응시간 이 너무 길어지면 액체 생성물이 다시 열분해하여서 가스나 좌를 생 성하여 수울을 감소시킨다. 그러나 반웅시간과 반웅온도를 증가시 키 면 asph alte n e 함량은 감소하고 수소의 소모는 증가한다. 단지 반웅 시간과 온도가 증가하면 0~ 상의 유황함량이 감소하고 접도가 감소하
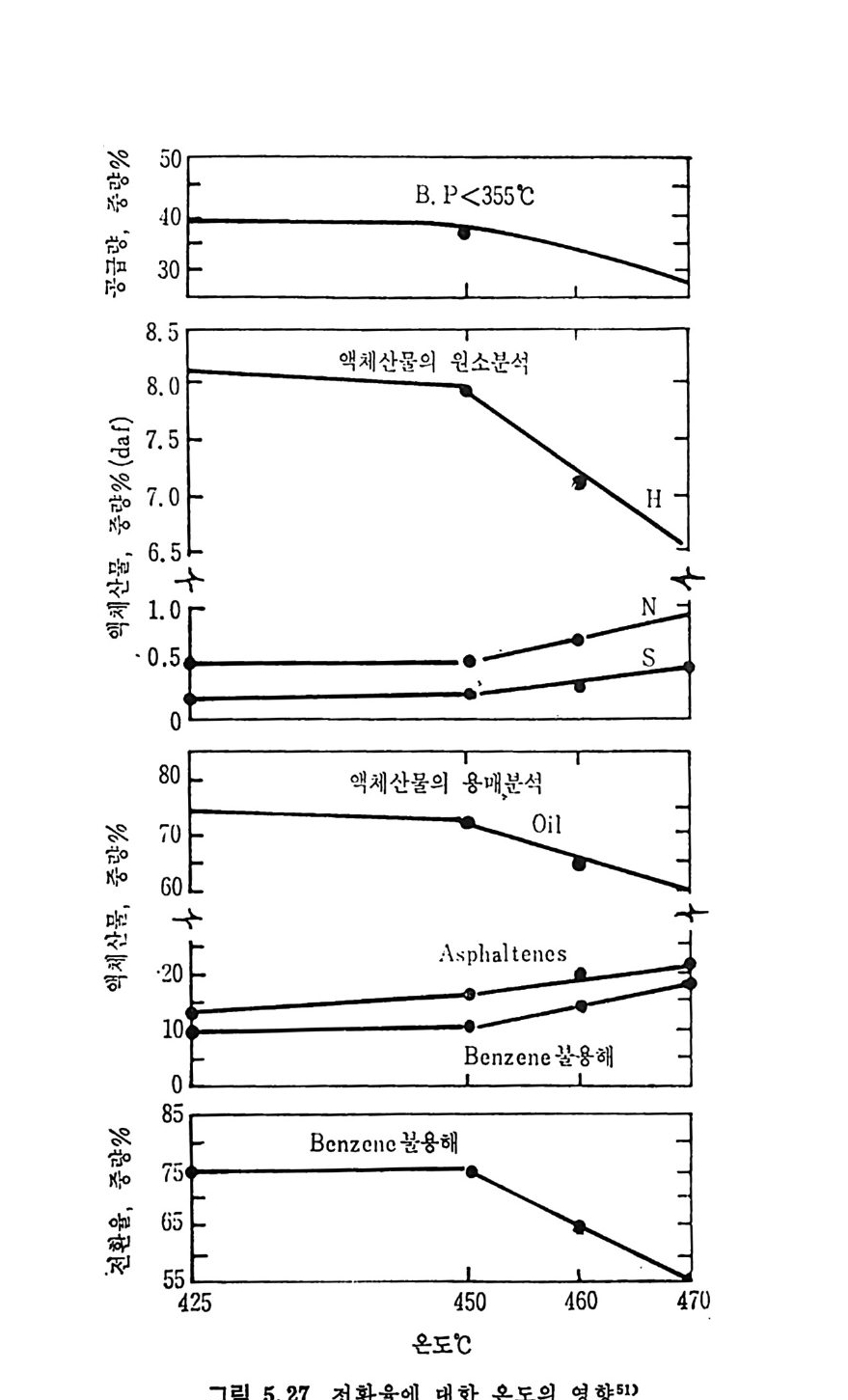 agf홍 50-4-0-3-0- l B\
agf홍 50-4-0-3-0- l B\
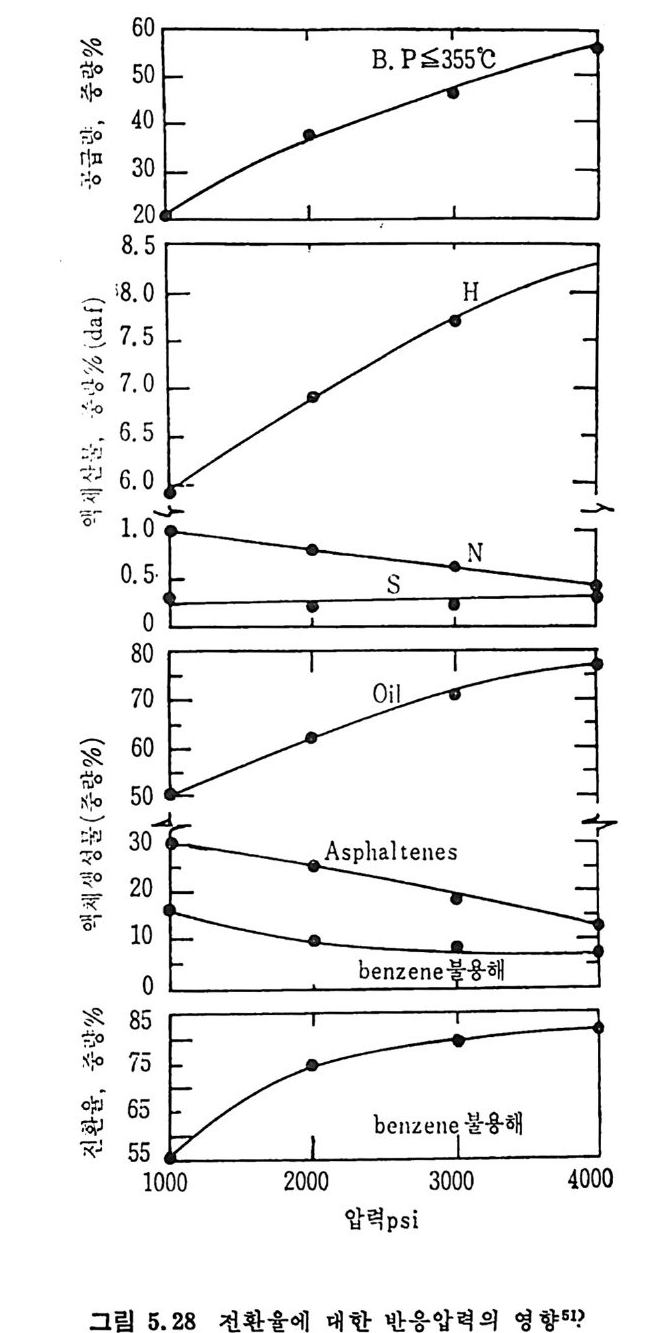 60
60
는 것 이 장접 이 다. 그 반면 수소의 소모가 크고 수울은 감소한다. 52) 석탄수소화 반응은 열역학적으로 압력이 증가하면 반응률이 증가한 다. 수소가 효울적으로 반응하기 위해서는 수소가 액상에 먼저 녹아 야 한다. 죽 Henry 의 법 칙 에 따라서 수소분압이 높아야 용해가 찰 아루어진다. 그러므로 수소분압이 증가할수록 액화반응률은 증가한다 고 할 수 있다. 또한 수소분압이 높으면 원하지 않는 coke 나 기체 형성을 처해할 분만 아니타 반응시간을 단축시키며 높은 온도에서의 열분해도 처지시키는 효과가 있다. 앞의 실험조건 61) 에서 온도를 425°C 로 유지하고 수소분압을 변화시켜, 압력이 전환율에 미치는 영향 을 실험하여서 그 결과를 그림 5.28 에 보여주고 있다 .51) 여기서 보 듯이 압력을 2,000 에서 4,OOO p s ig로 증가시켰을 때 벤젠에 바용해 물 질을 근거로 한 전환율은 겨우 5% 증가하였으나 엑체산물 내의 수 소함량과 oil 생성량의 증가는 매우 크다. 이제까지 제한된 실험결 과로서 조업변수가 전환율에 미치는 영향을 살펴보았다. 그러나 석탄 액 화반응은 석 탄, 용매 , 수소가스 및 촉매 가 함유된 4 가지 상의 혼합 물이 고온, 고압하에서 일어나는 매우 복잡한 반응계이고, 정립된 반응 메카니즘이 없는 상황이므로 이에 대한 앞으로의 많은 연구가 팔요하다고 하겠다. 참고문런 1) Mi lls, G. A. , Ind. Eng . Chem, 61, 6 (1969). 2) Ste r nberg, H. W. , Ray m ond, R. and Schweig h ardt, F. K. , Scie n ce, 188, 49 (1975). 3) Lee, E. S. , Chap ter 5 in Coal Conversio n Technolog y, C. Y. Wen and E. S. Lee Ed. , Addit ion -Wesley, Read i떄, Mass. , (1979). 4) Probste in , R. F. and Hick s, R. E. , Chap ter 6 in Sy n th e ti c F11e/s, McGraw-Hi ll, New York, (1982). 5) Mi tch ell, W. N. , Trachte , K. L. and Zaczepi ns ki, S. , Ind. Eng . Chem. Prod. Res. Dev. , 18, 311 (1979). 6) Ep pe rly, W. R. and Taunto n , J. , Coal Conversio n Technolog y, A. H. Pelofs k y Ed. , ACS Sy m p . Ser. 110, ACS, Washin gton , D. C. , (1979). 7) Ep pe rly, W. R. and Wade, D. T. , Prep ri n ts , AM-80039, Nat' 1
Pi! tr o leum Refi ne ry Assoc. Ann. Meeti ng , New Orleans, March, ( 1980) . 8) Nowa ck i, P. , Coal Liqu ef a c ti on Processes, Noy es Data Corp. , Park Rid g e, N. J. (19 79) . 9) Sto t l e r, H. H. and Schutt er , R. T. , Coal Processin g Technolog y, Vol. V. 73, AICHE, New York, (1979). 10) McCray, F. L. , McCl int o c k, N. and Bloom, R. , Jr. , Coal Proce· ssin g Technolog y, Vol. V, 156, AICHE, New York, (1979). 11) Ste r n b~rg, H. W . , Prep ri n t s , Am. Chem. Soc. , Di v. Fuel Che m . , 21, 7, 1 (1976). 12) Farcasiu , M. , Mi tch ell, T. 0. and Whit eh urst, D. D. , Prepr i n t s , Am. Chem. Soc. , Di v. Fuel Chem. , 21, 7, 11 (1976). 13) Dry, M. E. , Ind. Eng . Chem. Prod. Res. Dev. , 15, 282 (1974). 14) Pi the r , H. , Advances in Cata l ys i s , Vol. 4, 271, Academi c Press, New York, (19 52) . 15) Sto r ch, H. H. , Ch:i pt~r 39 in Chemi st r y of Coal Ut iliz a ti on , Vol. II . H. H. Lowry Ed. , Joh n Wi ley & Sons, New York, (1945). 16) Sto r ch H. H. , Golumbic , N. and Anderson, R. B. , The Fi sc her Trop sc lz and Relate d Sy n th e sis , W ile y & Sons, New York, (1951) . 17) Probste i n , R. F. and Gold, H. , Wate r in Sy n th e ti c F uel Producti on , MIT Press, Cambrid g e, Mass, (19 78) . _1 8) Meis e l, S. L. , McCulloug h , J. P. , Lechth a ler, C. H. and Weis z , P. B. , Chemt ec h, Feb. , 86, (19 76) . 19) Ch1ng , C. D. , Kuo, J. C. W. , Lan g, W. H. Jac ob, S. M. , Wi se , S. J. and Sil v erstr i , A. J. , Ind. Eng , Chem. Process Dzs. Dev. , 17, 255 (1978). 20) Fis h er, C. H. , Sp ru nk, G. C, . Eis n er, A. , O'Dennell, H. J. , Clarke, L. and Sto r ch, H. H. , Hy d rog e nati on and Liq u efa c ti on of Coal, Part 2 ; Eff ec t of Petr o g ra p h ic Comp o sit ion and Rank of Coal U. S. Bur. Mi ne s Tech. Pape r 642, (1942). 21) Gi ve n, P. H. , Cronauer, D. C. , Sp ac kman, W. , Lovell, H. L. Davis , A. and Bis w as, B. , Fuel, 54, 34 and 40 (1975). 22) D3 .Vis, A. , Sp ac km3 .n , W. and Gi ve n, P. H. , Energy Source, 3, 55 (1976). 23) Mi tch ell, G. D. , Davis , A. and Sp a ckman, W. , Prepr in t ~ . Am. Chem. Soc. Di v. Fuel Chem. , 21, 5, 189 (1976). 24) Neavel, R. C. , Fuel, 55, 237,.( 1 976). 25) vari Krevelen, D. W. , Coal, Elsevie r , New York, (1961).
26) Giv e n, P. H. , Fuel, 39, 147 (1960). 27) Wender, I. , Prep ri n t s , Am. Clt em . Soc. Di v. Fuel Chem. , 20, 4, 16 (1975). 28) Oele, A. P. , Wate r man, H. I. , Goedkoop , M. L. and Van Kreve· len, D. W. , Fuel, 30, 169 (1951). 29) Pott , A. and Broche, H. , Fuel, 13, 91 (1934). 30) Orchin , M. and Sto r ch, H. H. , Ind. Chem. E11g . , 40, 1385 (1948) . 31) An ge lovic h , J. M. , Pasto r , G. R. and Sil ve r, H. F. , Ind. Eng . Chem. Process Des. Dev. , 9, 106 (19 70). 32) Guin , J. A. , Tarrer, A. R. , Tay lo r, Z. L. and Green, S. C. , Prepr i n t s , Am. Chem. Soc. , Di v. Fuel Clt em , 20, 1, 66 (1975). 33) Curran, G. P. , Str u ck, R. T. and Gorin , E. , I11d. Chem. E11g . Process Des. Dev. , 6, 166 (1967). 34) Whit eh urst, D. D. and Mi tch ell, T. 0. , Prepr in t s , Am. Chem. Soc. Di v. , Fuel Clt em . , 21, 5, 127 (1976). 35) Hil l, G. R. , Harir i, H. , Reed, R. I. and Anderson, L. L. , Coal Scie n ce, Adv. in Clt em sit ry Ser. 55, 427, ACS, Washin g ton , D. C. (1966). 36) Wen, C. Y. , and Han, K. W. , Prep r in t s , Am. Chem. Soc. Di v. Fuel Chem. , 20, 1216 (1975). 37) Weller, S. W. , Cata l ys i s in tile Liq u id Phase Hy d rog e nati on of Coal and Tar, in Cata l ys is Vol. N. P. H. Emmett Ed. , Rein h old, New York, (1956). 38) Weller, S. , Clark, E. L. and Peli pe tz , M. G. , Ind. Eng . Chem. 42, 334 (1950). 39) Weller, S. and Pelip e tz , M. G. , Ind. Chem. Eng . , 43, 1243 (1951). 40) Weller, S. , Peli pitz, M. G. and Frie d man, S. , Ind. Eng . Chem. , 43, 1572, 1575 (1951 ). 41) Lie b in berg, B. J. and Potg iet e r , H. G. , Fuel, 52, 130 (1973). 42) Yoshid a , R. , Maekawa, Y. , Ishii , T and Takeya , G. , Fuel, 55, 337 (1976). 43) Ste r nberg, H. W. , Raym ond, R. , ancl Schweig h ardt, F. K. , Pap e r PreSente d at Am~ric a n Ch~mi ca l S:>c iet y , Di v. of Petr o leum Che- mi st r y , Chic a .g o , Aug us t, ll975). 44) K11 .w a, W. , Frie d m:i .n , S. , Wu, W. R. K. , Frank, L. V. and Yavorsky , P. M. , Prepr i n t s , Am. Clzem. Soc. Di v. Fuel Chem. , 19, 1, 192 (1974).
45) Potg iet e r , H. G. J. , F11el, 52, 134 (1973). 46) Wu, W. R. K. , and Sto r ch, H. H. , U. S. Bur. Mi ne s Bu::. , 65S, (1968) . 47) Wrig h t, C. H. and Severson, D. E. , Prepr i n t s . Am. Chem. Soc. Di v. Fuel Chem. , 16, 2, 68 (1972), 48) Tarrer. A. R. , Guin , J. A. , Pit ts, W. S. , Henley, J. P. , Prath er, J. W. and Sty le s, G. A. , Prep ri n t s , Am. Chem. Soc. Di v. Fuel Chem. , 21, 5, 59 (1976) . 49) Mukherje e , D. K. and Chowdhury, J. B. , Fuel, 55, 4 (1976). 50) Hawk, C. 0. and Hites hue, R. W. , U. S. Bur. Mi ne s Bull, 622, (19 65) . 51) Akhta r , S. , Frie d man, S. and Hites hue, R. W. , Prepr i n t s , Am. Chem. Soc. Di v. Fuel Chem. , 14, 4, 27 (1970). 52) Fu, Y. C. and Batc h elder, R. F. , Prepr i n t s , Am. Chem. Soc. Di v. Fuel Chem. , 21, 5, 78 (1976).
색인
기 간접 액 화 Indir e ct liqu efa c ti on 276- 82 겨 자 발화 Grate firi n g 114, 119-24 설계 식 141-2 석 탄공급방법 120-24 고연 량 Hig h Btu 가스 정 제 252-4 렉 티 졸 Recti so l 공정 254 벤팔드 Benfi el d 공정 254 실 렉 송 Selexol 공정 254 고정충 가스화반웅기 227-30 연소로 114-7, 119-24 고체 충 Solid bed 연 소모델 156-62 공업 분석 Proxim ate analys i s 13:.5 구탈 Gouta l 식 18-9 E: 만일입자연소 I 요 -4 듀레인 Durain 12 듀롱 Dulong 의 법 칙 I7 등온흡착법 27-8 E2 멕 티 졸 Recti so l 공정 254 루르기 Lurgi 가스화반웅기 229-30, 239-43,277-8 리 그닌 Lig n in 11-2 口 마세 알 Maceral 12, 28·2 - 5 마세랄분류 I2 메 탄화반응 Meth anati on 206-7, 253-5 모빌 Mobil 공정 279-82
미 반응중십 수축모델 Unreacte d shri· nkin g core model 94, 96 미 분란 Pulveriz e d coal 연소모델 I86-9I 밀도 28-30 1:1 바이 -가스 Bi- G as 249-50 반웅속도식 Rate exp r essio n 체 적 반옹 Volumetr i c reacti on 62-55,95 표면 반응 Surfa c e reacti on 65 반응열 Heat of reacti on 산소-흑연 203 수성 가스 전환반웅 Wate r -ga s shif t reacti on 208 수소가스화반응 205-6 수증기 -흑연 203-4 이 산화탄소를 이 용한 메 탄화 204 이 산화탄소-흑연 204 일산화탄소를 이용한 메탄화 206 반웅의 자유에 너 지 Free energy 수성가스 전환반웅 208 수소가스화 반응 205-6 수증기 -흑연 203-4 이 산화탄소-흑연 204 일 산화탄소를 이 용한 메 탄화 206 반흐름 반응기 Semi flow reacto r 7I-3 발라스트 베 드 Balaste d bed 127 발전 Power ge nerati on 개 방사이 클 Op en cy cl e 247 열 병 합 Combin e d cy cl e 247-8 벤필드 Benfi eld 공정 254 볼밀 시 험 Ball mi ll tes t 34 부드아르 Boudouard 반웅 254-5
분란연소 186-8 불꽃 버 너 Flare burner 131-2 비 극성 용해 도지 수 Nonp o lar solubil i· ty par amete r 291 비 말동반연 소 Entr a in e d firi n g sys · ter n II4-7, 129-35 바 말동반 흐름 반응기 233-4 人 사이 클론 버 너 Cy cl one burner 133 -5 사졸 Sasol 푼랜트 262, 277-9 석탄 가소성 Plasti city 33 가열시 목성 31-3 강도 34-5 고정 탄소 fixe d carbon 15 구조 str u ctu re 144-8, 286-7 근원 orig in II-2 금속성 분 mi ne ral matt er 19-20 기 계 쳐 성 질 mechanic a l pro p er - ty 33-5 기 공도 por osit y 23-6 내부표면적 27-30 발열 량 calorif ic value 17-9 분류 20-l 분쇄 도 gri n d abil it y 33-4 생성 11-2 수분합유량 mois t u r e conte n t 13-4 수소/탄소 원소비 197-8 연소시 독성 143~4 영국 국립석탄 협회 분류 21 원자 조성 ato m i c comp os it ion 262,264 정 결성 agg lo merati on 31
조성 consti tut i on 12-3, 144-8 조성 에 관한 2 성 분 가선 I44-8 취 약도 friab il it y 33 탄성 뮴 elasti ci t y 34-5 팽 창 dil a ti on 31-3 형성 for mati on Ix-2 회 분함 량 ash conte n t x 5 휘 발분 volati le matt er 14-5 석란가스화 기공복성 65-70 반웅개요 I97-8 반옹연 202-8 연공급 방식 237-9 연 화학 th ermochemi st r y 202-9 원리 I97-2 인-시 두 in- sit u 235-6 촉매 209, 217-22 화학평 형 I98-202 석 단가스화 반옹기 224-56 고정충 227-30 반응기재질 255-6 비 말동반충 233-5 열공급방법 237-9 유동충 230-2 석탄내 금속성분의 촉매 효과 액화 305-7 좌-가스반웅 70 석란액화 간접액화 276-2 광물조성 의 영 향 282-4 등급의 영 향 284-7 상업적 개발 26l-2 석 탄-용매 반응 290-4 압력의 영 향 3ll-2 액 화생 성 물분류 98-9 열 분해 pyro lys i s 274-5
용 매 의 성 질 287-90 용매 추출 공정 264-70 용매 추출 반응속도 294-304 정 도 deg re e 275-6 칙 접 엑 화 264-73 초기개발 261-2 촉매 농도의 영 향 306, 308-9 촉매 수소화 공정 270-3, 304 -I2 데 트라란 tet r a lin 전환 287-9, 291,295-300 석 탄조성 물의 티 l1 Thie s sen 분류 19 -20 석 탄/초}-수소반웅, 수소가스화 참조 수소가스화반응 71-9, 205, 222-4 수소액화 98 수소가스화공정 245 수증기 -가스전환반응 208, 217, 223 순영 Heat of wett ing 27 신탄 Sy n th ane 공정 217, 219-20 실 렉 송 Selexol 공정 254 。 아스판입l 1 Asph alte n e 275-6, 300-4 아스팔몰 Asp ha lto l 275-6, 304 아트리 터 스 At tri t us 289 안트라크실론 Anth r axy lo n 282, 289 언 발라스트 베 드 Unbalaste d bed 126-7 에 스알 -'I SRC 공정 265-70 에 치 -코올 H-Coal 공정 , 촉매 수소화 참조 연소강도 136-8, 142 열 분해 Py ro lys is 39-40, 42-60 급속열 본해 rap id pyr olys is 48- 55
순간연분해 flas h pyro lys is 55- 60 저 속열 분해 slow pyr olys is 44-8 연 분해 화학반흥공정 42 열 천평 Thermobalance 44 영 국표준팽 윤계 수 BSSI 40 윙 클러 Wi nk ler 공정 239, 246-7 이 그니플루이 드 I g n ifl u i d 보일러 x25 -6 이 동격 자 Traveli ng gra te 120 츠 자유라디 칼 메 카니 즘 Free radic a l mechanis m 292-4 자유팽 운 Free sw ellin g 31 자유팽 윤계 수 Free swell ing ind ex 31 저 열 량 Low Bt u 239-47 접 화밀도 Fi ri n g densit y 136-43 접 선 경 사 버 너 Tang e nti al corner fire d burnr 132-3 중열 량 Mediu m Btu 가스화 248-51 증여 용매 Donor sovent 291-4 직 접 액 화 Dir e ct liqu efa c ti on 264-73 질량접화밀도 Mass firin g densit y 137 大 촉매 수소화 270-3, 304-12 카 Char- 가스반응 62-5 좌-가스반응 활성 화에 너 지 94 좌-산소반웅 85-92, 95-6 카-수소반응 96, 71-5 좌~수증기 반웅 93-4, 96-7 좌 연소 X50~6, u2-3 물리져 모벨 150-3
반웅 153 반응속도식 153-6 좌-이 산화탄소반웅 80-5 = 코퍼 -토트젝 Kop pe r-Totz e k 245-7, 251 크라레 인 Clarain 12 쿨라우스 Claus 공정 254 E 탈수방법 255 탈휘 발화 Devolati liza ti on 165-7, 210-2
네 트라란 Tetr a li n 100-2 텍 사코 Texaco 공정 245-7 터 디 에치 TDH 124, 171-2 포 피 셔 Fis c her 분석 법 44 피셔 -트로프시 Fis c her-Trop sc h 공정 261, 278-9 근 휘발분연소 148-150 흡거정 윤방법 Sorpt ion swell ing tec hniq u e 35
김상돈 고려 대 학교 화학공학과 졸업 캐나다 웨스턴 온타리오대학교에서 석사 • 박사학위 취득 캐나다 맥매스터대학교 연구원, 미국 일리노이주 주립대학 에너지 자원연구소 연구원, 숭전대학고 교수, 캐나다 동력자원부 에너지연구소 초청연구원 논문 「석탄의 물리저 성질이 화학반응에 미치는 영향에 관한 연구」 의 40 여편 현재 한국과학기 술원 화학공학과 교수 석탄에너지 변환기술 -~86 년 2 월 1 일 찍음 ·-· 기 J 86 년 2 월 l5 일 퍼 냄 지은이 金相敦 퍼낸이 朴孟浩 펴낸곳 民音社 출판등록 I966. 5. I9 계 I-I42 호 우편대 체계 좌번호 010041-31-523282 IIO 서 울 종로구 관철동 44 의 l 734-4234 • 6no( 편집 부) 734-2000, 735-8524( 영 업부) * 파본은 바구어 드립니다. 값 6, 500 원
대 우학술총서 • 자 연과학 1 소립자와게이지상로삭용 숲鎭義 콜 /~13,600 원 2 動力學特論 李炳룻/값 5,400 원 3 질소고정 宋承達 著/값 2,800 원 4 相轉移와臨界現象 김두절 著 /~1 2,800 원 “劃媒作用 陳宗植 著/값 2,800 원 6 뫼스바우어分光學 玉恒南 著/길 2,800 원 7 극미량원소의 영양 昇正子 著 /~16,500 원 8 *慕 1 t틀繁와 有릎틀慕 1 t合物 尹能民 著 / ~1 5, 000 원 9 抗生物質의 全合成 姜錫久 著 /~19,000 원 10 국소적 형태의 A tiy ah-S inge『지표이론 지동묘 콥 / 값 2,800 원 11 Muco po ly sacchar i des 의 生 1 t릎 및 生物理릎 박준우 著 / ~1 3,800 원 12 ASTROPHYSICS ( 天體物理學 ) 洪承杓 著 / 값 4, 700 원 13 프로스타글란딘합성 숲賢旺 著 /~13 , 600 원 14 천연물화학연구법 禹源植 뭄/값 5,300 원 15 脂訪營養 숲淑喜 著 /~16,300 원 16 結晶化유리 金炳扇 뭄 /값 4,500 원 l`1
