 t기!l간- 츠: T°
t기!l간- 츠: T°  t기!l간- 츠: T°
t기!l간- 츠: T°
저자는 서 울 대 화 학 과 를 졸 업 하고 , 템 플 대 학교 에서 이 학 박사 학 위 를 획 득 했다 . 현재 이화여대 교 수 로 재 직 중 이며, 한국 화학연 구소 선임연 구 원 을 역임했다.
 Muco p ol y sacchar i des 의
Muco p ol y sacchar i des 의
 Muco p ol y sacchar i des 의
Muco p ol y sacchar i des 의
人1 문
이 책은 동물계에 널리 분포되어 있으며 독특한 구조적 특성을 갖는, mucop ol ys a ccharid e 로 총칭 되 는 일 련 의 다당류의 생 화학 및 생물리학에 관하여 기술하고 있다. 이 책의 저술은 대우재단의 〈기 초과학 분야 중에서 국내에서 연구활동이 미미한 분야의 단행본을 발간함으로써 국내 학계에 새로운 분야를 소개하고, 이의 연구기반 을 확충하는 사업〉의 일환으로 대우재단의 연구비 지원 하에서 수행 되었다. 우리 모두는 생명현상에 관련되는 생물고분자에는 단백질, 핵산 그리고 탄수화물이 있다는 것을 알고 있다. 분자의 구조와 상호작용 에서 궁극적으로 생명현상을 설명하려는 현대 생물학은 주로 단백 질과 핵산에만 관심이 집중되어온 느낌이다. 반면에, 탄수화물에 관한 연구는 이들의 구조가 단순하고 특정한 생물학적 기능이 확인 되지 않는 이유로 등한시되어 왔다. 그러나, 과거 10 수년 동안 탄 수화물, 특히 mucop o lys a ccharid e 에 큰 관십 이 주어 졌고 많은 연 구가 수행되었다. 이는 결합조직의 구성에 관한 홍미와, 이의 생물 학적인 의미를 규명하고자 하는 노력의 고조에서 기인된다. Muco- po lys a ccharid e 에 관한 연구의 진전에 따랴 이 다당류에 관한 많은 구조적 및 생물학적 기능에 관한 정보가 얻어졌으며, 이들은 새로 운 연구방향의 지침이 되기도 했다· 그러나, 아직도 이 분야에 관 한 우리의 이해는 극히 제한되어 있으며, 실험 결과에 대한 해석도날로 새로운 의미가 부여되고 있다. 이 책을 처술함에 있어서 처자는 내용의 균형에 노력하였다. 한 편으로는 mucop o lys acchari de 에 대한 전반적 인 연구결과를 종합하 여 이 다당류의 각종 목성을 제시하는 동시에, 아직 생물학적인 의 미가 부여되지 않은 다양한 연구내용울 기술함으로써 앞으로의 연 구방향의 지침이 되도록 노력하였다· 또한 현대 생물학 연구의 2 대 주류인 생화학과 생물리학의 균형에도 노력하였다. 처자는 생명 현상의 긍극적인 이해는 생물분자의 분자단위에서의 분자의 구조와 기능 및 분자간 상호작용의 상관관계의 규명에 있음을 믿고 있으며, 이를 반영코자 노력하였다. 이 책은 모두 9 장으로 구성되어 있다. 1 장에서 3 장까지는 전 반적인 개론과 화학적 구조에 대하여, 4 장과 5 장은 생화학적 측 면인 생합성과 대사물, 6 장과 7 장은 생물리학적 측면인 분자의 크기와 모양에 관한 연구결과를, 그리고 마지막 8 장과 9 장은 다 른 분자와의 상호작용을 기술하였다. 이 책의 많은 내용은 아직도계통적으로종합, 정리되어 명확하게 설명되지 않고 있다. 따라서, 필요에 따라 인용문헌을 보여주고자 노력하였으나 전체를 수록하지 못했다. 이 책의 내용에 관한 참고 문헌은 다음에 기술된 저서나 총론에서 찾을 수 있다. 1. M. B. Math ews, Connecti ve Tis s ue: Macromolecular St- rtt ct tt re and Evolt ttion , Molecular Biol og y, Bio c hemi st r y and Bio p h y s ic s Ser. 19. A. Klein z eller, G. F. Sp r in g e r and H. G. Wi ttm ann edit ed , Sp ri n g e r-Verlag , New York, 1975. (생물학적 측면에서 취급하며, 1974 년까지의 문헌을 거의 완벽하게 정 리하고 있다.) 2. L. Rodens, Str u ctu re and Meta b oli sm of Connecti ve Ti s- sue Prote o g ly c ans, in The Bi oc hemi st r y of Glyc o p ro te i n s and Prote o g ly c a ns, W. J. Lennarz edit ed , Plenum . Press, New York, 1980, Chap. 7. (생화학적 측면의 내용을 취급하며, 322 편의 참고문헌을 적고 있다.)-
3. B. Chakrabarti and J. W. Park, Glyc o sami no g ly c a ns: str u ctu re and int e r acti on , CRC Rev. Bi oc lzem. 8, 225~313 (1980) . (생뭉리학적 면운 중접적으로 취급하며, 347 편의 참 고문헌 웅 적고 있 다.) 4. W. D. Comp e r and T. C. Laurent, Phy si o l og ica l Functi on of Connecti ve Polys a ccharid e s, Phy si o l . Rev. 58, 255~315 (1978) . (생리학적 측면에서 내용을 기술하며, 373 편의 참고문헌을 수록하~ 있다.) 끝으로 이 책의 저술에 연구비를 지원하고 책이 출판되도록 배려 한 대우재단과, 처술 과정에서 많은 협조와 격려를 해 준 가족들어 1 게 감사한다. 1983 년 4 월 박준우
略 語 Ac acety l ADP adenosin e dip h osph ate AMP adenosin e monop h osph ate AO acrid i n e orang e Asn L-aspa rag ine AT-III anti thr ombin III ATP adenosin e tri p h osph ate BSA (blood) serum albumi n CD cir c ular dic h rois m 또는 cir c ular dic h roic Ch4-S chondroit in 4-sulfa te Ch6-S chondroit in 6-sulfa te CPC cety lp y r id i n i u m chlorid e (hexadecy l -) cs chondroit in sulfa te ( Ch4-S 와 Ch6-S 구별 않옹) DNA deoxy r ib o nucleic aci d Dol dolic h ol DS dermata n sulfa te Fru D-fru cto s e GAG gly c osam ino g ly c an (s) Gal D-ga lacto s e GalNAc N-acety l- D-ga lacto s a_m i ne Glc D-gl u cose GlcUA D-g lu curon ic acid GlcNAc N-acety l- D-gl u cosam ine Glc-6 S D-g lu cose- 6- sulfa te GlcNAc-6 S N-acety l- D-gl u cosam ine 6-su lfat e HA hy a luron ic acid 또는 hy a luronate HP hep a rin HPS hepa ran sulfa te IdUA L-id u ron ic acid KS kerata n su lfat e ( Ks -I 및 KS -II 로 구분) LDL low densit y lipo p r ote i n M averag e molecular we ig h t(평균 방법에 따라 Mn, Mw 등으로 표기)
MB meth y le ne blue MPS mucop o lys a ccharid e (s) NAD nic o ti na mi de adenosin e din u cleoti de ORD op tica l rota t o r y dis p e rsio n P ino rga nic ph osph ate ( dip h osph ate 는 p-p) PAP 3'-ph osph oadenosin e -5' -ph osph ate PAPS 3'-ph osph oadenosyl - 5'-ph osph osulfa te PG pro te o g ly c an (s) pl iso electr i c po in t PLA po ly- L -argi ni n e PLL po ly- L -Iys i n e RNA rib o nucleic ac id SDS sodiu m dodecy ls ulfa te Ser L-serin e Thr L-th r eonin e UDP urid i n e dip h osph ate UMP urid i n e monop h osph ate VLDL very low densit y lipo p ro te i n Xy l D-xy lo se
Mucopolysaccharides의 生化學 및 生物理學
서 문 3약 어 6제 1 장 서 론1.1 용 어 111.2 당단백질(glycoproteins) 131.3 Proteoglycans와 Glycosaminoglycans의 구조적 특성 191.4 Proteoglycans의 일반적 기능 및 구조 23제 2 장 Proteoglycan2.1 Proteoglycan의 분리 252.2 Proteoglycan 집합체 282.3 Proteoglycan 단위체 322.4 탄수화물一단백질 연결 38제 3 장 Glycosaminoglycans의 일차구조3.1 Glycosaminoglycans의 분리 433.2 Glycosaminoglycans의 화학적 분석 463.3 반복되는 이당류 단위체의 구조 및 특성 51제 4 장 Mucopolysaccharides의 생합성4.1 일반적 생합성 경로 634.2 Chondroit in sulfate 의 생합성 674.3 Hyaluronic acid의 생합성 754.4 Dermatan sulfate의 생합성 764.5 Heparin의 생합성 774.6 Heparan sulfate의 생합성 874,7 Keratan sulfate의 생합성 874-8 세포의 성장과 다당류 조성의 변화 89제 5 장 Mucopolysaccharide의 분해와 유전질환
5.1 효 소 965.2 Glycosaminoglycans의 분해 1075.3 Mucoplysaccharidoses 112제 6 장 Glycosaminoglycans의 분자 크기 및 유체역학적 성질6.1 고분자의 분자량, 크기 및 모양의 측정방법 1216.2 Glycosaminoglycans의 분자 파라미터 136제 7 장 Glycosaminoglycans의 구조 및 광학적 성질7.1 X-선 회절 1527.2 분광학적 성질 : 자외선 영역 1657.3 Glycosaminoglycans의 구조전이 1857.4 적외선 및 Raman Spectra 1907.5 NMR Spectra 195제 8 장 이온 및 작은 분자와의 상호작용8.1 산-염기 평형 : H+결합 2018.2 양이온 결합 2068.3 양이온성 염료 결합 및 metachromacy 2118.4 4가 암모늄염 및 아민류 결합 2168.5 물과의 상호작용 218제 9 장 거대분자와의 상호작용9.1 단백질과의 상호작용 2259.2 Collagen과의 상호작용 2329.3 Lipoprotein과의 상호작용 2349·4 입체적 배제작용 235색 인 243제 1 장 서 론 분자생물학으로 대변되는 최근의 생화학의 관점에서 보면, 생명 현상온 극히 최근까지만 해도 핵산과 단백질의 두 종류의 생물 고. 분자 (B i o p ol y mer) 로 설명되었다고 해도 과언이 아니다. 그러나, 생 명체는 이들 외에도 또 다론 화합물, 득히 탄수화물과 지질이 없이 는 존재할 수 없다는 것을 우리는잘 알고 있다. 이 책은 이들 중의 한 가지 인 탄수화물의 특수한 범 주에 속하는 mucop o lys accharid e - 로 통칭 되 는, 주로 척 추동물의 결 합조직 (connecti ve tiss ue) 에 존재 하는 일련의 화합물의 생화학과 생물리학에 관하여 취급한다. 비록 이 화합물에 대한 연구는 반 세기 이전부터 시작되었으나, 극히 최 근에 야 이 들의 구조나 성 질 들이 규명 되 었 다. 따라서 mucop o lys a c- charid e 라 볼리 는 화합물의 화학적 득이 성 은 이 들에 대 한 연구의 진전에 따라 변천되 어 왔다. 이 장에서는 mucop o lys accharid e 에 연관된 · 화합물의 용어를 명확히 하고, 이들의 화학적 구조의 득성 과 일반적 성질을 기술함으로써 다음 장들에서 취급될 구체적인 내 용의 안내 역 할을 한다· 또한 mucop o lys a ccharid e 와 유사한 당단 백 질 (gly c o p ro te i n ) 에 대 해 서 도 간단히 소개 한다. 1.1 용어 역 사적 으로는, mucop o lys a cchari de (MPS) 또는 ac idi c mucop oly -
.sa ccharid e 라는 용어 는 1930 년 대 에 Mey e r 가 동 물 조직 에 서 얻 어 진 점도가 높고 mu ci n 과 같 이 미끄러운 성질 을 갖는 다당류(p ol y sacchar i de) 를 총 칭하기 위하여 도입되었다. 처음에는 MPS 는 순수 한 다당류로만 인식되어 왔으나, 1960 년대에 와서는 MPS 는 생제 내에서 탄수화물 사슬이 단백질에 공유결합되어 존 재 한다는 것이 확인되었다. 이에 대한 예외는 hy a luronic a ci d 인데, 이 다당류에 대해서는 아직도 단백질과의 복합체가 명확하게 확인되지 않았다. MPS 의 화학적 조성(순수한 탄수화물과 탄수화물-단백질 복합체) 에 대한 혼돈은, 이들 물질을 조직에서 분리시킬 때 사용되는 알칼 리 처리나 단백질 분해 과정에서 탄수화물-단백질 연결이 쉽게 분 해되는 데 기인한다. 따라서 MPS 란 용어는 현재 화학적 관점에서 는 아주 애매하게 사용되고 있다. 죽, 어떤 때(학자)는 순수한 탄 수화물 부분을, 그리고 어떤 때는 탄수화물一단백질 복합체륭 지칭 하는 데 사용된다. 이 책에서는 MPS 는 위에서와 같이 탄수화물과 탄수화물-단백질 복합체를 구별할 필요가 없을 때만 사용된다. MPS 라는 용어의 애매한 점을 보완하기 위하여, 탄수화물 사슬 만을 지칭하는 데는 g l y cosam i no g l ycan(GAG) 란 단어를 사용한다· 이 용어는 g l y cosam in e( 아미노당 :a mi no su g ar) 과 g l y can( 다당류:p ol y saccharid e ) 의 복합어 로 MPS 의 탄수화물 사슬의 화학적 조성 을 잘 대 변한다고 볼 수 있 다. GAG 들은 모두 반복되 는 이 당류 (d i saccha rid e ) 단위제로 구성된 선형 고분자이다. 이당류 단위체의 성분 중 한 가지는 ami no sug a r, 좀더 엄 밀히 말하여, hexosami ne (gl u co- ·sa m ine 또는 ga lacto s am ine ) 이 며 , 다론 한 가지 는 hexauronic acid (glu curan ic acid 또는 idu ronic aci d) 이 다. (Kerata n sulfa te 는 예 의 적 으로 uronic ac id 대 신 에 ga lacto s e 를 포함하고 있 다. ) GAG 는 uronic acid 의 -COOH 기 이 외 에 도 대 부분 에 스테 로화된 황산기 를 포함하고 있으며, 중성 수용액에서는 다가 음이온으로 존재한다. 따라서 , GAG 둘은 가끔 〈동물조직 에 서 얻 은〉 음이 온성 다당류 (anio n ic pol ys a ccharid e ) 또는 산성 다당류 (a ci d ic pol y s accharid e ) 라 불려진다. 참고로, 자연계에 존재하는 음이온성 다당류로는 동물계 에는 GAG 들이 주종을 이루며, 식물계에서는 고등식물의 세포막
의 주성 분인 pe cti c acid (po lyg a lactu r onic aci d) , brown alga e 에 존 재 하는 alg ini c ac id( po lym a nnuronic ac i d 와 po lyg ulur onic a ci d 의 copo- lym er) , 많은 해 조류에 서 얻 어 지 는 carrag e enan (S03-기 물 포합) 등 여러 종류가 있다. MPS 는 이마 언급된 바와 같이 많은 동물의 조직이나 체액에 존 재 하며 , 특 히 피 부, 뼈 , 연골 (car ti la g e), 인대 (liga ment) 등과 같은 척 추 동물의 결 합조직 (connecti ve tissu e) 에 서 collag e n 이 나 탄성 의 섬유소와 함께 많이 존재한다. 따라서 MPS 를 보통 결합조적다당 류 (connec ti ve tiss ue p ol y saccha ri de) 라 부르기도 한다. 그러 나 척추 동물에서 얻어진 GAG 와 동일한 화학적 조성의 다당류가 하등동 뭄이나 박테리아에서도 가끔 발견된다. 그러나 이들에서의 다당류 는 생물학적 기능이나 존재하는 조직 등이 척추동물의 경우와는 크 계 다르므로 이 책에서는 MPS 에 관해서는 척추동물의 경우만 국 한지워 기술한다. Hy a luronic acid 를 제 외 한 모든 GAG 들은 생 체 내 에 서 단백 질 에 공유 결 합된 형 태 로 존재 하며 , 이 GAG- 단백 질 복합체 물 pro te o - gl yc an 이 라고 부른다. 비 록 hy a luronic acid 가 다른 GAG 들과 마찬가지로 단백질과의 공유 결합 상태로 조직 내에 존재한다는 확 실한 중거는 아직 없지만, 보통 p ro t eo g l ycan 을 언급할 때는 이 다 당류도 포함시 킨다. Pro t eo g l y can(PG) 는 일반적 인 당단백질 (gly c o - pro te i n ) 중에서 탄수화물 부분이 특별한 요건을 만족시키는 것으로 간주될 수 있으나, 이들은 엄격히 구별되어 명명되기도 한다. I . 2 Glyc o p ro te i n 결합 조직의 다당류 (GAG 또는 MPS 라 불려진다)는 단백질에 공유 결합을 한 형태로 조직내에 존재한다. 이와 같은 단백질―탄수화물 복합체는 결합조적다당류에만 국한된 것이 아니다. 자연 상태에서 는 대부분의 단백질이 탄수화물과 공유 결합을 하여 존재하며 이를 당단백질 (g l y co p ro t e i n) 이 라 부른다. 한 예로, 사람의 혈장(p lasma) 에서는 60 여종의 단백질이 분류되었는데, 이 중에서 혈청알부민
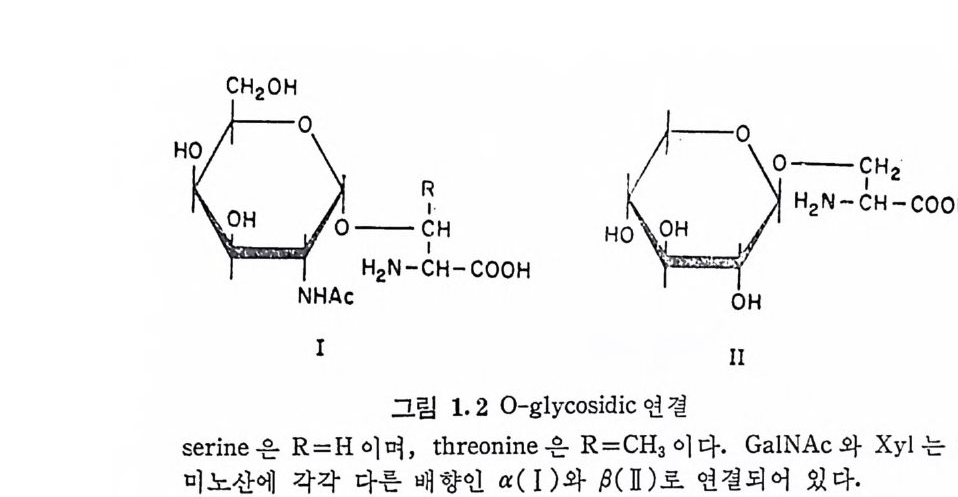
표 1.1 Glyc o p ro te i n 의 탄수화물-단백 질 연 결 Lin k ag e Stot a ab likl iatlyi 。 ccurrence N-Gi yco sid i c N-Acety lg l u cosami ny l- ± Many anim al and pla nt asp a rag m.e gly c o p ro te i n s 0-Glyc o sid ic N-Acety lg a lacto s ami nyl- Muc ins , blood gro up substa nc es, seri ne or thre onin e membrane gly c o p ro te i n s, im · mrmog lo bulin s , fet u in, anti fre eze gly c o p ro te i n s Xy lo syl - seri ne Mucop o lys a ccharid e s (pro te o g ly - cans) Galacto s yl - seri ne Earth w orm cuti cle collag en , pla nt cell walls • Mannosyl - serin e Yeast cell wall mannans, yea st inv erta s e, Aspe r gi ll1is nig e r glu coamy la se Mannosyl - th re onin e Earth w orm cuti cle collag e n, fun g a l ph y tot o x ic gly c o p e pt ide s Galacto s yl - hyd roxyl y s i n e + Collage ns, basement membrane L-Arabin o syl - hy d roxy- + Plant cell walls and gly c o p ro - pro li ne tei n s
(serum album i n) 과 pre albumi n 을 제 외 하고는 모두가 gly c o p ro te i n 이다. Glyc o p ro te i n 의 구조에 서 가장 특성 적 인 것은 탄수화물과 단백 질간의 공유 결합에 의한 연결이다. 단백질을 구성하는 20 여종 의 아미노산 중에서 단지 5 가지만 이 연결에 관여하며, 이들은 L-as pa rag ine , L-se ri ne , L-thr eonin e , 5-hy d roxy -L-ly s in e 과 4-hy d rox y-L-pro li ne 인 데 마지 막 2 가지 는 혼하지 는 않다· 표 1. 1 은 탄수화물-단백질 연결에 관여하는 당류와 아미노산을 요약한 것이다. 탄수화물―단백질 연결은 크게 N- g l y cos i d i c 과 0-g l y cos i d i c 의 두 가지 유형으로 나눌 수 있으며, 이들 간에는 산 또는 알칼리에
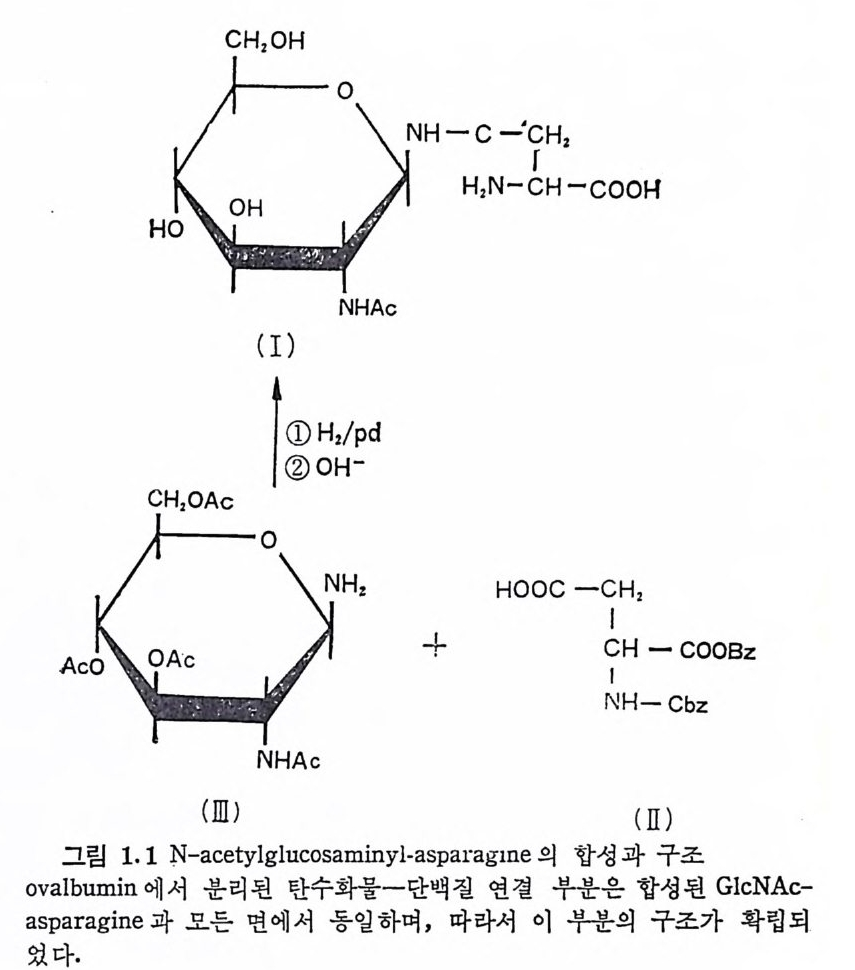 CH20H
CH20H
대 한 안정 성 에 서 큰 차이 가 난다. N-acety lg l u cosami ne (GlcNAc) 과 L-aspa rag ine (Asn) 간의 N-gl y c o sid i c 연결(그립 1.1) 은 최초로 확 인된 탄수화물一단백질 연결로, 1963 년에 ovalbum in에서 확인되 었다. 이 연결은 또한 화학적으로 a-benzy l- N-benzy lo xy -c arbony l- aspa rate ( II ) 를 3, 4, 6-Tri- 0 -acety l- N- a cety lg l u cosami ne ( III ) 과 축 합시 켜 합성 되 었 다. (C. H. Bolto n 과 R. W. Jea nloz, J. Org. Chem., 28, 3228, 1963. ) N-acety lg l y c o sy la mi ne 연결은 약산에서는 비교적 안정하다. Glc-
 ―RH_CHcIC。 。 H H,? 二 :H%-COOH
―RH_CHcIC。 。 H H,? 二 :H%-COOH
NAc-Asn 은 100°c 의 2M HC1 에 서 는 반감기 가 약 17 분으로 asp a r- tic a ci d 와 암모니아를 방출하면서 분해한다. 또한 약염기성에서 도 비 교적 안정 하여 100°C, 0. 2M NaOH 용액 에 서 반감기 가 100 분 이 나 된다· 그리고 NaBH4 존재 하에서의 GlcNAc-Asn 의 알칼리 분 해 는 GlcNAc 를 N-acety lg l u cosanit ol 로 전 환시 키 며 , 이 반응(보 몽 lM NaOH-lM NaBH0 100°C , 4~6 시 간) 은 GlcNAc-Asn 연 결 을 갖 는 g l y co p ro t e i n 의 확인 연구에 많이 응용된다. N-gl y c osid i c 연결아 산이나 알칼리에 비교적 안정한 반면에, N-ace ty l g alac t osam i ne(Ga !N Ac) 과 Asn 및 th reonin e (Thr), xy lo se (X y l)-se ri ne(Ser) 과 같은 serin e 이 나 th reonin e 에의 0-gly c osid i c 연결(그림 1.2) 은 비교적 알칼리에 불안정하다. (대부분의p ro t eo g l y can 는 Xy l- Ser 연 결 을 하고 있 다. ) 이 들 0-gl y c osid i c 연 결 은 상 온의 0.05~O.lM NaOH 용액에서도 24 시간 이내에 완전히 분해된 다. 알칼리에 의한 0-gly c osid i c 연결의 분해는 소위 ~-elim i na ti on 반응으로 알칼리 촉매에 의한 이분자 반응이다. 알칼리 분해에 의 해 serin e 과 thr eonin e 은 각각 이 들의 불포화 유도체 인 2-ami no - acry lic ac id 와 2-ami no croto n ic acid 로 전 환된 다. H2N— CCIHH 2— OCHO O H —> H2N-CCIIH -C2 OOH serin e 2-ami no acry lic ac id
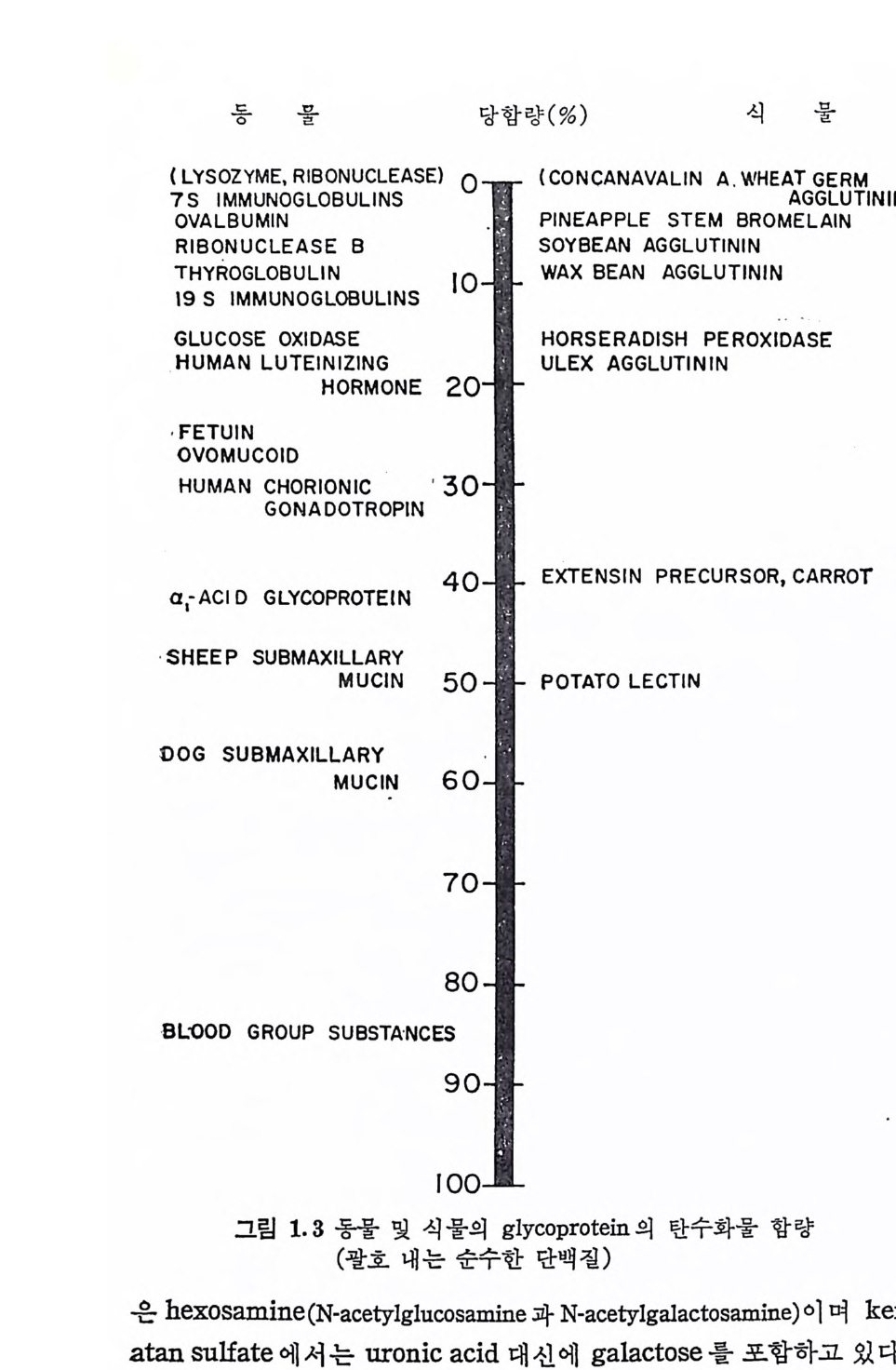
이들 불포화 화합 문 은 목성 적인 UV 영역에서 광흡수 을 나타내며, 이 성 질은 탄 수화물一단백 질 연결 부분에 seri ne 과 th reonin e 이 관여하는지를 규명하는 데 사용된다• Glyc o p ro te i n 의 또 다른 0-gl y c o sid i c 연 결 은 Hy d rox y ly s i n e 럿 Hy d roxy se ri ne 과의 연 결 이 다. 이 들 연 결 은 pro te o g ly c a n 에 서 는 아직 발견되지 않았 다. Gl y co p ro t e i n 의 탄수화물 부분은 단백질과의 연결 부분이 여 러 유 형 인 것은 물론, 그 크기도 단당류, 이 당류 및 다당류 동 다양하다. 또한 gly c o p ro te i n 에 서 탄수화물이 차지 하는 바 울도 몇 가지 colla- gen 에서의 o.5 % 에서부터 혈액형을 결정하는 g l y co p ro t e i n 의 85% 까지 크게 변한다. 종래 순수한 탄수화물이 라고 여 겨 져 온 gly c og e n 도 99 % 이 상의 당을 포함하는 gly c o p ro te i n 일 가능성 이 크다. 그 림 1. 3 은 몇 가지 동물 및 식 물의 gly c o p ro te i n 의 당 함량을 보이 는 것이다. Gly co p ro t e i n 의 탄수화물 부분의 크기나 당함량이 다양한 것과는 대 조적 으로, gly c o p ro te i n 의 탄수화물 부분은 몇 가지 공동된 단당 류로 구 성 되어 있다 . 자연계에는 100 여종의 단당류가 존재하고 있 으나, 이 중에서 다음의 10 여종만이 g l y co p ro t e i n 에서 확인되었다.
표 1. 2 Glyc op ro te i n 의 단당류 성 분 Hexose: Galacto s e, Mannose, Glucose Deoxy he x os e: L-F u cose Hexosam ine : •N -acety lg l u cosami ne , N-acety lg a lacto s ami ne Sia l ic aci d: N- acety l neurami nic acid Pento s e: Xy lo se, L-Arabin o se Uronic aci d: D-g lu curonic aci d, L-i d u ronic acid
이 표에 수록된 5 당류인 xy lo se 는 MPS 의 탄수화물-단백 질 연 결 부분에 서 주로 발견되 며 , L-arabi~ o -se 는 식 물 gly c o p ro te i n 의 전 형 적 인 성 분이 다. Uronic ac i d 인 D-g lu curonic ac i d 와 L-id u ronic ac i d 는 MPS 의 탄수화물의 반복되는 이당유 단위체의 성분이며, 다은 gly c o p ro te i n 에 서 는 발견되 지 않았다. MPS 의 또 다른 성 분
 등 뭉 당함 량 ( % ) 식 뭉
등 뭉 당함 량 ( % ) 식 뭉
1. 3 Prote o g ly c an 과 Glyc o sami no g ly c an 의 구조적 독성 Pro t eo g l y can(PG) 은 탄수화물과 단백질이 공유 결합 형태로 연 결되어 있다는 점에서 g l y co p ro t e i n 의 일종으로 간주된다. 일반적 으로, gly c o p ro te i n 에 서 는 탄수화물 부분이 15~20 개 의 단당류 법 위를 넘지 않는다. 그러나 PG 에서는 탄수화물 부분이 약 100 개 이 상의 단당류(전체 분자량이 약 20,000 이상)로 구성되어 있는 선형 고 분자이다. 또한 이들 다당류 사슬은 반복되는 이당류 단위제로 구 성되어 있다. PG 의 탄수화물 부분인 g l y cosam i no g l y can(GAG) 들은 그들의 모 세포에서 PG 의 성분으로 합성된다. 이에 대한 예외가 있다면 hy aluronic a ci d(HA) 인데, 아직도 이 다당류에 대해서는 단백질과의 복합체가 확인되지 않았다· 그러나 탄수화물 사슬의 유사성으로 인 하여 보통 PG 를 언급할 때 HA 도 포함시킨다. PG 에서는 하나의 중심 단백질 (Core Pro t e i n) 에 많은 다당류 사슬이 연결되어 시험관 을 씻는 솔과 같은 모양을 하고 있다. PG 의 한 전형적인 유형으로 소의 코연골 (bov i ne nasal car til a g e) 을 들 수 있다. 이 연골 PG 는 분자 량이 약 200, 000 인 중심 단백 질 에 분자 량이 약 20, 000 인 chon- -clro it in s ulfa te( GAG 의 일종) 사슬이 100 개 정 도, 그리 고 chondroit in su lf a t e 보다 약간 적은 수의 kerata n sulf ate 사슬이 연결되어 있 다(제 2 장 참조). 이 PG 의 탄수화물 함량은 약 92% 가 되며, 이는 혈액형 물질의 g l y co p ro t e i n 의 탄수화물 함량과 유사한 값이다. 따 라서 PG 와 일 반적 인 gly c o p ro te i n 의 구분은 탄수화물의 함량에 의 해서가 아니라, 연결된 탄수화물의 특성에 의해 결정된다. PG 의 탄수화물 성 분, 죽 gly c osami no g ly c an 이 갖는 공동적 특성 을 요 약하면 다음과같다. 1. 각 GAG 들은 hexosami ne (D-gl u cosam ine 또는 D-ga lacto s am ine ) 을 포함한 이 당류 단위 제 (A-B) 가 반복되는 선형 고분자이 다 . .2. 이 당류 단위 체 의 다른 한 성 분은 uronic acid (D-gl u curon ic aci d
3 참 조)재장 주요원ausovl .ne vurs odiflytii b hmoh,o umeree u lif-iyt ,co aobsdkcmc 'co lcrue r ,anaoachraam tiglt vselavhrae t s,lsv ahdoere solbnk,es ti ave slvs leluclsamn t ,g lol,bs uselees srcv lsec odfa roeseeno c, l a eueuhncy tf ua c,se osuarlpglitp 적 항사인 은 결 연1- (-4)./3 )-33{1-( 1)-4B(一 1 )--3(>3/ if) 1(>-4- (1一83-) (4- -)13{ )(一1a.3-- )13+(--{3 -() a1-4.) -4-(/13 >-(1a)- -4(一a-14)4 +)1-(-- -4{3 -.)(- 14-(X (-fi -+)-- 134)(--1 /3 구대체한 기위치 산 4 64 ,N3 ,62 N ,3 6? 2 6 6 에조구( 부 분성 의분주물 당e성류 분황.eaausocylcentlm -Nig ocdrna cuuligic cae-aaNeonml cs atyiitg rd uo cnaculigci nlmcoe-Ncaael saatiygt o d rnacuulcigic m locaealnacesN-atytig nr odaduiic ci ro dccun aluigic asconume lig rodcuc naluigic dnro audc iiic easocnmluig oytnec-aeluas Ncmlig aruculc do nigci norua d dciiic e coynec-alustaNmlig oclaa estg 입는류형 당D echdaar lsco M.ou31cypi화 수탄의표 자분량 10X 6d- 3lac Hluraoyinci o0 r xdshC151e4-ounl2-taft iin odr(neulc o )Ashafn itti lonCoh- s6uetiifa nt.dr一l025X4 )lu s Ce drnoc(honaftiit 24 X0l -5 a aeeDlsumnrttfa u) s Bleordnohc( nfatiti 11x01-3 nraeHip 02-X 10l3usnaar ee Hlptaf nraeh(luse ) tiitpaf -50x3 0 21usanae re Klttaf rud cnoii ii,지는d머 c i이나형머L, a
 6
6
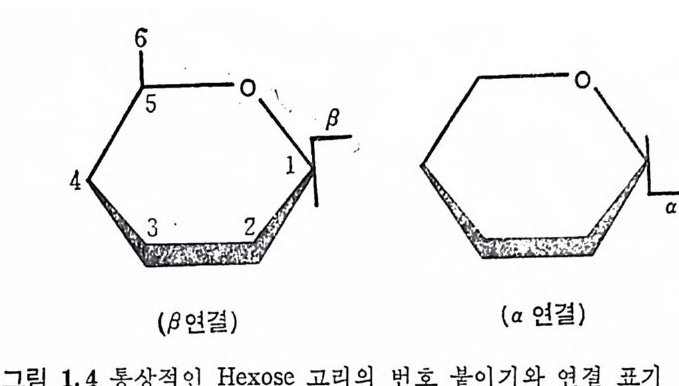
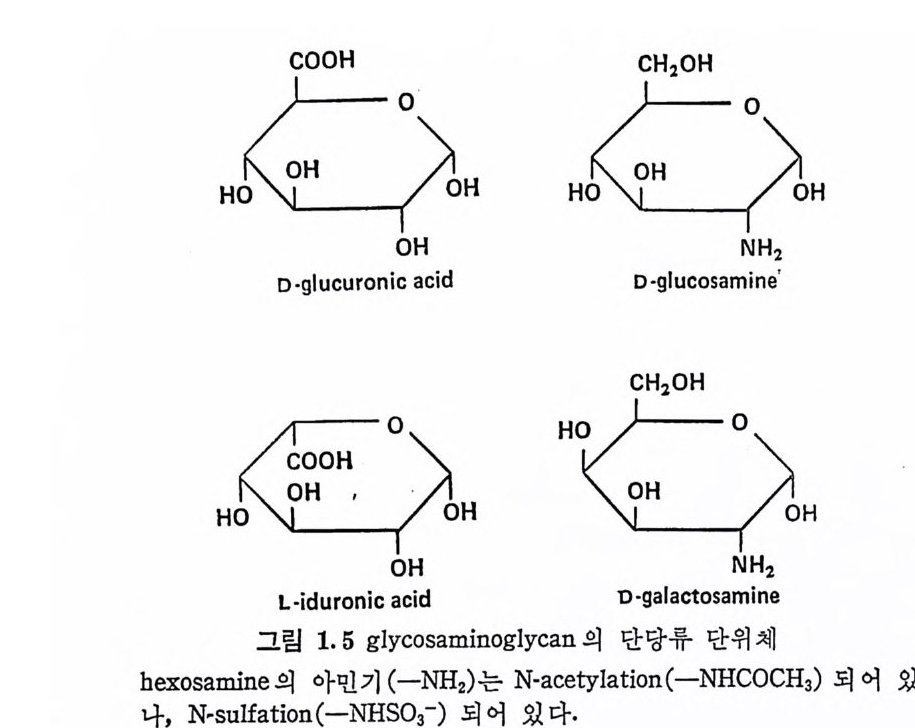
또는 L-id u ronic aci d, 혹 은 이 들 모두) 이 다. 단, kerata n sulf ate 는 uronic ac id 대 신 에 D-g a lacto s e 를 포함한다. 3, Hexosami ne 의 am i ne 기 는 N-acety la ti on 되 어 있 거 나, 아니 면 N-sulfa tion (hepa rin 밋 bepa ran sulfa te 에 서 부분적 으로)되 어 있 다· 4, Hy al uronic a ci d 륭 제외하고는 모두 에스테르화된 황산기 . (一 S03- )를 포함하고. 있 다. 이와 같은 특성을 모두 만족하는 다당류는 현재까지 최소한 6 가 지 가 확인되 었으며 , 이 들은 hy a luronic ac id( HA), chonclroit in 4- sulfa te ( Ch4-S) , chondroit in 6-sulf ate ( Ch6-S) , hepa rin (HP) , he- pa ran sulfa te( HPS), dermata n sulfa te( DS) 및 kerata n sulf ate (KS) 아다. 표 1.3 은 GAG 사술의 주성분을 정리한 것이다. 표 1.3 에서 알 수 있듯이 GAG 의 단당류체들은 모두 hexose 로 구성되어 있다. 그림 1.4 는 hexose 고리의 탄소 위치의 번호와 연 결 표시를 보여 준다. 당류간의 연결 표기는 연결된 당류의 탄소 번호와 이의 연결형 (a 혹은 /3)으로 표시된다. 예로 단당류가 다른 당류의 4 번 탄소에 /3형으로 연결되어 있으면 /3-( 1-4), 그리고 3 번 탄소에 a 형으로 연결될 때는 a-(1---+3) 연결이 라 부른다. GAG 들의 공통적인 단당류의 구조는 그림 1.5 와 같다. 이 그림 은 KS 의 성 분인 D-ga lacto s e 를 포함시 키 지 않았는데 , D-g a lacto s e- 는 D- g alac t osam i ne 의 -NH2 대신에 OH 기를 갖고 있다. Gluco-
 COOH CH20H
COOH CH20H
sami ne 과 ga lacto s ami ne 의 차이 는 C-4 위 치 의 OH 기 의 배 향에 있 다. 또한 D-gl u curonic ac id 와 L-id u ronic ac id 는 C-5 위 치 에 연결된 카르복실기 (COOH) 의 배치만 다른데, 이들은 서로 ep im er 의에 관따계라에 다 르있다다.. GCAhGo n의d ro에it스 in테 4르-s화u된lf a t황e 산과 기 c의ho n위dr치oi는t i nG 6A-Gsu l종f a류t e 의 반복되 는 이 당류 단위 체 는 N-acety lg a lacto s ami ne (GalNAc) 와 D-gl u curonic a ci d(GlcUA) 로 동일하며 연결 위치도 같다. Ch4 -S 와 Ch6-S 의 유일 한 화학적 구조의 차이 는 GalNAc 의 0-sli lfat i on 의 위치로 볼 수 있다. 죽 Ch 4- S 에서는 C-4에, 그리고 Ch6-S 에 서 는 C-6 위 치 에 0-sulfa tion 이 되 어 있 다. 초기 에 는 dermata n su lf a t e 를 chondroit in sulf ate B 로 불렀으나 이 책에서는 단지 Ch4- S 와 Ch6-S 만을 , chondro iti n su lf a t e(CS) 라 부른다. PG 의 탄수화물 성분으로는 표 1.3 의 주성분 이외에도 PG 의 종 류에 따라 차이 가 있으나 sia l i c a cid , mannose, fuc ose, ga lacto s e 및 xylo se 물 소량 포함하고 있다. 이 들은 KS 의 ga lacto s e 를 제 외
하고는 GAG 의 사슬의 주 축 을 이루는 반복되는 이당 류 단위 제 의 성분은 아니다· 소량 탄수 화물 성분 들 은 보통 PG 의 탄수 화물 -단 백질 연결 부분을 이루고 있으며, GAG 를 언급할 때는 보통 이둥 연결 부분의 성분은 포함시키지 않는다. I. 4 Prote o g ly c a n 의 일 반적 분포 및 기 능 Mucop o lys a ccharid e 는 척 추 동물의 많은 결 합 조직 과 체 액 , 예 로 피 부, 연골 (car ti la g e) , 혈관벽 (arte r i al wall), 탯 줄 (umb i l i cal cord), 안구의 유리 체 (vit reo us humor), 각막 (cornea), 관절활액 (syn o via l flui d ) 등에 널리 분포되어 있다. 또한 MPS 는 세포막이나 두뇌의 괴충에 서도 발견된다. 어떤 경우에는 세포 내에서도 존재하는데, 이의 좋 은 예가 mast 세포의 hep ar i n 이다. MPS 는 척추 동물에서만 아니 라 무척추 동물의 조직에서도 발견된다. MPS 의 분포는 조직에 따라 크게 변하며 같은종류의 GAG 도부 존 조직에 따라 분자량에 큰 차이가 있다. 또한 주어진 조직이냐 체액에서의 GAG 분포의 양상은 조직의 성장이나 노화에 따라서도 변한다. 특히 성장 과정에 있는 조직이나 암조직에서는 MPS 의 양 이나 종류가 비정상적으로 변한다. 정상적인 MPS 의 분포에의 이 상은 〈 muco p ol y sacchar i dose 〉라는 질환으로 나타나는데, 이는 MPS 의 대사 (me t abo li sm) 가 비정상적인 것에 기인된다(제 5 장 참조) . MPS 의 생물학적 기능은 아직 명확하지가 않다. 그러나 이들은 대체로 동물의 결합 조직의 섬유상 및 세포 성분을 안정화시키고 지지하며, 이들 조직에 유연성과 강직성을 제공하는 구조적인 역할 울 하고 있는 것으로 믿어지고 있다. GAG 들은 이당류 단위체당 l~4 개의 음이온기 (COO- 또는 so 디를 갖고 있으며, 이로 인하여 아 물질은 이 온 교환 수지 나 Ca++ 과 같은 양이 온의 덫 (Tra p)으로 작 용할 수가 있다. GAG 와 같은 이온화된 고분자는 점성도와 탄성이 큰 용액을 형성하며, 이 용액에서 GAG 분자는 건조된 상태에 비해 100~1000 배의 큰 부피 몰 점 유한다. 따라서 GAG 분자는 조직 내 에 시 다른 거대 분자의 확산을 방해하는 장애물로 작용할 수 있다`
'GA G 분자의 다가 음이온적 목성에서 , 이들 분자가 Ca 표와 같은 양이온 의에도 양이온성 거대분자나 거대분자의 양이온성 영역과 정전기적 상호작용을 할 수가 있다. 이와 같이 MPS 는 구조적 역 할 외에도, 생체의 염 및 물의 균형과 같은 생리적인 역할도 할 것 으로 짐작되고 있다· *추천 문현 Mucop ol ys a ccharid e 에 관해서는 이 책의 다음의 장들과 이들에서 인용 및 추천된 문헌의 참조를 바란다. Gl y co p ro t e i n 에 관해 텃 가지 총론을 소 개 하면 다음과 같다. R. 1. R. D. Marshall and A. Neuberge r, Aspe c ts of the str u ctu r e and Meta b oli sm of gly c o p ro te i n s , Adv. Carbohy r . Chem. Bi oc hem., 25, 407~478 (1970). (탄수화물一단백질 연결에 대해 자세히 취급) R. 2. N. Sharon and H. Lis , Glyc o p r ote i n s : research boom ing on long igno red, ubiq u it ou s comp o unds, Chem. & Eng . News, pp. 21~44(March 30, 1981) (g l y co p ro t e in에 관한 연구의 최근 동향 및 결과를 비교적 자세히 취급) R. 3. N. Sharon, Comp le x Carbohy d rate s , the ir chemi st r y, bio s yn th e sis and fun cti on , Addit ion -Wesley, 1975. (Glyp ro te i n 을 포함한 복합 탄수화물에 대 한 강의 노트로 많은 참 고 문헌 포함) R. 4. The Bi oc hemi st r y of GlyP rote i n s and Prote o g ly c ans, ed ited by W. J. Lennarz, Plenum, 1980. (Gl y co p ro t e in및 Pro t eo g l y can 에 관한 생화학을 12 명의 전문인이 집필했다. 이 책의 제 4 및 5 장의 많은 내용이 포함되어 있다•)
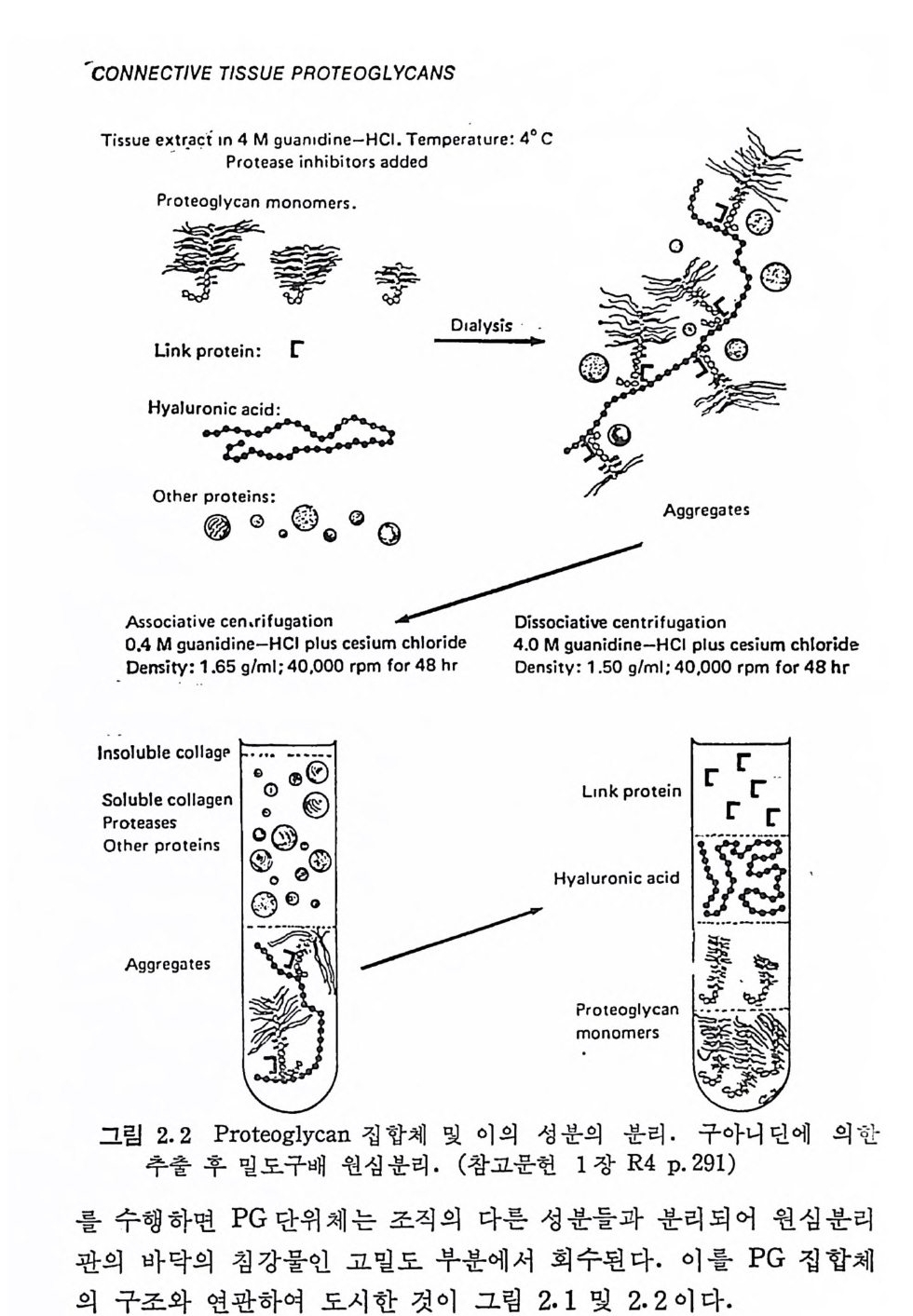
제 2 장 Prote o g ly c a n Hy a luronic aci d 를 제 외 한 모든 gly c o sami no g ly c an 들은 모세 포에서 p ro t eo g l y can 의 형태로 생합성되어 조직 내에 촌재한다· 그 러 나 아직 도 hy a luronic ac id 에 관해 서 는 GAG 나 PG 중 어 떤 형 태로 합성되는가는 확실한 대답이 없다. 이 장에서는 PG 의 거시적 구조와, 이를 연구하기 위하여 필요한 PG 의 분리 방법 등을 기술 한다. GAG 의 화학적 구조는 제 3 장에서 취급된다. 2. 1 Prote o g ly c an 의 분 리 조직에서 자연 상태의 PG 을 분리 추출하기 위해서는 PG 의 탄 수화물-단백질 연결 (2.4 참조)을 과괴시키지 않는, 가능한 한 약한 실험적 조건이 필요하다. HA 의 경우에는 이 다당류가 존재하는 조 직, 예로 눈의 유리체, 탯줄, 관절 활액 등을 단순히 물 또는 식염 수 용액으로 추출하는 것이 가끔 사용된다. 다른 PG 은 이와 같은 추출 방법으로는 거의 추출되지 않으며, 또한 초기의 MPS 의 추출 에 사용된 단백질 분해 효소나 알칼리 처리의 방법도 탄수화물-단 백질 연결을 파괴시키므로 PG 의 추출에는 적용될 수 없다. 1969 년에 Sajd e ra 와 Hascall(2.1) 이 구아니 딘 (gu an i d i ne) 을 사용 하여 소의 코연골의 PG 을 분해되지 않은 상태로 높은 수울로 분리 시킨 것은 PG 의 분리는 물론, PG 의 연구에 획기적인 전기를 마련
해 준 것으로 볼 수 있다. 자연 상태의 PG 를 분리시키기 위해서는 대 상 조 긱 에 따라 약간의 차이 가 있 으나, 근본적 으 로 는 Hascall 등 의 방법 을 응용한 것을 사용 하 고 있 다· 요 소 (Urea), 구아니딘 _NC1 또는 다 른 단백질 변성 제물 사용하면 조직에서 PG 을 거의 정량적 으로 분리시키는 것아 가능하다. 이 새로운 PG 의 분리 방법의 기 본적 원 리 는 〈해 리 성 (dis s oci at i ve )> 용매 의 이 용이 다. PG 들은 보 동 조직 내에서 집합체 (a gg re g a t e) 로 존재하는데, 약 4M 구아니딘一 HCl 이나 3M M g Cl2 용액에서는 이들 집합체 내의 PG 단위체간의 상 호작용이 거의 없어져 집합체는 해리되고, 따라서 이들 용매로 PG 을 추출하는 것이 가능해진다. 추출액을 해리성 조건으로 유지하고 밀 도구배 원 심 분리 (densit y gra die n t centr ifuga ti on , 보 통 CsCI 을 사용)
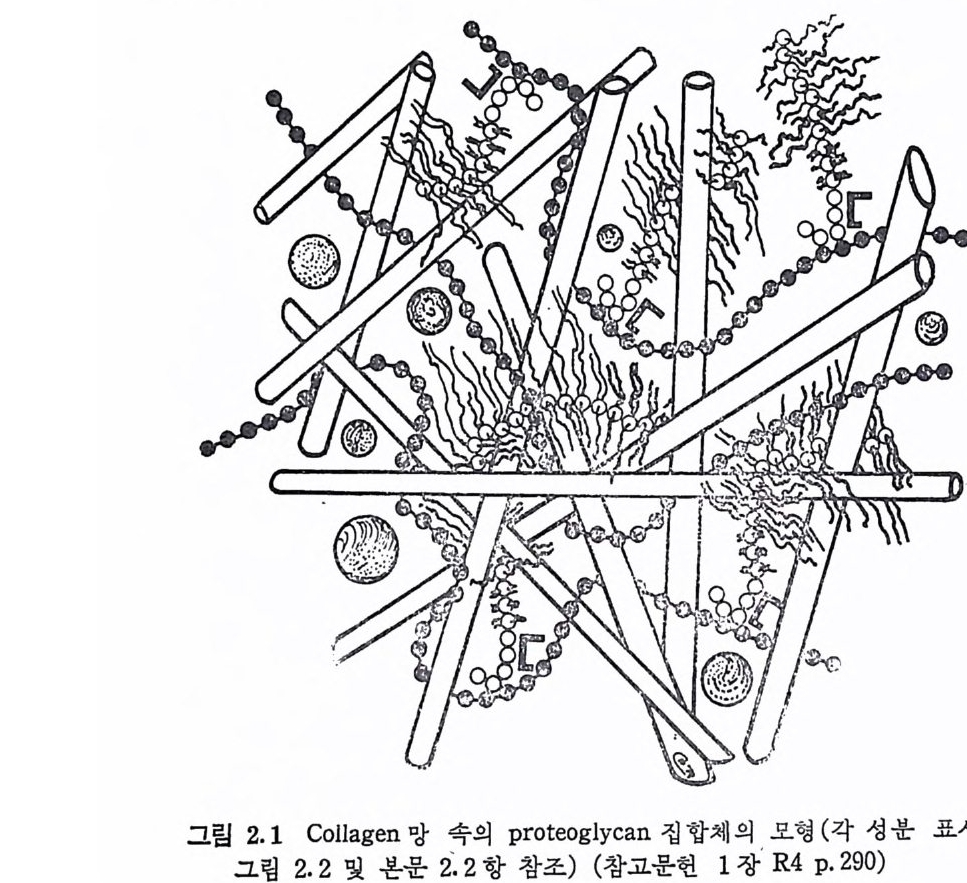 그림 2.1 Collage n 망 속의 pro te o g ly c a n 집 합체 의 모 형 (각 성 분 표시 는
그림 2.1 Collage n 망 속의 pro te o g ly c a n 집 합체 의 모 형 (각 성 분 표시 는
 rCONNECTIVE TISSUE PROTEOGLYCANS
rCONNECTIVE TISSUE PROTEOGLYCANS
분리된 PG 단위 체들 을 GAG 종류 에 따라 다시 분 별하는 것 이 가 끔 필요하다. 이 때 에 는 보 몽 이 온 교 환 Chromato g r ap h y 나 밀 도 구배 원 심 분리 가 이 용된 다· 그러 나 PG 의 다당 류 사슬 (gly c osami no - g l y can) 의 음이온적 독성인 전하 밀도나 분자량을 이용한 물_알콜 에 서 의 용해 도 차이 , 4 가 암모늄염 (예 로 Cety lp y r id i n ium chlorid e ) 과 의 침전에 의한 분별 방법도 이용된다· 2. 2 Prote o g ly c an 집 합체 Prote o g ly c an 이 생 물 고분자의 한 가지 개 체 로 확립 된 이 후에 도, 이 의 물리 화학적 독성 (예로, 분자량)이 나 구조의 규명 은 1960 년 대 후 반까지만 해도 극히 불완전한 상태였다. 이는 PG 가 집 합 체를 형성 하는 성질에 기인한다. 이의 좋은 예가 소의 코연골 의 PG 이다. 1960 년 전후의 Math ews 등에 의 한 연구 (2. 2) 는 이 PG 의 분자 량 이 크게 분산되어 있음을 보였다. PG 중 극소량만이 분자량 3X 106 0] 하였으며, 이 적은 분자량의 PG 는 자연상태의 PG 이거나, 아니 면 더 큰 분자 량의 PG 에 lys osomal pr ote a se 가 작용된 생 성 물 로 간주될 수 있으나 어느 것인가에 대해서는 확실하지가 않았다. 그러 나 많은 PG 제 제 (pr ep a rati on ) 에 서 는 어 떤 부분은 분자 량이 50 x 106 이나 되는 것이 관찰되었다. 이들 큰 분자량의 PG 는 진한 요소 또는 KSCN 용액에 의하여, 그리고 품은 염 용액에서는 약하게 가 열함으로써 분해 (d i sa gg re g a t e) 될 수 있음이 관찰되었다. 이는 큰 분 자량의 PG (실제는 PG 집합체)에서는 PG 단위체들이 단백질의 일부 폴 비공유 결합 형태로 함유하고 있으며, 이 비공유 결합은 〈수소 결합 파괴제〉나 열에 의해 파괴된다고 볼 수 있다. 비공유 결합을 하고 있는 단백질을 제거하면 PG 의 기본 단위체의 분자량은 약 .3. 5 X l06 으로 낮아진 다. PG 의 집합체 및 집합 인자에 대한 확실한 중거는 그립 2.2 에서 보여준 바와 같은 Hascall g rou p의 실험에서 제시되었다 (2.3). 앞에 서 언급된 PG 의 추출 과정에서 자연 상태의 PG 집합체는 4M 구 아니딘 _HCl 용액에서 해리된다. 해리된 PG 집합체 성분들은 두석
에 의해 해리제인 구아니딘의 농도를 0.4M 정도로 낮추면 다시 집 합체로 형성된다. 이와 같은 PG 집합체 형성 의 가역성은 밀도구 배 원심분리에서 얻어진 높은 밀도 부분 (PG 단위체)과 낮은 밀도 부분의 상층액을 합친 것을 분석 원심분리할 때도 관찰된다(그립 z.2 참조). 형성된 PG 집합체를 분리하여 다시 해리성 용매에서 원 심분리하면 PG 단위체를 집합체를 형성하는 다른 성분들로부터 분 리시킬 수 있다. Hascall 등에 의해 PG 의 집합 인자가 밀도구배 윈십분리 과정에 서 가장 낮은 밀도 부분에 존재한다는 발표가 있은 후, Mu i r 의 실 험 실 에 서 는 hy a luronic ac id (HA) 가 PG 와 작용하여 큰 집 합체 를 형성한다는 것을 발견하였으며 (2.4), 이어서 집합체의 성분으로 HA 가 실제로 존재한다는 것이 확인되었다 (2.5). 현재로는 이 다당류 가 PG 의 중요한 집합 인자와 동일하다는 것은 의심의 여지가 없 다. HA 와 PG 단위체간의 상호 작용에 의한 PG 집합체의 형성은 연 곁 단백질(li nk p ro t e i n) 에 의하여 안정화된다 (2.6). 초기의 소의 코 연골 PG 의 집합제 조성에 관한 연구에서는, 해리성 용매에서의 밀 도구배 원심분리시의 멘 상층액에서 두 종류의 단백질이 발견되었~ 며, 이들의 전기영동 (elec t ro p hore ti c) 이동도는 분자량이 각각 51,000 고} 47,000 에 대응하는 것으로 나타났다 (2.7). 그러나 chonclrosar- coma 에서는 단지 분자량이 47,000 에 해당되는 단백질만 발견되었 다. 최근에는 훨씬 적은 양이기는 하나, 작은 분자량의 단백질보다 더 빨리 움직이는 또 다른 단백질 성분이 관찰되었다. 이들 연결 단백질들은 아주 소수성 (h y dro p hob icity)이 강하여 뭄에 용해되지 않 는다. 그러 나 세제 (de t er g en t)의 존재 하에서 나, 혹은 이 분자에 더 천수성인 기몰 도입시킨 후에는 쉽게 물에 녹아 취급이 용이해진다. 연결 단백질간의 관계는 SDS (sodiu m dodecy l sulfa te) 존재 하에서 정 제된 시료를 전기연동 방법을 사용함으로써 추가로 밝혀졌다 (2.7, 2. 8) . 분자량이 51, 000 에 해 당하는 연결 단백 질을 mercap toe th ano1 로 환원시키면 분자량이 47,000 인 단백질과 같은 이동도를 나타낸 다. 이것으로보아 생체 내에서는분자량이 51,000 인 연결 단백질의
 그림 2. 3 중간 크기 의 Prote o g ly c an 집 합체 의 전자 현 미 경 사진 (120, 00(}
그림 2. 3 중간 크기 의 Prote o g ly c an 집 합체 의 전자 현 미 경 사진 (120, 00(}
펩티드 결합은 부분적으로 분해될 수 있으며, 분해되는 팹티드 견 합은 분해 생 성 물이 여 전 히 이 황화 다리 (dis u lfid e br i d g e) 로 연결 된 곳에 위치하고 있는 것으로 여겨진다. PG 집합체의 존재 릿 이의 전반적인 모형은 전자 현미경 (그립 2.3) 으로도 확인되었다 (2.8). 여러 연구자들에 의한 PG 집합체의 모형은 하나의 HA 사슬에 많 은 수의 PG 단위제가 연결되어 있으며, HA 와 PG 간의 상호 작용 은 연결 단백질에 의해 안정화되어 있다(그립 2.4). 따라서 PG 집
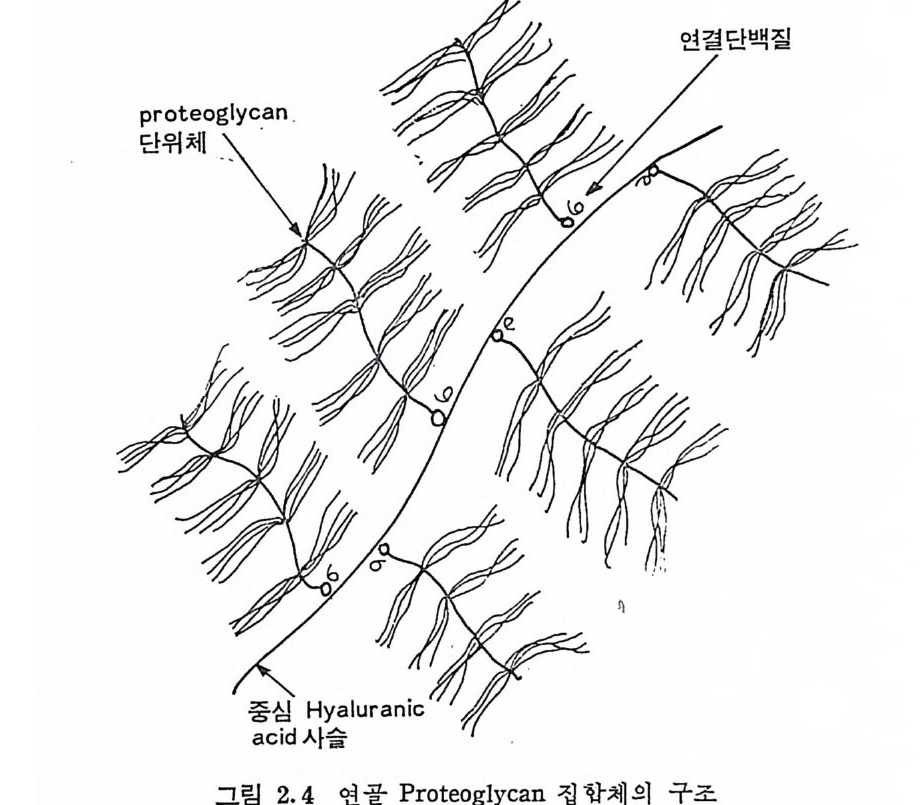 연결단백질
연결단백질
합체의 안정화는 그림 2.5 에서 보여 주는 바와 같은 ® HA 와 PG 단위체, ® PG 단위체와 연결 단백질, © HA 와 연결 단백질간의 상호 작용에 의해 이루어진다고 볼 수 있다. 앞서 언급된 HA 와 PG 단위체의 상호 작용 외에도, PG 단위체와 연결 단백질, 그리고
HA 와 연결 단백질간의 상호 작용도 확인되었다. 따라서 PG 집합 체를 형성하는 3 가지 성분, HA, PG 단위체 및 연결 단백질은 각 각 다른 두 성분과 결합하는 두 가지 결합자리를 모두 갖고 있는 것 으로 보아진다· 또한 최근에는 PG 단위체들이 스스로 집합체를 형 성할 수 있는 것으로도 해석될 수 있는 실험적 결과가 얻어졌다 (2.10).
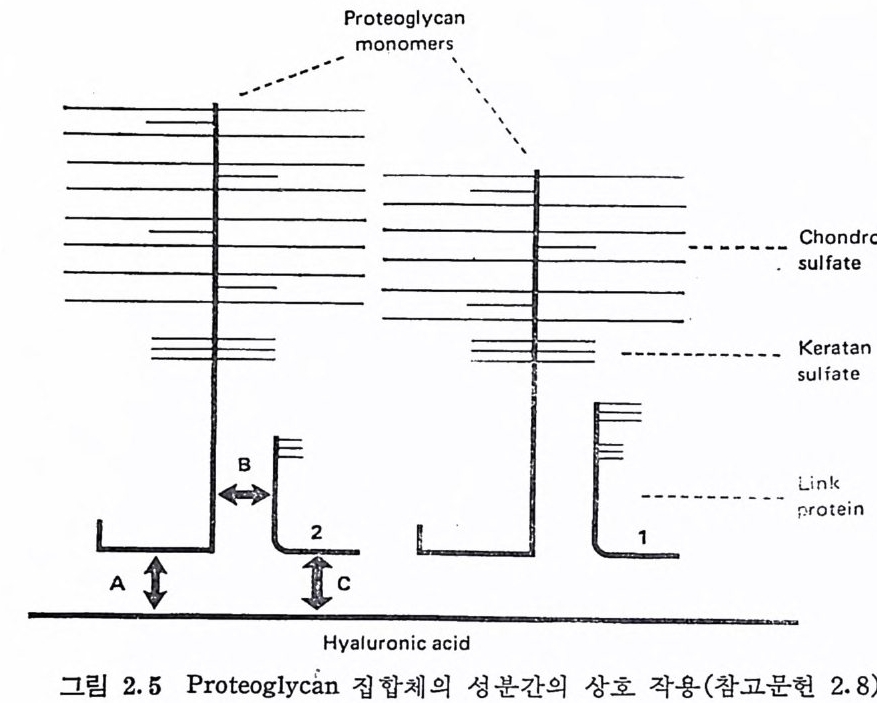 Prot eo g ly c a n
Prot eo g ly c a n
PG 단위체가 조직 내에서 큰 집합체로 형성되는 것은 이들이 연 골에 축척 되 는 데 필요한 부동화(i mmob il e) 구조를 형 성 하는 데 큰 기여믈 하는 것으로 보인다. 연골 조직의 HA 의 대부분은 이와 같 은 PG 집합체 형성에 관여하고 있다고 볼 수 있다. 2. 3 Prote o g ly c an 단위 체 조직에서 PG 은 많은 단위체가 HA 사슬에 연결된 집합체로 존제
함을 앞에서 보았다. 이 들 집합체를 형성하는 PG 단위 제 의 구조에 대 한 모형 은 이 미 1958 년 에 Math ews 와 Lozait yte(2 . 2) 에 의 해 재 안되었다. 이들은 소의 코 연골의 PG 에 관 한 여 러 물 리 화학 적 실 험을 동하여, 이 PG 은 분 자 량 이 4Xl06 정도인 중 심 단백질 (core p ro t e i n) 에 많은 수의 chondroit in sulfa te( CS) 사 슬 이 연결된 시험 관 씻는 솔 (brush) 모양을 하고 있다고 제안하였다. 이후의 많은 연 구자들에 의한, 다른조직에서 분리된 PG 의 연구에서도 이 모형과 일치 하는 결 과를 얻었으며, 이 모양은 또한 전자현미경으로도 확 인 되었 다. Hascall 과 Sajd e ra (2. 1 및 2. 3) 에 의 해 개 발된 해 리 성 용매 (예 로, 4M 구아니던 _HCI) 에서의 밀도 구배 원심분리로 이( 異 )물질이나 PG 집합체가 함유되지 않은 비교적 순수한 PG 단위체 를 용이하게 얻 는 것이 가능해졌으며, 따라서 PG 의 구조에 대한 브다 구체적인 정보가 얻어지게 되었다. PG 의 가장 전형적인 형태로 보통 소의 코연 골 PG 를 들고 있는데, 이는 제법이나 사용된 조직원에 따라 약 간의 차이가 있으나 분자량이 1Xl06~4Xl06 아며 단백질 함량은 - 7~8 % 이다. 이 PG 분자는, 평균적으로, 분자량이 2 · x105 인 중심 단백질에 분자량이 약 2Xl04 인 chondroit in sulfa te (CS) 사슬이 약 100 개 , 그리 고 분자 량이 4 X l03~8 x l03 인 kerata n sulfa te ( KS) 사 술아 30~60 개 연결되어 있다. 다당류 사술은 중심 단백질에 임의 로 무작위하게 연결되어 있다기보다는, 전체 단백질 분자의 주 축 의 20~30 곳에 1~10( 평균 4 개)씩 덩어리로 연결되어 있다(그립 2.6). PG 의 중심 단백질은 그림 2.6 에서 보듯이 끝 부분은 구형으로 되어 있으며, 이 부분에는 다당류 사슬이 연결되어 있지 않다. 이 단백질의 구형 부분이 PG 단위체가 HA 와 회합하여 집합체 를 형 성할 때 HA 의 결합 자리가 된다. CS 와 KS 사슬은 중심 단백질 에 균일하게 분포되어 있는 것이 아니라, 각각의 다당류가 많이 연 결된 단백질 영역을 갖고 있다. KS 사슬의 약 60% 는 중심 단백질 의 CS 가 많은 영역과 구형 부분 사이에 연결되어 있으며, 이 KS 가 많은 영역에는 CS 는 전체의 10% 정도만이 결합되어 있다. 이들 영역아 전체 단백질 분자에서 차지하는 비율은, CS 가 많은 영역
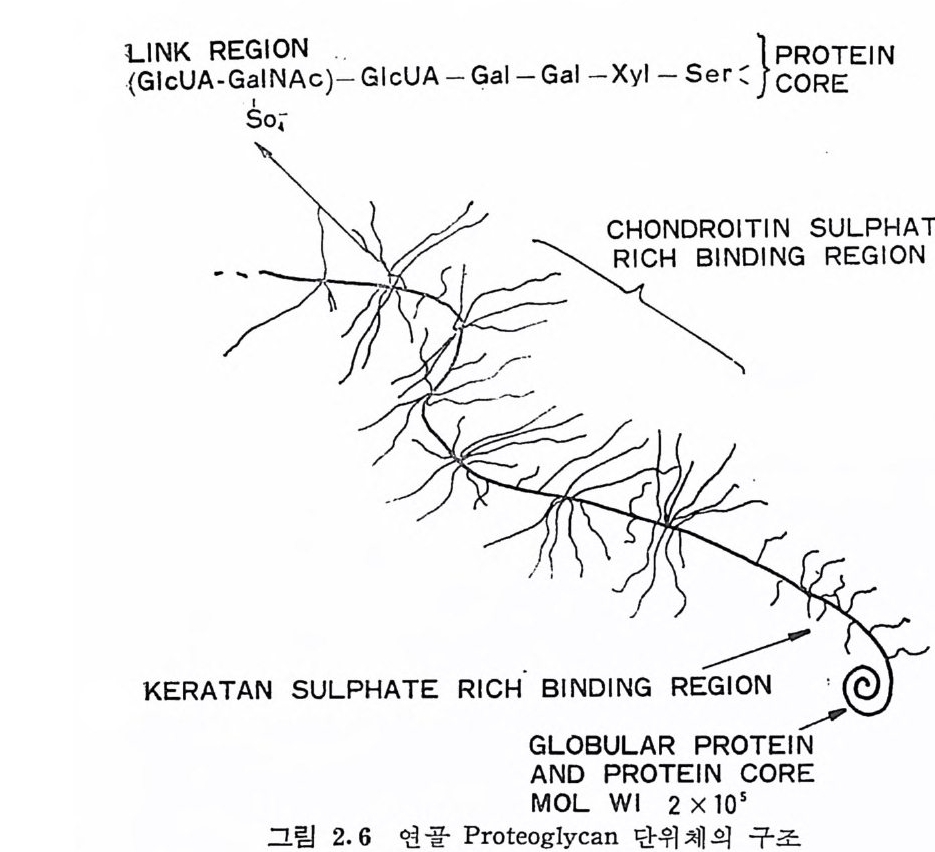 L(GlNlcKU AR-GEGaIlONNA c)- G lcUA-Gal-Gal 一 X y! —Se r : J}PcRo ROETE lN
L(GlNlcKU AR-GEGaIlONNA c)- G lcUA-Gal-Gal 一 X y! —Se r : J}PcRo ROETE lN
이 약 50% (분자량으로 1 X l05), KS 가 많은 영 역 이 약 12% (분자량으 로 2~2. 5 X 104) 그리 고 HA 결 합 부분이 나머 지 (분자량으로 6~8 X 104) 를 차지한다. 연골 PG 의 CS, KS 밋 단백질의 상대적 바울은 PG 의 원천에 따라 크게 변한다· 그러나 HA 결합 부분의 크기는 큰 차이가 없고, 따라서 PG 단위체의 분자량은 대부분 CS 가 많은 영 역의 크기에 따르는 것으로 보인다· PG 의 다당류, 죽 gly c osami no g ly c an, 사슬 (제 3 장) 및 탄수화물 -단백질 연결 부분의 구조 (4 절)는 비교적 잘 알려진 반면에 중심 단백질의 구조에 대해서는 거의 알려져 있지 않다· 소의 코연골의 PG 는 단백질 함량이 약 7% 인 것을 고려한다면, 중심 단백질은 분 자량이 약 200,000 이며 따라서 약 2,000 의 아미노산으로 구성되어 있을 것으로 판단된다. 이 중심단백질의 아미노산 조성의 분석, 단
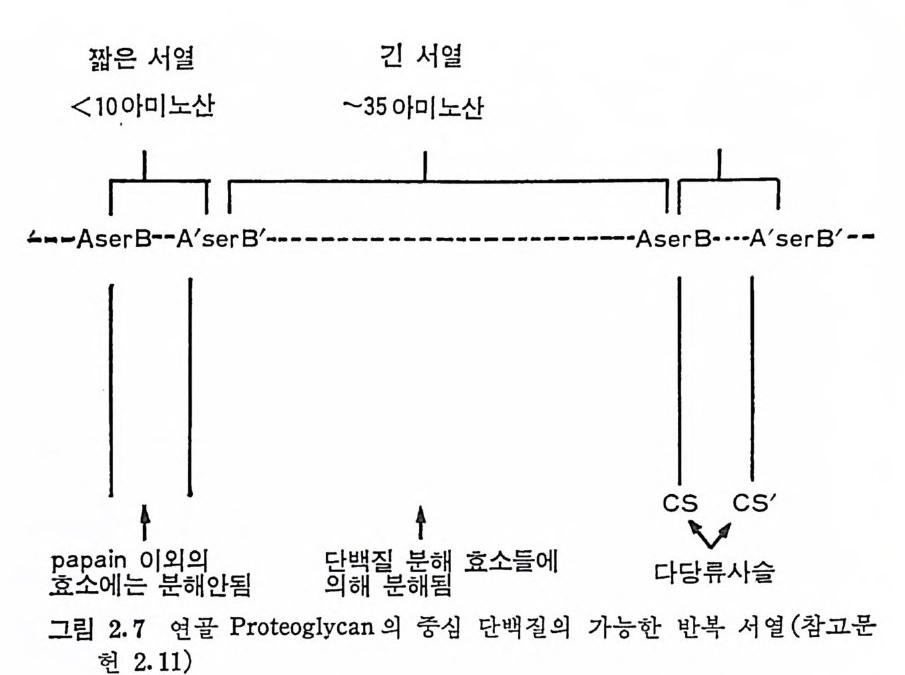 짧은서열 긴 서열
짧은서열 긴 서열
백질 분해 효소에 의한 분해 빛 면역학적 연구에서 Math ews(2.11) 는 이 단백질 분자가 짧은 펩티드 서열과 긴 펩티드 서열이 서~ 반복되면서 연결되어 있을 가능성이 크다고보고하였다(그립 2.7). Ma t hews 의 모형에 의하면, 짧은 서열은 10 미만의 아미노산으로 구성되어 있으며, 이는 적어도 하나의 글루타민산, 두 개의 gly c in e 과 두 개의 serin e 기를 포함하고 있다. 이 짧은 서열의 N 및 C 말단 se ri ne 에 다당류 사슬이 연결된다. 단백질의 긴 서열은 약 35 개의 아미노산으로 구성되어 있다. 여 러 동뭉 종 (s p ec i es) 및 조직 의 CS 형 PG 은 이의 아미노산의 조성아나 단백질 함량이 PG 의 원천에 따라 크게 변한다. 이는 연골 PG 의 중심 단백질의 짧은 서 열은 비교적 동일한 구조를 가지나, 긴 서열은 동물의 종류나 조직 에 따라 달라지는 것으로 볼 수 있다· 또한 이들 서열의 반복은 정 확하게 규칙적은 아니며 각 서열이 고분자 형태로 존재할 가능성이 있다. 지금까지 논의된 연골 조직의 PG 에 있는 다당류 사술의 주성분 은 CS 이다. 그러나 다른 다당류가 주성분인 PG 도 확인되었으나,
이돌에 관한 연구는 연골 PG 의 연구에 크게 미치지 못한다 . KS 가 탄수화물의 주성 분을 이 루는 PG 는 크게 두 종류로 구분된다. 골격 (skeleta l ) KS 라 부르는 KS 형 PG 은 주로 연공 PG 에 연결 되 어 있 다(그립 2.6 참조)· 고래의 되핵 (nucleus p ul p osus) 과같이 KS 가 다 당류의 주성분인 조직에서도 CS 가 전혀 함유되지 않은 순수한 KS 형 PG 를 분리하는 것은 가능하지 않다. 반면에, 각막기질 (corneal s t roma) 에 서 는 다당류로 KS 만을 포함하는 PG 이 존재 하고, 이 PG 울 각 막 KS 또는 kerata n sulfa te- I 이 라 부른다. (골격 KS 는 KS-II 라 부르기도 한다.) 이들 두 가지 KS 형 PG 는 이들이 존재하는 조 직이 서로 다름은 물론, 탄수화물-단백질간의 연결위치에도 차이 가 있다. 따라서 산이나 알칼리 처리시 안정성에 차이가 난다. Dermata n sul fat e(DS) 가 GAG 의 유일한 성분인 PG 는 돼지 피 부 및 소의 심장 판막에서 분리되었다. 이돌 PG 는 모두 단백질 함 량이 약 50% 이며, 분자량은 각각 3X10 헛돼지피부)와 2Xl05( 소의 심 장 판막) 정도이다. HA 도 다른 GAG 와 마찬가지로 PG 의 형태로 생체 내에서 촌재 하는가의 여부는 오랫동안 관심의 대상이 되었다. 여러 포유동물 조칙에서 얻은 HA 는 항상소량이나마 단백질을 포함하고 있어, 아 다당류가 단백질과 공유결합을 하고 있을 가능성이 크다· 초기의 관절 활액에서 분리된 HA 는 약 20% 의 단백질을 함유하는 것으로 보고되었으나, 이돌의 대부분은해리성 CsCl 밀도구배 원심분리에서 제거되며 단지 2~4% 만 남아 있게 된다. 그러나 이 정제된 HA 는 ECTEOLA-Cellulose 상에 서 의 chromato g r aph y 에 의 해 서 도 0, 35 % 의 단백질은 제거되지 않는다. 더우기 단백질을 125 I 로 표시하고 4M 구니아딘 -HCl 용액에서 CsCl 밀도 구배 원심분리를 시키면 방 사능은 HA 와 같이 존재한다 (2.12). 이와 같은 사실들은 HA 도 단 백질에 공유결합을 한 PG 의 형태로 존재함을 제시하기는 하나, 보 ` 다 확실한 중거는 단백질에 연결된 HA 의 o lig osaccbar i de 의 확인’ 에 서 얻 어 질 수 있 다· 그러 나 아직 까지 이 olig o saccharid e 는 확인’ 되지 않았다. Hepa rin ( HP) 은 생합성 과정에서는 아주 큰 분자량의 착물로 얻
어 지 나, 어 떤 조직 에 서 는 endog 1 ucuronid a se 에 의 해 세 포 내 에 서 분해되는 것으로 여겨진다 . 결합조직의 PG 들의 탄수화 물 - 단백질 연결 이 보통 Xy l- Ser 으로 구성 되 어 있 다는 중거 는 hep a rin 의 분리 과정에서 처음으로 확인되었다. 그러나 HP 형 PG 의 확인은 거의 최 근에 야 이 루 어 졌 다. Horner(2. 13) 는 쥐 피 부 윤 심 하게 pro nase 로 작용 시 킨 후에도 분자량이 약 106 이상이 되는 거대분자의 HP 가 존 재함을 보고했다. 여기서 단백질 분해효소 의 작용은 CS 형 PG 를 완전히 분해시키 므 로 , 이 거대한 HP 분자가 PG 일 것 이라는 것은 고려되지 않았다 . 단지 분자량 이 약 36,000 인 HP 사슬 이 중심 단 백질과는 다른 〈어떤 연결구조〉에 의해 서로 결합되 어 있다고 제시 되었다. 이 〈거대분자〉 HP 이 실제로 PG 이라는 것은 1978 넘에야 Rob i nson 등에 의해 밝혀졌다 (2.14). 이 HP 형 PG 는 분자량이 900, 000 을 상회 하며 , 분자량이 약 80, 000 인 10~15 개 의 HP 사슬 을 포함하고 있다. 이 PG 는 연골의 CS 형 PG 와 마찬가지로, 하 나의 중심 단백질에 많은 수의 HP 사슬이 연결되어 있다· 그러나 중심 단백 질은 다른 PG 의 단백 질 과는 달리 단지 gly c ine 과 serin e 만으로 구성되어 있으며, 적어도 ser i ne 의 2/3 에는 HP 사슬이 결 합되어 있는 것으로 나타났다. 이와 같은 HP 형 PG 의 구조적 특 성으로 인하여, 이 PG 는 pr onase 나 다른 단백질 분해 효소에 의 해 영 향을 받지 않는다• 그러 나 NaBH4 존재 하의 강알칼리 성 에 서 는 분해되어 말단(t erm i nal) x ylitol 기를 생성한다. Hep a ran sul fat e(HPS) 는 hep a rin 과 구조적 으로는 극히 유사하 나, 생물학적으로는 완전히 다른 물질로 여겨진다. 이 다당류의 PG 는 거의 모든 세포의 표면에 존재한다. 쥐 간의 세포막에서 분라된 HPS 형 PG 는 분자량이 약 80,000 이며, 평균 분자량이 14,000 정 도인 HPS 사슬 4 개 가 17, 000~40, 000 범 위 의 분자량을 갖는 중심 단백질에 연결되어 있다 (2.15). 이는 앞서 언급된 HP 형 PG 의 분 자량이 900,000 이며, HP 사슬이 10~15 개로 구성되어 있다는 것 과는 아주 대조적이다· 또한 HP 형 PG 의 중심 단백질아 gly c ine 과 ser i ne 으로 구성되어 있는 반면, HPS 형 PG 의 단백질은 일반 적인 단백질의 아미노산 조성을 갖는다. (HP형 PG 는 심한 단백
칭 분해에 의해 얻어지므로, 중심 단백질의 일부는 분해되어 제거 되었을 가능성은 있다.) 2.4 탄수화물-단백질 연결 Prote o g ly c an 의 탄수화물 성 분인 gly c osami no g ly c an 의 주축은 반복되는이당류 단위제로구성되어 있다. 그러나 이들이당류 단위 체의 여하한 성분도 PG 에서의 단백질―탄수화물 연결에 관여하지 않는다. 따라서, 이 연결 부분은 GAG 의 주성분과 구분하여 취급 하는 것이 바람직하다. PG 의 탄수화물―단백 질 연결 부분은 표 1. 1 의 gly c op r ote i n 의 연결 구조 중에서 다음 표에서 정리된 3 종류만이 관찰된다· 이들
표 2.1 Pro t eo g l y can 의 탄수 화물_단백 질 연 결 연 결 유 형 탄수화물一아미노산 Prote o g ly c an 0-gl y c osid i c Xy l- .Ser(OH) CS. HP, HPS, KS 0-gl y c osid i c GaINAc-,.Thr 혹 은 Ser(OH) 골격 KS (KS-]I ) N-gl y c osid i c GlcNAc---.Asn(NH2) 각막 KS(KS 一 I)
연결의 형태는 그림 1.1 및 1.2 에서 도시된 바와같다· 표 2.1 에서 볼 수 있듯이 KS 울 제 외 한 모든 PG 은 D-xy lo se 와 serin e 의 OH 기 사이에서 연결이 이루어져 있으며, 이와 같은 연결은 포유 동물 의 다른 gly c op ro te i n 에 서 는 아직 확인되 지 않은 PG 의 특징 중의 한 가지이다. 앞서 언급된 PG 의 탄수화물-단백질 연결 및 연결 부분의 구조 는 대략 다음의 과정 (g l y co p ro tei n 에서도 동일하게 적용됨)에 의해 규명된다. 1. PG 의 분리 빛 정제 2. 단백질 분해 효소 빛 다당류 분해 효소에 의한 가수분해· 3. 2 의 분해 과정 에 서 생 성 된 oli go saccharid e -p e p tide 의 분리 및 구조 확인·
이 와 같은 과정 을 통하여 PG 의 연결부분은 주로 Chic a g o 대 학의 Roden 연구실에서 규명되었으며, 다음에서는 CS 형 PG 의 연결부 분을 구체적 예를 들어 그 결과물 기술한다. CS 형 PG 에 hy a luronid a se 를 작용시 키 면 CS 사술은 분해 되 나, CS 의 주사슬과 단당류의 조성이 다른 탄수화물―단백질 연결부분 은 영향을 받지 않는다· 따라서 연결부분은 PG 를 hy a luronid a se 로 작용시킨 후, 단백질을 분해시켜 얻어진 생성물을 g el 여과하면 용이하게 얻어진다. 물론 단백질 분해믈 먼처 수행하고, 다음에 hy aluron i dase 를 작용시켜도 동일한 결과를 얻을 수 있다. 여기서 분리된 연결부분은특이 효소와의 작용및 알려진 구조를 갖는 물질
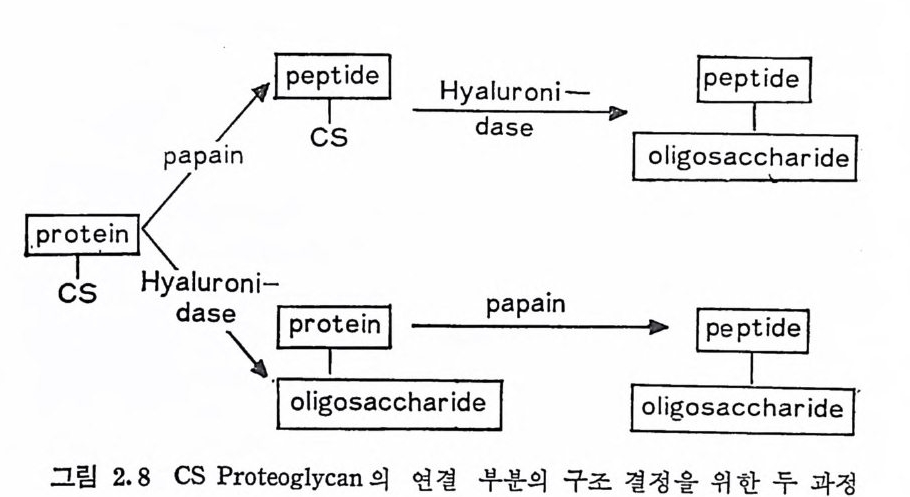 三pa; pu a/s irn o -.무邑e루's s acc harH i dyedap]I aua srp eo a n; ni -曰 「o h g루 o言sa cccc `됴ha 리러
三pa; pu a/s irn o -.무邑e루's s acc harH i dyedap]I aua srp eo a n; ni -曰 「o h g루 o言sa cccc `됴ha 리러
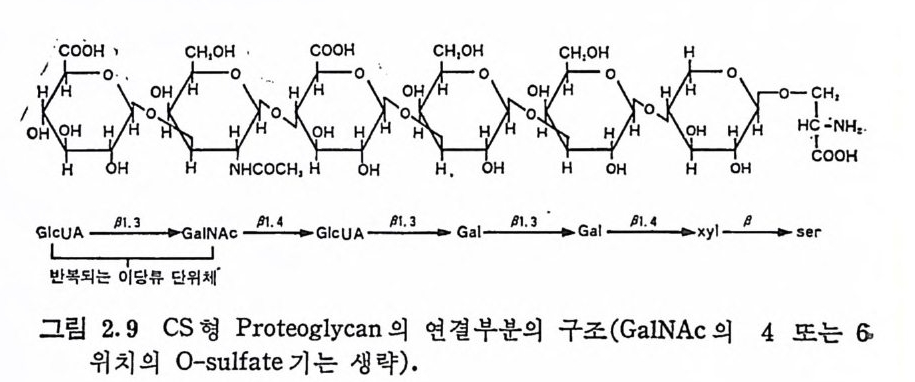 틀co0H《 、 C三H,OH , 0 :틀 COOH \CH\,OH :-CH, OH H EH HH,
틀co0H《 、 C三H,OH , 0 :틀 COOH \CH\,OH :-CH, OH H EH HH,
의 유도체와의 비교에서 그 구조 가 그 림 2.9 와 같음 이 확 립되었 다. 그림 2.9 에서 보여 준 CS 형 PG 의 연 결 부분의 구조는 척추 동 물 에 관 한 한 PG 의 원천 에 무 관 하게 동일하다. 그러나 무척추 동물 의 연 골 에서 얻어전 CS 형 PG 의 연결부분은 그림 2.9 의 구조와는 약간 차이가 있 을 것 으로 여겨진다. 예로, 오칭어 연골의 연 결 부분 은 Gal : Xy l : Ser 의 비 가 거 의 1 : 1 : 1 이 며 , 참게 (horseshoe crab: Li m ulus po lyp h ems) 에 서 는 Gal 나 Ser 에 비 해 월 등히 많은 xy lo se 폴 포함하고 있다. 이들의 CS 의 다당류 주사슬도 전형적인 CS 의 사슬과는 su lf a t e 함량에 약간의 차이가 있다. Dermata n sulf ate , hep a rin 및 hep a ran sulfa te 의 PG 는 CS 형 PG 와 동일한 연결 구조를 갖는다· 그러나 이미 언급한 바와 같이 KS 에서는 이들과 다른 연결 구조를 하고 있다. 각막 KS(KS -I )은 GlcNAc 와 Asn 의 NH 떠 사이 에 알칼리 에 서 안정 한 N-g ly c osid i c 연결 을 하는 반면 에 , 골격 KS(KS-Il )는 알칼 리 에 서 불안정 한 0-gl y c csi: lic 연 결 을 GalNAc 와 Ser 또는 Thr 의 OH 기 사이 에 하고 있 다. 이 들 KS 는 모두 sia l i c a c id, fu cose 및 mannose 등을 소량 포함하고 있다. KS-I 의 GlcNAc-Asn 연결은 mannose-GlcNAc 핵 을 갖는 gly c op ro te i n 의 전형 적 인 탄수화물― 단백질 연결의 유형이며, 따라서 이 PG이 mannose 를 함유하는 것은 충분히 예상할 수 있다. 골격 KS 의 구체적인 연결부분은 아주 복잡하며 아직도 명확하 지가 않다. 이 KS 는 단백질에 연결된 N-ace ty l g alac t osam i n y l 기 의 C-3 위 치 에 N-acety ln eurami ny l ga lacto se 가 연결되 어 있고, KS 의 주된 다당류 사슬은 C- 6 위치에 연결되어 있는것으로 여겨진다 (2.16). 그러 나 이 PG 에 서 흔히 발견되 는 mannose 및 fu cose, 그 리고 GlcNAc 에 비해 과량으로 존재하는 Gal 의 정 확 한 연결 위치 는 아직도 밝혀지지 않았다. 다만 mannose 는 연결부분 또는 이와 가까운 곳에 위치하고 있는 것으로 짐작되고 있다. KS 의 사슬이 반복되는 이당류 단위체로 구성되어 있으며, 에스 테르화된 황산기를 갖는다는 점에서는, KS 는 다른 PG( 또는 GAG) 와 유사하다· 그러 나 uronic ac id 를 포함하지 않으며 , 반복되 는 이
당류 단위체가 많은 g l y co p ro t e i n 에서 발견되는 것들과 아주 비슷 하다는 점에서는 PG 보다는 g l y co p ro t e i n(PG 와 구 별한 때)의 범주 해 포함시킬 수 있다· *추천문현 RI . H. Muir and T. E. Hardin g h am, Str u ctu r e of Prote o g ly c ans, in 1v.1' T P Inte r n. Rev. Sci. Bi oc hemi st r y Ser. One, Bi oc hemi st r y of carbohy d rate s , edit ed by W. J. Whelan. Balt imo re: Univ . Park Press, 1975, Vol. 5, p. 153-222. R2. U. Lin d ahl and L. Roden, Carbohy d rate - pe p tide link ag e s in pro te o - gly c a ns of anim al, pla nt and bacte r ia l orig in. In Glyc o p rot e i n s , edit ed by A Got tsc halk, 2nd Ed. , Elsevie r , Amste r dam, 1972, P. 491-517. *인용문헌 2. I. S. W. Sajd e ra and V. C. Hascall, Prote i n p ol ys a ccharid e comp le x from bovin e nasal carti lag e: A Comp a ris o n of low and high shear extr ac ti on pr ocedures, ]. Bi ol . Chem., 244, 77 (1969) . 2. 2. M. B. Math e ws and I. Lozait yte, Sodiu m chondroit inp r ote i n com- ple xes of cart i la g e . I. Molecular weig h t and shap e , Arch. Bi oc hem. Bi op lzy s. , 74, 158(1958) . 2. 3. V. C. Hascall and S. W. Sajd e ra, Prote i n p ol ys a ccharid e comp le x of bovin e nasal carti lag e: The fun cti on of gly c o p ro te i n in the for mati on of ag gr eg a te s , J. Bi ol . Chem. , 244, 2384 (1969) . 2. 4. T. E. Hardin g h am and H. Muir , The spe cif ic int e r acti on of hy al -uronic aci d wi th carti la g e pro te o g ly c a n, Bi oc him . Bio ph y s. Acta , 279, 401 (19 72). 2. 5. T. E. Hardin g h am and H. Muir , Hy al uron ic acid in carti lag e and pro te o g ly c a n ag gr eg a ti on , Bi oc hem. ]., 139, 365 (1974). 2. 6. T. E. Hardin g b am, The role of lin k -pr o te i n in the str uc tu re of carti lag e pro te o g ly c a n ag greg a te s , Bi oc hem. ]., 177, 237 (1979) . 2. 7. B. Cate r son and J. R. Baker, The lin k pro te i n s as spe cti c comp - onents of carti lag e pro te o g ly c a n ag gr eg a te in viv o , J. Bi ol . Chem. , 254, 2394 (1979) 밋 이 에 인용된 문헌 . 2. 8. B. Cate r son and J. R. Baker, The int e r acti on of lin k pr ote i n wi th
pr ote o g ly c an monomers in th e absence of hy a luronic ac id, Bi oc hem. Bi op hy s . Res. Commum, 80, 496 (1978) . 2. 9. L. Rosenberg, W. Hellmann and A. K. Klein s chmi dt , Electr o n mi cr oscop e stu d ie s of pr ote o g l yc an ag gr eg a te s from bovin e nasal carti lag e , ]. Bio l. C!z e m., 250, 1877 (1975) . 2. 10. J. K. Sheehan, I. A. Ni ed uszy n ski, C. F. Phelps , H. Muir and T. E. Hardin g b am, Self- a ssoc iat i on of pr ote o g ly c an subunit s from pig laryn g e al carti lag e , Bi oc henz. ]., 171, 109 (1978). 2.11 . M. B. Math e ws, Comp a rati ve bio c hemi st r y of chondroit in sulph -ate pr ote i n s of carti lag e and noto chord, Bi oc hem. ]. 125, 37 (19 71) . 2. 12. I. Scher and D. Hamerman, Isolati on of human sy no via l -flu i d hy al uronate by densit y-gra die n t ult ra centr i f uga ti on and evalu-ati on of its p r ot ei n conte n t, Bi oc hem. ]., 126, 1073 (1972) . 2. 13. A. A. Horner, Macromolecular hep a rin from rat skin : Isolati on characte riza ti on , and dep o lym e riz a ti on , J. Bi ol . Chem. , 246, 231 (1971). 2. 14. H. C. Robin s on, A. A. Horner, M. Hook, S. Og r en and U. Li n - dahl, A pr ote o g ly c an for m of hep a rin and its deg r adati on to · sin g le - ch ain molecules, J. Bi ol. Chem., 253, 6687 (1978) . 2. 51 . A. Oldberg, L. Kj el len and M. Hook, Cell-surfa c e hep a raa sulfa te: Isolati on , characte riz a ti on of a pr ote o g ly c an from rat live r membranes, J. Bi ol . Chem., 254, 8505 (1979) .
제 3 장 Glyc o sami no g ly c a n 의 일 차구조 Prote o g ly c an 의 탄수화물 부분인 gly c osami no g ly c an 은 대 체 로 반복되는 이당류 단위체로 구성되어 있으며, 이 단위체의 화학적 구 · 조에 따라 6 종으로 구분된다(표 1.3). Muco p ol y sacchar i des 의 생 물학 적인 기능은 이들의 물 리 화학적 특성에 기인되며, 이 특성은 일차 적 으로 GAG 의 화 학적 구조에 의해 결정된다. 이 장에서는 조 직에서 GAG 를 분리하여 화학적 구조를 결정하는 방법과 그 결과 · 롤 기술한다. 3. 1 Glyc osami no g ly c an 의 분 리 조직에서 GAG 를 분리시키는 것은 제 2 장에서 논한 자연상태의 PG 를 분리시키는 것보다는 훨 싼 간단하다. 이 경우에는 PG 의 중 심 단백질을 분해시키거나 탄수화물-단백질 연결을 파괴시키는 보 다 강력한 방법도 적용될 수 있다. HA 의 경우는 보통 단순한 물 또는 식염수 용액으로 이 다당류 몰 분리시키는 것이 가능하지만, 다른 GAG 에서는 알칼리나 단백 질 분해효소를 작용시켜 조직 (이에서 분리된 PG 포함)에서 탄수화물 ~ 을 방출시 킨다. CS 형 PG 등 대부분의 PG 는 xy lo se-seri ne 연결 울 하고 있으며, 이 연결은 알칼리 처리과정에서 쉽게 분해된다. 그러나 알칼리 처리에 의해 생성된 탄수화물 사술도 알칼리성 용액
에서 계속 분해되므로 , 특정한 연결 부분을 유지시키기 위해서는 알 칼 리 처리시 붕수소화물 (예로 NaBH 4 ) 을 첨가하여 x y lose 률 xy litol 로 환원시켜 더 이상의 탄수화물 분해를 피 할 필요성이 있다. 이와 같은 알칼리 처리 과정의 복잡성으로 인하여, 최근에는 알 칼 리 처 리는 xy lo se-serin e 연 결을 다몬 연결 (hy d roxy am i no 산에의 연결)과 구분하기 위해서만 사용되는 실정이다. 조직에서 GAG 를 방출시키기 위한 가장 보편적인 방법은 pa p a in 과 같은 단백질 분해 효소의 작용이다· 보통은 광범위한 목이성을 갖는 단백질 분해효소를 이용하여 격심하게 단백질을 분해시켜, 단 지 작은 찬여 펩티드만이 탄수화물 사슬에 남아 있게 하는 것이 바 람직하다· 그러나, 연결부분의 구조나 이 부근의 단백질의 구조를 연구하기 위해서는 보다 선택적인 효소를 사용하는 것이 요구된다. 단백질을 가수분해시칸 후, 탄수화물 성분을 분별하여 분리시키 기 위해서는, 분해 산물에 포함되어 있는 처분자량의 생성물과 소 량의 찬여 단백질을 제거하는 것이 요구된다. 이를 위해서는 tri - ·ch loroaceti c a ci d 로 단백질을 침전시켜 제거한 다음에, 여액을 두 석 (di al y s i s) 시 키 는 것 이 사용된 다. 그러 나 두석 과정 에 서 HP, HPS 나 KS 와 같은 처분자량의 다당류가 소실될 가능성이 있다(이는 두석 듀브를사용전에 약 85°C 에서 3 일 정도건조시킴으로써 막 을수 있다). 두석에 대한 대응 방법으로에타놀이나 4 가 암모늄염 에 의한 침전을 이용한 GAG 의 정제가 대량의 다당류를 얻기 위하 여 사용되나, 이 방법에 의한 생성물은 약간의 불순물을 포함하고 있을 가능성이 크다. 눈의 유리체에서의 HA 또는 연골조직의 CS 와 같이 한 종류의 다당류가 주성분인 조직에서는 GAG 를 다시 분별할 필요성이 없 다· 그러나 대부분의 조직에서는 여러 종류의 다당류가 혼합되어 존재하고, 이들을 GAG 유형에 따라 분별하는 것이 필요하다. GAG 의 분별은 이돌간에 촌재하는 전하밀도의 차(예로 이당류 단위제당 HA 는 1, cs 는 2 그리고 HP 는 약 3.5) 와 에타늘에서의 용해도 차이를 이용하는 것이 보통이다. 에타놀에 의한 분별침전은 가장 간편한 반면에, l~2% 의 높은 다당류의 농도 및 충분한 염 (보동 식
초산염)의 존재룹 필요로 한다. 또한 KS 경우는 에타늘의 농도가 아주 높지 않으면 침전이 얻어 지 지 않는다. 이 방법 은 화학 구조가 극히 유사한 Cb4 -S, Cb6-S 및 DS 의 분별에도 적용된다. 예로 돼지 피부의 DS 와 CS 혼합문 은, 에타놀 농도가 30% 이하에서는 DS 가, 그리고 40% 이상에서 는 CS 가 침전된다. (D S 의 COOH 기는 CS 의 COOH 기에 비해 훨 싼 약산이다.) 다당류간의 전하밀도차를 이용한 또 다른 분별 방법으로는 전기 영 동법 , 이 온교환 chromato g rap h y , 4 가 암모늄염 에 의 한 침 전 등 여러가지문 들 수 있으며, 이들의 구제적인 내용은 참고문헌 Rl 에 잘 정 리 되 어 있 다. 다만 이 책 에 서 는 cety lp yridi n ium chlor ide (CPC)-cellulose 상에 서 여 러 다당류를 chromato g rap h y 에 의 해 분 별한 결고日卜 보임으로써 다당류간의 분별 서열의 일반적인 경향을 보이고자 한다.
표 3.1 CPC-cellulose column 에 서 의 GAG 의 분별 에 사용된 용리 액 (eluent) Eluent 용충된 다당류 1. 1% CPC Kerata n sulf at e 2. 0.3M NaCl Hy alu ronic aci d 3. 0. 3M Mg C 12 Hep a ran sulf ate 4. 40% pro p an ol-20% meth a nol Chondroit in 4-sulf at e -1. 5 % aceti c aci d 5. 0. 75M Mg C 12-0. lM aceti c acid Chondroit in 6-su lfat e 6. 0. 75M Mg C I2 Dermata n sulf ate 7. 1. 25M Mg C l2 Hepa rin
이 표에서 용리액의 이온 강도가 중대할 때 용리되어 나오는 다당 류의 순서 는 KS>HA>HPS>Ch4 -S >Ch6 -S >DS>HP 이 며 , 이 는 이들 다당류의 전하밀도의 서열과 거의 일치하고, 에타늘에서의 용 · 해도 서열과는 반대가 된다. 따라서 GAG 간의 에타늘에 대한 용해 도 차이도 전하밀도에 기인된다고 해석할 수 있다.
3. 2 Glyc osami no g ly c an 의 화학적 분석 조직에서 분리, 분별된 다당류의 목성은 분자량이나 거시적인 ~ 자형태로 규정될 수 있으나, 일차적인 특성은 이들의 화학적 성분 으로 결정되어진다. 표 3. 2 는 미 국의 국립 보건원 (Nati on al Insti tut e of Hea lt h) 의 지 원 으로 시 카고 대 학의 Math ews 와 Cif on ell i 교수가 세 계 의 여 러 학자 들에게 GAG의 표준시료로 제공하고 있는 GAG 의 분석결과를 요 약한 것이다. 여하한 GAG 에 대해서도 절대적인 표준시료는 존재 할 수 없으며, 따라서 이 표는 어떤 특정한 분리 조건에서 기대될 수 있는 결과의 전형적인 예로는 참조될 수 있다. 이 표에서 사용 된 화학적 분석방법은 다음과 같으며, 아돌은 GAG 분석에 많이 이 용된다. 1. 질소 : Kj el dahl 방법 을 이 용한다. 2. Uronic ac id : Di sc he(J . Bio l Chem. 147, 189(1947)) 의 carbazole 방법 에 의 한 홉광도의 측정 에 서 구한다. IdUA 와 GlcUA 는 서 로 발색 정도가 다르며, KS 는 uronic a ci d 의 특성이 아닌 황 색을 띤다. 3. Hexosami ne s : 개 량된 Elson-Morga n 법 (Bio c hem. ]. , 27, 1824 (1933) )에 의한 발색법을 이용한다. N-sul fat e 된 hexosami ne 은 빨리 분해 하므로 N-acety la ti on 이 필요할 경 우가 있 다. 4, Sulf ate : 산성 에 서 가수분해 에 의 해 방출된 S04= 몰 BaCI2 로 침 전시 키 고 ge lati n 에 서 혼탁도를 분광학적 으로 측정 한다. N- sulf ate 기 는 약한 산성 가수분해 나 HN02 와의 반응을 이 용하 여 0-sulf ate 기 를 가수분해 시 키 지 않고도 측정 될 수 있 다. 5. 아미 노산 빚 기 타 당류 : 아미 노산 분석 기 나 chromato g r aph y 방법 (Carbohyd r. Res., 12, 39(1970)) 을 이 용한다. 7. Hexosam i ne 의 비 : 아미노산 분석기에서 측정된다. 8. Uronic acid 의 비 : NaBH4 로 환원시 킨 후 분해 시 켜 분석 한 다.
μ어μ여ω앙Z mgω검되|μ∞ .어it 。∞N. @.{N 。。. ∞。N. .。{{ [ ·〕(a。 i .。h i& 。.∞∞。 h.}。(。 .{。{ < N@---t- 잉$」i어ωm디강μ여gμ다N “lmSωm얻여i〕ω’Ri; … } ·h.여NN .N@ * N.∞.NN*∞ .‘”。.∞*a { .。.。N。 N.N。-φ- +.μi..‘. 〕{(.(。〕。(.a〕} @]-.i。v - am(a i.。。N。.va ma (.〕。。∞iv。。- - .。。a∞p.。(}。 .m。∞{。- - ia 。∞+。암+ (‘m〕(〕。 N iω다{써Qμi[ -.N 띠.。i .m%N h.Nh “μ .μ... ..μ.. .{。。。 。-iv。 - ]-N -[( ..μ.. •μi -.。{ a 강。+ 。(‘i〕(vi y 〕 i(γ쩌y ELQ섭i섭5 “-…iN닐ι-잉- .φN m.[m ω·{ m 어{.{ {。. m.a (。(〕〕· ][ 。.{.m。 ‘“」 .ι.. ‘. 4k‘ .i... .μ... l。g ‘。(띠(〕
)u-sS며Qmh이{g양뺑이예벼5패{Z{다 。어쉰·다。。μι:되Q。i〕·영{:F1:다잉u”;。}Q·다< c { Qυi【m@*〕어v-”l@“얻잉잉-mI}aS 여。.{..@Nm ∞.여N.。엉.∞Nh i v ∞.*∞.m.。h[ mN - a。..。∞.@。。(a ] +。*。.k. ‘[ •。@*.. ‘N예J .(.〕.[。]a]。()(a { ){(( ()(〕。·..“μ<.. .... 。]。n〔.(。〕N.‘*Y。.a a ( 。{{。。.]。。。-.Na - ( (.‘〕.。‘.。iv。。μ.a . . .。N(。。{。(띠(〕.〕。【.〕 m-{。(.〕。‘.。어{a“- a |。엽@。@·。엽l l 〕()〕(‘*。 m〕()。(‘@。(‘〕(。N〕여 N{ 다·ui。”。ι효5{gN뼈 · % 짜서~ 업m되L써꾀iu며。auω김 띠여ωωa”。%g업다 a잉5{업벼검ag강mMω。” Sdu”ωaω μ여(m”여iQ]]……… [a쩌Nm”gU。‘O잉iim 5g。um어aωα 3 {a”」、i aμωm ak되-선 a<잉 ii akio 없[g] 밤{。쾌K5592 성인olasc t 각소막 공연 4 -1 -14 6~5155~1235 3,31
J5 40n 8 6131 48[2 05 7d evrrev ronr eusrtgii지직점 연돼의 조막물neor n파Uh품 산 (pa)부j허소상ip H 의 원천료 시ntor 사c중(연람 g의 소he배리nso 의out 댓 rdo) 공 부 골 --1 32 1--34--3 4-12- 53집Cu-품처 3 +리상+을 - 4전 '리`,방분법제 정 Id rAAUl:GcU 44:66 9: 8 337 :6 uSle S6-. 9%S S-2 6 47 4-4 8%%39% tfa% 14r치 위61%1- 5S - ,4SS4 4% %6- Neusl 6 -e-N lustafaftS-6 %7 % a무:게 omlo rcule naoa: s bmm sc e .Geaa0nltiti,g 은 또 는비 하 한 대10 0이에 : c a M 6 aK= K ( 적 장험 실 산의 계 까〔 서 식까에〔서값 ) 및조참에 d 5M .~0 2.Nd l raC:0 g/i. ) 됨 안정 시명추 는도 농 (영로 a.rr 5l 2e 4.a mo .:heohCG .3 g t:1 .yp 침 ;침온P이과C ;작용n api;ap전C눌타 전 여에교환 :f 조참 문본 은법방 석분B emorP 4DS2C 6-hC S,.-4hl SCs h,raulo 3v,ue siit ].(: gg이 한는 및 에석소분의효 류 당 en 8)a9(1 s o055le13~uco541l, m24561 emu!s-N. igtaf에 입 과결바 는한 대이들의 구체적인 방법은 참고문헌 R1 럿 이에서 인용된 참고문헌 의 참조플 추천한다. Uronic ac id 의 조성 은 오랫 동안 GAG 의 일 차구조에 있 어 서 콘 관심의 대상이 되었으며, 이의 결정은 앞서 언급된 많은 방법들% 복합적으로 이용하므로 다음에서 종더 구체적으로 취급하고자한다. Tay lo r 동 (3. 1) 은 HP 와 HPS 를 NaB3H4 로 환원 시 켜 얻 은 생 성 물 울 산 가수분해 시 켜 uronic acid 의 조성 을 방사능 chromato g r ap h y 로 측정하였으며, 이 반응의 과정은 그림 3.1 로 요약된다. 죽, 다 당류를 상온에 서 1-eth y l- 3-(dim eth y la mi no p ro p yl) -carbodii mi de (EDC) 로 pH 4. 75 에 서 반응시 킨 후, 삼중수소 (3H) 로표시 된 NaB3H4 와 50°C 에서 반응시켜 COOH 기를 환원시킨다· 두석으로정재한 시 료를 건조시키고 4N H2S04 로 100°c 에서 가수분해 (황산기 및 다당 류 사슬이 분해됨)후 HN02 로 아민기를 제거하고, 생성된 알데히 드기는 다시 방사능으로 표시되지 않은 NaBH4 로 환원시킨 후 방 사능 chromato g r aph y 에 서 분석 한다. 이 때 다당류의 L-idu ronic ac id 는 L-[3 H ]id o san ( II ) 과 L-[3 H )id i t o1 ( ill ) 로 얻 어 지 며 , D-gl u- curonic a ci d 는 D- 〔3 H)g lu cit ol(V) 이 된다· 또한 g lucosam in e 은 방사능으로 표시되지 않은 anh y dromann it ol(N) 로 전환된다.
표 3.2 에서 볼 수 있듯이 GAG 의 당류 성분의 분석에서는 uronic acid 와 hexosami ne 의 비 가 반드시 1 : 1 로 나타나지 않는다. 이 는 일차적으로는 이들의 분석방법에 기인된다. uronic a ci d 와 he- xosam i ne 은 모두 다당류를 가수분해시켜 얻어진 산물을 발색시켜 정 량되 는데 , 많은 양의 가수분해 산물은 가수분해 과정 에 서 다시 분해 되 어 소실 된다· 또한 glu curonic ac id 와 idu ronic ac id 는 발 색정도가 서로 다르다. 이와 같은 분석방법에 의한 오차는 표 2.3 에 서 HA, Ch4 -S 및 Ch6-S 는 거 의 비 슷한 uronic ac id 와 hexo- sami ne 의 비 를 보이 나 (이 들은 모두 glu curonic ac id 만 포함하고 있으며 hexosam i ne 의 양은 가수분해 손실을 고려한 양임), 다른· 다당류에서는 크게 차이가 있는 것에서 반영된다. uron ic a ci d 와 hexosami ne 의 비 가 1 : 1 로 나타나지 않는 또 다른 이 유는 GAG- 단백질 연결부분의 탄수화물에 기인된다. 연결부분은 반복되는 이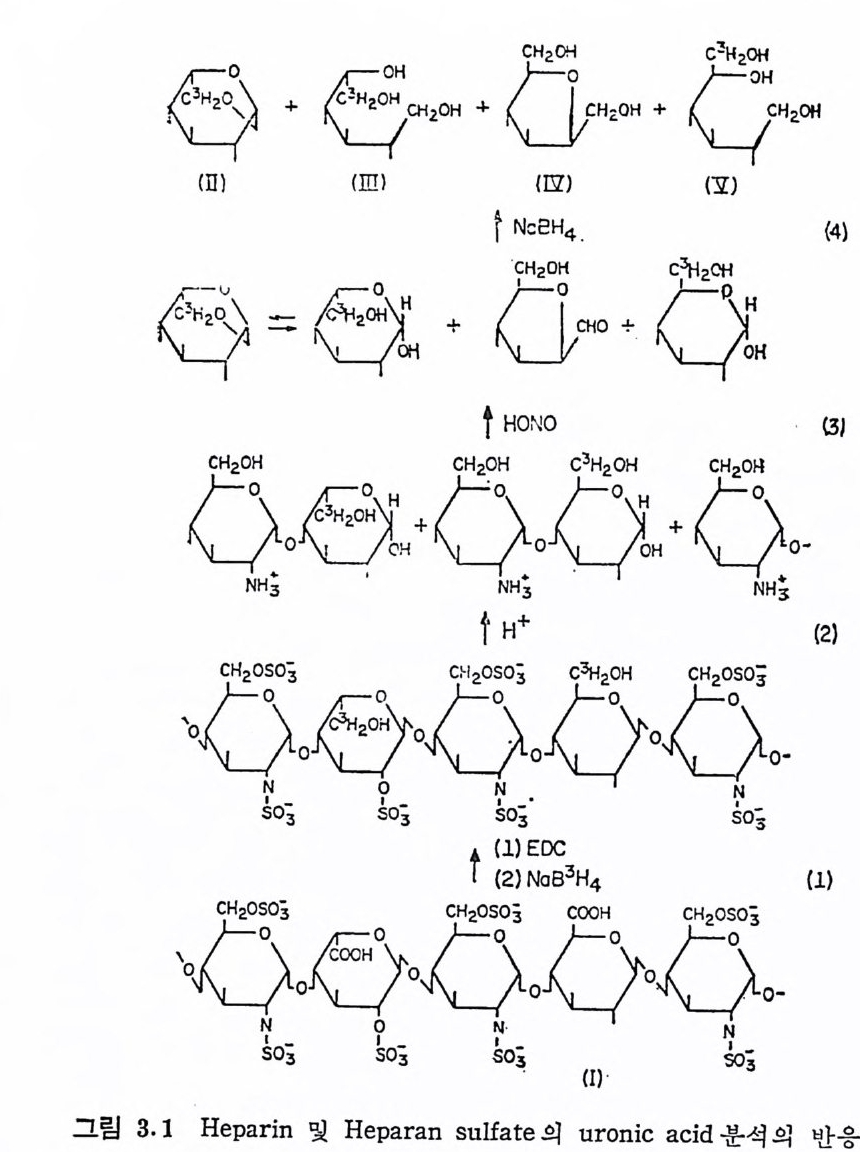 巳 《:어 20H + 디CH2 어 C H,0H + :CH~C2 어H 2 어
巳 《:어 20H + 디CH2 어 C H,0H + :CH~C2 어H 2 어
당류 단위제와는 다른 탄수화물 구조를 갖고 있으며, 이에 의한 GAG 의 당류의 조성에 대한 영향은 분자량이 낮은 다당류에서는 무시 될 수 없 다. HP 및 HPS 는 D-gl u curonic ac id 와 L- id u ronic acid 를 uronic aci d 로 포함하고 있으며 , D-gl u curonic ac id 의 상 당량은 연결부분에 촌재한다.
3.3 반복되는 이당류 단위체의 구조 및 특성 GAG 는 일반적으로 특정한 조성의 반복되는 이당류 단위제로 구 성된 선형 고분자로 간주되고 있다. 그러나 이당류 단위제가 탄수 화물 사슬 전체를 통하여 동일하다거나, 같은 유형의 GAG 가 동일 한 이당류 단위체를 갖는다는 것은 이상적인 경우에 불과하며, 많 은 경우에는 상당한 구조상의 불균일성이 관찰된다. 3. 3. 1 Hy a luronic ac id Hy a luronic aci d 는 1934 년 에 Mey e r 에 의 해 소 눈의 유리 체 에 서 처음으로 분리되었다. 이 다당류는 관절활액, 피부 등 여러 결합 조직에서도 발견된다. 다른 GAG 가 모두 동물 조직에서만 확인된 것과는 대조적으로, 이 다당류는 A 군 포도상구균이나 많은 박테리 아에서도 촌재한다는 것이 확 인되었다. 이러한 점 외에도 HA 는 다 른 GAG 와 다른 몇 가지 특성을 갖고 있다. 이들은; 1. 분 자량이 아주 크다. 다른 GAG 의 분자량이 1Xl04~5Xl04 인 데 반하여 HA 는 1Xl06~5Xl06 의 분자량을 갖는다. 이는 이 분자의 유체역학적 부피와 관련하여 큰 의미를 갖는다. 2. 에스테로화된 황 산기를 포함하지 않는다. 3. HA 사슬과 단백 질 이 공유결 합을 한 pro te o g ly c an 으로서 의 존 재가 확 인되지 않았다. HA 의 산 가수분해 는 GlcNAc 와 GlcUA 간의 N-acety lg l u cosa-mi ni d i c 연결을 우선적으로 파괴시켜 GlcNAc 가 환원성 말단에 있 고 fil, 3 로 GlcUA 에 연결 된 이 당류 단위 체 인 hy a lobiu r onic ac id 가 생 성 된 다· 그러 나 고환 (tes ti cu lar) hy a luronid a se 를 작용시 킬 경 우 에 는 N-acety lh y a lobiu r onic ac id 두 단위 체 가 4-0-D- gl u cosami ny l 연결로 결합된 4 당류 단위체가 주생성물로 얻어진다. 이에 반하여 박테 리 아성 hy a luronid a se 에 의 한 분해 에 서 는 glu curonic acid 의 c-4 와 C-5 사이에 이중결합이 있는 hy a lobiu r onic ac i d 의 유도 체인 그림 3.2 의 화합물이 얻어진다.
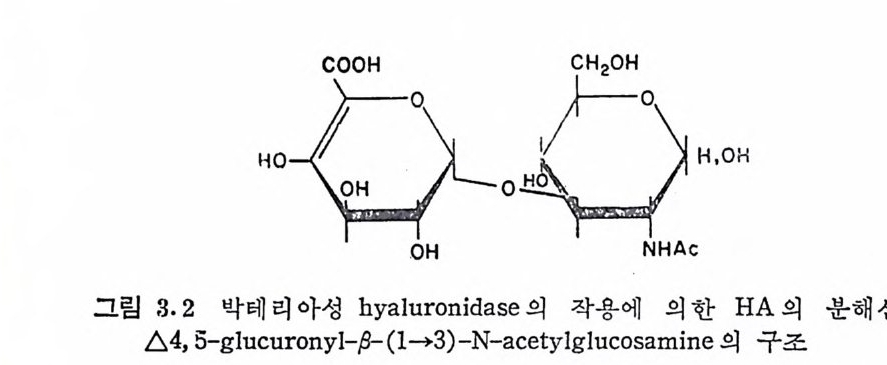 o {COOHc ~。一Ac
o {COOHc ~。一Ac
위에서 언급된 바와 같은 부분적 산 가수분해, 효소에 의한 분해 등의 연구 결과로 HA 는 다음과 같은 반복되는 이 당류 단위체를 가 징이 밝혀졌다.
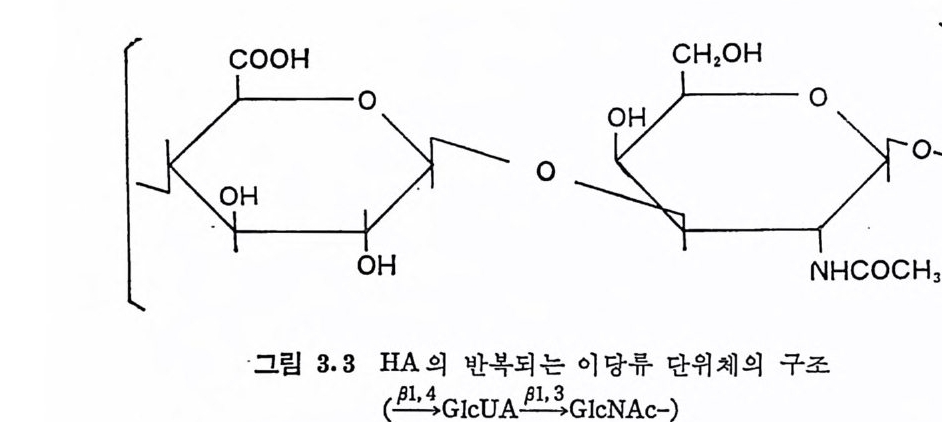 COOH CH20H
COOH CH20H
HA 는 용액에서 아주 거대한 음이온으로 존재한다. 용액 중의 HA 분자(실제는 염 또는 이온 상태이나 편의상 HA 로 지칭)는 야 주 큰 유체 역 학적 부피 (hy d rody n ami c volume) 물 차지 하며 (lg 의 HA 는 거의 1l 의 부피를 점유한다), 이 부피 내에는 다른 거대 분자가 촌재할 수 없다. 따라서 이 분자는 조직 내에서 다른 거대분자의 확 산이나 접근을 방해하는 역할을 하리라 짐작되고 있다. HA 의 거 대한 유체역학적 부피로 인하여, HA 용액은 점성도와 탄성이 아주 크다. 이에서 HA 는 관절 표면의 기계적 s tr ess 를 흡수하는 완충
제 (shock absorber) 의 역할을 할 것이라는 것 을 짐작 할 수 있다· 또 한 이 다당류는 건(t endon) 의 표면이 나 활액 막과 같은 고제 -0각 제 계 면에서 윤활제의 역할을 하고 있다는 것이 제안되기도 했 다. 최근 에는 용액 중의 HA 분자는 기계적 에너지를 전기 적 인 것으로 전환 시키는 역할울 한다고 제시되기도 했다 (3·2). 이미 제 2 장에서 보 았듯이, HA 는 다몬 pro te o g ly c an 단위체가 집합체몰 형성할 때 중 심 연결자리를 제공한다. 이로부터 이 다당류는 chondroc yt e 에서 pr ote o g ly c an 을 합성 할 때 의 조절 작용을 하리 라 추측될 수 있으 나 (3.3), 이에 대한 실험적 결과는 아직도 완전히 긍정적인 것만은 · 아니다. 3. 3. 2 Chondroit in 및 Chondroit in s u lfat e Chondroit in 과 chondroit in sulf ate ( 4 및 6 sulfa te) 에 서 반복되 는 이 당류 단위체의 기본구조는 GlcUA 쁘 ~GalNAc 가 g1, 4 연젼로 결합된 것이다(그림 3,4). 죽 HA의 GlcNAc 대신에 GalNAc 가 포 함되어 있다. Chondroit in 은 많은 사람들에 의 해 서 는 보통 GAG 로 분류되 지 않으나, David s on 과 Mey e r (3, 4) 에 의 해 오칭 어 껍 질 과 소의 각 막 (cornea) 중에 촌재하는 다당류의 소량 성분으로 분리되었으며, chondroit in sulf ate ( CS) 생합성의 전도물질로 추정되고 있다. 이
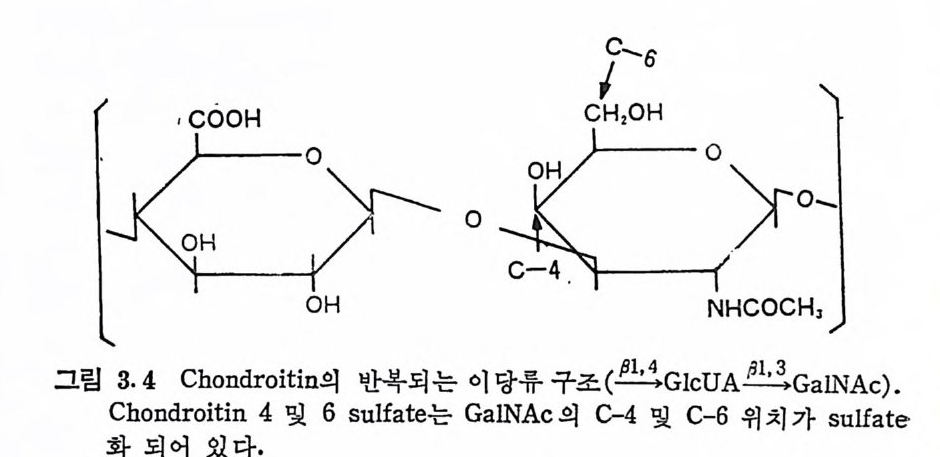 ,CO OH cC l/1'H60H \
,CO OH cC l/1'H60H \
다당류는 CS 를 HCl-me t . hanol 에서 처리한 후 알카리 가수분해시 킴으로써 쉽게 실험실적으로 얻음 수 있다 . 히믈 Ch6-S 에서 예를 들 어 보면,
 Ocoo-O -• C QH,OSO; -: C H, 0COOCH°, 0CH,ONHH° COCH,
Ocoo-O -• C QH,OSO; -: C H, 0COOCH°, 0CH,ONHH° COCH,
의 반응경로로 표시된다 (3.5). Chondroit in 4 및 6-sulfa te ( Ch 4-S 및 Ch 6-S) 는 정 확한 황산기 의 위 치 가 규명 되 기 전 에 는 각각 chondroit in sulf at e A 와 chondro- itin sulf at e C 로 불려졌 으며, 아직도 많은 문헌에는 이와 같은 명 명 이 이 용되 고 있 다· 초기 의 문헌에 서 는 chondroit in sulfa te B 라 는 다당류를 볼 수 있는데, 이는 다음 항에서 언급될 dermata n sulfa te 를 지 칭 한다. Chondroit in sulfa te 가 그립 3. 4 에 서 보여 준 반복되 는 이 당류 단위체로 구성되어 있다는 것은 단지 이상적인 것에 불과하며, 많 은 CS 형 다당류에서는 이 구조에 대한 상당한 변화가 su lf a t e 기의 위치 및 su lf a t e 화 된 정도에서 관찰된다· 소의 기관지 (t rachea) 에 서 분리된 CS 는 단지 GalNAc 의 일부분만이 sul fat e 화 되어 있으 며, 이는 매 3 번째 GalNAc 의 C- 4 에 황산기가 연결되어 있다고 제안되었다. 황산기의 함량이 낮은 CS 형 다당류는 사람의 혈장과 쥐의 갈비 (ri b) 에서도 분리되었다. 앞서 언급된 황산기의 함량이 낮은 CS 와는 반대로, sul fat e 화 된 정도가 큰 cs 도 여러 조직에서 분리되었다. 상어 연골의 CS 는 GalNAc 의 C- 6 에 황산기가 연결된 것 외에도, GlcUA 의 C-2 및
C-3 의 일부가 sulfa te 화 되 어 있 다. 이 과다하게 sulfa te 화 된 CS 롤 Suzuki( 3 . 6) 는 chondroit in sulfa te D 라 명 명 하였 다· 오칭 어 와 horseshoe crab 연 골에 서 분리 된 과다 sulfa te 화 된 CS 는 chon-droit in sulfa te D 와는 광회 전 성 (Op tica l Rot at i on ) 과 IR 스펙 트럼 이 다르다· 이 다당류는 GalNAc 의 4 빛 6 위 치 모두에 황산기 가 연 결 되 어 있 으며 이 를 chondroit in sulfa te E 라 부르기 도 한다• 이 당류 단위체당 2 개의 황산기를 갖는 또 다른 CS 형 다당류가 kin g crab 연골에 서 분리 되 었 다. chondroit in sulfa te K 라 부르는 이 당류는 GlcUA 의 C-2 또는 C-3 위 치 와 GalNAc 의 C-4 위 치 가 sulfa te 화 되 어 있 다. CS 의 GalNAc 의 C-4 또는 C-6 중 한 위치에만 황산기가 연결 된 이 상적인 Ch4-S 또는 Ch6-S 는 극히 희귀하며, 대부분은 혼합 형으로 촌재한다 (3.7). 혼합형 CS 는 보통 CS 형 다당류를 부분적 으로 효소분해시켜 생성된 4 당류 단위체의 구조에서 규명된다. CS 는 GAG 중 생체 내에서 가장 많은 양으로 존재하는 다당류이 다. 동일한 개체에서도 연골성 조직에 다라, 그리고 동일한 조직에 서는 성장상태에 따라 CS 의 양은 물론 CS 의 종류간의 비도 크게 차이가 난다. 일반적으로, 성장기에 있는 신생 또는 종양성 조직에 서는 많은 양의 CS 가 존재한다. 이에서 Diet r i c h 등 (3.8) 은 이 다 당류가 세포분화에 관여하며 세포의 인식이나 접착성과 같은 세포` 의 득정한 성질을 결정하는 인자일 것이라는 제안을 했다. CS 는 양이온, 득히 Ca+ +과의 결합력이 크다. 따라서 이 다당류가 결합 조직 의 광화 (mi ne rali za ti on ) 에 관여 하리 라 추정 된 다. 3. 3. 3 Dermata n sulf ate Dermata n sulfa te ( DS ) 는 1941 년 에 Mey e r 와 Chauff er 에 의 해 돼지 피부에서 처음으로 분리되었다. 이 다당류는 연골에서 분리된 CS 와 조성이 극히 유사하나 광회전성이 다르다. 아들은 CS 와 조 성 이 유사한 다당류라는 점 에 서 cbondroit in sulfa te B 라 명 명 하 였다. DS 는 또한 소의 허과 he p ar i n 의 부산물에서 분리되었으며, HP 와의 유사성에서 /3- hep ar i n 이라고도 불렀다. DS 는 이외에도
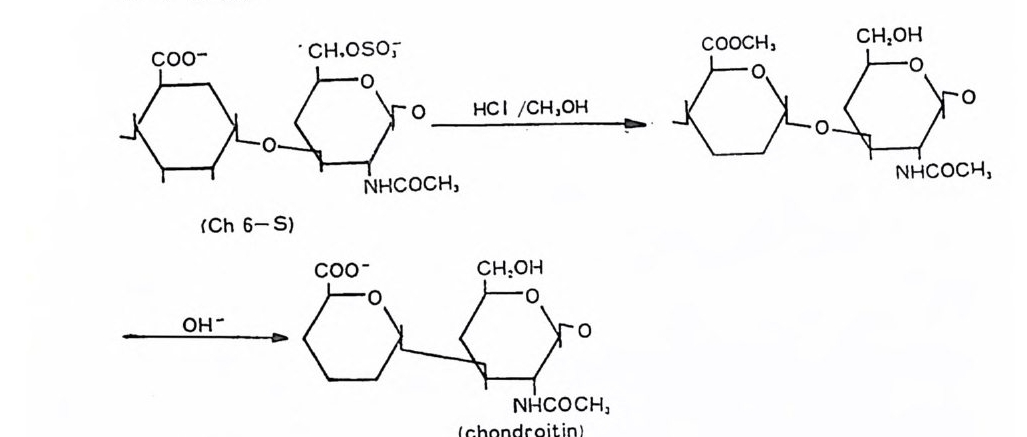
돼 지 위 접 막(g as tri c mucosa), 건 (ten don), 심 장판막 (hear t value), 탯 줄 (umb ili cal cord) 빛 여러 섭유상 연골 등에서도 분리되었다. DS 의 반복되 는 아 당류 단위 체 의 hexosami ne 성 분이 GalNAc 라 는 것은 곧 확인되었으나, uronic ac i d 의 성분은 비교적 최근에야 밝혀 졌 다. Carbazole 발색 법 에 의 한 uronic acid 의 분석 은 단지 -G alNAc 의 50% 에 해당하는 GlcUA 의 색을 나타내며, 따라서 이 다당류의 uronic ac id 는 GlcUA 가 아닐 것 이 라고 짐 작되 었다. DS 의 uronic acid 의 주성 분이 L-id u ronic ac id 라는 것 은 1965 년 에 Hoff m an 에 의 해 규명 되 었으며 , gly c osid i c 연결은 Ch4-S 의 그것 과 동일하다는 것도 연이어 밝혀졌다.
 CH20H
CH20H
DS 사슬의 주축은 그림 3. 5 에 서 보듯이 IdUA-a (l, 3)-GalNAc 이당류 단위체가 /31 ,4 연결을 하고 있으며, GalNAc 의 C- 4 위치의 대 부분이 0-sulf ate 화 되 어 있 다. DS 와 Ch4 -S 의 차이 는 L-IdUA 와 D-GlcUA 의 차이이며, L-IdUA 의 a 연결은 D-GlcUA 의 /3연결 에 대응한다. HP 빛 HPS 도 L-IdUA 를 포함하고 있으며, 이들도 C 연결을 하고 있다. DS 도 CS 와 마찬가지로 그림 3.5 의 이상적인 구조에서의 상당한 변형을 보이고 있다. DS 사슬의 일부는 L-IdUA 가 아닌 D-GlcUA 로 구성 되 어 있음은 오래 전부터 지 적 되 어 왔으며 , Frasson 과 Roden (3.8) 이 고환 hy a luronid ase(/3 -glu curonid ic 연결을 분해)에 의해 부 분적으로 분해된 DS 의 분해산물에서 IdUA 와 GlcUA 를 모두 포 항하는 4 당류 단위체를 발견함으로써 확인되었다· 그러나 DS 의
GlcUA 의 함량은 전체 uronic ac id 의 20 % 룬 넘 지 않 는 것 이 보 통 이 다 . DS 의 0-sulfa te 화 는 GalNAc 의 C-4 위 치 뿐 만 아니 라, IdUA 의 일부에서도 관 찰 된다. 돼지 피부에서 얻어 진 DS 의 반 복 되는 이 당류 단위 체 는 C-2 또는 C-3 에 sulf at e 기 가 치 환된 IdUA 를 갖고 있으며 , 이 과다 sulfa te 화 된 DS 를 dermata n sulfa te D 라 부른 다 (3. 9) . 그리 고 hog fish 의 배 소 (noto c hord) 에 서 분리 된 DS 에 서 는 GalNAc 의 C-4 및 C-6 모두가 sulfa te 화 되 어 있는 이 당류 단위 체 가 발견 되 었 으며 , 이 를 chondroit in sulfa te H 라 부른다 (3. 10) • 3. 3. 4 Hep a rin 및 Hep a ran sulf ate HP 과 HPS 의 이 당류 단위 체 의 hexosami ne 은 glu cosami ne 이 며 , uronic ac id 는 IdUA 와 GlcUA 를 모두 포함하고 있 다· 초기 의 HP 빛 HPS 의 구조에 대 한 연구는, sulf at e 기 의 위 치 , N-acety l 기의 존재 유무, 당류간의 연결 등 다양한 구조적 측면에서 연구자 들간에 의견의 일치를 보지 못 했 다. 그러나 최근에는 비록 복잡하 고 시료의 원천에 따라 다르긴 하지만, 전체적인 구조의 모형이 정 립되었다. HP 의 uronic ac id 는 약 70~90% 가 IdUA 이 며 나머 지 는 GlcUA 이 다. 다른 GAG 들의 hexosami ne 이 거 의 완전히 N-acety l 화 된 것 과는 대 조적 으로, HP 의 glu cosami ne 의 대 부분은 N-sulfa te 화 되 어 있으며 , 단지 일부분만이 N-acety l 화 되 어 있 다· 또한 glu -cosami ne 의 대 부분은 C-6 에 , 그리 고 IdUA 의 대 부분은 C-2 에 ·0- sulfa te 화 되 어 있 다. 따라서 이 다당류는 이 당류 단위 제 당 2~3 개의 황산기를 갖고 있다. 단당류간의 결합은 모두 1-- ► 4 결합이며, id uronid i c 및 glu cosami n id i c 연결은 a 배향을, 그리고 glu curon- idi c 연결은 8 배향을 하고 있다. HP 의 구조적 특성을 대변하는 7 당류 단위제를 그림 3.6 에서 보이고 있다. HPS 와 HP 사이에는 명확한 구조적 차이는 없다. 단지 HPS 는 HP 에 비 해 N-acety l 정 도가 높고 (40~100%), IdUA 보다는 GlcUA 가 많이 포함되 어 있으며 , 0-su lfa te 화 된 정 도가 낮다. 따라서 .HP S 를 hep a rin monosulfa te 또는 bep a rit in sulf ate 라고 부르기
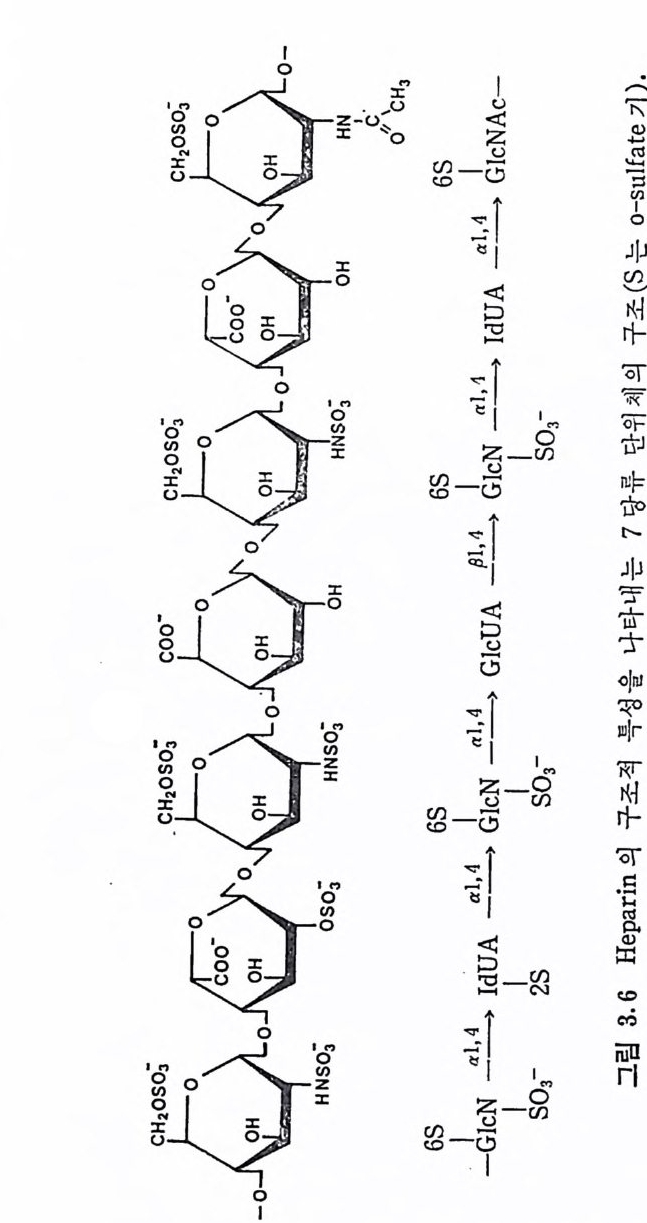
도 한다. 이 두 다당류의 구분은 구조적 차이보다는 항응고 작용의 유무로 행해지며, HPS 는 이 작용이 거의 없다. HPS 사슬에서는 N-acety l 또는 N-sulfa te 된 glu cosami ne 이 무작위 하게 배 열 되 어 있다기보다는, 이들이 부분적으로 모아져 있는 (blo ck> 공중합체로 여 겨 지 고 있 다. 그리 고 대 부분의 0-sulfa te 기 는 N-sulfa te 된 hexo- sami ne 보다는 IdUA 에 연결되어 있다.
HP 는 1916 년 McLean 에 의해 발견된 후, 이것이 갖는 혈액의 항 응고작용 및 항지 방혈 중 (anti lipe mi c) 등의 생 물학적 활성 으로 인 하 여 큰 관심의 대상이 되었다. 이 다당류는 상품용으로는 허파에서 분리되며, 심장, 콩팥, 피부, 혈액, 지 라 (s p leen) 등에도 존재한다. HPS 는 보통 HP 의 부산물로 얻어지며, 콩팥, 간 및 회장(il eum) 조칙의 GAG 의 주성분을 이루며, 많은 세포의 표면에서도 분리된 다. 이와 같은 HP 및 HPS 의 조직에서의 분포는 다른 GAG 둘이 주로 결합조직에 존재한다는 것과는 퍽 대조적이다. HP 의 독특한 약리 작용인 항응고작용과 이 분자의 구조와의 상관 관계는, 보다 약리작용이 큰 다당류를 얻고자 하는 실용적인 면에 서뿐만 아니라 항응고작용의 기구를 규명하기 위하여 많은 연구가 수행되었다 (3.11). 이풀 위하여 다음 scheme 에 의한 HP 의 화학적 변형이 많이 이용되었으며, 이는 다른 다당류의 변형에도 적용된다. Na2C03/(C 晶) 3NHSe0p3 a I rinl (§- N많S0뻥3-셨, 홍-00 S?053%- )H 20 N-desulf ate d belp ( aR riCn 0 ()-N20H t , OSO 겁 N-acyl (또는 ary l) hepa rin (-NHCOR, -0S0 잡 HP 의 약산성 가수분해 는 N-sulfa te 기 를 분해 시 키는데 흔히 사 용되 며 , 이 때 에 는 약간의 gly c osid i c 연결 과 0-sulfa te 기 도 분해 된다. HP 의 N-desul fati on 은 이 다당류의 항응고작용의 감소를 가쳐 온다· 그러 나 자연 상태 의 HP 에 서 는 N-sulfa tion 정 도와 항응 , 고작용의 능력과는 큰 상관관계가 없음이 발견되었다. NaBH4 에 의 한 HP 의 COOH 기의 환원도 항응고작용의 감소로 나타난다. HP의 항응고작용은 이 다당류의 sul fat e 의 함량보다는 분자량과 밀접 한 관계가 있다. 중합도가 8 인 처분자량의 HP 은 비록 이당류당 황산기가 2~2.8 개일지라도 거의 항응고작용을 보이지 않는다. 분 자량이 4,500~15,500 사이의 HP 에서는분자량과 항응고작용의 상 관관계는, 분자량이 10,000 까지는 분자량이 증가할 수록 항응고작 용도 중대되나, 이 이상의 분자량에서는 거의 일정한 값을 보인다 (3.12). 3. 3. 5 Kerata n sulf at e Kerato s ulfa te 라고도 불 려 지 는 kerata n sulfa te ( KS) 는 uronic ac id 대 신 에 D-ga lacto se 를 반복되 는 이 당류의 성 분으로 포함하고 있 다. KS 의 기 본적 이 당류 단위 제 는 D-ga lacto s e 과 GalNAc 가 서로 fil, 4 연결로 결합되어 있으며, 대부분의 GlcNAc 는 C-6 위치 가 0-sulfa te 화 되 어 있 다•
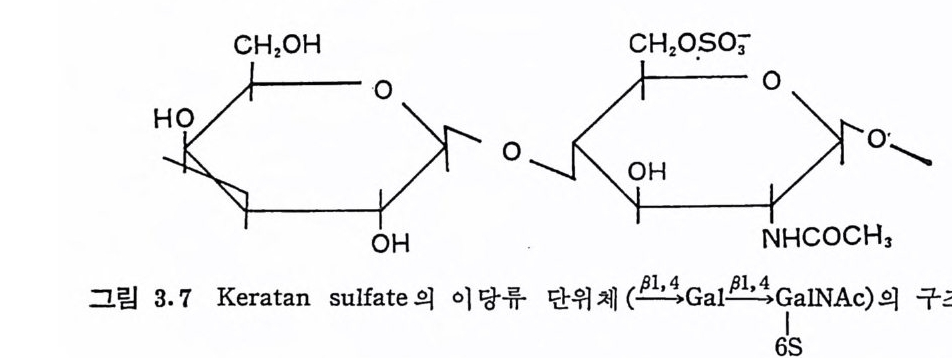 CH20H
CH20H
KS 는 보통 탄수화물-단백질 연결 부분의 구조에 따라 구분된다 · (2.4 항 참조). 각막 (cornea) 에 존재하는 KS(KS-I) 은 탄수화물 사슬 의 GlcNAc 가 중심단백질의 Asn 의 am i de 기에 알칼리에서 안정한 N-gl y c osid i c 연결로 결합되어 있으며, 연골조직에서 CS 와 공존하 는 골격 KS(KS-II )는 GalNAc 가 단백 질의 Thr 또는 Ser 에 0-gly - -co sid i c 연결을 하고 있어 알칼리에서 쉽게 분해된다. 그러나 이들 두 종류의 KS 에서 탄수화물의 구조에는 뚜렷한 차이가 없다. KS 의 sulfa te 함량은 KS 를 분리한 조칙에 따라 크게 변한다 (3.
13). 어 떤 KS 는 GlcNAc 의 C-6 위 치 도 sulfa te 화 되 어 있지 않은 반면에, 다른 KS 는 Gal 의 C-6 위치마처 sul fat e 화 되어 있다. 각 막 KS 는 sulfa te 기와 GlcNAc 의 비가 1 보다 적은 것이 보통인 반면에, 골격 KS 는 1.8 까지 되기도 한다. *추천문현 Rl . L. Roden, J. R. Baker, J. A. Cif on ell i and M. B. Math e ws, Isola- tion and characte r iz a ti on of connecti ve tiss ue po lys accharid e s, Meth o ds Enzy m ol. , 28, 73~141 (1972) (G!yc osami no g ly c an 의 분리 및 분석 방법 을 상세 히 기 술) R2. R. W. Jea nloz, Mucop o lys accharid e s of hig h er anim a ls, in the Carbohy d rate s , edit ed by W. Pig m an, D. Horto n and A. Herp, Vol Il B, Academi c Press, New York, 1970, p. 589~625. (Glyc osami no g ly c an 의 화학을 주로 취 급) R3. N. Sharon, Mucop o lys a ccharid e s I: Chem ica l Str uc tu r e, in Comp le x carbohyd rate s , Addis o n-Wesley, Read ing , 1975, p. 258~281 . (Mucop o lys accharid e 는 물론 대 부분의 복합다당류의 화학을 취 급한 강의 노트) *인용문현 3. 1. R. L. Tayl o r, J. E. Shiv e ly, H. E. Conrad and J. A. Cif on ell i, Uron ic aci d comp o sit ion of hep a rin and hep a ran sulfa tes , Bi oc hemi st r y , 12, 3633 (1973) . 3. 2. T. W. Barrett , Mechanoelectr ica l tra nsducti on in hy a luron ic ac id salt soluti on in an entr o p y-d riv e n pr ocess, Phys io l. Che111. Phys . , 8, 125(1976) and Hy a luronic acid salt- a mechanoelectr ica l tran s_ ducer, Bi oc him . Bi op h y s . Acta , 385, 157(1975) 3. 3. C. J. Handley and D. A. Lowt he r, Inh ibi t ion of pro te o g ly c an bio s yn th e sis by hy a luron ic aci d in chondrocy tes in cell cultu re, Bi oc him . Bi op h y s . Acta , 444, 69 (1976) . 3. 4. E. A. David s on and K. Mey e r, Chondroit in, a new mucop o lys ac- charid e , ]. Bi ol . Chem., 211, 605(1954). 3. 5. T. G. Kanto r and M. Schubert, A meth o d for the desulf at i on of
chondroit in sulfa te, J. Amer. Chem. Soc., 79, 152(1957). 3. 6. S. Suzuki, Isolati on of novel dis a ccharid e s from chondroit in sul- fates , J. Bi ol . Chem., 235, 3580(1960). 3. 7. C. R. Falty ne k and J. E. Sil be rt, Cop o lym ers of chondroit in 4- sulfa te and chondroit in 6-sulf at e in chic k embryo ep iph y s es and oth e r carti lag e , J. Bi ol . Chem., 253, 7646(1978). 3. 8. L. A. Fransson and L. Roden, St ru ctu re of dermata n sulfa te. I. Deg r adati on by tes ti cu lar hy a luronid a se, ]. Bi ol . Chem . , 242, 4161 (1967): _. Il Characte r iz a ti on of pr oducts obta i n e d by by a luronid a se dig e sti on of dermata n sulfa te, J. Bi ol . Chem. , 242, 4170(1967) . 3. 9. A. Malmstr o m and L. A. Fransson, St ru ctu re of pig skin derma- tan sulfa te. 2. Demonstr a ti on of salfa ted idu ronic ac id resid u es, Eur. ]. Bi oc hem., 18, 431(1971). 3. 10. K. Anno, N. Seno, M. B. Math e ws, T. Yamag a ta and S. Su- zuk i, A new dermata n po lys ulfa te chondroit in sulfa te H, from - Hog fish noto c bord, Bi oc him . Bi op lzy s . Acta , 237, 173 (1971) 3.11. J. Ehrlic h and S. S. Sti va la, Chemi st r y and ph armacolog y of hep a rin , J. Pharm. Sci. , 62, 517(1973). 3. 12. S. S. Sti va la and P. A. Lib e rti , Phy s ic o cbemi ca l stu d ie s of frac - tion ate d bovin e hep a rin . 1V. Cu( Il ) bin d ing in relati on to pH , molecular weig h t, and bio lo g ica l acti vit y, Arch. Bi oc hem. Bi op hy s. , 122, 40 (1967) . 3. 13. J. A. Cif on ell i, A. Saunders and J. Gross, Kerata n sulfa te frac - tion s from bovin e and human tiss ues, Carbo. Res., 3, 478(1967)~
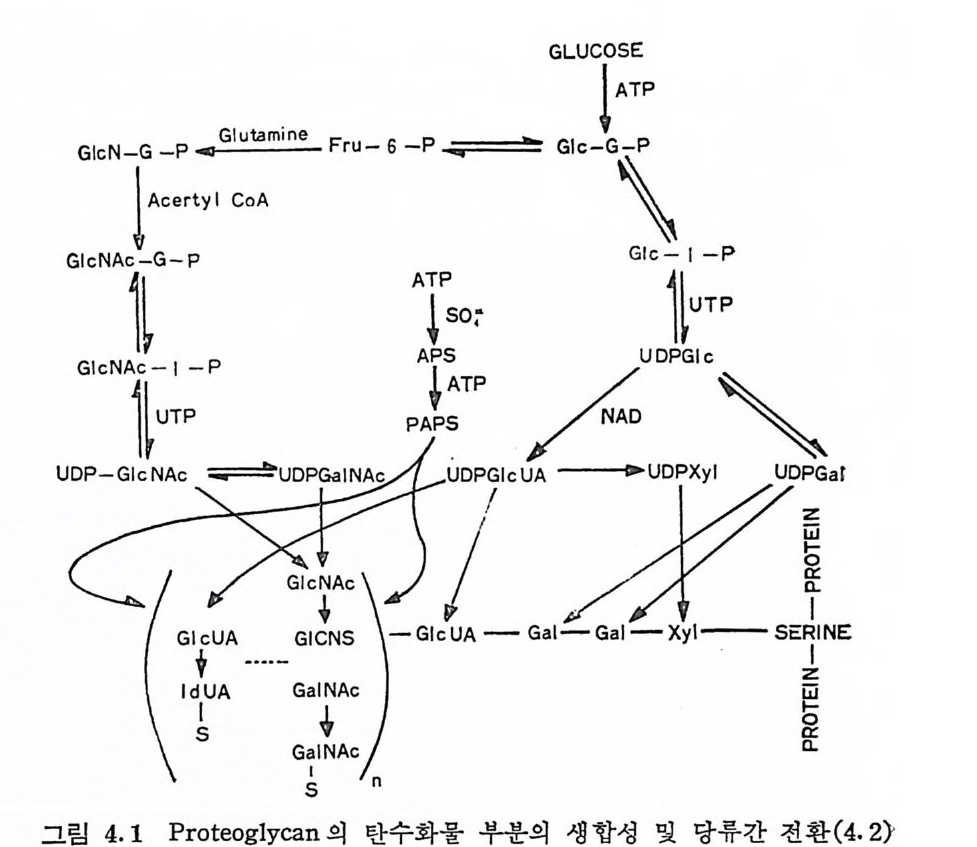
제 4 장 Mucop ol ys a cchari de 의 생 합성 Mucop o lys accharid e 는 체 내 에 서 pr ote o g ly c an 으로 존재 한다. PG 의 생합성에 관한 연구는 초기에는 피부조직을 주로 사용하였 다. 최근에는 연골조직이나 mas t세포 종양을 생합성 연구의 조직 원으로 주로 이용하고 있으나, 생합성 과정은 피부에서와 큰 차이 가 없다. PG 의 생합성 과정은 CS 에 대해서는 바교적 상세하게 알 려져 있으며, 다몬 다당류의 생합성도 CS 와 유사한 경로로 진행되 는일 반것적으 로경 로믿폴어 지기술고하 있고다,. 다이음 에장 에개서개는의 먼다저당 P류G의 의 합생성합과정성을에, 관c한s 와 HP 을 중심으로 적는다. 4.1 일반적 생합성 경로 Glyc osami no g ly c an 이 라는 다당류와 중심 단백질이 공유결합을 하 여 존재하는 p ro t eo g l ycan( 다른 당단백질에서도 동일)의 생합성에 관한 일차적인 관심은 탄수화물 사술과 중심 단백질의 생합성 순서 이 다. Puromy cin 이 나 cy c lohexim i de 와 같은 단백 질의 생 합성 을 선택적으로 억제하는 물질이 PG 에 당과 황산기가 첨가되는 것도 억제하는 것으로 보아, 당단백질 (PG 포함)은 모두 중심단백질이 먼 처 합성되고, 탄수화물 사슬이 이 단백질에 첨가되는 것으로 믿어 졌다. 그러 나 최근에는 xy lo se 나 {3 -x y los i de( 예로 P-ni tro pb enyl - ~-D-
xy!o sid e ) 가 배 양된 chic k embryo chondrocy te 에 서 의 CS 생 합성 에 서 는 pu romy cin 의 억 제 작용을 극복하는 것 으로 보고되 었으며 (4.1), 이는 적당한 조건 하에서는 중심단백질이 촌재하지 않을 때에도 CS 사슬의 합성이 가능하다는 것을 의미한다· 또한 PG 의 존재가 확립 되지 않은 HA 에서는 HA 다당류 사슬이 중심단백질이 없이도 생 합성될 가능성이 크다· 그러나 HA 는 합성단계에서는 PG 으로 얻 어지나, 합성된 HA 가 주위 매체로 방출될 때 적당한 탄수화물 연 결이 분해되어 조직 내에서는 단백질에 결합되지 않은 순수한 탄수 화물로 존재할 수 있다. 이는 새로 합성된 HA 가 세포막표면에 연 결(탄수화물―단백질의 공유결합일 가능성이 큼) 되어 있는 것에서 짐작될 수 있다. 앞서의 몇 가지 불확실성에도 불구하고, 현재로는 PG 의 생합성은 합성된 중심단백질에 탄수화물의 사슬이 연결되는 것으로 여겨지 고 있다. 이때 탄수화물 사슬은 이를 구성하는 단당류에 해당하는 nucleo ti de- 당에 서 성 장중인 분자의 적 당한 위 치 에 당이 전 이 됨 으 로써 합성 이 진 행 된 다. 그러 나 L-id u ronic ac id 는 탄수화물 사슬 에 첨 가된 D-gl u curonic ac id 의 C-5 ep im eriz a ti on 에 의 해 형 성 된 다. 또한 0-sulfa tion 과 N-sulf ati on 도 고분자 상태 에 서 uronic ac id 와 N-acety lh exosami ne 의 변형 으로 일 어 난다. PG 의 생합성에 소요되는 당류는 g lucose 로 공급되며, 이는 ur idi n e dip h osp b ate ( UDP) 에 의 해 활성 화된 다· 그림 4. 1 은 PG 의 탄수화물 사슬의 생합성에 관련된 당류간의 상호전환을 보여 주 는 것이다. 비록 PG 의 생합성은 탄수화물 사슬이 중심단백질에 첨가됨으로 써 진행되는 것은 확실하나, 이 두 과정 (단백질 합성과 탄수화물의 첨가)간의 정확한 시간적 관계는 아직 명확하지가 않다. 탄수화물 사슬의 첨가가 r i bosome 에서 중심단백질의 합성이 완료되기 전에 도 시작될 가능성이 있다. (ovalb !l m i n 의 생합성은 이 경우에 속 한다.) PG 의 탄수화물 부분의 생합성의 시작은 중심 단백질과 다당류 사 술간의 연결 종류에 따라 각각 다른 과정으로 진행된다. CS 와 같이
 GLUC!OASTEP
GLUC!OASTEP
Xy l- Ser 연결 을 갖는 PG 에 서 는 Ser 기 에 UDP-xy lo se 에 서 xylo se· 를 직접 이동시킴으로써 생합성이 시작된다. 이와 유사하게, 골격 KS 에 서 는 Thr 이 나 Ser 의 OH 기 에 UDP-GalNAC 에 서 GalNAc 가 전이됨으로써 탄수화물 사술의 성장이 시작된다고 추정되나 아 직 확실 한 직 접 적 인 중거 는 없 다. 다만 상피 (ep ithe li al) muc in 이 냐 GalNAc-Thr 연결을 갖는 다른 g l y co p ro t e i n 들에서 관찰된 탄수화 물 사슬의 합성경로가 골격 KS 에서도 적용되리라 믿어질 뿐이다. 박테 리 아의 복합탄수화물 (com p lex carbohy d rate ) 의 생 합성 에 는 지 질 (lipi d) 에 결 합된 당 중간체 가 관여 하는데 , 포유동물의 조직 에 서 도 유사한 중간제가 당단백질의 생합성에 작용할 가능성이 있다· 포 . 유동물에 서 는 do li chol( 그립 4. 2) 이 미 생 물에 서 의 짧은 사슬의 iso p r - eno i d 에 대응하여 탄수화물의 생합성에 관여할 것으로생각되고 있
다. 각막 KS 의 GalNAc-A s n 연결 은 doli ch ol 경로 를 통해 합성된 다는 몇 가지 실험적 인 중거 가 보고되었다 (4.3),
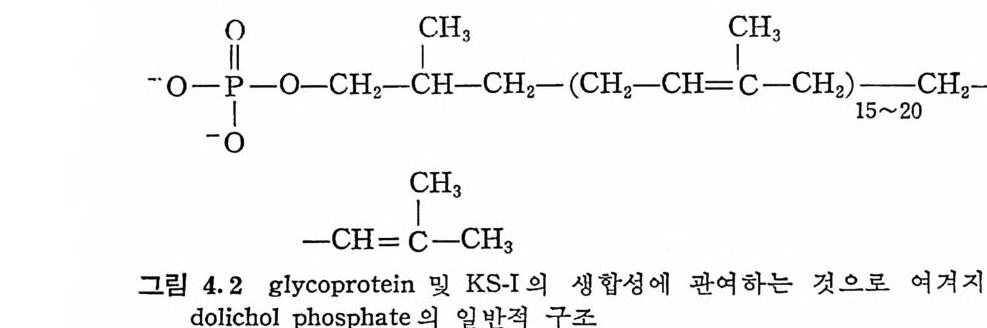 -·o--ooPI -0— CH2 — CCHH3- C H2 -( CH2— C H=? CH— 3 CH2 )1 — 5~20C H2-•
-·o--ooPI -0— CH2 — CCHH3- C H2 -( CH2— C H=? CH— 3 CH2 )1 — 5~20C H2-•
탄수화물―단백질의 연결을 시작으로 하는 탄수화물 사슬의 성장 은, nucleo ti de- 당에 서 단당류를 성 장중인 PG 의 탄수화물의 끝부 분에 단계적으로 이동시킴으로써 계속된다. 이 과정은 당전이효소 (g l y cos ylt rans fe rase) 의 기 질 목이 성 에 의 해 조절 된 다 (R 2) . 즉 어 떤 특 정 한 gl yc osy lt r a nsfe r ase 는 첨 가되 는 단당류, 이 것 이 첨 가되 는 위 치, 형성되는 연결의 구조와 배향 (a 또는 /3)을 결정한다. PG 의 탄수화물 사슬의 성장이 종료되는 메카니즘은 아직도확실 하지 않다. 많은 gl yc op r ote i n 에 서 는 sia l yl t r a nsfe r ase 에 의 해 탄 수화물 사슬의 끝에 sia l yl 기 가 도입 되 어 다른 gl yc osy 1t r a nsfe r ase • 7} sia l yl 기 에 다른 당을 첨 가시 킬 수 없으므로 탄수화물의 성 장이 종 료된 다. (GM2 ga ng lisi d e 에 는 두번째 sia l yl 기 가 도입 될 수 있 다. ) 이와 유사한 GAG 생합성의 종료 메카니즘으로 CS 의 0-sulfa tion 을 둘 수 있다. CS 의 GalNAC 의 C-4 위치에 황산 기 를 도입하면 GlcUA 의 첨가가 방해된다· 그러나 C-6 위치에 황산기를 도입시킬 때는 GlcUA 의 첨가가 계속되는 것으로 보아 sulf ate 화된 다당류 사슬의 종료와 hexosami ne 의 sulfa te 화 의 관계 는 아직 도 명 확하 지는 않다. PG 에서 탄수화물의 성장의 종료는 어떤 특정한 종료 메카니즘에 의해서보다는, 세포의 배출기구에 의해 다당류 사슬이 세 포막에 결 합된 gly c osy ltra nsfe rase 와의 접 촉 범 위 밖으로 밀 려 나갈 때, 탄수화물의 성장이 종료될 가능성이 있다· PG 의 0-sulf ati on 은 이 미 탄수화물 사슬에 도입 된 uronic ac id
에 서 일 어 난다. 또한 GlcUA 의 ldUA 로의 ep im eri za ti on 도 고분 자 상태 에 서 진 행 된 다. HP 의 ep im eriz a ti on 은 N-desulf at i on 밋 N-ace ty la ti on 과 밀 접한 관계가 있으며, 이들 고분자의 변형은 다 음에서 취급되는 다당류의 개별적인 합성과정에서 상세하게 취급 된다. 4. 2 Chondroit in sulfa te 의 생 합성 Chondroit in sulfa te( CS) p ro t eo g l y can 은 중심 단백질에 탄수화 물이 Xy l- Ser 연결로 결합되어 있으며, 반복되는 이당류 단위제와 연결부분을 요약하면 다음과 같다. 巳 GlcUA~► 〔 G 『 INAc 무> GlcUAl 므 Gal 뜨 Gal 4 또는 6 sulf ate p一l, 4 x__ _y _ ,l 一~ Ser. 'CS 사슬의 합성 에 는 6 종류의 gly c osy lt r a nsfe r ase 가 관련되 어 있 으며, 이들의 존재 빛 기질의 선택성이 확인되었다(표 4.1), cs 의 생합성을 이의 진행순서에 따라 보기로 하자. Xy lo se-Serin e 연결 : CS 의 생 합성 은 PG 의 중심 단백 질 (합성 과정 에 있는 pe p tide 사술도 가능)에 있는 serin e 기의 OH 에 UDP-xy l ose 에서 X y l 을 이동시킵으로써 시작된다. 이 반응에 촉매 역할을 하 는 xy l osy ltra nsfe r ase 의 활성 은 1966 년에 암 탉의 난관 (o vi duc t) 에 서 처음으로 확인되었으며, 연이어 쥐의 지만세포종 (mas t ocyt oma), 수정 란 연골 (embr y on i c chic k carti la ge ), 뇌 (brain ) 등에서도 발견되 었다. 연골 PG 는 이의 중심단백질의 ser i ne 기의 약 50% 에는 당이 결 합되 어 있지 않음에 도 불구하고 xy lo se 의 수용체 (accept or) 로서 작 용하지 않는다. 또한 hy a luronid a se 를 써 서 CS 의 사슬을 짧은 oli go saccharid e 로 분해 시 켜 도 PG 의 찬여 serin e 기 는 xy lo se 의 수용체 로 작용하지 않는다. 이 같은 사실은 단백 질의 serin e 기 의 x y lose 의 수용체로의 역할은 거대한 CS 사슬의 공간적 방해에 의
표 4. 1 chondroit in sulfa t e 합성 에 관여 하는 당전 이 효소 빛 이 들 효소 의 외부기질 Enzym e Exog e nous accep tor s I. Xy lo syl tra nsfe r ase Smi th- deg r aded carti la g e pr ote o g ly c an L-Seryl g l y c y lg l y c ine 2. Galacto sy ltra nsfe r ase I D-Xy lo se 0-{3- D-Xy lo syl - L-serin e Meth y l, eth y l, b_u t y l, and octy l /3-D-x y lo p yran osid e Benzy l {3-D-xylo p yran osid e p-Ni tro p h eny l /3- D-xy lo p yi·an osid e 3. Galacto syl t r an sfe r ase II 4-0 -/3-D-G alacto s y l -D -xylo se 4-0-{3-D- Galac t os y l 一 0- /3-D-xy los y l- 도 ser i ne 4. Glucuronosyl t r an sfe r ase I 3-0-{3- D-G alacto sy l- D-ga lacto se 1,3 1,4 0 꿉-o- Galac t os y l- 。-/3-D-g alac t os y l- D-xy lo se 5. N-Acety lg a lacto sami nyl- GlcUA_ 玉 aINAc-GlcUA-GalNAc tran sfe r ase ― ► GlcUA 一 GalNAc (chondroit in hexasaccharid e ) GlcUA 一- ► (GalNAc-4S)-GlcUA 一 (GalNAc-4S) 一 GlcUA 一 (GalNAc-4S) (chondroit in 4-sulf at e hexasaccharid e ) 6. Glucuronosy lt r an s fer ase II GalNAc-GlcUA-GalNAc- ―- ► GlcUA 一 GalNAc (chondroit in p e nta s accharid e } (GalNAc-6S) ―- ► GlcUA ―- ► (GalNAc-6S) 一 GlcUA-(GalNAc-6S) (chondroit in 6-su lf at e pe nta s acchari de )
하여 결정되기 보다는, ser i ne 기 부근의 아미노산 조성, 죽 중심 단백질의 일차구조에 의해 결정된다고 해석될 수 있다. 연골 PG 의 중심단백질에는 CS 와 KS 가 모두 연결되어 있다. CS 는 모두가 Xy l- Ser 연결을 하는 반면에 , KS 의 일부는 GalNAc- Ser, 그리고 나머지는 GalNAc-Thr 연결을 하고 있다. 이 PG 에서
는 CS 사슬이 어떤 특정한 Ser 에, 그리고 KS 가 다 른 Ser 에 연결 되며 나머지 Ser 은 다당 류가 철합 되지 않은 상태로 존재할 가능성 이 크다. 죽 xy lo sy lt r a nsfe r ase 는 단백 질 의 어 떤 목정 한 조 건을 만족시키는 Ser 기를 찾아 X y l 를 전이시켜 CS 사 술의 생합성을, 그리 고 GalNAc-tr a nsfe r ase 는 다몬 특정 한 Thr 이 냐 Ser 기 에 GalNAc 를 전이시켜 KS 사슬의 생합성을 시작 한 다고 여겨진다. ::::J... 러나, PG 의 CS 와 KS 사슬의 생합성이 중심단백질의 한쪽 끝에서 시작되어 점차적으로 단백질 주축을 따라 나아가는지, 아니면 단백 질 주축에 서 무작위하게 진행되는지는 알려져 있지 않다. CS 형 PG이 생합성되는 조직에서는 다른 다당류의 PG 도 합성 된다. 따라서 어떤 주어진 세포가 특정한 다당류에만 선택적인 xy lo sy ltra nsfe rase 만을 포함한다고 단정 할 수 없 다. 예 로, 연골세 포 (chondroc yt e) 에서는 CS 를 우선적으로 생성하기는 하냐, CS 와 유사한 경로로 합성이 시작되는 HPS 도 생성한다. 이에서 동일한 xy lo sy lt r a nsfe r ase 가 Xy l 로 연 결 된 여 러 다당류의 형 성 에 관여 한 다고 볼 수 있다. Xy lo sy lt r a nsfe r ase 는 PG 의 중심 단백 질을 Smi th 분해 시 켜 얻 어 진 생 성 물을 매 체 로 하는 aff ini t y chromato g ra ph y 방법 에 의 해 여 러 조직에서 분리 빛 정제되었다 (4.4). 이 효소는 분자량이 95,000 ~100, 000 이 며 , 분자량이 23, 000 및 27, 000 인 각각 다른 subunit 두 쌍으로 구성되어 있다. X y l 의 전이는 PG 의 새로운 다당류 사슬의 합성의 시발점인 동 시에, PG 전체의 생합성의 조절작용을 할 것으로 생각된다. UDP- Xy l 은 UDP-gl u cose 를 산화시 켜 UDP-GlcUA 을 생 성 하는데 관여 하는 UDP-gl u cose dehy d rog e nase 활성 의 강력 한 억 제 물(i nh i b it or) 이 다 (4. 5). 만약에 중심 단백 질 과 nuclo ti de- 당의 불균형 이 일 어 나 면, 이는 PG 의 합성에 큰 영향을 미친다. 예로, 충분한 양의 중 심 단백질이 합성되지 않으면 UDP-X y l 의 농도가 중가되고, 이는 UDP-gl u cose dehy d rog e nase 에 영 향을 미 쳐 UDP-GlcUA 의 생 성 이 감소하게 된 다. 이 는 UDP-GlcUA 의 decarbox .yla ti on 에 서 생 성 되 는 UDP-Xy l 의 생 성 을 감소시 키 게 된다. 따라서 탄수화물-단
백질 연결의 중요 우1 치에 x y lose 가 존재하는 것은 단백질과 탄수 화물 사슬의 생합성의 불균형에 민감하게 반응하는 조절 메카니즘 을 제공하기 위한 것으로 간주된다. Galac t ose 의 전이 : 중심단백질에 X y l 가 연결됨으로써 시작된 PG 의 탄수화물 사슬의 생 합성 은, 두 개 의 ga lacto s y l 단위 의 연속적 인 첨가로 이어진다. Gal 의 전이는 다음의 두 과정으로 진행된다. UDP-Gal+Xy l -t Gra anlascfet or as yse l - I _► Gal- /3- (l-+4)-X y l+UDP UDP-Gal+Gal-/3- (l-+4) Xy l tra n~sfe rase II 국 Gal- /3- (1-+4) -Gal-/3 ( l-+4)-Xy l+ UDP. 첫 단계의 Gal 전이에는 X y l-Ser 이 보다 좋은 Gal 의 수용체 이긴 하나, 단당류인 Xy l 및 이의 유도제에도 Gal 가 전이된다. 또한 두번 째 Gal 전 이 반응에 서 는 Gal-/3 (l-+4)-Xy l 가 외 부기 질 (exog e nous subs t ra t e) 로 사용될 수 있 다. Gal 전이의 두 반응에서 Gal 의 수용체 간에는 어떤 경쟁적인 관계 가 존재 하지 않는다. 즉, 반응물에 D-xy lo se 를 첨 가해 도 이 것 이 Gal 가 Gal-X y l 에 첨가되는 것에는 영향을 미치지 않으며, Gal- X y l 의 존재도 Gal 가 X y l 에 첨가되는 것에 영향을 주지 않는다. 이 는 앞의 두 Gal 전 이 과정 에 는 각각 다른 ga lacto s y !tra nsfe r - .as e, I 및 JI 가 작용하고 있음을 의미한다• Galacto s y ltra nsfe r ase I 은 탄수화물 사슬의 합성 을 시 작하는 x y los y l t rans f erase 와 어느 정도의 독이한 상호작용을 보인다. •Ga lacto s y ltra nsfe r ase I 은 xy lo sy ltra nsfe r ase 가 존재 할 때 는 .xylo sy lt r a nsfe r ase 의 항제 (anti bo dy ) 에 의 해 침 전 이 형 성 되 나, 이 효소만 있을 때는 침전이 얻어지지 않는다· 또한 약간 정제된 효소 를 부동화된 xy lo sy ltra nsfe r ase (sep h arose 에 공유결 합 또는 sep - harose 에 연결된 중심 단백 질에 흡착된 상태) 가 포함된 column 에 통과시 키 면, 비 교적 순수한 ga lacto s y 1t r a nsfe rase 가 높은 이 온강 도의 세 제 용액 의 용출에 서 얻 어 진다. Galacto s y1 t r a nsfe rase 의 완 전한 활성에는 인지질(p hos p hol ipi ds) 을 필요로 하는 것으로 보인다.
이 는 수정 란의 연골에 서 얻 어 진 mi cr osomal pe llet 에 ph osph oli pa se· C 룰 작용시키면 효소의 활성이 약 25% 로 감소하나, 인지질등을 침 가하면 활성이 재생되는 것에서 알 수 있다 (4.6). Gal-Xy l 에 Gal 을 전 이 시 키 는 효소인 ga lacto s y tra nsfe r ase II 는 4-0- 로 치 환된 xy lo se 을 Gal 다음에 갖는, 보다 큰 Gal 의 수 용체를 필요로 한다. 이 효소는 단당류인 D-g a lacto s e 나 Gal-/3- (1 _► 3)-Gal 에 는 ga lacto s e 를 전 이 시 키 지 않는다. 따라서 이 효소는 _ 단지 말단 단당류 수용체 뿐만 아니라, 다음의 당 (x y lose) 까지도 인 식 한다고 볼 수 있 다. 이 와 같은 ga lacto s y lt r a nsfe r ase II 의 수용체 선 택 성 때 문에 Gal-Xy l 이 당류 단위 체 에 는 단지 한개 의 ga lacto s e· 만이 첨가된다고 볼 수 있다. Glucuronic aci d 의 Galacto s e 로의 전이 : CS 의 탄수화물-단백 질의 연 결 부분은 Gal-Gal-Xy l- Ser 에 GlcUA 가 UDP-GlcUA 에 서 전 이 됨 으로써 완료된 다. 이 반응에 관여 하는 glu curonosy1 t r a ns£erase 는 CS 의 반복되 는 이 당류의 합성 에 관여 하는 또 다론 glu curonosy L tra ns£erase 와는 다르다. 그러 나 이 효소의 선 택 성 은 앞서 언급된 ga lacto s y lt r a nsfe rase II 만큼 높지 는 않으며 , Gal-/3 -( 1-3)-Gal 나 다른 Gal 를 포함하는 화합물, 그리 고 약하기 는 하나 D-ga lacto s e· 도 UDP-GlcUA 에 서 GlcUA 가 전이 되 는 수용체 로 작용한다. UDP-GlcUA + Gal-{3 -( l-3) Gal 一 GlcUA- {3 -(1-3)-Gal- {3 (1-3)-Gal+UDP 반복되는 이당류 단위체의 합성 : CS 의 무제포 (cell free ) 생합성에 관 7 한 연구는 수정 란 연골 (embr y on i c chic k car til a g e) 에서 얻은 두세포 조제 를 UDP-GlcUA 와 UDP-GalNAc 와 함께 배 양시 키 면 sulf at e 화가 낮은 다당류를 형 성 한다는 것을 보였 다. 이 다당류는 N-acety l- ga lacto sami ny lt r a nsfe r ase 와 glu curonosy ltra nsfe r ase 의 두 효소 가 두 가지 단당류 성분을 성장하는 다당류 사슬의 비환원성 말단에 반복적으로 첨가함으로써 얻어진다. 비환원성 말단의 GlcUA 에 UDP-GalNAc 에 서 GalNAc 가 전이 되 는 것은 수용체 의 sulf ate 화 여 부에 무관하게 HA, Ch4-S 및 Ch6-S 에 서 얻 어 진 oli go saccharid e 에 서 모두 일 어 난다. HA 의 oli go saccharid e 가 CS 의 oli go sacchar-
i de 와 마찬가지로 GalNAc 의 수용체로 작용한다는 것은, GalNAc 의 전이는 수용체의 말 단 단당류에 의해서 결정되며 두번째 당류의 종류는 크게 중요하지 않음을 의 미 한다 (HA 와 CS 의 hexosami n e 은 각각 GlcNAc 와 GalNAc 로 서 로 다르다) . N-acety lg a lacto sami ny 1t r a nfe rase 가 기 질 에 대 한 선 택 이 없 음 에도 불구하고 생성되는 다당류는 아주 균일하게 얻어지는 것은 또 다몬 과정이 다당류의 생합성에 크게 관여하고 있음을 의미한다. 바 록. cs 와 HA 는 모두 chondrocy te 에 서 합성 되 나, 효소의 기 질 선택성의 결여에서 예상되는 HA-CS 의 혼성제 (동일 다당류 사슬에 GalNAc 와 GlcNAc 가 모두 포함)의 형 성 은 관찰되 지 않는다. 이 는 이들 다당류의 생합성이 세포 내에서 각각 다른 구획에서 진행되거 나, 아니면 다른 메카니즘에 의해 조절됨을 나타낸다. 이에 대한 한 가지 설 명 은, 내 질 망상체 (endop la smi c reti cu lum) 나 Golgi 체 의 막에 다가효소착물 (mul ti enz y me comp le x) 이 존재 하고, 이 효소착물이 주어 진 다당류를 다른 효소의 방해가 없이 잘 조절하며 합성한다는 것이 다. 이와 같은 다가효소 착물은 앞서 언급된 xylo sy lt r a nsfe r ase 와 ga lacto syl t r a nsfe rase 의 상호작용에 의 해 생 성 될 수 있 다. 그 러나, 아칙도 다가당전이 효소의 형성에 관여하는 효소들간의 상호 작용은 생체 내에서는 확립되지 않았다. UDP-GlcUA 에 서 GlcUA 를 GalNAc 에 전 이 시 키 는 데 촉매 작 용을 하는 효소인 glu curonosy l tr a nsfe r ase II (GlcUA-Gal 연결 에 관여하는 효소와 구별하기 위해 II 로 표시)는 비환원성 말단에 GalNAc 을 갖는 chondroit in 과 Ch6-S 의 oli go saccharid e 에 작용한 다. 그러 나 Ch4 -S 의 oli go saccharid e 에 는 이 효소에 의 해 GlcUA 가 첨 가되 지 않는다. 따라서 Ch4 -S 의 합성 에 서 는 GalNAc 기 의 C-4 위치의 su lf a ti on 은 GlcUA 의 첨가 이후에 일어난다고 볼 수 있 다. 이와 같은 GlcUA 전이효소의 기질 선택성에서 GalNAc 의 C- 4 -su lfa tion 이 CS 사슬의 종료 메 카니 즘으로 간주될 수 있으나, 이 에 대한 확실한 중거는 아직도 없다. Sulfa ti on : CS 의 생 합성 에 서 는 GalNAc 의 C-4 및 C-6 위 치 가 .s u lf a ti on 되는 것이 필요하다. 비록 sul fat e 화 된 nucleo ti d e-당
(UDP-GalNAc- i! S) 의 생합성이 관 찰 되기도 했으나, 이 nucleoti de -당 은 GAG 의 sulfa tion 의 중 간 체 는 아 니 다. GAG 의 sulf ati on 은 이 들 다당 류 의 중합 과 동시에, 또는 중 합 직후에 일어 난다 (4.7). GAG 나 다 몬 생 물 계 의 sulfa tion 반응에 서 sulfa te 기 의 donor 는 3'-ph osph oadenosy l- 5'-ph osph osulf ate ( PAPS) 이 며 , 이 는 APT 와 sul fat e 기 간의 두 단계 반응에 의해 생성된다. APT+su lf a t e:;;::= 푸 MP-sul fat e+ py ro p hos p ha t e (adeny ls ulfa te) AMP-sul fat e+ATP ― ➔ PAPS+ADP 이 반응에 의해 생성된 PAPS 의 구조는 다음과 같다.
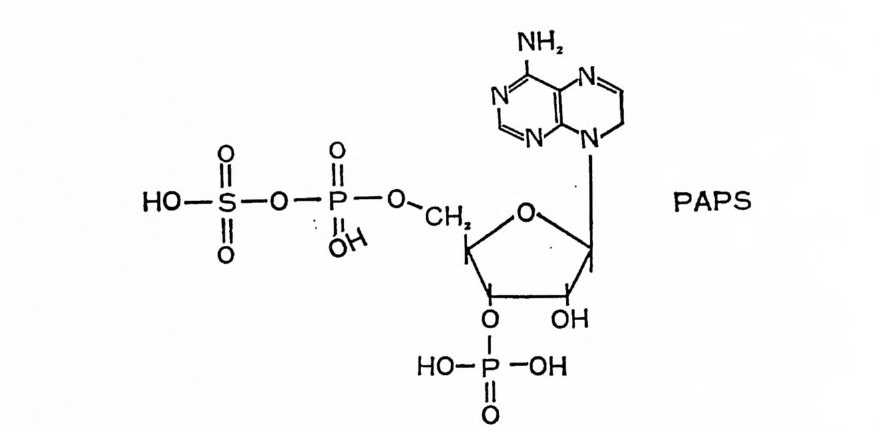 H 。 -o-S 。II O- OI-IPI。 IO I C H PAPS
H 。 -o-S 。II O- OI-IPI。 IO I C H PAPS
PAPS 의 합성 은 다른 nucleo ti de- 당의 합성 과 마찬가지 로 cy top la - sm 에 존재 하는 수용성 효소에 의 해 진행 된다. PAPS 에 서 sulf ate 기 몰 전이 시 키는데 촉매 역 할을 하는 sulfo tra nsfe r ase 가 존재 함이 확인되 었으며 , chondroit in 은 물론 비 환원성 말단에 GalNAc 를 갖 는 oli go saccbarid e (특히 홀수 개 의 단당류로 구성 된 것) 가 이 효소 의 기질로 작용한다. 지금까지 우리는 CS 의 생합성에는 6 종의 당전이효소가 관련되 어 있음을 보았다. 이 들 효소와 생 합성 과정 및 GalNAc 의 su lfat i on 을 요약하면 그림 4.3 와 같다.
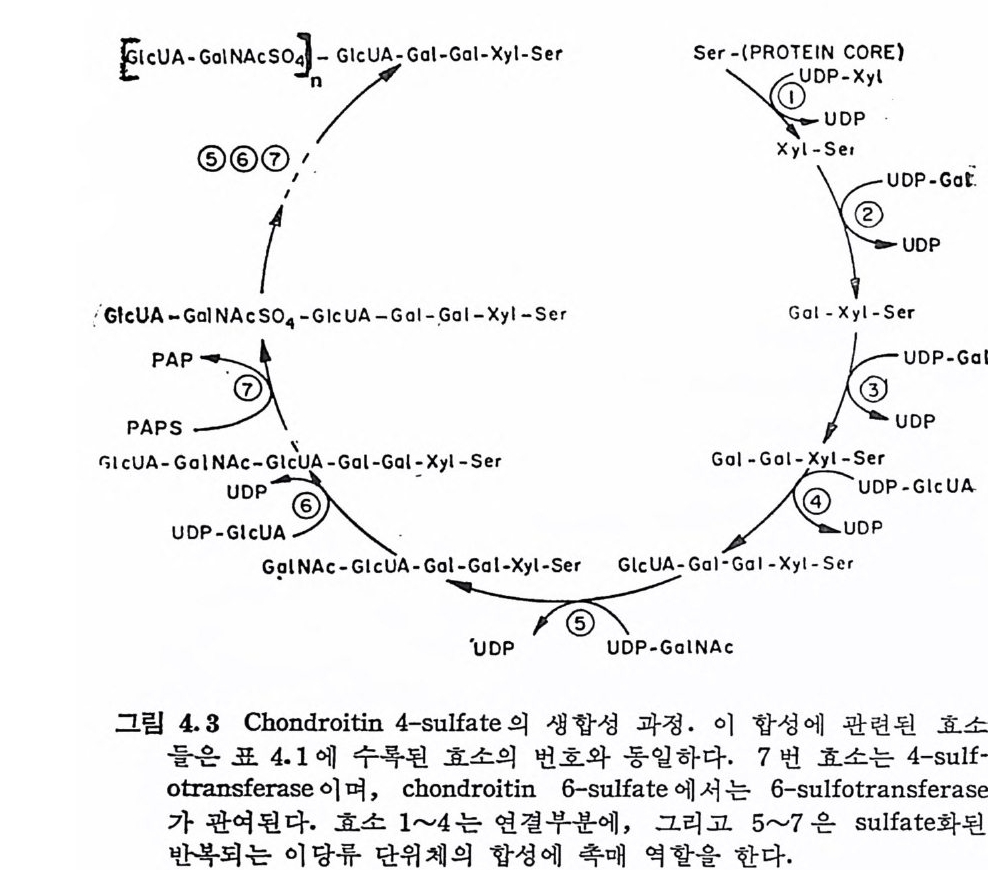 iGG IflecPUU1AAcA:U--UAG: 二G- a®G:l :No 三\®AN :cAcSI-p•uc ® Os~o:I J / I- G 广 -lcG U lc: AUO-_G1} aG-l Xo二-l ,G-yG la- ol s-le-XXry y l\ - - SSeerr ~ INsAeG rc :<[\GXo :l-yX:DPu eyl 책\NiI l- p DSr eP r -DG pI.e GUupa A t f
iGG IflecPUU1AAcA:U--UAG: 二G- a®G:l :No 三\®AN :cAcSI-p•uc ® Os~o:I J / I- G 广 -lcG U lc: AUO-_G1} aG-l Xo二-l ,G-yG la- ol s-le-XXry y l\ - - SSeerr ~ INsAeG rc :<[\GXo :l-yX:DPu eyl 책\NiI l- p DSr eP r -DG pI.e GUupa A t f
GAG 의 생합성에는 2 개의 합성 조절메카니즘이 작용한다. 이 중 한 가지 는 이 미 언급된 UDP-GlcUA 생 성 에 대 한 UDP-Xy l 의 억 제 작용이 다. 또다른 조철은 hexosami ne 의 합성 과정 에 서 일 어 난다· UDP-GalNAc 는 UDP- Gl cNAc 와 평 형을 이 루고 있으며 , UDP 一 GlcNAc 는 fru.ct os e-6 -ph osp h ate 와 glu ta m ine tr a nsami da se 의 반응에 의 해 생 성 된 glu cosami ne -6-ph osp h ate 에 서 합성 된 다(그립 4.1 참조). UDP-GlcNAc 는 이 Fru .-6 -P 와 glu ta mine 반응의 억 제 물이 다. 따라서 다당류의 생 합성 이 느리 면 UDP-GlcNAc 의 농도가 중가되 고, 이 는 UDP-GlcNAc 생 합성 의 전도물질 인 GlcN-6-P 의 생성 속도를 감소시켜 전체 다당류의 합성이 조절된다. 이와 같은 -
UDP-GlcNAc 에 의한 다당류 합성 조절은 많은 g l y co p ro t e i n 의 생 합성에도 유사하게 적용된다. 4. 3 Hy a luronic ac id 의 생 합성 HA 의 반복되 는 이 당류 단위 체 는 GlcNAc-/3- (l-4 )GlcUA 이 며 , 이는 /3 1,3 연결로 결합되어 있다. 이 다당류는 1955 년에 Glaser 와 Brown(4. 8) 이 Rous Sarcoma 에 서 얻 은 무세 포 조제 중에 서 UDP-GlcUA 와 UDP-GlcNAc 에 서 oli go sacchari de 로 생 합성 되 었 다· 그 뒤 A 군 연쇄 상군(g rou p A s t rept ococ ci)에서 얻은 입 자상 효소 조제를 이용하여 거대분자의 HA 가 합성되었다. 많은 포유동물 조 직 조제 에 서 도 두 가지 nucleo ti de- 당에 서 고분자량의 HA 가 합성 되었으나, HA 사술의 생합성에 관한 구체적인 메카니즘은 아직 잘 알려져 있지 않다. CS 사슬은 중심 단백 질 에 UDP-Xy l 에 서 X y l 가 전이 됨 으로써 이 다당류 사슬의 생합성이 시작된다는 것이 확립된 반면에, HA 에서 는 CS 형 PG 와 유사한 PG 의 존재마처 확실하지가 않다. 그러나 · 단백 질 의 합성 을 완전히 억 제 시 키 는 pu romy c in 과 chloramp h enic o l 이 HA 의 생합성에는 거의 영향을 마치지 않는 것으로 보아 HA 는 순수한 다당류로 합성될 가능성이 크다고 볼 수 있다· HA 의 반복되는 이당류 사슬의 합성에 관한 연구도 극히 미마하 다· 그러나 이와 관련된 몇 가지 연구가 보고되었다. Str o olmi ller- 와 Dorf ma n(4. 9) 은 UDP-GlcUA 와 UDP-GlcNAc 가 모두 존재 할 때 고분자의 HA( 분자량 24,600) 를 합성하는 연쇄상구균계가 입자상 효소 조제를 UDP-GlcUA 와 배양시킬 때 GlcUA 한 단위를 전이시 킬 수 있음을 발견했다· 그러나 유사한 실험에서 GlcNAc 의 전이 는 확인되지 않았다. 또한 HA 에서 얻어진 6 및 5 당류 단위체를 연쇄상구군 효소와 필요한 nucleo ti de- 당의 혼합물에 첨가했을 때 에 도 이 들 oli go saccharid e 에 의 GlcUA 나 GlcNAc 의 첨 가가 관찰 되지 않았다. 이는 유사한 조건하에서 CS 의 o lig osacchar i de 에는· 당이 쉽게 전이된다는 것과는 아주 대조적이다. 따라서, HA 의 생
합성은 CS 의 생합성과 다른 경로로 진행될 가능성이 있다. HA 의 생합성의 가능한 하나의 경로로 지질 중간체가 제안되었 다. 이 의 한 가지 는 박테 리 아성 pe p tido g l yc an 이 나 다른 박테 리 아 성 다당류의 경우와 유사한 지질 중간체이며, 다론 한 가지는 포유 동물의 gl yc op r ote i n 중 GlcNAc-Asn 연결을 갖는 oli go sacchari de 의 형 성 에 관여 한다고 알려 진 doli ch ol pyro p h osp h ate 중간체 이 다 (그림 4.2 참조). 그러나 아직도 HA 가 지질 중간체 경로로 합성된 다는 중거 는 없 다. 지 질 중간체 경 로의 특성 은 urid in e monop h os- p ha t e(UMP) 의 생성이다. UDP-GlcNAc+Dol-P-GlcNAc-P-P-Dol. +UMP 그러나 UMP 의 생성은 거의 관찰되지 않았으며, 오히려 UDP 의 생성이 쉽게 측정되었다 (4.9). 이는 GlcNAc 가 앞의 반응식에서 보 여 준 바와 같은 GlcNAc-1-ph osph ate 상태 가 아닌 GlcNAc 자제 로 전이됨을 나타낸다· 또한 지질-py ro p hos p ha t e 의 dep h osp h oryl at- ion 을 억 제 하여 pe p tido g ly c an 의 합성 을 막는 bac itra ci n 도 HA 의 생성에는 큰 영향을 주지 않음이 관찰되었다. 앞서의 지질 중간체 경로에 대한 부정적 실험 결과와는 달리, 지 질 중간체를 지지하는 실험 결과도 보고되었다. GlcUA-GlcNAc- P-P-Dol 인 이 당류一지질이 sim i a n-vir u s-40(SV 40) 으로 변태된 사람 의 허파 fi broblas t에서 분리되었으며, 이것이 GAG 의 형성에 관여 히는 지질 중간체일 것으로 생각되었다 (4.10). 그러나 이 이당류-지 질의 GlcUA-+GlcNAc 의 연결은 HA 의 1->3 와는 다른 1-+4 로 밝 혀졌고, 따라서 이 중간체는 HA 보다는 HP 생합성의 중간물질일 가능성이 크다. 4. 4 Dermata n sulfa te 의 생 합성 DS 의 구조를 Ch4-S 와 비 교하면, Ch4-S 의 반복되 는 이 당류 단 위 제 의 GlcUA 가 DS 에 서 는 L-id uronic a ci d(IdUA) 로 치 환된 것 과 IdUA 의 일부가 sul fat e 화 된 것 외 에 는 모두 동일 하다. (DS 의 ldUA-GalNAc 의 al, 3 연결 은 CS 의 GlcUA-GalNAc 의 {,1, 3
연전에 상응한다.) 지금까지 알려진 DS 의 생합성 과정은 CS 에서 확립된 과정과 갇 은 양상으로 진행된다는 것이 다. 다만 IdUA 는 성장하는 탄수화물 에 UDP-IdUA 에서 IdUA 가 전이되는 것은 아니며, 이미 다당류 에 결 합된 GlcUA 의 C-5 ep im eriz a ti on 에 의 해 생 성 되 는 것 으로 알려지고 있다. 이에 대한 구제적인 내용은 다음 항의 hep ar i n 의 생합성을 참조하기 바란다. DS 의 반복되는 이당류 단위체를 형성하는데 촉매작용을 하는 효 소들에 대해서는아직도구체적으로연구되지 않았다. 그러나 2 종의 당전 이 효소, glu curonosyl t r a nsfe r ase 와 N-acety lg a lacto s ami ny l- t rans f erase 가 존재할 것이라는 것은 쉽게 짐작된다. 후자의 효소 로 비 환원 성 말단에 IdUA 를 갖는 DS 의 oli go saccharid e 에 UDP- ' GalNAc 에서 GalNc 를 전이시킴이 관찰되었다 (4.11). 이 효소의 작 용은, HP 의 생 합성 에 관여 하는 N-acety lg l u cosami ny I tr a nsfe r ase 가 GlcUA (I dUA 는 아님)에만 GlcNAc 를 전이시키는 것과는 대조 적이다. 4. 5 Hep a ri n 의 생 합성 HP 는 hexosami ne 으로 D-gl u cosami ne (N-acety l 또는 N-sulf- · a t e 화 됨)을, 그리고 uronic ac i d 로는 GlcUA( 소량)과 IdUA( 다량) 을 함유하고 있다. Glucosam i ne 의 아민기가 대부분 N-sul fat e 된 것 외 에 도, 이 다 당류는 glu cosami ne 의 C-6 밋 IdUA 의 C-2 위 치 의 상당량도. sulfa te 화 되어 있다. 다당류와 중십단백질의 연결은 ·CS 와 유사한 GlcUA-Gal-Gal-Xy l- Ser 으로 구성 되 어 있 다. HP 및 HPS 의 hexosami ne -uronic aci d 연결는 a(l-+4) 로, 다른 GAG 의 /3 (1-+4) 와 차이 가 있 다· HP 의 탄수화물 주축의 합성은 CS 의 합성 경로와 거의 같으며 이는 다음과 같이 요약된다. L 중심단백질의 합성. 2. xy lo sy lt r a nsfe r ase 에 의 한 탄수화물 사술의 합성 시 작.
3. 두 가지 ga lacto sy I tr a nsfe r ase 와 gI ucuronosy I tr a nsfe r ase 에 의한 연결 부분의 합성. 4- N-acety lg I ucosami n y ltra nsfe r ase 와 gl ucuronosy I tr a nsfe r - ase 의 반복되는 작용에 의해 반복되는 이당류 단위체로 구성 된 탄수화물 사슬의 합성 . HP 의 sulfa tion 및 GlcUA 의 IdUA 로의 ep im eri za ti on 은 탄수화 물사슬의 합성과 거의 병행하여 진행된다. 이 과정의 HP 사슬의 변형은; 1. GlcNAc 의 N-deacety la ti on 및 N-sulfa tion 2. GlcUA 의 ep im eri za ti on 에 의 한 IdUA 의 합성 3- Glucosami n e 의 C-6 및 IdUA 의 C-2 위 치 의 sulfa tion 동이 다. HP 의 중심단백질의 합성에 대해서는 다른 PG 의 경우와 마찬가 지로 아칙 잘 알려져 있지 않다· 그러나 탄수화물-단백질 연결부분 의 생합성에는 CS 의 생합성에 관여하는 효소들이 여기서도 관여한 다고 여겨진다. 따라서 이 부분에 대해서는 CS 의 생합성을 참조하 기를 바란다. GlcNAc 의 전 이 (GlcNAc-a-(1--+4)GlcUA 연결 의 형 성 ) :HP 의 반복되 는 이 당류 단위 체 의 hexosami ne 은 UDP-GlcNAc 에 서 GlcNAc 가 성 장중인 다당류 사술의 비환원성 말단에 있는 GlcUA (I dUA 가 아님) 에 전이됨으로써 형성된다. 이 반응에 촉매 역활을 하는 N-acety l- gl yc osami n y 1 tr a nsfe rase 의 존재 및 이 의 기 질 특이 성 은 Heit ing 과 L i ndahl 에 의해 밝혀졌다 (4.12). 이들은 HP 을 HN02 로 분해시 키고, Dowex 50 에서 여러 탄수화물-단백질 연결부분을 분리하여 각각에 대한 GlcNAc 의 전이를조사했다. 이들의 결과는표 4.2 에 요약하였다. HP 의 연결부분을 포함한 분해 생성둘 A2, B1 및 B2 중에서 단지 B1 만이 GlcNAc 의 수용제로서의 활성이 관찰된다. 이 부분은비환 윈 말단에 GlcUA 와 IdUA 를 약 반씩 갖고 있으며 , 탄수화물-단 백질 연결부분 외에 2 단위의 반복되는 이당류를포함하고 있다· 그 러 나, B1 을 /3-glu curonid a se 로 처 리 한 B1_f3 에 서 는 GlcNAc 의
표 4. 2 Hep a rin 의 생 합성 에 서 의 가능한 GlcNAc 의 수용제 럿 GlcNAc 의 전이 HP 분해 부분 구 조 G전l cNAc 의이 Hy a luronic aci d GlcUA- ► GlcNAc- ► GlcUA-+GlcNAc + 6 당류체 -► GlcUA- ► GlcNAc •co mp o und A2 IdUA-+GlcNAc-+GlcUA-+Gal--.Gal -+X y l- ► Ser 값 om p ound Bz G !c UA- ► GlcNAc--.GlcUA-+Gal-+Gal -+Xy l- +Ser IIdUA 一 GlcNAc 코 UA 一 GIcNAc 一 GIcUA frac ti on B1 lGI-c►U GAa 一 巨 G Glac 巨NA cX- y► J U --A.S 一er G lcNAc 귁 GlcUA + -+Ga 巨 Gal-.X y !--.Ser IIdUA 一 GlcNAC 석 UA 一 GlcNAc 一 GIcUA frac ti on B1-~ lGl-c+NGAacl -一-. GUaAJ 귓- - . XGly cJ-N -A.Sce 귁r GlcUA 귁 Ga 巨 Gal 士 -+Xy l- +Ser
전이가 거의 관찰되지 않는다. 이는 GlcNAc 는 IdUA 를 말단에 갖 는 oli go saccharid e 에 는 전 이 가 일 어 나지 않음을 의 미 한다. 또한 B1 보다 이당류 단위체가 하나 적은 恥나 A2 에도 GlcNAc 는 전이 되지 않는다. 반면에, 반복되는 이당류 단위제가 3 인 HA 의 6 당 류체에는 비록 당류간 연결이 /3 (1 一 4) 가 아닌 /3(1 -3) 이지만 Glc- NAc 의 전이가 일어난다. 이와 같은 GlcNAc 수용체의 크기에 대 한 선 택 성 은 HPS 의 oli go sacchari de 에 서 도 관찰된다. 이 결 과는 HP 사슬의 생합성에 대한 에카니즘을제시하지 못한다. 따라서 HP 의 생합성에는 최소한 탄수화물-단백질 연결부분과 가까운 영역에 서는 지질 중간체가 관여하리라는 가능성을 배제시킬 수 없다. GlcUA-a(l->4)-GlcNAc 연결의 합성 : Helti ng 과 Lin d ahl 은 앞서 언급된 GlcNAc 의 전이와 유사한 실험을 GlcUA 의 전이에서도 수 행 하였 다. 쥐 의 masto cy tom a 에 서 수행 된 GlcUA 의 전이 실 험 은, 이 단당류는 이당류 단위체가 2 개는 몰몬, 1 개인 HP 연결부분 fr a g men t에도 전이됨을 보였다. 그러나, HA 에서 얻어진 비환원
성 말단에 GlcNAc 를 갖는 5 당류체에는 GlcUA 가 전이되지 않 았다. 따라서 HP 의 이 당류 단위 체의 생 합성 에 관 여 하는 gl ucur- osy I tr a nsfe rase 의 기 질은 마지 막 GlcNAc 가 f3 가 아니 고 a 배 향으 로 연결되어 있어야 한다고 여겨진다. HP 사슬의 변 형 : N-sulfa tion 은 이 미 다 당류 사슬에 도입 된 Glc-NAc 의 N-acety l 기 를 치 환시 켜 일 어 난다. HP 의 deacety la ti on 은 N-sulfa tion , C-5 ep im eriz a ti on 및 0-sulfa tion 등 일 련 의 HP 사 술의 변형에 대한 기폭제 역할을 한다. 이와 같은 다당류 변영은 ` 모두가 고분자 상태에서 일어나며, 고분자 사슬에서 명 확한 중간과 정을 거치면서 진행된다는 것이 밝혀졌다. 그러나 전반적인 변형은 아주 빨리 진행되며 완전히 sulfa te 화된 HP 사슬이 형성되는 데는 ` 30 여 초밖에 소요되 지 않는다. HP 사슬의 변 형 은 Sweden 의 Li n dahl gr oup 에 의 해 집 중적 으 . 로 연구되었으며, 이제는 전반적인 변형의 순서가 비교적 상세하게 알 려 졌 다. 이 들은 Furt h masto c y tom a 의 mi cr osomal frac ti on 을 UDP-GlcNAc 및 UDP 壬 13C]GlcUA 와 반응시키고, 일정 시간 후 PAPS 를 첨 가했 다· 또한 UDP-GlcNAc, UDP-GlcUA 및 PAPS 을 반응 초기에 동시에 첨가하는 등 여러가지 비교실험을 수행하였다· 반응 혼합물을 pa p a in 으로 처 리 하고 DEAE-cellulose 상에 서 chr- omato g rap h y 로 반응 생 성 물을 분리 하였 다. Lin dahl g rou p에 의해 수행된 실험의 전형적인 생성물의 chro- ma t o g ram 을 그림 4. 4 에 서 보여 주고 있 다. PAPS 가 존재 하지 않을 때 의 UDP-GlcUA 와 UDP-GlcNAc 의 반응 혼합물에 서 는 두 가지 생성물이 확인되었다. 이 중 한가지는 HA 와 같은 위치 (困 ) I 에서 용출되며, 다른 것은 이보다 빨리 용출되었다. 빨리 용출되는 부분(田)은 HA 보다 낮은 전하밀도를 갖고 있는 것으로 해석되고, 따라서 N-acety l 기 가 deacety la ti on 되 어 생 성 된 것 으로 설 명 된 다. PAPS 가 존재할 때는 3 종류의 성분이 추가로 나타나며, 가장 늦게 용출되는 성분은 표준 HP 과 같은 위치에서 나타난다. 나 머지 두 성분은 그립 4.4 에서 보여 준 바와 같이 N-sul fati on 과 0-sul fati on(IdUA) 된 생성물로 밝혀졌다. 이 실험 결과에 따르는·
HP 의 생합성 과정은 대략 다음과 같이 요약될 수 있다. 1. HP 생합성의 일차적 생성물은 困번 위치의 GlcUA 와 GlcUAc 로 구성된 다당류이다. 2. 困 성분의 N-deace ty la ti on 은 자유 아민기를 갖는 띠번 성분 울 생성한다· 그러나 deace ty la ti on 은 단지 일부분(약 50%) 에 만 행해지며, IdUA 는 생성되지 않는다. 3. 자유 아민기 가 N-sulfa te 화 되 면 성 분 困을 생 성 하며 , N-ac- e ty l 정도는 약 25% 로 감소한다. 그러나 IdUA 는 거의 생성퇴 지 않는다. 4. GlcUA 의 ep im erase 는 N-sulfa te 화된 다당류에 작용하여 GlcUA 을 IdUA 로 전환시킨다. 이와 동시에 IdUA 의 C- 2 위 치가 O 一sul fati on 되며, 이는 囚위치에서 나타난다. 5. HP 분자는 glu cosami ne 의 C-6 위 치 에 0-su lfa tion 됨 으로써 생합성이 완료된다. 실험적으로는 HP 을 합성할 때 5 종의 성분이 완전히 구분되어 얻어진 것은, 실제 생제내에서의 HP 의 생합성은 몇 가지 과정을 통 하여 점차적으로 주어진 순서에 따라 진행된다는 것을 제시해 주고 있다. 그리고 HP 사슬의 여러가지 변형들은 이 과정에서 서로 연 관되어 진행됨을 의미한다. 만약 이들이 서로 임의로 일어난다면, 생 성 된 HP 고분자 사술은 N-sulf ati on , ep im eri za ti on , 0-su lf at i on 등에는 서로 상관관계가 없고, 따라서 생성물은 그림 4.4 와는 완. • 전히 다른 하나의 넓를 띠를 갖는 chroma t o g ram 을 보일 것이다. 그러나 이 결론은 어디까지나 실험실적 조건에서 얻은 결과에 의한 것이며, HP 의 생체 내에서의 생합성이 같은 형태로 진행된다는 것 은 아직 증명 되 지 는 않았다. 더 우기 대부분의 HP 은 약간의 N-ac-· ety l 기 를 포함하고 있 으며 , N-sulfa tion 정 도와 0-sulfa tion 정 도, 그리고 IdUA 의 함량 간에는 엄밀한 정량적인 관계가 성립되지 않 는 것으로 되어 있다· 앞서 언급된 HP 사술의 변형에 관한 몇 가지 추가적 정보를 다 읍에서 기술한다.
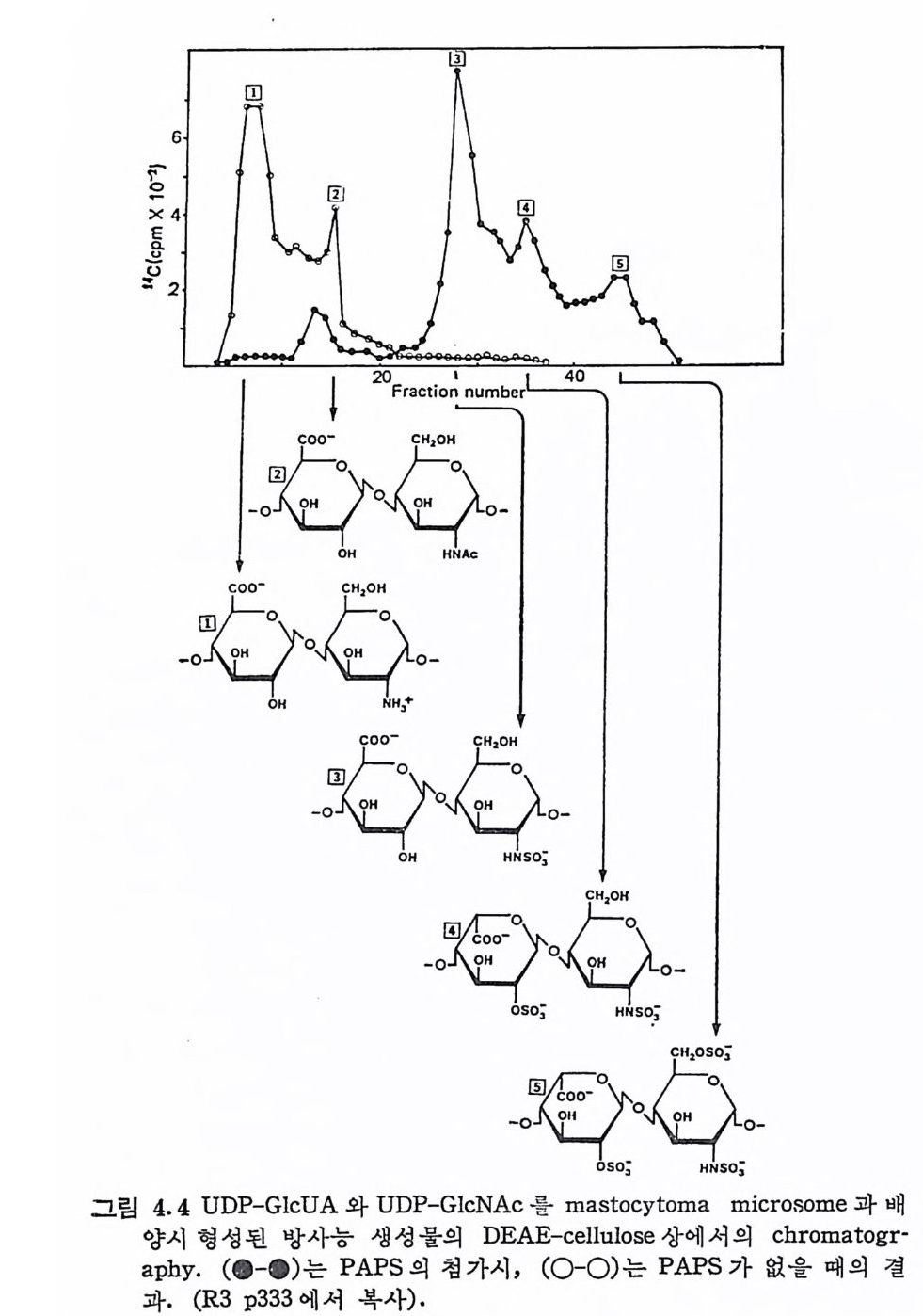 642
642
N-deacety la ti on 과 N-sulfa tion : HP 의 N-acety l 기 륭 제 거 시 키 는 deacety la se 가 Furth masto c y tom a 에 서 얻 은 homog e nate 의 100, 000g frac ti on p elle t에 존재한다는 것이 확인되었다. 이 효소는 [3H] 로 표시 된 N-acety l 기 에 서 〔떤〕 CH3COOH 를 방출시 키 며 , 효 소 활성의 최적 p H 는 6. 5 부근이고 완전한 활성을 위해서는 Mn. . + 이온이 필요하다. HP 의 N-deacety la ti on 은 이 다 당류의 변형 과정 을 전 반적 으로 조절 한다는 점 에 서 큰 홍미 가 있 다. N-deacety It i on 이 없 아 는 합 성 된 중간체 의 HP 이 N-sulfa tion , ep im eriz a ti on 및 0-sulfa tion 과정을 통해 완전한 HP이 되는 일련의 반응을 거칠 수가 없다. 따 라서 조직 내의 deace ty lase 의 활동도와 이의 조절이 HP 전도체 분 자가 HP 으로 전환될 것인지, 아니면 HPS(N-sulfa tion , 0-su lfa tion 밋 IdUA 화 정도가 HP 에 비해 낮다)로 될 것인가를 결정하는 중 요 인 자가 된 다. HPS 분자 내 에 서 발견된 HP 와 유사한 구조는 아마도 이 다당류의 합성 초기 단계에서 N-deacety la ti on 에 의해 형성된 것으로 간주된다. 이와 관련하여 mas t ocyt oma 의 0-sulfo tra nsfe rase 의 수용체 선 택 성 에 관한 연구는 0-sulfa tion 이 HPS 의 N-acety la ti on 된 부분에 서 보다는 N-sulfa te 화된 부 분에서 우선적으로 일어남이 관찰되었다. N-sulfo tra nsfe r ase 는 PAPS 의 sulfa te 기 를 자유아민 기 에 전 이 시키는 데에 촉매 역할을 하며, 이 효소의 활성은여러 조직에서 얻 어진 효소재계에서 확인되었다. N-sul fati on 은 자연 상태의 다당류 보다는 N-desul fat e 화 된, 죽 자유 아민기를 포함하는, 유도체에 서 더 용이하게 진행되며, 자유 아민기를 N-ace ty la ti on 시키면 sul fat e 기의 수용체로서의 활성이 85% 이상 감소한다. 이는 화학 적 또는 효소에 의해 deacety la ti on 된 자유 아민기에 s ulf a t e 기가 전이된다는 앞서의 결론과 일치한다. L-idu ronic acid 의 생 합성 : HP 이 나 HPS 의 uronic ac id 로 IdUA 가 존재한다는 것이 밝혀진 후, 이 uronic a ci d 의 생합성의 전도체 로서 UDP-IdUA 를 masto c y tom a 등의 조칙 에 서 확인 하려 는 많은 노 력이 행해졌으나 성공하지 못했다· 또한 HP 의 fr a g men t에 대한
GlcNAc 의 전이 실험에서 비 환원성 말단에 GlcUA 를 갖는 경우에 ’ 는 GlcNAc 가 전 이 되 나, IdUA 롤 갖는 frag m ent 에 는 GlcNAc 가 전이되지 않 음이 밝 혀졌 다. 이 제 는 HP 의 IdUA 는 합 성 단계에 서 UDP-IdUA 에서 전이되는 것이 아니 라 , 이 미 다당류에 도입된 . GlcUA 의 C-5 ep im eri za ti on 에 의 해 생 성 된 다는 것 이 확 립 되 었 다. Uronic ac id 의 고 분 자 상태 에 서 의 ep im eri za ti o n 은 algi ni c ac id 의 생합 성 에서 먼처 관찰되었다 (4.13). 해양 혹 조 (mar i ne brown alga e) 의 탄수화물의 주성 분은 D-mannuronic ac id 와 이 의 C-5 ep im er 인 L-gu luronic acid 로 구성 되 어 있 다. 이 두 uronic acic i 의 관계는 D-GlcUA 와 L-IdUA 의 관계와 동일하다.
 H,OH 仁。 H,OH
H,OH 仁。 H,OH
1960 년까지만 해도 algi ni c ac i d 는 이를 이루는 nucleo ti de- 당 .. UDP-D-mannuronic ac id 와 UDP-L-gu luronic ac id, 에 서 합성 된 다고 여 겨 져 왔다· 그러 나 1971 년 Norwey 의 Haug 와 Larsen 이 해 조의 po lym annuronic ac id 를 D-mannuronic ac id 와 L-gu lur- onic ac id 로 구성 된 전형 적 인 algi ni c acid 로 전환시 키 는데 촉매 역 할을 하는 효소를 발견함으로써 uronic ac id 의 ep im eriz a ti on 이 고분자 상태에서 일어남을 보였다. HP 의 IdUA 가 algi ni c ac id 의 gu luronic ac id 와 유사한 경 로 불 거쳐 생합성된다는 것은 Sweden 의 L i ndahl 등 (4.14) 에 의해 규 명되었다• 이들은 mi cro some 효소를 UDP-[14CJ -G lcUA 및 UDP- GlcNAc 와 반응시 켜 두 종류(그립 4. 4 의 印 및 困 성 분)의 sulf ate 화 가 되지 않은 다당류를 얻었다. 이 반응 혼합물에 PAPS 와 방
사능 표시 가 얀 된 UDP-GlcUA 을 과량으로 첨 가하여 다시 반응 시 켰 다. PAPS 존재 하에 서 방사능이 표시 얀 된 UDP-GlcUA 는 UDP-[14 이 GlcUA 보다 아주 과량이므로, 두번째 반응 과정에서는 무시할 수 있는 양의 방사능만이 다당류에 첨가된다. 이 반응 생성 물을 분석 한 결과는 sulfa te 화가 되 지 않은 다당류는 방사능 표시 된 IdUA 을 포함하지 않으며 , 방사능은 단지 GlcUA 에 서 만 검 출퇴 었 다. 그러 나 0-sulfa tion 된 다 당류는 IdUA 와 GlcUA 에 서 각각 30% 및 70% 의 방사능을 나타내었다. 따라서 방사능으로 표시된 IdUA 는 이 미 다당류에 첨 가된 [14 이 GlcUA 의 ep im eriz a ti on 에 의 해 서 생 성 되 며 , 0-sulfa tion 과 ep im eriz a ti on 은 서 로 밀 접 하게 연관되어 있음을 알 수 있다. 이는 HP 에서 IdUA 의 대부분아 0- sulfa tion (C -2 위치)되어 있다는 것과 잘 일치한다. 0-sulfa tion 과 ep im eriz a ti on 과의 관계 는 다음과 같이 설 명 된 다. GlcUA 와 IdUA 의 ep im eri za ti on 은 가역 적 이 다. 그러 나 0-sulfa te 된 IdUA 는 e pi merase 의 기질로 작용할 수 없고, 따라서 IdUA 로 고정 된 다. 이 와 같은 가역 적 ep im eriz a ti on 은 DS 의 생 합성 과정 에서 IdUA 의 일부가 GlcUA 로 전환되는 것에서 관찰되었다. Uronic ac id 의 C-5 ep im eriz a ti on 의 메 카니 즘은 C-5 위 치 의 수 소를 추적함으로써 규명될 수 있다. L i ndahl 등은 UDP-[5 - 3H] - GlcUA, UDP-[14CJ -G lcUA 및 방사능 표시 가 안된 GlcNAc 를 masto c y tom a 에 서 얻 어 진 mi cro some 효소와 반응시 키 고 생 성 물을 분리 분석하여 각 성분에 따른 방사능의 분포를 조사하였다 (4.15). IdUA 는 도입된 전체 [14 C]-uronic a ci d 의 약 반을 차지하나, 이 는 3H 은 포함하지 않는다. 그러나 GlcUA 의 2 번이나 3 번 위치에 3H 을 표시할 때는 떤가 IdUA 에서 겁출된다. 이와는 대조적으로, GlcUA 에서는 14C 과 떤 모두가 검출되었다. 이 결과는 GlcUA 의 ep im eri za ti on 은 GlcUA 의 C-5 위 치 에 있는 수소가 제 거 되 면 서 진 행됨을 의미한다. GlcUA 의 C- 5 에서 용매로 방출되는 3H(H20 에 존재)는중류에 의 해 정 량적으로 회수된다. 이 회수된 3H • HO 의 양은 e pi merase 의 활성 및 이 효소의 기질 선택성을 연구하는 데 활용된다. 그림 4.4 에 .
있는 HP 합성 의 중간체 1~4 을 mi cro some 효소 조제 와 반응시 켜 , e pi merase 에 대한 기질의 목아성을 조사하였다 (4.16). 3 번 중간체 (N-sul fat e 되었으나 0-sul fat e 는 안됨)에서는 60% 까지의 3H 가 방 출 퇴 나, 1 밋 2 번 중간체 (N-acety la te d 혹은 N-deacety la te d 되 었으나 sul fati on 은 안됨)에서는 ep im eri za ti on 이 완전히 일어 나 지 않는다. 이 는 C-5 ep im erase 의 작용에 는 기 질 이 N-sulfa te 화 되어 있어야 한다는 것을 의미한다. 3 번 중간체와 mi cro some 효소와의 배양에서는 IdUA 함량이 전체 uronic a ci d 의 19~26% 로 증가된다. 그러나 PAPS 촌재 하에서는 ldUA 의 함량 (3HH0 의 방 충량 )이 더욱 중대된다. GlcUA 의 ep im erase 는 쥐 의 masto c y tom a 를 원 심 분리 한 상층 액 에 서 상당한 활성 을 보였 으며 , concanavali n A-sep h arose 와 HPS-seph arose 상의 affi ni t y chromato g r ap h y 에 서 약 8000 배 까 지 정제되었다 (4.16). 그러나 이 효소에 대한 분자생물학적 성질은 잘 규명되지 않았다. 0-sulfa tion : HP 사슬의 생 합성 은 gl ucosami n e 의 C-6 및 ldUA 의 C-2 위 치 에 0-sulfa tion 을 필요로 한다. 이 반응에 서 촉매 역 할 을 하는 0-sul fot rans f erase( 두 종류일 가능성이 있다)와 아민기를 sulfa tion 시 키 는 N-sulfo tra nsfe r ase 는 neop l asti c mast 세 포의 mi cro somal pe llet 에 서 확인되 었으며 , 이 들 효소의 몇 가지 특성 이 측정되었다 (4.17). 다음 표 4.3 은 이들의 결과를 요약한 것이다. 이 표에 서 N-sulfo tra nsfe r ase 와 0-sulfo tra nsfe r ase 는 다른 효
표 4. 3 Hep a rin 의 Sulfo tra nsfe r ase 효소들의 복성 0-sulfo tra nsfe r ase N-sulfo tra nsfe r ase 최적 PH 7.5 ·7. 5 PAPS 에 대한 Km lxl0-4M 2xl0-5M Mn+ +의 효과 활성 중가 (4~5 배) 활성 중가 (4~5 배) Ca+ +의 효과 영향 없음 활 성 중가 KCI050mM) 활 성 억제 활 성 억제 NaCI (O. 125M) 영향 없음 활성 80% 감소 열 (50°C, 1 분) 활성 60% 감소 활성 15% 감소
소 분자라는 것 이 자명 하다. 0-sulfo tra nsfe r ase 도 두 종유일 가 능성이 있으나, 이들에 대한 구별은 되지 않았다· Glucosami ne 의 C-6 위 치 의 0-sulfa tion 은 HP 외 에 도 KS 에 서 도 관찰된다. (Ch6-S 의 hexosam i ne 은 glu cosami ne 이 아닌 ga l-
acto s ami ne 이 다. ) 따라서 동일한 효소가 HP 와 KS 에 모두 작용 할 가능성을 배제시킬 수 없다. 그러나, KS 과 HP 의 연결의 배향, g lucosam i ne 의 아민기의 치환상태의 차이 밋 이웃 당류의 차아폴 고려한다면, 각각 다른 효소가 KS 와 HP 의 0- sul fati on 에 관여할 가능성이 더욱 크다고 여겨진다. 4. 6 Hep a ran sulfa te HPS 는 구조적으로 HP 과 밀접한 관계가 있다. 이 다당류는 HP 의 생합성 과정에서 다당류 사슬의 변형이 HP 에 비해 적게 일어난 것으로 간주될 수 있다· 이는 GlcNAc 에서 N-deacety lt i on 된 정도 가 낮고, 따라서 다음 단계 의 N-sulfa tion , GlcUA 의 ep im eriz a - tion 에 의 한 IdUA 의 생 성 텃 0-sulfa tion 의 정 도가 낮은 것으로 해석된다. HPS 와 HP 이 동일한 다당류 전도체에서 어떻게 각각 다른 분자 로의 전환이 결정되는가에 대한 명확한 해석은 없다. 단지 HP~ 합성 후세포내에 남아 있으나, HPS 는 세포 표면으로아동하는 것 으로 보아, 이들은 다당류 사슬의 변환효소의 상대적 비가 다른 다 가효소계에 의해 합성되거나, 아니면 효소들의 상대적 활성이 다~ 세포내의 다본 위치에서 각각 합성된다고 볼 수 있다· 또한 HP이 mast 세 포의 미 립 체 (gran ule) 에 처 장되 어 존재 하는 것으로 보아, 소 량의 변형효소가 장기간 이 다당류에 작용하여 큰 고분자 변형을 초래할 가능성도 있다. 4. 7 Kerata n sulfa te 의 생 합성 KS 의 반복되 는 이 당류 단위 체 는 C-6 에 sulfa te 화된 GlcNAc 와·Gal 로 구성되어 있다. KS 의 탄수화물-단백질 연결은 각막 KS (KS-I) 에 서 는 GlcNAc 와 Asn, 그리 고 골격 KS 에 서 는 GlcNAc 와 Thr 또는 Ser 사이에서 이루어진다. 뚜6 \cNAc 므 Gal ~二~~ - GGG』 l c:NNNA:c;广_ !_.A방sn (합KS IS )e r) KS 의 생합성에 관한 정보는 극히 미미하며 단편적이다. 그러나 KS-I 과 N-gl y c osid i c 연 결 로 구성 된 gly c op ro te i n 간의 구조적 유 사성에서, 이들은 유사한 경로로 생합성이 되리라 믿어지고 있다. 죽, doli ch ol p hos pha t e( 그립 4. 2) 와 UDP-GlcNAc 의 반응에 서 생 성 된 Dol-P-P-GlcNAc 및 이와 유사한 Dol-P-P- 당류가 중심단백질 의 Asn 에 당류를 전이시키는 것으로 판단된다. UDP-GlcNAc+Dol-P->GlcNAc-P-P-Dol+UMP (1) GlcNAc-P-P-Dol+NH2-?C- CH2 기 단백 질 1- GlcNAc 一 NH ― ?C- CH2 기 단백질 |+Dol-P-P (2) 이 메카니즘을 지지하는 실험적 결과로는, (1) 의 반응을 억제시키 는 tun ic a my cin 이 cornea 의 배 양에 서 KS -I 의 합성 속도를 크게 처하시키는 것을 들 수 있다 (4.3). 그러나, tuni cam yci n 은 단백질 의 합성 속도를 저하시키고, 다른 GAG 의 합성도 이 물질의 존재 하에 서 상당히 감소하므로 tunica my cin 이 GlcNAc 와 Dol-P-P 반 옹만 선택적으로 억제한다고 볼 수는 없다· KS 의 GlcNAc 에 의 Gal 의 전 이 는, 많은 gly c o p ro te i n 에 서 N- .ac ety Il acto sami ne 단위 의 형 성 에 관여 하는 lacto s e syn the ta s e 에 의해 촉진된다고 믿어지고 있으나, 이 효소작용에 대한 충분한 실 험 적 결과는 없다. 이 와 동시 에 KS-II 의 탄수화물-단백 질 부분의 생합성, 그리고 GlcNAc 의 0-su lf a ti on 등에 대해서도 거의 연구되
지 않은 실정이다. 4.8 세포의 성장과 다당류 조성의 변화 Mucop ol ys a ccharid e 의 생 합성 과 관련 하여 언 급되 어 야 할 내 용 은 세포의 성장에 따르는 GAG, 특히 세포표면의 GAG, 조성의 변 화이다. 이는 최근에 Kramer 에 의해 잘 정리되어 있으므로 (R5), 여 기서는 이들 내용의 요약에 의한 소개에 국한한다. 세포의 성장과 GAG 의 조성의 변화와의 상관 관계는 조직 내의 GAG 의 상당량이 세포 표면에 결합되어 있다는 것이 밝혀지면서 큰 관심을 끌었다. (어떤 경우에는 세포를 약하게 tryp s i n 처리하 여도 sul fat e 화된 GAG 의 63~84% 가 제거된다 (4.18)) . 이에 대한 최 초의 연구는 1964 년에 Hamerman 등이 3T3 세포와 이를 po lyo ma vir u s 로 변 태 시 킨 세 포 (PY 3T3) , 그리 고 Sim i an vir u s-40 으로 변 태 시 킨 세 포 (SV3T3) 에 서 hy a luronid a se 에 의 해 분해 되 는 HA 의 양의 변화를 보고한 것에서 찾을 수 있다. 변태된 PY3T3 및 SV3T3 세포는 변태되지 않은 3T3 세포에 비해 훨 싼 적은 양(경우에 따라 서는 1/20) 의 HA 를 포함하고 있음이 보고되었다. 아러한 HA 양의 감소는 SV40 으로 변태된 사람의 fi broblas t에서도 관찰되었다· 그 러나 이 연구에서도 정상세포는 밀집된 비성장 단계에서, 변태된 세포는 밀집된 융합성 배양에서 진행되었으므로 엄밀한 비교는 가 능하지 않다. 급격한 성장 단계에 있는 3T3 세포와, 이에서 변태된 SV3T3 세 포의 GAG 조성의 차이도 많은 연구자들에 의해 보고되었다. 이들 의 결과는 비록 정량적인 면에서는 서로 차이가 있으나, 정성적으 로는 거의 일치한다. 즉 정상 3T3 세포는 변태된 세포에 비해 훨싼 많은 양의 CS 와 DS(chondroit ina se ABC 에 의해 분해)를 함유한다. 또. 한 chondroit ina se ABC 에 의 해 분해 되 지 않는 KS 와 HPS 는 정 상 3T3 세포에서 많음이 밝혀졌다. 그러나 HA 는 오히려 SV3T3 과 같은 변태된 세포에서 많이 존재함이 발견되었다. Mak it a 와 S i mo j o(4.19) 는 아프리카산 녹색원숭이의 신장(Af r ic an
Green i\fon key Ki dn ey: AGMK) 세 포 륭 SV-40 으로 변 태 시 킨 세 포에 서 정상세포에 비해 약간의 KS 및 HPS 의 중가, CS 의 감소 그리고 HA 가 중대 함을 관찰했 다. 이 는 3T3 에 비 해 SV3T3 에 서 sulfa te 화된 GAG 가 감소하고 HA 가 중대한다는 일반적 결과와 약간의 차이 가 있 다. 또한 다른 세 포, 예 로 chic k embryo fibr oblast 을 SV-40 으로 변태시킨 경우에는 HA 의 합성이 크게 증가한다는 것이 여러 연구자둡에 의하 여 보고되었다. 이와 같은 연구자들 간의 세 포변태와 GAG 함량 간의 상관관계의 차이는 아마도 이들이 사용한 세포의 종류, 성장단계 및 실험 조건 등의 차이에서 기인된 것으로 해석된다· 표 4.4 는 3T3 세포의 성장 단계 및 SV-40 에 의한 변태 에 따른 GAG 조성의 변화를 보여 준다.
표 4. 4 3T3 와 SV3T3 의 GAG 조성 . GAG 는 [3H 〕와 〔 sss] 로 표시 된 glu - cosam i ne 을 도입시킨 후 세포 표면의 try p s in 처리로 GAG 를 재거하 여 NaCl 농도에 따라 용출시켰다 (S. Vannucc hi등, Bi oc hem. ]. 170, 185 (1978) ) . Peak area % nonsulfa ted GAG sulfa ted GAG 3T3( 정지 상태) 24. 4 士 2. 3 74.3 土 3.1 3T3( 성장 단계) 44. 5 士 4.1 54. 0 士 4. 2 SV3T3 47.7 士 7.0 51. 0 士 3. 8
이 표에서 우리는 SV3T3 에서의 GAG 조성은 정지 상태의 3T3 의 • 조성과는 큰 차이가 있으나, 성장 단계에 있는 세포의 조성은 거의 동일함을 볼 수 있다. 따라서, 정상 세포와 변태된 세포의 GAG 조 성을 비교할 때는 이들의 성장 단계를 명확히 하는 것이 중요하다. 낮은 세포 밀도의 급성장 단계인
와 sulfa te 화된 GAG 의 합성 의 감소는 이들 세포가 비성장 단계 에 있 을 때만 성립 될 가능성이 크다. 성장 에 따 른 GAG 조성의 변화는 생 물체 의 나이와 GAG 의 조 성 간 의 관계에서도 관 찰 된다. 이는 표 4.5 의 신생 (neona t e) 쥐와 성 장 된 쥐의 여러 조직에서 sul fat e 된 GAG 의 조성을 비교함으로써 볼 수 있다.
표 4. 5 신 생 (ne o nate ) 및 성 장된 (adult) 쥐 의 여 러 조직 에 서 의 Glyc os- ami no g l yc ans 조 성 의 비 교 (4. 21) T i函 ue Tmdahoryu ,tcia dt oI p eisss o s uyl lu( µef핵 a ) g t C / O C gO · sCuhlofan dterS o Auitl Cfina ted mCsuahlcofoan ptd eor lo yBits ianc c haHriedp e as r a(n% s) ulf at e Ne on a te Ad ul t Neon ate Adult Neonate Adult Neonate Adult Br ain 560 565 78 93 <2 <2 22 7 Ileu m 300 1150 12 <2 22 75 67 25 Sp le e n 420 400 43 7 29 65 28 28 Lung 630 1160 35 <2 34 30 31 70 He ar t 270 340 53 16 29 42 28 42 Ki dn ey 520 400 23 <2 27 10 51 90 Liv e r 320 225 41 <2 36 48 23 52
이 표는 신생쥐의 대부분의 조직에서는 CS, RPS 및 DS 를 거의 같 은 양으로 포함하고 있으나, 성장된 쥐에서는 CS 의 양이 크게 감 소하거나 거의 존재하지 않음을 보이고 있다· 또한 DS 와 HPS 의 상대적 양도 변함을 보여준다. 이와같은 성장에 따르는 GAG 조성 의 변화는 암조직 (신생 조직에 대응)과 주위의 정상조직 (성장된 조칙) 의 GAG 변화에서도 유사하게 관찰된다. 죽 암조직에서는 빠른 성 장단계의 신생조직에서와 마찬가지로 CS( 득 히 Ch4-S) 의 양이 크게 중대하며, DS 와 HPS 는 조직에 따라서 상대적 비가 변한다. 따라 서, 대부분의 암조직은 주위의 정상조직에 비해 월등히 많은 sulf at e 화된 GAG 를 함유하고 있으며, 이들의 대부분은 중가된 CS 양에 기인된다. 빠른 성장단계에 있는 신생 조직이나 암조칙의 CS 의 중가는, 이 다당류가 세포분열에 큰 역할을 하고 있는 것으로 해석될 수 있다.
이에 대한 메카니즘은 아직 알려져 있지 있으며, 세포의 활성에 미 치는 GAG 의 역할은 앞으로 규명되어야 할 중요한 과제 중의 하나 로 여겨진다. * 추천문현 RI . L. Roden, Bio s y n th e sis of ac idic gly c osam ino g ly c ans, in: Meta b oli c Co11j ug a ti o11 aud Meta b oli c H y d rolys is , edit ed by W. H. Fis h man, Vol. 2. Academi c Press, New York, 1970. p. 345. (19 70 년도까지 의 연구 결 과에 대 한 완벽 한 Revie w ) R2. H. Schachte r and L. Roden, The bio s yn the sis of anim al gly c op ro - tei n s . Vol. 3 of Rl serie s , 1973. p. 1. (MPS 보다는 gly c o p r ote in 전 반에 관해 취 급) R3. L. Roden and N. B. Schwartz , Bio s yn the sis of connecti ve tiss ue pro te o g ly c ans, in: Bi oc hemi st r y of Carbohy d rate s , MTP Inte r na- tiou al Revie w of Scie n ce, Bio c hemi st r y serie s one, ed ited by W. J. Whelan, Vol. 3, Butt er Worth s , London, 1975, p. 95. R4. u. Lin d ahl, M. Hook, G. B 죠 cks t rom, I. Jac obsson, J. Riese n_ fiel d, A. Malmstr o m, L. Roden and D. S. Fein g o ld, Str u ctu re and bio s yn the sis of hep a rin - lik e po lys accharid e s, Fed. Proc. Am . Soc. Exp. Bi ol . 36, 19 (1977) R5. P. M. Kramer, Mucop o lys accharid e s: Cell bio l og y and Mali gna ncy, in: Stt rf a c es of Normal and Mali gn ant Cells, edit ed by R. 0. Hy ne s, W iley Inte r scie n ce, New York, 1979, p.1 49. (성장에 따른 GAG 의 변화에 대한 내용을 취급) * 인용문현 4. 1. N. B. Schwart z, L. Gall iga n i, P. L. Ho and A. Dorf ma n, Sti m- ulati on of syn the sis of free chondroit in sulf at e cha in by P-D - Xy lo sid e s in cultu red cells, Proc. Natl . Acad. Sc i. U. S. A. 71, 4047 (1974) 4. 2. J. E. Sil be rt, Str u ctu re and meta b oli sm of pro te o g ly c ans and gly c o sam ino g ly c ans. J. Invest . Derma., 79, 315(1982) 밋 R2 참조. 4. 3. G. W. Ha rt and W. J. Lennarz, Ef fec ts of tu nic a my cin on th e bio s yn the sis of gly c osam ino g ly c ans by embryo n ic ch ick cornea, J.
Bio l . chem. 253, 5795(1 9 78) 4. 4. N. B. Schwartz and A. Dorfm an, Purifi ca ti on of rat live r chondr-osarcoma xy lo syl t r a nsfe r ase, Arch. Bi oc hem. Bi op hy s ., 171, 136(1975) 밋 이의 참고문헌. 4. 5. E. F. Newf ield and C. W. Hall, Inh ibi t ion of UDP-D-gl u cose dehy - drog e nase by UDP-D-xy lo se: A po ssib l e reg ula to r y mechanis m , Bi oc hem. Bio p h y s . Res. Commun., 19, 456(1965) 4. 6. N. B. Schwartz , Bio s yn the sis of chondroit in sulfa te: Role of ph osph oli pids in the acti vit y of UDP-D-ga lacto s e: D-xy lo se ga lacto s y l tra nsfe r ase, J. Bi ol . Chem., 251, 285(1976) 4. 7. S. DeLuca, M. E. Ric h mond and J. E. Sil be rt , Bio s :1-1 :h esis of chondroit in sulf ate . Sulf at i on of the poly s accharid e chain , Bi oc he- mi st r y , 12, 3911 (1973) 4. 8. L. Glaser and D. H. Brown, The enzym a ti c syn th e sis in vit ro of hy a luronic aci d chain s , Proc. Natl . Acad. Sc i., U. S. A. 41, 253 (1955) 4. 9. A. C. Sto o lm ille r and A. Dor fma n, The bio s yn th e sis of hy a luronic aci d by Str e p toc occus, J. Bio l. Chem., 244, 236(1 9 69) 4. 10. S. J. Turco and E. C. Heath , Glucuronosyl - N-acety glu cosam iny l pyrop h osph ory d oli ch ol: Formati on in SV40-tr a nsfo r med human lung fibr oblasts and bio s yn the sis in rat lung micr osomal pr ep a rati on s, J. Bi ol . Chem., 252, 2918(1977) 4.11 . A. Malmstr o m and L.-A. Fransson, Stu d ies on the bio s yn the sis of dermata n sulfa te, FEES Lett ., 16, 105(1971) 4. 12. T. Heltin g and U. Lin d ahl, Bio s yn the si s of hep a ri n. I. Trans fer of N-acety lg l u cosami ne and glu curon ic acid to low-molecular wei- gh t hep a rin frag m ents , Acta Chem., 26, 3515(1972) 4. 13. A. Haug and B. Larsen, Bio s yn th e si s of algi na te . Pa rt II . po lym a nnuron ic aci d C-5 epi m erase from Azoto b acte r vine lanid i (Lip m an), Carbohyd r. Res., 17, 297(1971) 4. 14. M. Hook, U. Lin d ahl, G. Backstr o m, A. Malmstr o m and L. A. Fransson, Bio s yn the sis of hepa rin . ID , Formati on of idu ron ic aci d resid u es, J. Bi ol . Chem., 249, 3908(1974) 4.15. U. Lin d ahl, I. Jac obsson, M. Hook, G. B 걸 cks tr om and D. S. Fein g o ld, Bio s yn the sis of hepa rin . ,i[ . Loss of C-5 hyd rog e n duri ng conversio n of D-g lu curonic aci d to L-id u ron ic acid resid u es, Bi oc him . Bi oP hy s. Res. Commun. 70, 492(1976)
4. 16. A. Malmstr i :im , L. Roden, D. Fein g o ld, I. Jac obsson, G. Bae-kstr i: im , M. Hi: ii:ik and U. Lin d ahl, Bio s yn th e sis of hep a rin , Parti al pu ri fica ti on of the uronosy l C-5 ep im erase, ]. Bi ol . Clze m . , 255, 3878(1980) 4. 17. T. Heit ing , Bio s yn th e sis of hep a rin : Solubil iza ti on , pa rti al sep a rati on , and pu rifi ca ti on of urid i n e dip b osph ate - g a lacto s e: Accep tor ga lacto s yl t r a nsfe r ase from mouse masto c y to m a, ]. Bi ol . Chem., 246, 815(1 9 71) 4. 18. R. Robli n, S. 0. Albert, N. A. Gelb and P. H. Black, Cell surfa c e chang e s correlate d wi th densit y-d ep e ndent gro wt h inl tlb i t ion , gly c osam ino g ly c a n meta b oli sm in 3T3, SV3T3, and conconavali n A selecte d reverta n t cells, Bio c hemi st r y , 14, 347(1975) 4.19. A. Mak ita and H. Sh im ojo , Polys acchari de s of SV-40 tra nsfo r med gr een monkey kid n ey cells, Bi oc lzim . Bi op / zys . Ac ta , 304, 571 (1973) 4. 20. J. J. Hop w ood and A. Dor fm an, Glyc osam ino g ly c an sy n th e sis by cultu r ed human skin fibr obasts aft er tra nsfo r mati on wi th sim i an vir u s 40, ]. Bio l . Chem., 252, 477(1 9 77) 4. 21 . L. 0. Samp a io , C. P. Diet r i c h and 0. G. Fil ho , Chang e s in sulf - ate d mucop o ly s accharid e comp o sit ion of mammali an tiss ues durin g gr ow t h and in cancer tiss ues, Bi oc llim . Bi op h ys . Acta . , 498, 123(1977)
제 5 장 Muco p ol y saccha ri des 의 분해 와 유전 질환 Muco p ol y sacchar i de 는 p ro t eo g l y ca 로로 세 포 내 에 서 생 합성 되 어 세포의 매체로 방출된다. MPS 의 생체 내 분해는 대체로 아들의 생 합성과 반대방향의 일련의 반응들에 의하여 진행된다. 어란 토끼나 쥐의 피부의 HA 의 반감기는 2~5 일이며, 피부의 CS 는 7~14 일, 그 리 고 DS 는 7~10 일 이 다· 그러 나 MPS 들의 반감기는 동물의 나이 나 조직에 따라 다르며, 쥐의 cos t al 연골의 CS 는 17 일이나 된다. MPS 의 다당류 사술인 GAG 는 여러 외효소 (exoenzy mes) 에 의하여 비환원성 말단에서부터 g l y cos y l 기는 물론 치환된 sul fat e 기가 제거 된 다. 이 와 더 불어 hy aluron i dase 와 같은 각종 목이 성 을 갖는 내 효 소 (endoenzy m es) 가 관여 한다. 예 로 h y aluron i dase 는 HA 빚 CS 사 술의 N-acety lh exosami ni d i c 연결 을 분해 시 킨 다. MPS 의 생 체 내 분해 에 대 한 관심 과 이 에 대 한 연구는〈 muco p ol y. saccha ri dose 〉로 총칭 되 는 유전 적 요인 에 의 한 MPS 대 사의 이 상이 사람에게서 발견되면서부터 시작되었다고 볼 수 있다. 이 질환은 부 분적으로는 20 세기 초반에 임상적으로 확인되었다. 그러나 보다 명 확한 원인은 MPS 의 구조가 밝혀진 최근에야 규명되고 있다. MPS 의 생체내 분해 과정은 바교적 찰 규명되었으며, 이 과정들에 관여 하는 효소들도 밝혀졌다. 그러나 이들 효소가 어떻게 총괄적으로 MPS 의 대사에 작용하는가에 대해서는 아직도 잘 알려져 있지 않다.
5.I 효소 Pro t eo g l y can 을 분해 시 키 는 효소는 크게 4 가지 유형 으로 구분될 수 있으며, 이들은 다음과 같다. 1. 내당분해효소 (endo g l y cos i dase) : 탄수화물 사술 중 특이한 연결 을 분해시킨다. 2. 의 당분해효소 (exo g l y cos i dase) : 탄수화물 사술 중 비환원성 말 단의 연결을 분해시킨다. 3. 황산기 분해 효소 (sul fat ase) : 비 환원성 말단에 있는 당류의 황산 기를 제거시킨다.
표 5.1 Muco p ol y sacchar i de 의 분해 에 관여 하는 효소계 효 소 분해되는 다당류 Endog ly c o sid a ses Hy al uron ida se HA, Ch4-S, Ch6-S, Hepa rin a se HP, HPS Exog ly c o sid a ses g-Gl ucuron ida se HA, Ch4-S, Ch6-S, HP, RPS a-Iduron ida se .D S, HP, HPS /3- Galacto s id a se KS, 탄수화물―단백질 연결부분 a-N-acety lg l u cosami ni d a se HP, HPS /3- N-acety lh exosami nd ase HA, Ch4-S, Ch6-S, KS, DS p-xy lo sid a se* 탄수화물―단백질 연결부분 Sulfa tas es Ar yls ulf ata s e B Ch4-S, DS Iduronate Sulfa tas e DS, HP, RPS Hepa rin Sulfa m i da se HP, HPS (N-desulfa tion ) GalNAc 6-S sulfa tas e Ch6-S, KS Gic N AC 6-S sulfa tas e HP, HPS 기타 Acety lt r a nsfe r ase HP, HPS Prote a se PG 의 중심 단백질 *포유동물에서는 존재가 확인 안 됨.
4. ace ty l 전 이 효소 (ace ty l t rans f erase) : desullfa te 된 HP 럿 HPS 의 아민기에 CH 3 CO 기 룹 전이시켜 , 다 른 효소에 의해 아둔 다 당류가 분해될 수 있도록 한다 • 이외에 도 PG 의 완전한 분해에 는 중심단백질 률 분해시키 는p ro t ease 가 필요하다 . MPS 의 분해에 관련되는 효소와 이들에 의해 분해되는 다당류를 표 5.1 에 수록하였다. 개개의 효소들의 목성은 다음에서 기술한다- 5. 1. I 내당분해효소 (Endo g l y cos i dases) 가장 잘 알려 진 내 당분해 효소는 고환 (tes ti cu lar) h y aluron i dase 이 다. 이 효소는 HA 를 4 당류(주성분)또는 이보다 큰 여러 크기의 짝 수의 단당류로 구성 된 ol ig osacchar i de 로 분해 시 킨 다. Hy a luronid a se- 는 많은 조직 에 존재 하는 endo- fi- acety lhexosam i n i dase 의 일 종이 며 , HA 는 물론 chondroit in, Ch4 -S 및 Ch6-S 도 이 효소의 기 질 로 작용된 다. 그러 나 CS 의 분해 는 HA 나 chondro iti n 에 비 해 느리 다. 고환 h y aluron i dase 의 활성 의 최 적 p H 는 5 인 것 으로 보고되 었 다. (S) _ fJI , 4 -➔ GlcUA 一> GGalIcNNAAcc_ --t- +GlcUA ― (HA, Chondroit in, CS) Hy a luronid a se H y aluron i dase 는 작은 oli go saccharid e 보다는 큰 분자에 우선 적 으 壘 로 작용한다. 따라서 HA 나 CS 는 이 효소에 의해 단지 바교적 큰 oli go saccharid e 까지 만 분해 되 며 o lig osacchar i de 는 여 러 외 효소 (exoenz y me) 에 의해 단당류까지 분해되는 것으로 추정된다. H y aluron i dase 는 동물의 여 러 조직 에 널 리 분포되 어 있 다 (5. 1) . HA 를 주로 생 합성 하는 세 포인 skin fi broblas t의 배 양에 서 는, 사람 의 경 우에 는 h y aluron i dase 가 존재 하지 않으나 chic k emb ry o 에 서 는 이 효소가 촌재함이 발견되었다. 피부 hy aluron i dase 와 고환 h y aluron i dase 의 큰 차이는 전자가 4 당류를 주로 생성하는데 반해 후자는 6 당류 또는 그보다 큰 크기 의 o lig osacchar i de 를 생 성 한다 는 데 있 다. H y aluron i dase 는 몰몬 다른 내 당분해 효소도 피 부 PG 의 주성분인 DS 나 HPS 는 분해시키지 않음이 확인되었다.
H y aluron i dase 는 정 상적 인 MPS 의 대 사, 특히 HA 와 CS 의 대 사 에 크게 관여 하고 있 다. 이 는 f3-glu curonid a se (5. 1. 2 참 조) 가 결 핍 된 환자의 소변에서 DS 와 HPS 는 검 출 되나 HA 나 CS 는 검출되지 않 는 것에서 짐작된다. 또한 Ch 4- S 와 DS 의 비환원성 말단의 GlcNAc 4-sul fat e 에 서 황 산기 를 제 거 시 키 는 sulfa tas e (5. 1. 3 참조) 가 결 핍 된 Marote u x-Lamy 환자에 서 도 단지 DS 만이 생 체 내 에 서 축적 된 다는 것 도 h y aluron i dase 의 생 체 내 역 할를 반영 한다. MPS 의 또 다른 내 당분해 효소는 he p ar i nase 이 다. 이 효소가 간에 존재한다는 것은 이미 40 여년 전에 보고되었다 (5.2). 그러나, 극히 최근에야 이 효소에 대한 추가적인 정보가 얻어졌다. Hurler 병 환 자의 간에서 분리된 HPS 의 구조 연구에서 HP 와 유사한 다당류를 생 체 내에서 부분적으로 분해시키는 효소가 존재한다는 것이 다시 확 인되었으며, 이 효소는 내장점막과 쥐의 mas t ocyt orna 에서도 확인 되었다· 오랫동안 이들 효소는 HP 나 HPS 몰 분해시키기 보다는 이 들 다당류의 생합성 과정에 관여하리라는 추측이 강했다. 그러나 Arbo g as t등은 최근에 쥐간에서 얻은 he p ar i nase 가 HP 를 분자량이 약 4000 인 조각으로 분해시키며, 효소활성의 최적 p H 가 4.4 라는 것 을 보고하였다 (5.3). HPS 를 분해시키는 내효소도 오랫동안 간헐적으로 보고되었다. Was t eson 등 (5.4) 은 p la t ele t의 효소가 HPS 를 6 당류까지 분해시키 며 , 아 효소를 endoth eli al 및 glial 세 포 표면의 다당류에 작용시 키면 대부분의 HPS 가 분해됨을 발견하였다. 그러나 CS 와 DS 는 이 효소에 의해 영향을 받지 않으며, HP 는 단지 약간 분해될 뿐이다. 주] 간의 lys osome 부분의 HPS 을 분해 시 키 는 내 효소는 HP 를 거 의 분해시키지 않음도 보고되었다. 이와는 대조적으로, 쥐 지라 (s p leen) 의 lys osome 부분은 HP 와 HPS 모두에 작용하여 단당류나 이 당류 까지 분해시킨다. HPS 을 분해시키는 내효소의 기질 특이성은 주로 Klein 등에 의 해 연구되었다 (5.5). 이들은 HPS 는 hexosam i n i d i c 은 물론 glu cur- onid i c 연결도 내당분해효소에 의해 분해된다는 것을보였으며, HPS 에 만 선 택 성 을 갖는 endo g lucuron i dase 를 부분적 이 나마 정 제 하였 다.
5. 1. 2 외 당분해 효소 (Exog ly c osid a ses) HA 나 CS 의 h y aluron i dase 에 의 한 분해 산물은 비 환원 성 말 단에 /' 3로 연결 된 GlcUA 를 갖는 ol ig osacchar i de 이 다. 이 는 {3-gl ucuron- i dase 에 의해 GlcUA 가 제거되고 나머지 부분의 비환원성 말단에 N-ace ty lhexosam i ne 을 갖는 o lig osacchar i de 로 전 환된 다. 아 oli g- • osacchar i de 에 는 다시 N-acety lh exosami ni d a se, xy lo sid a se, ga l-acto s id a se 등이 작용하여 다당류는 완전히 분해된다· 또한 DS,HP 및 HPS 의 비환원성 말단에 있는 a 로 연결된 IdUA 는 a-id u ronid a se 에 의 해 분해 된 다· 그러 나 DS, HP 및 HPS 에 포함된 GlcUA 는 /3-g lucuron i dase 에 의해 분해됨은 물론이다. 지금까지 언급된 당 분해효소들은 모두가 외효소 (exoenz y me) 라는 것이 알려져 있다. P-Glucuronid a se : /3-g lucuron i dase 의 기 질은 비 환원성 말단에 p로 연결된 GlcUA 를 갖는 o lig osaccha ri de 와 다당류가 될 수 있다. 그 러 나, 이 들 중에 서 4 당류 이 상의 크기 를 갖는 당류만 /3-gl ucuron- ―pi1 d a3s Gea 에l N의Ac 해( CS분 의해 이되 당며류 , )G와l c같UA은 브 '이. !당G류lc N단Ac위( H체A 의는 이 이당 류효) 소나 에G lc의U 해A 분해되지 않는다. 반면에 KS 및 탄수화물-단백질 연결부분의 이당 류체 인 GlcUA 뜨 !Gal 는 /3-g lucuron i dase 의 기 질 로 작용된 다. HP 및 HPS 의 이 당류인 GlcUA 브쇼 GlcNAc 가 이 효소의 기 질로 작용 하는가는 아칙 알려지지 않았다. /3 -Glucuron i dase 는 생 쥐 의 간, pr ep u t ial 선 및 사람의 태 반 (5. 6) 등에서 분리 정제되었다. 이 효소는 조직이나 분리 방법에 따라 약 간의 차이는 있으나, 분자량은 280,000~300,000 범위에 있으며,분 자 량이 70, 000~79, 000 인 3 개 (쥐 의 간) 혹은 4 개 (생 쥐 의 간, pre pu ti al) 의 subun it로 구성 되 아 있 다. p-N -acety lh exosarnin i d a se : HA, CS, DS 및 KS 의 /3- D-N-acety l- bexosami n id i c 연결 에 작용하는 외 당분해 효소가 포유등물의 조직 에 존재한다는 것은 오래전부터 알려져 왔다· 초기의 조잡한 효소제재 에 서 의 연구는 N-acety lg l u cosami ni d i c 및 N-acety lg a lacto sami - nid i c 연결 모두를 분해시키는 것으로 나타났으며, 뒤따른 정제된 효소에 의한 연구에서도 한 효소가 두 당류를 모두 분해시키는 것
으로 나타났다. 이 효소, /3 -D-N-ace ty lhexosam i n i dase 는 두 가 지 동종효소(i soz y me) A 와 B 로 촌재하며, 이외에도 몇가지 소수 (mi no r) 형태도 관찰되었다. A 형은 a 와 /3 subun it로 구성된 데 반 하여, B 형은 a subun it만으로 되어 있다. 그러나 이들동종효소들 의 정확한 기질 목이성은 아직도 규명되지 않았다. 7 종의 GAG 중 5 종 (HA, Ch4-S, Ch6-S, DS 및 KS) 이 /3- hexosami n id i c 연결을 갖 고 있고, 따라서 f,- D-N-ace ty lhexosam i n i dase 는 이 들 모두에 게 작 용한다. 이에서 이 효소는 GAG 의 분해에서 가장 큰 역할을하리라 짐작된다· 그러나, 이 효소의 결팝에 따르는 mucop o lys accharid o se 는 아직 확인되지 았았다. a-D -N -acety lg u cosarnin i d a se : HP 과 HPS 의 g lucosam i ne 은 al, 4 로 uronic a ci d 에 연 결 되 어 있 으며 , 이 는 /3- D-N-acety lh exosami ni - dase 에 의해서는 분해되지 않는다. 그러나, 이 연결에 작용하는 a-D-N-ace ty l g lucosam i n i dase 의 존재 가 1939 년 에 달팽 이 간취 장 (hep a to p a ncreas) 에 서 확인 되 었 다· 포유동물 조직 에 서 도 a 득이 성 을 갖는 g lucosam i n i dase 가 발견되었다. 정상인의 소변에서 분리된 효 소는 분자량이 307,000 이고, 심한 전하 불균일성을 보이는 gly c o- p ro t e i n 이 라는 것 이 밝혀 졌 다 (5. 7) . a-N-D- g lucosam i n i dase 의 결 핍은 Sanfi lippo A 라는 질환으로 나타난다. a-L- idu ron ida se : DS, HP 및 HPS 의 a 로 연결 된 IdUA 는 이 것 이 비환원성 말단에 있을 때 a-L- i duron i dase 가 작용하여 제거된다. a-L- i duron i dase 의 존재 에 대 한 확증은 1970 년 대 에 야 얻 어 졌 다. Ma ta lon 등 (5. 8) 은 정 상인의 간과 skin fibl oblast 추출물을 desulf · a t e 화된 DS 에 작용시 켜 IdUA 의 방출을 보임 으로써 이 들 조직 에 a-L- i duron i dase 가 존재 함을 제 시 하는 동시 에 , Hurler 환자의 fib- roblas t에는 이 효소의 활성이 정상인에 비해 크게 낮다는 것을 보 고하였다. Hurler 병과 연관하여 조직 내의 a-L- i duron i dase 의 검출 및 정 량이 수행 되 며 , a- i duron i dase 의 기 질 로는 ph eny l -a-L-in d u-ronid e , 4-m eth y lu mbell ifer yl idu ronid e , 방사능으로 표시 된 이 당류체들이 이용된다. 정 상인의 소변에서의 a- L-i duron i dase 는 약 1000 배 (
정인자〉의 능력으로 비교시)까지 정제되었으며, 이 효소는 다시 Hu- rler 병 교정형과 비교정형으로 분리되었다. 이 들의 분자량은 각각 87,000( 교정형)과 67,000( 비교정형)으로 측정되었다· 또한 최근에는 사람의 콩팥의 수용성 단백 질 에 서 a-L- i duron i dase 가 25, 000 배 정 제(약 80% 순도)되었으며, 이 효소는 흡수력이 낮고, 바교정형이며, 분자 량은 60, 000 士 6, 500 이 다 (5. 9) . 이 효소를 d it h i o t hre it ol 로 환원 시 키 고 po lya cryl a mi de ge l 전 기 영 동을 수행 하면 분자 량이 31, 000 인 한 성분이 관찰된다. P-D -G alacto s id ase : 포유동물의 조직 에 서 는 최 적 pH , 분자 량, 기 질 의 선 택 성 등 여 러 성 질 이 서 로 다른 fi -D- g alac t os i dase 둘이 존재 한다. 이들 효소는 CS, DS, HP 및 HPS 의 탄수화물-단백질 연결 부분, Gal 뜨노 al 밋 Gal 뜨 !X y l 과 KS 의 이 당류 단위 처 l oJ Gal 뜨 GlcNAc 연결 둥에 작용한다. 최적 p H 가 산성영역인 fi-D -ga l- ac t os i dase 는 A 형과 B 형으로 구분된다. 사람의 간에서 분리 정 제된 A 형은 분자량이 72,000 이며, 이는 더 큰 분자량 (600,000~800,000} 의 B 형에서 적당한 조건하에서 생성되나, B 형과는동일한 항체 결 정 인자를 갖는다 (5.10). P-D-xy lo sid a se : 많은 GAG 들의 PG 은 중심 단백 질 과 Xy l- Ser 연 결 을 하고 있 다. 그러 나 이 연결 에 득이 성 을 갖는 fi -D-x y los i dase 는 아직 포유동물 조직에서는 발견되지 않았다. 대신에, fi-x yl o sid a se 의 활성 을 나타내 는 fi-g lucos i dase 가 돼 지 콩팥의 상등액 , 쥐 콩팥 l y sosome 의 부분 등에 서 발견되 었 다· 또한, 사람간의 homog e nate 에 서 한 효소가 fi-g lucos i dase 와 fi-x y lo sid as~ 활성 을 모두 나타 내 는 것 이 발견되 었 다. 그러 나 이 상의 연구에 서 사용된 fi-x yl o sid a se 의 기 질은 P-n it ro p hen y l-0-x y los i de 와 같은 합성 물질 이 다. 이 결 과와는 대 조적 으로, 0- fi -D-x y los y l-L-ser i ne 을 기 질로 사용할 때 는 쥐 간 및 콩팥의 lys osome 부분 모두에 서 fi -D-x y los i dase 의 활성이 관찰되지 않는다. 반면에, 식물이나 무척추 동물의 fi-xylo - s i dase 는 fi-g lucos i dase 의 활성 을 보임 과 동시 에 Xy l- Ser 연결 을 분해시킨다. 포유동물 조직 이 Xy l- Ser 연결을 분해 시 키 는 P-D - xy los i dase 을
함유하지 않는다면, 소변에서 분해되 지 않 은 X y l-Ser 이 검출될 것 이 예측된다. Tom i na g a 등 (5. 1 2) 은 사람의 소변에서 1 m g/!에 대응 하는 x y los y ls er i ne 을 결정 형 으로 분리 했다 · 그러 나 이 양이 PG 의 정 상적 인 분해 에 의 해 생 성 되 는 x y los y lse ri ne 의 양 으로 간주하기 에 충분한지의 여부를 가름하기 위해서는 보다 정확한 PG 의 전환에 관 한 자료가 필요하다. 5. I. 3 황산기분해효소 (sul fat ases) HA 을 제외한 GAG 둘 은 모두 황산기를 갖고 있 으며, 이들은 탄수 화물 사 슬 이 g l y cos i dase 에 의 해 분 해 되 기 전 에 sul fat ase 에 의 해 제거된다 . GAG 의 황산기 의 위치물 정리하면 다음과 같다. 1. Ch4 -S 및 DS : GalNAc 의 C-4 2. Ch6-S 및 KS : GalNAc 의 C-6 (Ch6-S) 또는 Gal 의 C-6 (KS) 3. KS, HP 및 HPS : GlcNAc 의 C-6. 4. HP 빚 HPS : IdUA 의 C-2. 5. HP 밋 HPS : Glucosam i ne 의 N. 이 들 각각의 황산기 에 작용하는 sul fat ase 가 포유동물의 조직 내 에 존재하는 것이 확인 되었다. 이들 sul fat ase 는 모두 외효소로, 비환 윈성 말단에 있는 단당류 단위제의 sul fat e 기에만 작용한다. N-acety lg a lacto s ami ne 4.- sulfa te sulf ata s e : Ch4 -S 및 DS 의 C-4 위 치 의 황산기 를 분해 시 키 는 이 효소는 오랫 동안 aryl s ulfa tas e B 로 볼 려 져 왔다. Ar yls ulfa tas e B 는 arys ulfa tas e A 와 마찬가지 로 p-ni t - rocate c hol sul fat e 믈 분해 시 킨 다. 그러 나 이 두 효소의 차이 는 Ba+ +과 A 합에 의 한 이 들 효소의 불활성 여 부 (aryl s ulfa tas e A 는 불 활성화된다)에 있다. Ch 4- S 와 DS 의 비환원성 말단의 GalNAc 4-S 황산기 가 aryl s ulfa tas e B 의 기 질 이 되 는 반면 에 , Gal 3-S cerami de 는 ary ls ulf ata s e A 에 의 해 분해 된 다· 또다른 ar y lsul fata se 인 ary l_ :su lfa tas e ~ 주로 세 포막에 결 합되 어 있 으며 ste r oid su lf a t e 를 분해시키는 것으로 추정되고 있다. Ar yls ulfa tas e B 가 GAG 의 분해에 관여한다는 사실은 mucop o ly-
sacchar i dose 의 일종인 Marote a ux-Lamy s y ndrome 의 연구를 통 하여 밝혀졌다 . 이 질환의 환자 소변에서는 DS 의 양은 중대 되나, Ch4-S 의 양에는 변화가 없다 . 따라서 이 돌 환자에 서 결핍된 ary l- sulfa tas e B 는 DS 에 만 작용한다고 추정 되 었 다. 그러 나, 이 효소가 비 환원 성 말 단에 GalNAc 4-S 를 갖는 DS, Ch4-S 및 이 들의 oli go - saccha ri de 에 모두 작용한다는 것 이 밝혀 졌 다 (5. 13) . Ar yls ulfa tas e B 에 의 한 Ch4-S 및 Ch4 -S o lig osaccha ri de 의 분해 는 기질 1 분자당 1 개 이상의 황산기가 방출되는 것이 관찰되었다 (5.13, 5.14). 그러나 이 결과가 이들 실험에서 사용된 효소 제재에 gly c o sid i c 연결을 분해시 키는 hexosam i n i dase 나 g lucuron i dase 가 소량 존재 하여 생 긴 결 과인지 , 아니 면 ary ls ulfa tas e B 가 정 말로 다 당류의 내부 황산기도 분해시키는 것에 기인하는 것인가에 대한 명 확한 대답은 없다. Aryl s ulfa tas e B 는 두 가지 형 태 로 존재 하며 , 주성 분 형 태 는 DE- AE-cellulose 에 흡착되 지 않으나 소량 성 분인 Bm 형 은 이 에 흡착되 며, 열에 약하다 (Ary lsul fat ase A 는 Bm 형과 유사한 성질을 보인 다) . 태 반에 서 분리 된 a ry lsul fat ase 는 iso electr i c fo cus i n g에 서 p l 가 8. 2 이 나, 뇌 에서 얻어 진 소량형 (Bm) 은 p l 가 각각 6. 8, 7-0 및 7.2 인 세 띠로 분리된다. N-acety lg a lacto s ami ne 6-sulfa te sulf ata s e : 이 효소는 Ch6-S 와 KS, 에 작용하여 황산기 를 방출시 킨다· 초기 에 는 GalNAc 6-S sulfa tas e- 의 기 질로 작용하는 Ch6-S 와 KS 의 공통접 이 C -6위 치 에 sul fat e 화된 hexosam i ne(Ch6-S 는 g alac t osa mi ne 이며 KS 에서는 g lucosa mi ne) 으로 인 식 되 었으나, Di Ferran t e 등 (5.15) 의 연구에 서 이 효소는 ga lacto se (Ch6-S 의 GalNAc6-S, KS 의 Gal 6- S) 구조에 작용한다는 것 이 확인되 었 다. 또한 glu cosami ne 6-sul fat e 와 ga lacto sami ne 6-sul fat e 에 는 각각 다른 두 종류의 hexosami ne 6-sulf ate sul fat ase 가 작용한다 는 것도 밝혀졌다. GalNAc 6-S sul fat ase 는 Ch6 -S에 고환 h y aluron i dase 를 작용 이 켜 얻 어 진 4 당류체 및 이 를 다시 /3-g lucuron i dase 로 작용시 켜 생성된 3 당류체에서 황산기를 방출한다. 그러나 고분자 상태의 cs.
나 불 포화된 이 당 류체 의 6-su l fat e 에 는 작용하지 않 는다. 4 당류체 롱 이 효소와 장 시간 반응 시키 면 2 개의 황 산 기가 모두 방 출 되고, 따라 서 GaINA c 6-S sul fat ase 는 내 부 황 산 기 에도 작용 하 는 외 효소 (cxo e n z y m e) 의 역 할 도 한다는 것 이 보고되 었 다 (5.16) . 그 러 나, Horw it z 와 Dor f man 은 위 의 결론 은 사용된 효 소 제 재 (fibr oblast 추운 물 ) 에 존재 하는 ~-g Iucuron i dase 에 의 한 4 당 류체 의 분 해 에 의 한 것 이 며 , GalNAc 6-S sul fat ase 는 비 환원 성 말단의 GalNAc 6-S 에 만 작용하는 의효소라는 것을 보였다 (5.17). (이 와 유사한 실험결 과 의 해석을 앞서 언급된 ary su lfa tas e B 에서도 할 수 있다.) 이 효소는 여러 분자적 성질을 규명 할 만큼 정제되지는 못했다· 사람의 태 반의 추 출 물에 존재 하는 GalNAc 6-S sul fat ase 는 약 20, · ooo 배 정 제 되 었 으며 , 이 의 SDS po lya cry la mi de ge l 상에 서 의 전 기 영동은 분자량이 78,OOO(GPC 에서는 100,000) 으로 추정되는 주띠와 불 순뭉로 간주되는 2 개의 소량의 띠 를 보였다 (5.20). 그러나 이 정제 된 효소는 Gal 6- S 에 는 활 성 을 보이 지 않으며 , 따라서 이 효 소가 KS 를 분해시키는지에 대해서는 의문이 있다. so 근, P04-3, SO 근, S 2 0 근 CN-빛 고농도의 Cl- 등의 음이 온은 이 효소의 작용을 억 제 시 키 며 , 2-merca pt oe t hanol 과 같은 SH 기 를 갖는 시 약의 작용에 의해서는 효소 활 성이 증대된다. 반면에, fibr oblast 추출 액에서 분 리 된 GalNAc 6-S sul fat ase 는 P0 4 -3 와 고농도의 NaCl 에 의 해 효소 작용이 억 제 되 나, GalNAc, GlcUA, 무기 so 근 , Ch 4- S 의 4 당류 체 등은 거의 영향을 미치지 않음이 보고되었다· 또한 이 효소의 최 적 p H 는 4.8 로 나타났다 (5.16). 이 sul fat ase 의 결핍은 소변에서 -C h6-S 와 KS 를 배 출 하는 Morqu io 질환을 나타낸다. N-acety lg l a cosarnin e 6-su lfa te sulfa ta se : KS, HP 및 HPS 에 존재 하 는 GlcNAc 6-S 에 서 황산기 몰 제 거 시 키 는 데 촉매 역 할 을 하는 sulfa - t ase 는 최근에 Di Ferran t e 등에 의 해 발견되 었으며 (5.15), 정 상인의 소변에서 분리되어 정제되었다 (5.18). 이 sul fata se 는 분자량이 97, 000 정도인 심한 전하 불균일성을 보이는 당단백질이다. 이 효소는 동전점 (p l) 이 5.4~8.3 범위인 여러 형태로 존재하며, 효소활성의 최적 p H 는 7.7 로 밝혀졌다. 이 효소의 기질 목이성에 관한 연구에서
는, 이 효소의 최 적 p H 가 5. 5 이 며 , GlcNAc 6-S 와 Glc 6-S 물 기 진 로 하는 전형적인 외효소라는 것도 밝혀졌다. 이 효소는 인제의 거 의 모든 조직 에 존재 하나, 콩팥과 fi broblas t에 서 효소 활성 이 득히 크다는 것이 확인되었다. 최 근에 는, HP 밋 HPS 에 만 작용하고 KS 에 는 활성 이 없는 GlcNAc 6-S sul fat ase 가 존재한다는 것이 Kresse 등 (5.19) 에 의 해 보고되 었 다. 따라서 각각 다몬 GlcNAc 6-S su lf a t ase 가 HP 와 HPS, 그리 고 KS 에 작용할 가능성 이 크다. lduronate sulfa tas e : IdUA 를 포함하는 다당류에 서 IdUA 의 C-2 위 치 에 치 환된 황산기 에 특이 성 을 갖는 id uronate sul fata se 는 Hun- te r s y ndrome 의 연구 과정에서 발견되었다 (5.21). Hunte r fibr o. blas t에 서 얻 어 진 3ss 표시 된 다 당류를 chondroit ina se ABC 로 처 리 하고, 다음에
과 심장에서의 존재는 확인되지 않았다. 배양된 피부 fibr oblast, 암 과구세포, 대식세포 (macro p ha g e) 등에서도 이 효소가 발견되었다. HP sul fa m i das 텍 기질 득이성은 아직 완전히 규명되지 않았으 나, 35S 로 표시된 N-sulfa ted HP 을 기질로 사용 할 때는 단지 5% 미만의 방사능이 방출되는 것으로 보아, 이 효소는 기질 1 분자당 1 개의 N-sul fat e 기에만 작용하는 외효소로 볼 수 있다. 이와 같은 추정은 HP 분자를 박테리아성 he p ar i nase 로 분해 시켜 얻어진 4 및 6 당류체 를 효소의 기 질 로 사용하면 oli go saccharid e 1 분자당 단 지 1 개의 황산기물 방출하는 것에서 더욱 명확해진다 (5.23). Sul fa m i dase 는 외당분해효소와 유사하게 기질의 비환원성 말단의 N-sulfa ted g lucosam i ne 에 서 황산기 를 제 거 한다고 생 각할 수 있 다. 그러 나 he p ar i nase 의 작용에 의 해 생 성 된 o lig osacchar i de 는 말단 에 불포화 uronic a ci d(UA) 를 갖고 있을 수 있으며, 이 불포화 UA 는 su lf am i dase 의 작용에 영 향을 미 치 지 않는 것 으로 볼 수 있 다. 그러나, 이 효소가 단지 비환원성 말단기의 N-sul fat e 기에만 작용 하고 6.U A-GlcN-2, 6-d i sul fat e 나 GlcN-2, 6-d i sul fat e 에 는 작용하 지 않을 가능성을 배제시킬 수는 없다. 5.l. 4 기타 효소 PG 의 완전한 분해에는, 앞서 언급된 g l y cos i dase 와 sulfa tas e 와 에도 ace ty 1 tr ans f erase 와 단백질 분해효소가 필요하다. a-Glucosami ni d e -N -Acety ltra nsfe r ase : Hep a rin sul fa m i n i dase 에 의해 N-sul fat e 기가 분해된 자유 아민기를 갖는 g lucosam i ne 은 a-N-ace ty l g lucosam i n i das 텍 기 질 로 작용되 지 않는다. HP 밋 HPS 의 체내 분해에 관한 초기의 연구에서는, 이 자유 아민기를 갖는 g lucosam i ne 을 분해 시 키 는 a- g lucosam i n i dase 의 활성 을 발견 하는 것에 많은 노력이 가해졌으나, 성공되지 못했다. 반면에, lys osome - 에 서 ace ty l-CoA 에 있는 ace ty l 기 를 g lucosam i ne 에 전 이 시 키 는 a- g lucosa min i de-N-ace ty l tr ans fe rase 가 존재 하는 것 이 확인되 었으 며 (5. 24) , 이 제 는 HP 와 HPS 는 모두 N-ace ty l 화된 후 a-N-acety l- g lucosam ini dase 에 의 해 분해 된다고 믿 어 지 고 있다. 이 효소는 댜
몬 lys o some 효소가 대부분 가수분해 효소인 것 과는 대 조적 으로 〈합 성 〉효소라는 점 이 특 이 하다. Prote a se : PG 의 생제 내의 전환은 중심 단백질의 분해에 의해서도 일 어 난다. 1956 년 에 Thomas 는 토끼 귀 에 p a p a i n 을 주입 하면 귀 연 골의 강인성이 급격히 감소하고 오중에서 많은 양의 GAG 가 배설 된다는 것을 보고 하었다 (5.25 참조) . PG 의 GAG 는 중심단백질이 분해되면, 조직 내에서 유동화되고 당 분해효소의 작용이 없이도 오중으로 배설된다. Revell 과 Muir ( 5.25) 는 35 S 로 표시 된 CS 형 PG 를 guine a pig에 혈 관 주사한 후, 오중에 서 PG 는 배 설 되 지 않으나, 방사능의 9~20% 는 24 시 간 이 내 에 cs 사슬의 형태로 배설됨을 보였다· 또한, 배설된 CS 사슬은 주입된 PG 의 CS 에 비해 거의 분해되지 않았음도 확인되었다. 이와유사하 게 CS 를 주입할 경우에도, CS 는 분해되지 않고 방사능의 20~58% 가 24 시간 이내에 오중으로 배설된다. . 이 견과는 PG 은 분자의 크기 때문에 신장의 gl omeruli 막을 통과 하여 오중으로 배 설 될 수 없고, 반드시 대 사과정 (단백 질 분해 또는 탄수화물 사슬의 분해)을 거쳐 조직에서 제거됨을 나타낸다. 5. 2 Gly cosam i no g l y can 의 분해 우리는 5.1 에서 MPS 의 생체 내 분해에 관여하는 효소들을 보았 다. 이 항에서는 이들의 효소가 MPS 에 어떻게 작용하여 이들을 분 해시키는가에 관하여 취급한다. HA 를 제외한 다른 GAG 들은 조적에서 PG 형태로 존재하며, 이 둘의 분해에는, pr ote a se, sulfa tas e 및 당분해효소가 필요하다. 일 반적으로, GAG 의 분해에는내당분해효소와의당분해효소모두가관 여하는 것으로 보인다. 그러나, 이들 효소의 상대적 기여도는 아직 알 수 없으며, 조직이나 세포에 따라 분해 양상도 변하는 것으로짐 작된다. 또한 MPS 의 분해가 l y sosome 내에서 세포 내적으로진행되 는가, 아니면 세포외 매체에서 일어나는가에 따라서도 검출되는 분· 해산물에 큰 차이가 날 것이다. GAG 는 세포 내에서는 탄수화물 사-
술이 단 당류 또는 작은 o lig osaccha ri de 까지 심 하게 분해 되 고, 단당 류 분해산물은 다시 PG 의 생합성 과정에 이용될 수 있다. Hy a luronic aci d : 이 론상 HA 는 두 가지 외 효소인 {3-gl ucuronid a se 와 {3 -N-ace ty l g lucosam i n i dase 의 반복적 인 작용만으로 단 당류 성 분으로 분해될 수 있다. 또한, 내효소인 hy aluron i dase 의 작용에 의 해 생 성 된 olig o saccharid e (주성 분은 4 당류체 ) 를 체 외 로 배 출시 킴으로써 이 다당류의 전환이 가능하다. HA의 분해에는 앞서 언급된 내효소와 외효소가 모두 작용하고 있는 것으로 보인다. 쥐의 피부에서의 HA 전환은 1 일 피부조직 lg 당 0.23m g으로 나타나며, 이 양은 고분자 상태의 HA 또는 큰 분 자 량의 HA 조각이 생 리 적 조건 하에 서 의 효소인 {3-glu curonid ase @) 와 {3 -N-ace ty l g lucosam i n i dase@) 의 반복 작용에 의 해 분해 되 는 다당류 양보다는 많다. 따라서 상당량의 HA 는 hy a luronid a se @)에 의해 분해되어 전환된다고 볼 수 있다. ® @® GlcUA/31~ , G3 lcNAc ―p1 ~, 4G lcUA 一/3귁I ,: 3i -- l-c-N-Ac• ―{31 一, 4 이 와는 대 조적 으로, 오중으로 배 설 되 는 o lig osacchar i de 에 결 합 된 GlcUA 의 양은 정 상적 인 GlcUA 를 포함하는 다당류의 대 사량보 다 적 다. 따라서 h y aluron i dase 에 의 해 생 성 된 o lig osacchar i de 의 일부는 외효소에 의해 단당류까지 분해된다고 여겨진다. Chondroit in sulf ate : 연골조직에는 많은 양의 CS 형 PG 를 포함하 고 있고, 따라서 이 조직에서의 CS 분해에 많은 관심이 주어졌다. 사람의 연골에서는 내효소인 hy a luronid as~ 활성은 거의 관찰되지 않는다. 그러 나 embryo nic chic k chondroc yt e 에 서 는 이 효소의 활 성 이 검 출되 었 다. 이 h y aluron i dase 는 〈고환〉 h y aluron i dase 의 최 적 p H 가 5 부근인 것과는 달리, p H2.8 에서 최대의 활성을보인다. 배 양된 embryo nic chic k chondroc yt e 에 서 의 hy aluron i dase 의 존 재 는 Glaser 와 Conrad(5. l) 에 의 해 서 도 제 시 되 었 다· 이 chondrocy- te 에서 CS 는 황산기가 포함된 이당류체까지 완전히 분해된다. 그 러 나 {3-gl ucuronid a se 및 {3 -N-ace ty lhexosam i n i das 텍 활성 억 제 물인 saccharo-1, 4- lac t one 과 2-aceto ami do -2- deoxy - D-ga lacto -
• nolac t one 을 첨가하면 CS 는 단지 10~15 개의 단당류체로 구성된 o lig osacchar i de 로만 분해 된 다. 이 는 CS 의 정 상적 인 대 사에 는 내 효소인 hy a luronid a se(CD), 외 효소인 /3-g lucuron i dase( @) 와 /3- N-acety lh exosami ni d a se@ ) 가 종합적 으로 작용함을 의 미 한 다. cs 형 PG 의 대사에는 이들 효소 외에도 sulfa tas e(@ : aryl s ulfa tas e B 또 는 GalNAc 6-언S sul fat ase) 와 平/3또-g는 a®la c t os i『 da se @ ){ 도 필®요 하、다 . 〔 GlcUAp~l. 귁 4 ;a@l .N....AI 이 np~I, G 4 lcUAp+I, 多3 al ―p-l-,; 3t Gal ―g1, 7 4 X y l8- Ser 4 또는 6-sulfa te H y aluron i dase( (D)의 작용에 의해 생성된 o lig osacchar i de 는 위 에서 보듯이 여러 외효소의 작용에 의해 비환원성 말단에서부터 단 계 적 으로 분해 된 다. 이 당류체 보다 큰 o lig osacchar i de 나 CS 의 비 환 원성 말단에 있는 GlcUA 가 /3-g lucuron i dase@) 의 작용으로 분해 되면 황산기 가 C-4 또는 C-6 위치에 연결된 GalNAc 가 비환원성 끝 에 존재 하게 된 다. 이 는 다시 aryl s ulfa tas e B (Ch4-S 의 경 우) 또는 GalNAc 6-S sul fat ase 에 의 해 황산기 가 제 거 된 후, /3- N-hexosami - n i dase(@) 에 의해 분해된다. 이 과정이 CS 사슬 전체의 반복되는 이당류체에서 계속되며, 탄수화물―단백질 연결부분은 연속적인 /3-ga lacto s id a se (@) 의 작용에 의 해 분해 된 다. 마지 막의 X y l-Ser 을 분해 시 키 는 /3 -x y los i dase 는 아직 포유동물에 서 는 발견되 지 않았으 며, X y l-Ser 은 오중에서 검출되었다. Ch 4- S 의 생 체 내 분해 는 aryl s ulfa tas e B 에 의 한 C-4 위 치 의 황산 기 분해과정이 전체적인 반응속도를· 결정하는 과정으로 여겨진다. 이는 이 다당류의 효소분해 생성물의 대부분이 비환원성 말단에 Gal-NAc 4-S 를 갖고 있는 것 에서 짐 작된 다· 그러 나 6-sul fat e 기 는 4- sul fat e 기 에 비 해 비 교적 빨리 분해 된 다. 따라서 Ch4-S 와 Ch 6- S 의 혼합물의 효소 분해 에 서 는 시 간에 따라 6- 홍 ul fate 와 4-su lfa t~ 비 가 감소하게 된다. Dermata n sulfa te : D84 근 약간의 GlcUA (uron ic ac i d 의 주성 분은 ldUA) 을 포함하고 있 어 hy aluron i dase 에 의 해 GlcUA 양에 해 당하는 정 도
만큼 분해될 수 있다. DS 의 반복되는 이당류체로 구성된 탄수화물 사슬이 나 hy aluron i dase 의 작용으로 생 성 된 DS 의 olig o saccharid e 는 비환원성 말단에서부터 idu ronate sulfa tas e((D ) , a-L-id u ro- nid a se(@), ary su lfa tas e B(@) 및 /3- N-acety lh exosami ni d a se(@) 의 반복되는 작용에 의해 분해된다. DS 의 탄수화물―단백질 연결부 분은 CS 형 PG 의 경우와 동일한 과정으로 분해된다. ®Id켜U A ―a®JI, - 3-@-:.:>. .G.f a l·-N-Ac -© ― pi l , ~ih 4yG a-ll urcoUn-iAd a ―psIet , . 3. :.GalNAc ―©i 一 2 sulfa te 4 sulfa te p-glu curonid a se DS 의 분해 에 작용하는 효소 중 hy aluron i dase 를 제 외 하고는 모 두 외효소이다. Hepa rin 맞 Hepa ran sulf ate : HP 및 HPS 의 내 부연결 을 분해 시 키 는 내효소, he pari nase 의 존재는 확인되었으나, 이 효소의 정확한 기 질 특이 성 은 아직 명 확히 규명 되 지 않았다. 그러 나, hep a rin ase 의 작용은 외효소들의 활성을 증대시키는 것으로 생각되고 있다. HP 과 HPS 는 다른 GAG 들과 마찬가지로, 일련의 내효소들에 의 하여 단당류까지 분해될 수 있으며, 이룰 그림 5.l 에서 보여 준다. 이 그림에서는 탄수화물-단백질 연결부분은 포함시키지 않았는데, 이 부분은 CS 나 DS 에서 와 동일하고, 따라서 CS 및 DS 에 작용하 는 효소와 동일한 효소가 이돌 연결부분에 작용하리라 생각된다. Kerata n sulf ate : KS 의 반복되 는 이 당류체 를 분해 시 키 기 위 해 서 는 {3-D-N -acety lh exosami ni d a se ((D) , {3- D-ga lacto s id a se (®) , N-ac-ety lg l u cosam ine 6-sulfa te sulfa tas e (@) 및 ga lacto s e 6-sulfa te sulfa tas e@) 의 효소들이 필요하다. 이 들은 모두 외 효소로 KS 사 술의 바환원성 말단에서부터 단계적으로 작용한다. ®G귀6a slup®_!ll f ,-a 4 tG e®~ l ·키 c6~ Ns· uA•l C~f a ―tpe® !l , - 3 + Gal ―一 KS 의 탄수화물一단백질 연결부분은 여타 MPS 와는 다르며, gly - co p ro t e i n 과 유사하다. 이 들의 분해 에 작용하는 당분해 효소는 참고 . 문헌 (5. 26) 을 참조하기 바란다.
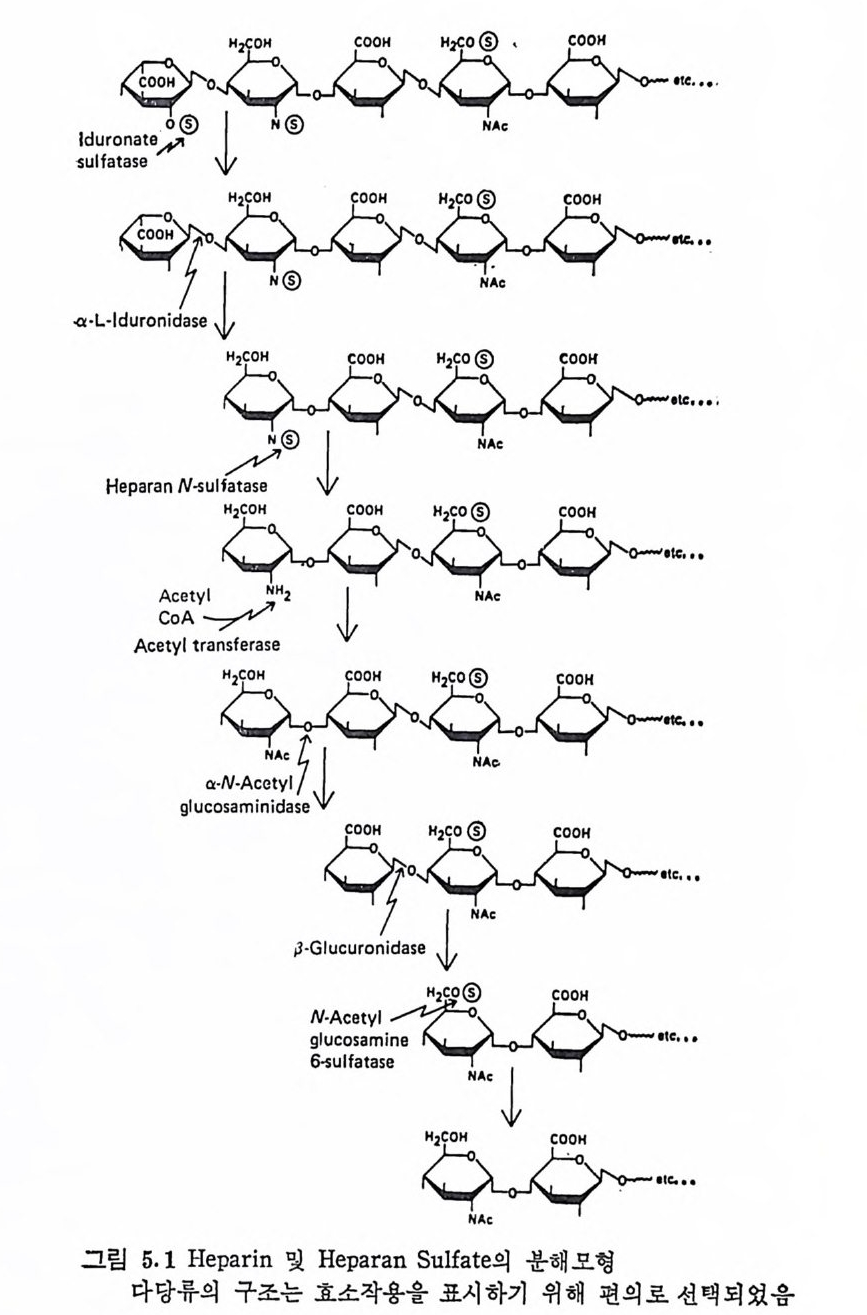 言호$ saet e/ 군』 :호:도 ·'c ••
言호$ saet e/ 군』 :호:도 ·'c ••
5. 3 Mucop o lys accharid o se 사람에게서 MPS 의 대 사에 이 상 (abnormal) 이 있으면
갖(갖배i 。lppl T핸캉N람[m짱hF·용·배-‘에f r A mμ←N당배되-QU。-해’)마·하오배피f ig응(얘p야g ~‘캉밤킹흰합{γ‘·매F에πmT {배피 {피&쉰빼f멤캉[에T람g‘·-F‘V 억뿌캉·{뎌홈 다력·*뽑 *랙{〈’{牛껴뺨 밤、짱•밤훤AN뉴캘N배‘힘· W 현)(·{매양κ N빼··N(빼←‘하{람W·맨”뉴‘빼 m {N-κ(·M용-F ) 멘캉{뉴N(캄킹K·싸렐쟁κ매)바 ←PE양람if{r어。‘t。캉{,’ p응 m
어Qk<여mμm성}i”(mi]<이u ·중{τ;*{」F·파뿌。#셰· 맨·뼈씨H파-서며 ‘멤T(F배)중서 성김어。어μω}p성니i엉m녀m}(·ωωl어m〕껴다Bl a 얘섭mωi어“업aμωQS 【k。m(a-【μ애a여』}경여띠}ω}”“i]디!ωm요여i日띠다〕} g@어s@여ai디띠K}{ }μS벌ωg다m섭여【잉m{필Q여여Pg}여{m%ωmK죄 어a여msl어m디【Z엄…깅8【@g·닝i|“g어캅·(야”{i요먼} 힘Q어ω{섭g어m}【m디ω%%‘k다a{랙Qmμ S iauZιωimφu{sR“여iSm。i}띠…a∞E야Q디Emi어l」m “m{}어@디어띠l@ 니어…mZiιc“여EE{ulmu。야옵ω@어}얘엉5”5일입μ “l。있갑잉여m【섭m∞}·”l다;써i【써〕a。띠@μm다되언 어되며m【띠띠〕어띠k}』{【μ@(ωμ어}【되다]mEmS 씨·@ω〕·(。]a엽여Q}ic【μ성a…따m섭다염 색 체 성 열 성 (auto somal recessiv e ) 으로 전 달된 다. 죽 부모 모두가 Hurler sy n drome 유전인자풀 보유하고 있을 때, 자녀에게는 성별 에 관계 없 이 Hurler s y ndrome 이 전 달된 다. 반면 에 Hunte r sy n dr. ome 은 성 (sex) 과 관련되어 있으며, 유전인자를 보유하고 있는 어머 니는 이 유전병을 아들에게는 전달시키나 딸에게는 전달시키지 않 는다. 다만 딸의 반은 잠재 형 이 되며 손자에게서 다시 나타날수 있 다. 현재 까지 알 려 진 muco p ol y sacchar i dose 는 Hunte r sy n drome 을 제외하고는 모두 상염색체성 열성이다. Hun t er 와 Hurler s y ndrome 은 앞서 언급된 바와 같이 IdUA 를 포함하는 대사에 관련되어 있다. 비록 한 가지 효소(예로 a-icl uronid - ase) 가 정 상적 으로 존재 할지 라도 다른 효소 (예 로 idu rona te sulfa tas e) 가 결핍되어 있으며 IdUA 의 C-2 위치에 연결된 황산기가 제거될 수 없으며, 따라서 a- i duron i dase 에 의해 분해되지 않 는다. 이때 DS, HP 및 HP 없근 체내에서 축적되고 이들의 많은 양이 소변으로 배설 된다. 이들 질환의 환자에서는 HPS 는 주로 간에서, 그리고 DS 는 지라 (s p leen) 에서 발견된다. 이와같은 조직에서의 GAG 의 축적 이 아 들 환자의 임상적 중상을 유발하는 요인으로 간주되고 있다. Sanfi lippo s y ndrome 둘은 Hun t er 나 Hurler s y ndrome 과 유사하 기는하나, 신체적 결함은 비교적 적은 반면에, 심한 지능저하 물 보 인다. 이 질병은 HP 및 HPS 의 대사에 이상이 있는 것 으로, 관련 된 효소에 따라 A, B, C 및 D 형 으로 구분된 다. Sanfi lippo A 형 에 서 는 HP 나 HPS 의 N-sul fat e 기 를 분해 시 키 는 sul fa m i dase 가 결 핍 되 어 있 다. 그러 나 Sanfi lip po B 및 C 형 환자에 게 는 sul fa m i dase 는 정상적으로 존재하나, 이 효소에 의해 생성된 자유 아민기의 N- ace ty la ti on 에 요하는 acety It r a nsfe r ase 또는 a-GlcNAc 을 제 거 시 키 는 a.,-N-ace ty l g lucosam i n i dase 가 결 핍 되 어 있 어 비 환원 성 말단 의 g lucosam i ne 기 가 분해 되 지 않는다. 최 근에 보고된 Sanfi lip po D 형은 HP 빛 HPS 의 GlcNAC 의 C- 6 위치에 있는 황산기를 제거시키 는 sul fat ase 가 결핍되어 있는 것으로 여겨진다. KS 의 조직 내 축적 으로 특정 지 워 지 는 Morqu io s y ndrome 은 Gal- NAc 6-S sul fat as 텍 결핍에서 연유한다. 이 효소는 Ch6-S 의 C-6
위치의 sul fat e 기는 물론, KS 의 g alac t ose 의 C- 6 에 연결된 황 산기 에도 작용한다. 따라서 이 질환의 환 자에서는 Ch6-S 와 KS 가 체내 에 축 적되고, 상당량 이 소변으로 배 설 된다. 지능발달은 정상이나 심 한 공 격변 형 중상운 보이는 Morqu io s y ndrome 과 유사한 중 상 은 GalNAc 6-S sul fat ase 의 활 성 이 정 상적 인 mucop o lys accharid o se \i ]][형 환자 에서 도 관 찰 된다. 이 새로운 mucop o lys acchari do se 환 자의 fi broblas t에 는 GlcNAc 6-S sul fat ase 가 결 핍 되 어 있 다. (KS 의 hexosam i ne 인 GlcNA 안근 대 부분 C- 6 위 치 에 황산기 가 연결 되 어 있다.) DS 와 Ch 4- S 의 GalNAc 4-S 의 황 산기 를 제 거 시 키 는 데 촉매 작용 을 하는 ary ls ulfa tas e B 의 결 핍 은 Marote a ux-Lamy s y ndrome 을 유발한다. 이 병에 걸린 환자의 소변에는 많은 양의 DS 가 검출되나 · Ch4-S 는 검 출 되 지 않는다. 따라서 , 초기 에 는 aryl sulfa tas e B-는 DS 에만 작용하는 것으로 추정되었으나, 여러 실험적 결과에서 이 효 소가 Ch4-S 에도 작용하는 것으로 밝혀졌다. fi-g lucuron i das 텍 결 핍 에 의 한 muco p ol y saccha ri dose 에 서 , 임 상적 중상이나 체내에 축적되는 다당류에 대해서는 연구자들간에 큰 차이를 보인다. Sl y등 (5.27) 은 Hun t er 나 Hurler s y ndrom 탸卜 유 사 한 중상을 보이는 환자의 소변에서 정상보다 많은 양의 Ch 4- S 밋 Ch6-S 을 검출하였다. 반면에, DS 와 HPS 의 양은 정상적인 범위에 서 검출되었으며, HA 는 소변에서 발견되지 않았다고 보고하였다. 이 와는 대 조적 으로 , Beaude t등 (5. 28) 은 fi-g lucuron i dase 가 결 핍 된 환 자의 소변에서 현처한 양의 GAG 의 증가, 특히 IdUA 를포함하는 다당류는 10~20 배 를 발견했으며 , 앞서 Sly 등이 보고한 환자의 소 변에 서 도 CS 보다는 DS 와 HPS 의 양이 중가한다고 보고했다. 이 들 보고간에는 DS 와 HPS 의 양에는 서로 일치되지 않으나, hy al~ 。· n i dase 에 민감한 GlcUA 를 포함하는 다당류가 fi-g Iucuron i dase 가 결핍된 환자의 소변에서도 현저하게 중가되지 않는다는 것은 서로 가 일치된다. 따라서 비목 fi-g lucuron i dase 가 결핍되어 있으나, 이 에 보조 역 할을 하는 h y aluron i dase 가 이 에 민 감한 다당류의 대 부 분을 분해시킨다고 불 수 있다.
표 5. 2 에 수록된 muco p ol y sacchar i dose 에 는 fi -D-N-ace tylhexo- 손 sam i n i dase 의 결핍에 따 른 질환 이 포 함 되어 있 지 않 다· 이 효소의 결핍은 주로 gly c o p ro te i n 대사의 이 상증 상으 로 나타나며, A 형 8- D-N-ace ty lhexosam i n i dase 의 결 핍 은 , Tay -S achs 질 환을 , 그리 고 A 형과 B 형 효소가 모두 결핍된 경 우 에 는 Sandhoff 질환을 유발 한다. HA, Ch4 -S, Ch6-S 및 DS 의 체 내 분 해 에 fi-N -D- ac ety lh e- xosam i n i dase 가 관여 한 다는 것 은 확 인되었으나, 아직 도 이 효소 의 결 핍에 의한 심한 GAG 의 조 직 내 축적 은 관 찰 되지 않았 댜 또한 · 이 효소가 결핍된 사람에서는 다 른 mucop o lys accharid o se 환자 에 서 보통 관찰되는골격변 형 과 같 은 임상 적 중세도 관 찰 되지 않 는다. 이 는 또 다른 GAG 에 득이 한 fi -N-ace ty lhexosam i n i dase 가 조직 내 에 존재하고, 이것이 GAG 를 분해시킬 가능성을 제시하고 있으나 · 아직 확인되지 않았다. 지 금까지 언급된 muco p ol y saccha ri dose 의 대 부분은 DS, HPS 밋 KS 의 대사의 이상에 의한 것이며, CS 는 이돌에서 보다 아 주 희 귀 하게 나타난다. HP 와 HPS 간의 구조적 유사성에도 불 구 하 고, HP 의 대사의 이상에 따른 질환은 아직도 관찰되지 않은 것은 아 주 홍 미 로운 것 이 다· 또한 여 하한 muco p ol y sacchar i dose 에 서 도 PG 의 생 합성이 비정상적인 경우는 발견되지 않는 것도 관심의 대상이 된다. GAG 의 대사에 관여하는 효소들의 결핍에 따른 GAG 의 조직내 축 적 이 어 떤 메 카니 즘을 동하여 muco p ol y saccha ri dose 의 임 상적 중 세 를 유발하는가는 아직 확실하지 않다. 다만 병리 학적 으로는 축 적 된 오물에 의한 세포(특히 신경계동 세포)의 사망이 이 질환 의 마 지 막 단계로 간주되 고 있다· 또한 잔여 GAG 부분이 다 른 lys o some 효소나 세포의 발육신호의 해석에 영향을 미칠 것이라는 것 이 실험 적으로 계시되기도 했다. * 추천문현 Rl. E. F. Neufe ld and J. C. Frata n to n i, Inborn errors of mucop o! y s a-ccharide meta b olism , Sc ien ce, 169, 141 (1970)
(대사에 관한 초기 의 연 구 결 과 문 간 단히 기 술 하고 있 다.) R2. A. Dorfm an, Adventu res in vis c ous soluti on s, Mo!. Ce ll Bi oc hem.,. 4, 45 (1974) (주로 muco p ol y sacchar i dose 에 관한 처 자의 경 험 을 취 급한 다) R3. A. Dorfm an and R. Mata l on, The mucop o lys a ccharid o se s (a rev- iew ), Proc. Natl . Acad. Sc i. U. S. A. , 73, 630 (19 7 6 ) ( R4 보다는 화학적 이 다) R4. A. L. Fluharty , The mucop o lys accharid o ses: A syn ergi sm betw een clin ic a l and basic inv esti g a ti on s, J. Inves t . De rm a. 79, 38S (1982) * 인용문현 5. 1. J. H. Glaser and H. E. Conrad, Chondroit in S04 cata b oli sm in chic k embry o chondrocy tes , J. Bi ol . Che m ., 254, 2316 (1979) and Ref s th erein . 5. 2. L. B. Jaq u es, Hep a rin a se, ]. Bi ol . Chem. , 133, 445 (1940) 5. 3. B. Arbog a st, J. J. Hop w ood, and A. Dorfm an, Hep a rin a se acti - vit y in rat live r, Bi oc hem. Bi op h y s . Res. Commun., 75, 610 (1977) 5. 4. A. Waste s son, M. Hook, and B. Weste r mark, Demonstr a ti on - of a pla te l et enzym e deg r adin g hep a ran sulf ate , FEES Le tt., 64, 218 (1976) 5. 5. U. Klein and K. von Fig ura, Part ial pu rifi ca ti on and characte r -- iza ti on of a hep a ran sulf ate spe ci fic endog lu curonid a se, Bi oc hem. Bio p l zy s. Re s. Commun., 73, 569 (1976) 5. 6. F. E. Brot, C. E. Bell and W. S. Sly, Purifi ca ti on and pro p er ti es . of {3-glu curonid a se from human pla centa , Bi oc he m i st r y , 17, 385 (1978) 5. 7. K. von Fig u ra, Human a-N-acety lg ! u cosami ni d a se. I. Purifi ca - Hon and pro p e rti es , Eur. ]. Bi oc lzem., 80, 525 (1977) 5. 8. R. Mata l on, J. A. Cif on ell i, and A. Dor fm an, L-id u ron ida se in· cultu red human fibr oblasts and live r, Bi oc hem. Bi op h y s . Res. Commum., 42, 340 (19 71) 5. 9. L. H. Rome, A. J. Garvin and E. F. Neu feld , Human kid n ey a- L-id u ronid a se: Purifi ca ti on and characte r iz a ti on , Arch. Bi oc hem. Bi op h y s. , 189, 344 (1978) 5. 10. A. G. W. Norden, L. L. Tennant. and J. S. O'Br ien , GMl ga n- glios id e p~ga lacto s id a se A: Purifi ca ti on and stu d ie s of the enzym e ·
from human liv e r, J. Bi ot . Chem., 249, 7969 (1974) ·5, 11, P. A. Ockerman, Identi ty of p-glu cosid a se, p-x y lo sid a se and one of the p-ga lacto s id a se acti vi t ies in human live r when assay e d wi th 4-meth y lu mbell ifer yl - P-D-gl y c osid e s: stu d ie s in cases of Gaucher's dis e ase, Bi oc lzim . Bi op l zy s . Acta , 165, 59 (19 68 ) 5. 12. F. Tomi na g a, K. Oka and H. Yoshid a , The iso lati on and ide nt- ifica ti on of 0-xy lo sy l- serin e and S-meth ylc y s te i n e sulfo x id e from human urin e , ]. Bio c lrem., 57, 717 (1965) 5. 13. R. Mafa lo n, B. Arbog a st and A. Dorfm an, Defi cien cy of chon-droit in sulfa t e N-acety lg a lacto s ami ne 4-sulfa te sulfa tas e in Mar-ote a ux-Lamy syn d rome, Bio c lzim . Bi op l zy s . Res. Commun., 61, 1450 (1974 ) 5. 14. J. Gnio t - S zulzyc ka and P. V. Donnelly, Ar yls ulfa tas e B (Maro- tea ux-Lamy fac to r ) : A pa rt of the enzym e sys te m respo nsib l e for sulfa te release from mucop o lys accharid e frag m ent, FEES. Lett ., 65, 63 (1976) 5. 15. P. Di Ferrante , L. C. Gin b erg, P. V. Donnelly, D. T. Ferrante and C. T. Caskey, Defi cien c ies of glu cosam ine -6-su lfa te or ga la- cto s ami ne -6- sulfa te sulfa tas es are respo nsib l e for dif fer ent muc-opo lys accharid o ses, Scie 1 1ce, 199, 79 (1978) 5. 16. J. Sin g h , N. Di Ferrante , P. Nie b es and D. Travella, N-acet- ylg a lacto s ami ne -6-sulf ate sulfa tas e in man: Absence of th e enz- yme in Morqu io dis e ase, J. Clin . bzvest. , 57, 1036 (1976) 5. 17. A. L. Horwi tz and A. Dorfm an, The enz yme defe c t in Morqu io ' s dise ase : The spe ci ficity of N-acety lh exosami ne sulfa tas es, Bi oc - him . Bi op l zy s. Res. Commun., 80, 819 (1978) -5. 18. R. Basner, H. Kresse and K. Von Fig ura, N-acety lg l u cosami ne - 6-su lfat e sulf ata s e from human urin e , ]. Bio l . Chem., 254, 1151 (1979) 5. 19. H. Kresse, E. Paschke, K. von Fig ur a, W. Gil be rg and W. Fuchs, San filippo desease type D: Defi cien cy of N-acety lg l u cosa-mi ne -6- sulf ate sulfa tas e req u ir e d for hep a ran sulf ate deg r ada- tion , Proc. Natl . Acad. Sc i. U. S. A. 77., 6822 (1980) ·5, 20. J. Gloss!, W. Trup pe and H. Kresse, Purifi ca ti on and pr op e rt ies of N-acety lg a lacto s ami ne -6-su lph ate sulph ata s e from human pla centa , Bio c lrem. ]., 181, 37 (1979) 5. 21. T. W. Lim . I. G. Leder, G. Bach and E. F. Neu feld , An assay
for idu ronate sulfa tas e (Hunte r correcti ve fac to r ) . Carbohy d r. Res., 37, 103 (1974) 5. 22. A. Lemair e , J. Pic a rd and A. Gardais , Le Cata b oli sm e de !'he- pa rin e : Etu d e in viv o de la desulfa tion de I'hep a rin e chez le rat, C. R. Acad. Sci. Paris, 264, 949 (1969) 5. 23. C. P. Diet r i c h , A hep a rin sulfa m i da se from mammali an lym p h oid tiss ues, Can. ]. Bi oc hem., 48, 725 (1970) 5. 24. U. Klein , H. Kresse and IC von Fig u ra, Sanfi lippo syn drome type C: Defic i e n cy of acety l- CoA: a-gl u cosami ni d e N-acety lt ra ns- fer ase in Skin fibr oblasts , Proc. Natl . Acad. Sc i., U. S. A. 75, 5185 (1978) 5. 25. P. A. Revell and H. Muir , The excreti on and deg r adati on of chondroit in 4-su lph ate adm inist e r ed to gu in e a pigs as free chond-roit in sulph ate and as pro te o g ly c an, Bi oc hem. ]., 130, 597 (1972) 5. 26. V. Pate l , Deg ra dati on of gly c op ro te i n s , in: The Glyc oconj u g a te s , Vol. ll. ed ited by M. Horowi tz and W. Pig m an, Academi c Press, New York, 1978, p. 185 5. 27. W. S. Sly, B. A. Quinton , W. H. McAi ist e r and D. L. Ri m oin , Beta glu curon ida se defic ien cy: Repo rt of cli ni c a l radio l og ic, and bio c hem ica l fea tu res of a new mucop o lys accharid o sis , J. Pedia t r . , 82, 249 (1973) 5. 28. A. L. Beaudet, N. M. Di Ferrante , G. D. Ferry , B. L. Nic h ols and C. E. Mu llins, Varia t i on in the ph enoty pic exp r essio n of {3-glu curon ida se defic ien cy, J. Pedia tr . 86., 388 (19 75)
제 6 장 Glyc o sami no g ly c a n 의 분자 크기 및 유체역학적 성질 Cell and tissu e, shell and bone, leaf and flow er, are so many po rti on s of matt er, and it is in obedie n ce to the laws of ph y s ic s tha t the ir pa rti cle s have been moved, moulded and confo rm ed. 위 의 말은 D'arcy Thomson 이 1917 년 에 『 On gr owt h and f orm 』 이라는 책에서 말한 것으로, 이는 현재 생물학의 주류를 이루고 있 는 분자생물학을 대변하고 있다고 볼 수 있다. 생명 현상의 분자론 적 입장에서의 설명은 생물분자들의 구조의 이해에서 비롯된다. 고분자 물질의 구조는 크게 두 가지 측면으로 구분된다. 하나는 분자량, 분자의 모양 등 거시적인 것이며, 다른 하나는 내부구조 빛 3 차구조와 같은 미시적인 것이다. GAG 의 거시적인 구조는 이 장 에서, 그리고 미시적인 구조는 다음 장에서 취급된다. 6. I 고분자의 분자량, 크기 및 모양의 측정 방법 이 항에서는 고분자의 여러 분자 파라미터를 결정하기 위한 실험 적 방법과 이의 배경이 되는 기본 원리를 간단히 기술한다. 분자의 과라미터 중에서 가장 중요한 것이 분자량일 것이다· 고 분자 물질의 분자량은 여러 가지 물리화학적 방법에 의해 측정된다.
주어진 고분자 물질이 모두 동일한 분자량을 갖는 분자들로 구성되 어 있다면, 측정된 분자량은 사용된 방법에 무관하게 동일한 값이 얻어질 것이다· 그러나 대부분의 고 분자 물질은 이 물 구성하는 분 자의 크기가 서로 다르고, 따라서 측정된 평균 분자량은 이의 결정 에 사용된 방법 에 따라 각각 다 르게 나타난다. 이 를 표 6.1 에서 비 , 교하였다.
표 6.1 평균분자량의 정의 밋 이의 측정에 사용되는 방법. N; 는 분자량 M 湜갖는분자의 수. 평군 방법 정의 측정방법 숫자 평균 (M 五) Z (Mi N i ) /2Ni 삼두압, 총괄성질 우게 평균 (Mw) I;(M ;2N; )/ I;M iN ; 광산란, 초원심분리 Z 평군 (M,) I; (M閩 )/I; (M澤 ) 초원십분리 접도. 평균 (Mv)* I; (M;Cl+a)N, /I; (M;N;) 점성도 * a 는 분자의 모양인자.
6.1.1 삼투압 맞 총괄성질 가장 간단한 분자량 측정 방법 은 용액 의 증기 압 강하, 비 점 (boil ing • po in t) 상승 및 빙 점 (free zin g po in t) 강하와 같은 용액 의 총괄 (coll iga - tive ) 성질을 이용하는 것이다· 그러나, 이돌 방법은 보통고분자용 액에서는 사용되지 않는데, 이는 고분자의 분자량이 크고, 용해도 ` 가 낮아 주어진 용매에 녹아 있는 용질(고분자)분자의 수가 적기 때 문이다. 삼두압 (osmo ti c p ressure) 은 낮은 용질의 농도에서도 농도에 비교` 적 민감하게 변하기 때문에 고분자의 분자량 측정에 가끔 이용된다. 용액의 삼두압 (7r) 은 용질의 농도 (C) 와 온도 (T) 에 따라 변하며, 아 는 일반적으로 다음과 같이 표현된다. n/C= 물 [l +B2C+GBP2+ ···] (6-1) 여기서, B2 와 GB2 는 각각 용매국臼 l 및 용질극봉질 간의 상호 작 용을 반영하는 v i r i al 계수들이며, 분자량 (M) 은 무한히 붉은 농도 로 외연장한 tr /C 에서 구해진다·
(tr/C) C-0 =겅 R TT (6-2) 석 6-1 과 6-2 는 용질의 분자량이 모두 동일할 때는 그대로 적용되 나, 동일하지 않을 때는 분자량 (M) 은 수 평균 분자량 (Mn) 으로 대 체된댜 용질 이 GAG 와 같이 다전해 질 (po lye l ectr o lyt e) 일 때 는 반대 아 온 (counte r i on) 에 대한 삼두압의 기여도 고려해야 한다. 예로, 다% 과 같이 용액에서 해리되는 M,P 을 고려하자. M.P~zM++p -• (6-3) 만약에 다가음이온 p -z 와 양이온 M+ 가 용액에 존재하는 이온들 의 전부라면, 이들은 모두 삼두막의 같은 쪽에 존재하여 (전기적 중 성도를 유지해야 함) p-z 이온 1 개당 z+l 개의 입자가 존재하는 경 해우리와되 동지일 한않 은삼 상두태압의을 분나자타량내의게 7된다 平1. T 에따라 해서,당 하이는 다분전자해량질을 용 액갖은는 용질이 용해된 용액과 동일하게 거동한다. 이에서 다가이온 (P-’) 과 반대이온 (M+) 의 수 평군 분자량이 (1r/C)c-O 에서 얻어지며, p -z 의 분 자량이 계산된다. 대부분의 생물고분자의 삼두압실험은 다른 지지전해질 (BX) 의 존 재 하에서 수행된다. 이때에는 Donnan 평형이 고려되어야;한다. 강 전해질 BX 에서 생성되는 B+ 및 X-이 온, 그리고 물분자가 삼두막 웅 자유로 몽과할 때의 용액의 삼두압은 다음과 같이 주어진다. (균)아 -0=RT 〔武汀+ 4( 江z :% 』 (6-4) 여기서 ,C p는수 평균 분자량 (Mn) p을 갖는고분자의 무게농도 (w/v) 이다. 식 (6-4) 는 충분히 높은 지지전해질 농도 (CBX) 하에서는 용액 의 삼두압은 고분자만이 포함된 용액의 삼두압과 같아지고, 따라서 (M 야가 용이 하게 산출됨 을 보여 준다. 이 는 높은 CBX 에 서 다전해 질의 반대이온이 해리되지 않는다고 생각하는 것과 동일하다. 6.1.2 침강과 조원심분리 초원 심 분리 (ult rac entr ifug a ti on ) 시 의 고분자의 침 강속도 (sedim enta -
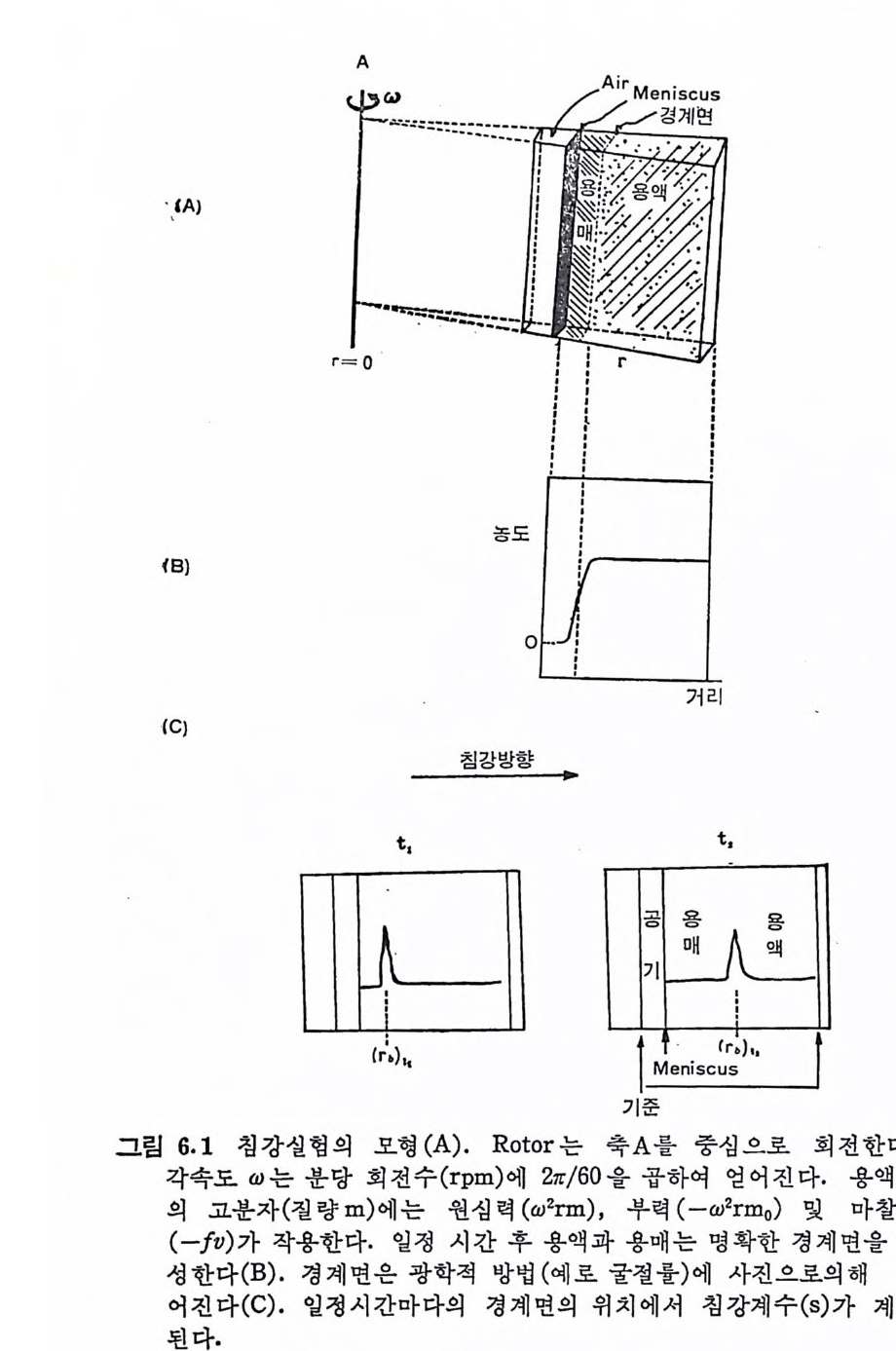 A 戶
A 戶
tion veloc ity) 측정은 고분자 물질의 분자량을 결정하는 데 아주 유 용하게 사용된다. 적절한 광학장치가 부착된 초원심분리기에서의 침 강속도 (v) 에서 침강계수 (s) 가 구해지며, 이는 분자량(!VI)과 식 (6-5) 로 연관지어진다. M(Nl-J V p ) -= 言V =s (6-5) 여 기 서 , V 와 p 는 각각 용질 의 pa rti al spe ci fic volume 과 용매 의 밀도를 나타낸다. N 는 Avog ad ro 수, f는 용질의 마찰계수, 그리 고 o 와 r 은 ro t or 의 각속도와 회전중심에서의 거리룽 의미한다. 침강계수 (s) 는 보통 그립 6.1 (C) 에서 보여준 Schie r en 사진의 경 계면 이동속도에서 얻어지는데, 이는 식 6-6 으로 정의된다. v= 건dr r =r 奭, ' (6-6) 이 식을 그림 6.1 을 참조하여 적분하면 ln(~rb=) t,w 2s( t 2- t 1) 의 관 계가 얻어지며, s 는 ln 〔( rb ) 1, ' 1(rb ) h 〕웅 t 2- t,에 대해 g ra p h 룹 그 려 구한다. 용액 중의 다른 전달현상과 마찬가지로, 침강속도는 용 질간의 상호작용 때문에 농도 (C) 에 따라 다르다. 따라서 고분자의 분자량을 식 (6-5) 에 의해 구하기 위해서는 무한히 움은 농도에서 의 침강1계/수s =(so+) 가(l +요K 구s되C며);, +이=는 (다+음의t _o식 을 이용하여 얻어(진6-다7). 식 6.5 에 의한 분자량 (M) 의 계산에는 마찰계수(j)가 필요하다. 이는 초원심분리 과정에서 시간에 따르는 농도구배를 굴절폴로 구 하고(그림 6.lB), 이에서 확산계수 (D iff us i on coe ffici en t :D) 를 계산하여, 식 6-8 을 적용시킴으로써 얻어진다. D= 焉- (6-8) 확산계수 D 도 농도에 의존하므로, D 와 C 의 관계에서 D 를 c-o 로 외연장하여 Do 를 구하고, 이룰 식 6-8 에 대입하여 무한히 붉 은 용액에서의 마찰계수 f o 을 계산한다. 따라서, 침강과 확산 Data 에 의한 분자량 계산은 다음의 Svedber g식으로 주어진다. M=RTso/ (1 尹) Do (6. 9)
침강쵸각산방법에 의한 분자량 측정에서는, s 와 D 가 모두 같은 조 건(목히 온도)하에서 얻어져야 한다. 이는 마찰계수f가 용액의 점성 도(TJ)에 민감하게 변하기 때문이다. 이 점은 보몽 So 와 Do 를 어떤 표준상태(예로 20°c 수용액)로 보정시킴으로써 해결된다. 즉, 실험이 온도 T 의 완충용액 b 에서 수행되었다면, 20°c 물에서의 값은 다 음과 같이 보정된다• S20,.,= fi각:};:': ·읍 •ST,b (6-10) D20,o= 29 尹 ·1/20후 , ., .DT,b (6--1 1). 보정된 So 와 Do 를 식 6-9 에 대입하면 침강-확산 방법에 의한 분 자량이 얻어진다. 침강속도 측정은 분자의 모양에 대한 정보도 제공한다. s 와 분 자량 (s 와 D 또는 다론 방법에서 측정)에서 마찰계수 f가 구해진다. 용 매내의 고분자의 부피가 1\tl V/N 으로 주어진다고 가정하면, 아 고 분자가 구형으로 존재할 때의 반경 (R) 이 계산된다· 구형인 분자의 마찰계수(f s p)는 S t okes 법칙에서 다음으로 주어진다. fsp = 6n1JR (6-12) 만약에 분자가 구형이 아닌 다른 형태로 존재하면, 마찰계수는 표 . 6·2 에 정리된 식으로 주어지며, 실제의 f와 계산된 fs p의 비교얘 서 분자의 모양이 추정된다. 수용액 중의 고분자는 많은 수화된 물을 포함하고 있다. 따라서 앞서 언급된 f/fs p에 의한 분자 모양의 추정은 수화된 고분자 (GAG 는 아주 크게 수화됨)에는 용이하게 적용되지 않는다. 이때에는 분자 량과 침강계수, s 의 관계에서 고분자의 모양이 추정되는데, 실함 적으로 So 와 분자량은 식 (6-13) 으로 표현된다. s0=K111. (6-13) 여기서 a 값은 모양인자이며, 이는 점성도를 취급할 때 다시 언급 된다. 침강-확산방법에 의한 분자량 측정은 GAG 와 같은 분자량이 크 게 분산된 고분자에는 적용이 용이하지 않다. 이 경우에는 칩강평형
표 6.2 분자의 모양과 마 찰 계수 모양 마 찰 계수 설명 구 형 f =6 찌 R R= 반 경 장(p 구ro l형a te ) f= 67rf JR p ( b/ a) 2 /3l n ({1[1- +b Z(1/ a 一 Z ) b 1 12 /2 a 2 ]-b/ 마 2a= 단장 축축 킬컬이 이 , 2b= 타원형 R p= 같 은 부피 를 갖 는= (a구bZ )형 l/ 3의 반경 편(o b구 la 형te ) f =6 rrr; R 。 (a/b) 2/(3at 2a /n b- 드I (a 12)/1b/ 드Z 1) 1/Z 2a= 단장 축축 길 길이이, 2b= 타원형 Ro= 같은 부괴 를 갖 는= (a구2b형) l의13 반 경 긴막대형 f=6 짜 RT(3/2) 1/3{2(Ian/b[2)2(at/3 b )]- 0 .11} a= 경길 이의 I/2,b= 반 Rr= 같은 부괴물 갖 는= (3구b형2a/의2) 11반3 경
(Se dim enta t i on e qu ili b ri um) 방법을 적용하여 평군분자량을 얻을 수 있다· 초원심분리 과정에서, 이상용액의 단위시간당 단위면적당 흐 로는 용질의 양(])는 식 6-14 로 주어 진다. J= L [w2rM(l-Vp )- RT/C (aC/ar)]; L =C/Nf (6-14 ) Ro t or 의 회전속도 (w) 가 아주 크지 않으면, 어느 시간 후 시험관내 에는 용질의 농도구배에 평형이 이루어진다. 이때는 식 6-14 에서 ]=0 가 되며, +d1 C/dr=w2rM(l-V p )/RT 가성립된다. 이폴적 분하면 식 6-15 가 얻어지는데, 분자량은 lnC(r) 과 규의 관계에서 구해진다. lnC C(a()r ) -( J)~ -VP2R) T(r 2- = a_ 2 } (6--15 ) 침강평형의 식을 다른 방법으로 경계조건을 도입하여 적분하면, 주 어진 화학종 C i에 대해 다음의 식이 성립한다. Ci (b) -Ci ( a) :::: (l)2 (lRTVp ) 구 C i 0Mi (6-16 ) a 와 b 는 용액 column 의 양끝 (a 가 me ni scus) 을, 그리고 c i o 는 초 기의 농도(무게/부피)를 나타낸다. 이를 모든 분자량에 대해 합하면;
C(b) c_ 0C (a) =- 硏 (R1T-V p) b2 -2a 2 2麟Ci0 M i (6-17) 이 된다· 무게 평균분자량• ili w = 고고 C C i ° i oM i 는 평형시의 양끝의 농도 차에서 식 6-7 을 이 용하여 구해진다. 침강평형의 da t a 를 다른 방 법으로 처 리 하면 Z 평균 분자량 , M'~L: ]C訂i 0건 M=i 2, 이나 수 평균 분 자량도 구할 수 있다. 6.1.3 점성도 고분자 물질의 분자량과 분자 모양에 관한 정보를 얻기 위하여 사용되는 또 다른 실험방법은 점성도 측정이다. 점성도 실험결과는 보통 식 6-18 에 보여 준 Hug gins 식 으로 분석 된 다. 1Jsp / C = [7J] +K' [7J] C (6-18) 비점도 (s p e cifi c vis c osit y: T/ s p)는 1Js p =( :麟 -1) 로 정의된다. 본성 점성도(i n t r i ns i c v i scos ity:[7J])는 환산점성도(7} s p/C)를 용질의 농 도(C)에 따라 p lo t한 것을 c-o 로 외연장하여 얻으며, 보통 dl/gr 의 단위로 표시한다. 본성점성도는 유체역학적 이몬의 전개에서 분자의 모양을 반영하 는 인 자 (S i mha 인 자 : u) 와 분자의 비 용적 (spe ci fic volume: Vm) 의 곱으 로 나타난다. [1J] =v• Vm•N/M (6-19) 점성도인자 v 는 구형분자에서는 2.5 이며, 타원형에서는 축간의 비 (a/b) 가 클수록 이보다 큰 값을 갖는다. 만약에 고분자 코일의 유효 반경 이 관성 반경 (rad ius of gyra ti on : RG) 와 같은 크기를 갖는다면, 식 6-19 는 다음으로 표현된 다. [7JJ =K 陶 /M (6-20 ) 여기서 KI 는 또 다른 상수이다· 주어진 고분자에 있어서, RG 는 사술의 길이, 죽 분자량의 함수이다· 고분자가 용액에서 치밀한 T 형을 가질 때 (0 용매에 녹아 있을 때)는 RG 는 Ml/2 에 비례하므로[7}] 는 Ml/2 에 비례한다· 그러나 ()용매보다 더 좋은 용매에 녹아 있을 때는 RG 는 M 이 중가할 때, M112 보다 급격히 커지며, [7}]와 M
는 반실[r험J] 적=인K MM aa rk-H ouw i nk 식으 로 연관지어진다. (6-21 ) K는 주어진 분자모양에서는 분자량 (M) 에 무관한 상수이며, a 는 형분 자을, 모o양. 7을5 일반 영때 하는는 임 인 의자 코이일다 .(ra nad o가m Oc.o5i l )일 형 을때,는 그분리자 고는 1치 보밀다한 구쿨 때는 확장된 딱딱한 막대 모양을 하고 있음을 의미한다. 여러 GAG 의 점성도 파라미터인 K 와 a 값은 6.2 항에서 취급된다. GAG 와 같은 다전해질 용액은 용액의 이온강도(i on i c str en gt h) 가
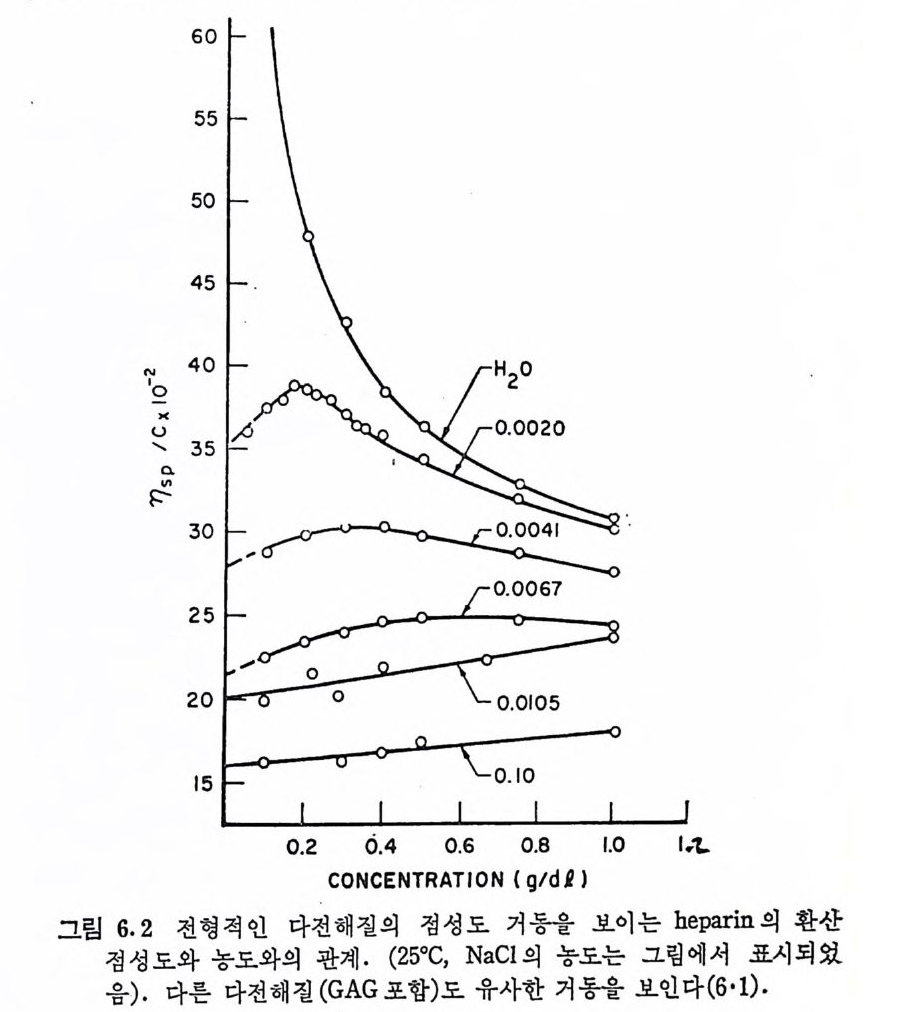 50
50
크지 않을 때는 식 (6-18) 에서 예측되는 TJ s p /C 와 C 간의 직선관계가 관찰되지 않는다. 이는 낮은 이온강도의 용액에서의 다가이온(p ol y i on) 의 팽창으로 설명된다 . 따라서, 낮은 이온강도에서 Hu ggi ns 석 (식 6- 18) 을 이용하여 〔 n ] 를 구하기 위해서는 다전해질의 농도 (C) 를 변화시킬 때 용액의 이온강도(다전해질 및 지지전해질의 기여 를 노 두 포함)를 일정하게 유지시킬 필요가 있다· 그러나, 높은 이온강 도의 용액에서는 다전해질에 의한 이온강도의 기여 를 무시할 수 있 으므로 단지 지지전해질의 농도를 일정하게 하면 충분한 TJ sP/C 와 C 간의 직선관계가 얻어지고 [까값이 구해전다. 일반적으로, 다전해질 분자의 모양은 다가이온 전하와 분자사슬 의 강직 성 에 따라 변하므로, 이 온강도의 변화에 따르는 [r;]의 해 석 은 분자 모양의 변화의 가능성이 고려되어야 한다. 첨가된 지지전해질이 없을 때의 다전해질 용액의 점성도 변화 (7Js;i; /C) 는 C 가 감소할수록 중대하는 것(그립 6.2 참조))를 기술하기 위하여 Fuoss 와 S t rauss(6.2) 는 식 6-22 를 제안하였다. TJs p/ C= A/ (l +BvC ) (6-22 ) 실험적인 파라미터 A 와 B 는 C/ T/ s p을 vC 에 대해 p lo t한 결과 에서 구해진다. A 는 용매환경에서의 용질인 다전해질의 차폐된 (shie l ded) 본성점성도([TJ ]co) 를 나타낸다. B 는 용질 분자간의 상호 작용을 반영하는 것으로 Yuan 둥은 이 값을 B=5.22 y1p/ a2( p는 단 위길이당 분자량, a 는 다가이온의 주축이 N 분절을 갖는 Gauss i an · Co i 1 형일 때 자유로이 움직이는 분절의 길이)로 표현했다 (6.3). 아 주 품은 다전해질 용액의 점성도로부터 가끔 식 6-22 의 A(=[TJ] °°) 값이 0 또는 음의 값을 나타냄이 관찰되었다. 이는 식 6-22 에 또 다른 과라미터 K” 를 도입시킴으로써 실험과 일치시킬 수 있다· TJs p/ C= A/ (l + BvC-K C) (6-23) 고분자 물질의 본성점성도[TJ]는 앞서 보여 준 [r;J =KM« 에서 고 분자의 분자량과 연관지어진다. 그러나 K 와 a 값을 알지 못하면 [TJ]에서 M 이 계산되지 않는다. (대부분의 실험은, 이와 반대로, lo g[TJ]와 M 의 관계에서 K와 a 를 구한다.) 또 다른 [77] 와 분자 량의 관계 는 Scherag a -Mandelkern 식 에 서 고분자의 침 강계 수와의
함수로 나타낸다. 一(10 0)麟 i 1 3 1l 尸 ]1 1 3( T1J o 내 I p) 국 ( a/b) 'Sc herag a- Mandelkern 과라 미 터 6 는 분자의 축비 (a/b) 의 함수이 다 . 따라서 알려 진 분자량을 갖 는 고 분 자의 본성 점 성 도와 침 강계 수 (s) 의 결과에서 분자 의 모양에 대한 정 보 (a/b) 가 얻어질 수 있으나, 8 값 이 a / b 의 값에 따 라 단지 약 간 변하기 때문에 여기서 구한 a/b 는 큰 의미를 갖지 못한 다. 예로, 편구형 타원체에서 a/b 가 1 에 서 200 까지 변 할 때 p는 단지 2,12Xl06 에서 2,15Xl06 으로만 변 한 다. 따라서 식 6-24 는 분 자의 모양 (a/b) 을 결 정하는 데 이용되 기 보다는 점성도와 침강계수에서 M 값을 추정하는 데 더욱 많이 활 용된 다. 이때에는 8 값 을 보통 2.20Xl06 을 사용하며, 이 방법에 의 해 구해진 분자량은 실제값과 10% 이내에서 잘 일치한다. 6. 1. 4 광산란 (Ligh t Scatt er i ng ) 용액 상 태의 고분자 를 규정하는 데는 분자량과 분자량 분포 이외 에도, 분자의 크기와 모양에 관한 정보가 필요하다. 분자의 크기는 보 통 관성 반경 (Radiu s of gyra ti on : RG) 또는 양끝간길 이 (end-to - end d i s t ance) 로 표시된다. 광산란 방법은 분자량은 물론, 관성반경을 축 정하는 가장 직접적인 방법 중의 한 가지이다. 광산란 실험은 보통, 그림 (6.3) 에 도시된 바와 같이, 주어진 파 장 (A) 의 빛이 시료에 의해 산란될 때의 산란광의 세기를 여러 각도 (0) 에서 측정함으로써 이루어진다. 개개의 입자에 의한 광산란은 입 자의 편국률(p ola ri zab ility) 에 의 존하며 , 각도 0 에 서 의 산란광의 세 기와 산란입자의 파라미터와의 상관관계는 용액의 농도~동(fl uc tu a· · ti on) 의 열역학적 이론 (6.4) 에 따라 다음과 같이 주어진다. 푼=占〔京 -+2B2C+ •••] (6-24 ) 여기서 K 는 광학적 상수로서 A, 용액의 굴절률 (n), 농도에 따른 굴절뮬의 변화 (dn/dc), 및 아보가드로수(N)로 다음과 같이 주어 진다.
 Fil te r to iso lat e
Fil te r to iso lat e
K= 꿉星 (dn/dc) 2 (6-25) B 2 와 C 는 각각 제 2v i r i al 계수 및 농도 를 의미하며, Ro 는 0 에서 의 산란광의 세기, 그리고 Po 는 산란인자 (sca tt er i n g fa c t or) 로서 8 에서의 실제입자에 의한 산란광의 세기와 Ra y le ig h 산란시의 산란 광의 세기의 비로 주어진다. 큰 입자(또는 거대분자)에 의한 광산란은 여러 산란중심 (윈자로 간주될 수 있다)에서의 기여를 모두 고려해야 한다. Brown 운동 을 하고 있는 분자 (또는 입자)에 의한 산란인자 (Po) 는 다음으로 주어진다. Pe= 畜접三 (6-26 ) N-4ft은r- s i n산(0란/2중) 심로의 정 의수된, 다R. i 1 는일반 산적란으중로심, hiR와 i fj는 간아의주 거작리은이 며값,이 며h ,는 s i n(hR i 1) 를 Ta y lor 전개륭 하면 식 6-26 은 다음과 같이 변형된다` Po= 꿉절절 h- 흑紅+ ... 〕 ::1- 걸느 RG2 (6-27) 이 식에서 분자의 관성반경 RG 는; RG2= 경 N1 TiE=` ' l lZ=Fj Ri j2 (6-28)
로 정의된 값이다. 식 (6-27) 은 Po 의 h, 즉 T41rs i n(0/2) 의 의존성 에서 RG 가 계산될 수 있음을 보여 준다. 만약 분자의 크기가 작아 hRH 가 너무 작은 값이면, Po 는 1 에 극히 가까운 값을 보이고, 따라서 정확한 RG 값이 Po 의 h 의존성에서 용이하게 산출되지 않 는다. 광산란에 의한 RG 의 측정은 RG 가 2 의 6% 이상(가시광선 의 경우에는 RG 가 약 80A 이상)인 거대분자에서만 유용하게 사 용된다. 광산란 방법에서의 분자량 측정은 앞서 보여 준 식 (6-24) 를 이용 한다. 식 (6-27) 에서 h= 챕 :._s i n(0/2) 을 대입하고 hR 너의 높은 항 울 무시한 후, 식 (6-24) 에 대입하면; 뚱 닉 (1 +~:~ sin 2 (0/2) ) 〔겅 ~+2B2 이 (6-29 ) 가 얻어진다. 식 (6-24) 는一K瓦C一 울 주어진 각도 (0) 에서 C 에 대해 도 시하고 c-o 로의 외연장한 절편에서 NE:Po;가 얻어짐을 보인다. 그러나 Po 는 분자의 모양에 따라 변하므로 분자량 阮 '0 을 알기 위 하여 Po, 죽 RG 값이 필요하다. 이는 적절한 분자 모델에서 계산 될 수 있으며, 이에서 阮 L0 을 추정할 수 있다. 식 (6-29) 을 이 용하여 분자의 모양과 무관하게 분자량을 구하는· 방법이 Z i mm 에 의하여 고안되었다· 이 방법은 그립 6.4 에서 보 여 주는 바와 같이, KC/Ro 을 o-o 빛 C->O 로 이중 외연장하는 것 이 다. KC/Ro 를 s i군 (0/2) +KC (K 는 임 의 의 상수로 그림 6. 4a 에 서는 1580 으로 선택)에 대해 여러 농도와 산란각도에서 도시한다. 예시된 그립에서 x 축과 거의 평행인 선들은 동일한 0 값에서 C 를 달리한 값이며, 빗금은 주어진 C 에서 0 값이 변한 경우이다. 여러 농도에서의 산란각이 • 0 으로 될 때의 KC/Ro 의 값들을 c-o 로 외 연장(그림에서 oo 로 표시)한 직선의 절편과 기울기에서 1/ .M.,와 2B2 가 각각 구해진다· 또한 여러 산란각도에서 c-o 로 외연장한 값들 을 다시 0->0 로 의연장하면 절편에서 1/ 阮;.,가 다시 확인되며, 기 울기에서 관성반경 RG 가 얻어진다. 후자의 외연장은 식 (6-29) 에 서 C=O 로 한 식 (6-30) 을 얻는 것과 동일하다.
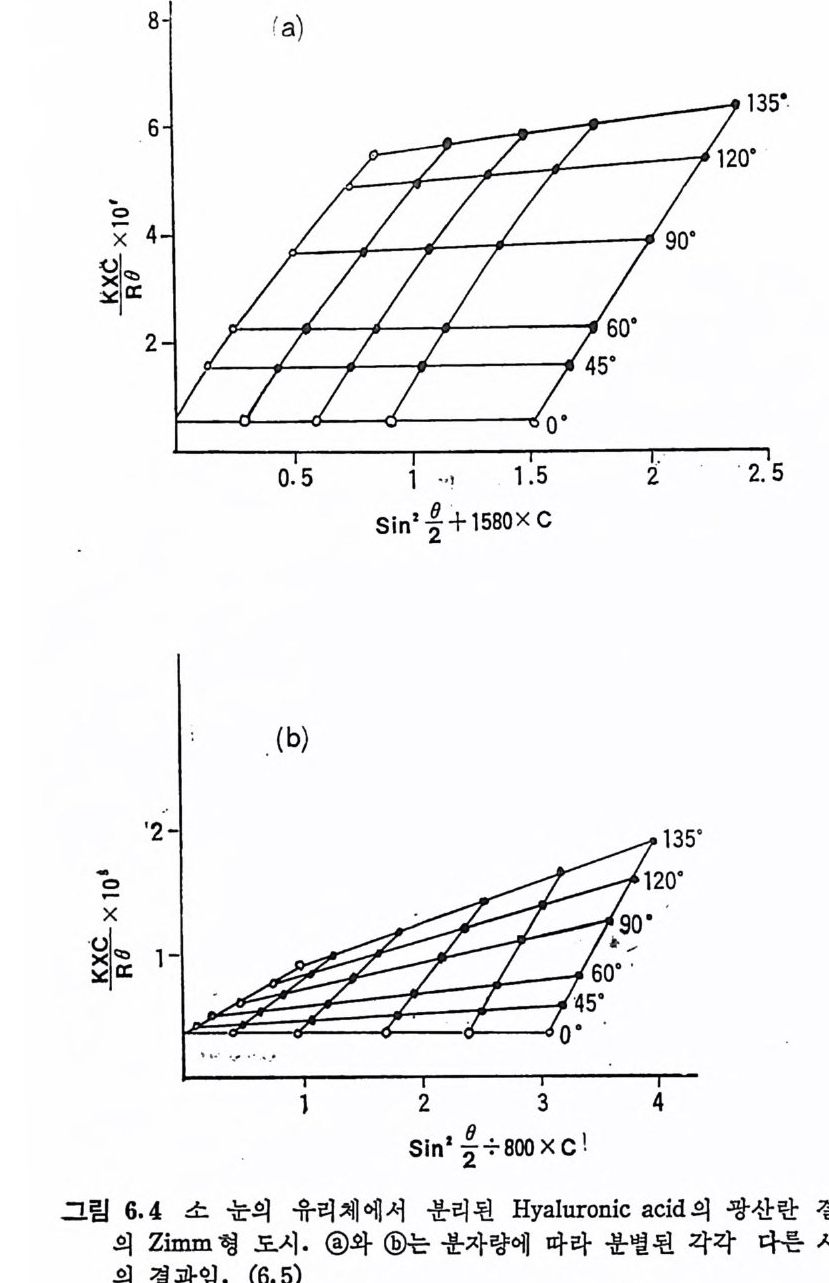 8-j ra)
8-j ra)
(KC/Ro)c-o= 습:〔 l+ 멸전 s i군 (8/2) 〕 (6-30 ) 그림 6. 4 의 data 를 독립 적 인 방법 에 서 얻 은 K 값, 4. 58 x 10-1 을 사용하면 (a) 에 서 는 M., 가 1. 7 x 106, RG 가 1430A, (b) 에 서 는 111 。 가 2,8Xl05. RG 가 54A 이 얻어진다. 광산란 방법에서 얻어진 관성반경을 분자차원에서 해석하는 것은· 분자의 모양에 따라 차이가 난다· 표 6.3 은 몇 가지 거시적 분자 모양에 서 의 RG 와 분자의 dim ensio n 과의 상관 관계 를 보여 준다.
표 6.3 관성반경과 분자모양의 관계 분자형태 1 관성반경 (R 이 설명 구 형 -,13j5 R R = 반경 장 구형 (p rola t e) 타원형 V(2+ 규 )/5a 축길이는 각각 2a,2a,r2a 막대 (rod- li ke) 형 L/-,11 2 L= 막대길이 임의 코일형 (random coil ) (ii2) 1/2/VT h= 양끝간 길이
이론상으로 광산란 방법은 분자나 입자의 크기와 분자량을 측정 하는데 광범위하게 사용될 수 있다. 그러나, 이 방법의 실재적 적 용은 분자의 크기에 따라 큰 제한을 받는다. 큰 분자의 경우에는 ` 식 (6-27) 에서 높은 항을 무시하였기 때문에 각도에 따른 산란광의 세기, 즉 분자의 모양을 충분히 나타내지 못한다· 또한 이 식은 h-+O, 죽 0 一 0 에서는 큰 분자에서도 잘 성립되나, 이와 같은 낮은 각도에서의 산란광의 측정은 실험상 거의 불가능하고, 따라서 정확 한 RG 의 계산이 용이하지 않다. 이와는 반대로, 작은 분자에서는 앞서 언급한 바와 같이 Po 의 각도 의존성이 적어 RG 의 산출이 또 한 어려워진다. 이들 문제를 해결하는 한 가지 방법은 짧은 과장의 빛 (下논} 커진다)을 사용하는 것이다. 용매나 용질 분자는 UV 또는 진공 UV 영역의 빛을 흡수하므로 이들은 광원으로 사용될 수 없으며, 대신에 X- 선을 보통 사용한다. X- 선 산란은 보통의 가시광선 산란에 비해 각도 조준아 극히 용 이하여, 아주 낮은 각도에서의 산란도 비교적 정확히 측정된다. 따 라서 산란광의 세기를 o-o 로 외연장하는 것이 용이해진다. 〈낮은 -
각도 X- 선 산란 (Low Ang le X-ray Sca tt e ri n g)〉이 라 불리는 이 방법 에서의 산란 중 심은 분자의 전자들로 간주될 수 있으나, 분자량과 관성반경의 계산은 광산란과 거의 감은 방법으로수행된다. 즉 분자 량은 0=0 에서의 산란을 c-o 으로 외연장함으로써 얻어진다· 또한 RG 는 산란광의 각 도 의존성에서 보통의 광산란과 같은 방법으로 구할 수 있다· 그러나 보통은 약간 다른 방법에서 직선 그라프 상 에서 구하는 것이 시도된다. 이는 식 (6-27) 의 처음 항이 ¢ ERc2/ 3 의 전개에서와 같음을 이용하여, P 。 ::e- h. 'R 군 / 3 으로 두고 In(Po) 와 sin 2 (0/2) 의 그래프의 기울기에서 RG2 를 구하는 것이다. lnPo= -h2RG2/3 = -1~6 군 RGs2 in2 (0/ 2) (6-31) 낮은 각도 X- 선 산란은 광산란에서는 쉽게 측정되지 않은 RG 가 10A 정도인 분자의 과라미터들도 정확하게 얻어진다· 또한 확장된 입자의 단면적이나 단위 길이당 무게를 결정하는 것도 가능하다· GAG 는 물론, 다른 생물고분자의 분자 파라미터들은 지금까지 언급된 삼두압, 점성도, 침강속도와 광산란 방법이외에도 전기영동 법 (electr o p h oresis ) , 유동복굴절 (flow bir e fr ing e nce) , 전 기 이 색 법 (elec _ tric dic h rois m : 전장에 서 분자가 배 향하는 성 질 이 용)등의 여 러 유체 역 학 적 방법에 의해서도 측정된다. 이들 방법 밋 지금까지 언급된 내용 의 보다 구체 적 인 기 술은 생 물물리 화학 (b i o p h y s i cal chemi st r y ) 에 관 한 참고문헌 Rl 과 R2 에서 볼 수 있다· 그리고 X- 선 회절 및 분광 학적인 방법에 의한 분자 구조의 연구방법은 제 7 장에서 기술된다· 6. 2. Glyc o sami no g ly c an 의 분자 파라미 터 6.2.1 일반적 경향 GAG 들의 분자량은 일반적으로 이들 다당류를 분리한 조직은 뭉 론 분리 방법에 따라 크게 다르다. 동일한 조직일지라도 이에서 분리된 GAG 들의 분자량이 모두 동일하다기보다는 크게 분산되어 있다. 표 6.4 는 GAG 들의 분자량과 크기에 관한 몇 가지 자료를 정
리한 것으로, GAG 의 분자량이나 크기에 관한 완전한 자료를 제시 하는 것은 아니며, 앞서 언급된 GAG 의 분자량의 광범위한 분산 성 (p ol y d i s p ers ity)을 재 확인 하고, 이 들의 일 반적 인 경 향을 제 시 하는 데 그 목적이 있다. 표 6·4 는 동일한 시료에서 얻은 GAG 로부터 분별한 Ch 4- S 와 DS 의 분자량이 측정 방법에 따라 크게 차이가 남을 보이고 있다. 일반적으로, 균일한 분자량은 분자량의 정의, 예로 수 평균 분자 량 (Mn) 과무게 평군분자량(同.,)에, 무관하게 동일한 값을 나타낸 다. 그러나 다분산된 물질에서는 큰 분자량의 분자가 阮 ;o 에 크게 기여하여 항상 阮 ;o( 보통 광산란밋 초원심분리로 측정)이 lWn( 삼두 압으로 측정)보다 큰 값을 보여준다. 이 두가지 평균분자량의 차이 는 분자량의 분포정도를 반영한다고 볼 수 있다. GAG 는 분자량이 크게 분산되어 있다는 점에서, 같은 종류의 분자는 거의 동일한 분 자량을 갖는 단백질과 대조적이다. GAG 분자들의 용액상태에서의 크기가 ·모 양을 반영하는 몇 가지 유 체역학적 과라미터를 표 6.5 에서 볼 수 있다. 이 표는 많은 시료 의 경우, 분자량이 각각 다른 부분을 개별적으로 측정한 결과를 종 합한 것 이 다. 따라서 , so, no 및 [TJ] 값들의 하한선은 가장 적 은 분자량 부분을, 그리고 상한선은 가장 큰 분자량을 갖는 부분의 결 과를 나타낸다· 표 6.5 는 HA 와 Ch 4- S 는 점성도의 모양인자 a 가 o.75 에 가까운 값을 가침을 보여 준다. 이는, 이들 다당류가 사용 된 용액 조건하에서는 임의코일 (random co il)형을 하고 있는 것으로 해석될 수 있다. 반면에 다른 다당류들의 a 값은 확장된 막대형 (e xt ended rod) 으로 간주될 수 있는 a=l 부근의 값을 보여 주고 있다. GAG 는 물론, 대부분의 다전해질의 유체역학적 성질은 보통 염 (sal t)의 존재 하에서 측정된다. 특히, 점성도 측정에서는, 그립 6.2 에서 보듯이, 전기점성 (elec t rov i scous) 효과로 인하여 낮은 염의 용 액에서는 환산점성도(T/ s p /C) 가 C 가 감소할수록 급격히 중대하여 [1)]의 계산이 어 렵게 된다. 낮은 염 용액에서의 희석에 따르는 1J,p/ C 의 중가는, 다전해질 분자의 이온화 정도가 낮은 이온농도의 용액 에서 중대되고, 따라서 음이온 자리간의 정전기적 반발력이 중대되
epaShL sdEiopill anoRdm col i R5-o,nra2d -0 domc o 84l0 i da-8R, r0-no4 70mdo c 0oi l o04mnaRd -0 10oc0l 0 i moaRnd Icoi oR0020540- 1304
3R . 조 참d n/dc660. 1)(6mµ 546 .1064(56 m찌 은yy(aaol c 63s 1l2aR .4nG5 D)a.cnotp p.img 미의표터리 적 물 의파 참헌라고문 c Aciidychl oasacderPruce iSo e Mud micT eMunhen qiw M yy o84.Xrso0 V dH1 6u obleuac oi0UP-/.M 0Oni6tr cdaiLSMl.C Oa NI 0.3x -5 1 55 2CaNlM. 0 L S7『x1.7 X0 6l7. 1u s-x10o1l aCN 2M. 0. 51x 8 0.l3l0x5-L+S U X6 0l 31 .5 0 17 .2x。 u -l3X55 0xl0U roc aldc-55bmili+SL U 8xl06 5_x310 S dvl ao+LSiful iUny 0051 xl_ 501x 5.4yvOs canar t.i。 6l0 X2 .1X 140lr Sl-O PM1 .0s cuoVccoettp 7lx-5 04.01 llXsa4-na 10e S1noL B noodr no4+hC.0IP +5Mtiivi ca ear CIaNM.20litg tefauls-궈 lL .lfQ xLQ51- 1l0 x 3 1,-844 S
ip。 (1Egm)
a . 780.67 02 0 .1 0.82. 7806.0 7.74 04 11. 41 1. 4o7 .00 . 1 00. 1
yy표im o5osa.n6aG c cll 유 학 n역미적제과의리 )3R터 (g , 426 p. nnsoeeaSnu- omddiiiossVfcfttiii yt vw.M,020X s31 01W0xD,X0 w1207.[}] 1 -•10enoesS(vlS(uc2c/Kem roc ce) s) ae atl Md(/Xm// /mK(itr) gg )l가O 21-7I.6 5707-M02Cy. 7a 4.1N.4e0o 3r.uV-n4 .2r 5Ho7a-24ls.5u3i. t6i c 1. 3 -4;P0H. O 2M 15 371 - .03pbkbn saRda9i t.69- 5 i97ci.5 1. 2.7-1Rskbn ab03 .0iit 65-10aC 2 lN .1M- .67391cUm .or db218 .2. 11.165-.a M5N0I CUmb . 3r8.1 doc65-l1 HN.O1 C Io9 2.9 .-.1rd5c7b 9 2m.U 1. 7 .8;aH N.MC0l.I6.10 61 041. bc o03p o Rmreost 5.2 6hW 1.0 52.11 eal690. lC N M2 0.caera6 0a.5Chndonro gilttii 78 4 - .0+!aC NM.2 0. raC0 5173 0.13 .2-9a. .1 eie4 s-ullgttafM -43P Q 4-7822.0 .53ka .7 h 0.95. -3I2Scr 00 44rl Ca 0 NM 2.06 ea.5a-4dnohCn rgl .tio11. iti .2-42. 4-2392 6 . 6-9.0l Ca 0 3. N223M02.0- 1. 80l. .50 0aNsl 1.e as elsu6- tapatf 1-53aNM2.0.1C 5 I+lB1eenuf . nmerDag at rOPM2.ou elstaf 6-1.45 .971--08.08 .207 5 . -51265.01-7.4 .901.NM2.0 ICaneorC.1a naaerKt .524--40 .0 94 0.0852o.1 laC NM.lO65 eeB1nluf u .ls e gtfa .47 15-0210 3 9.144.2.0-630...11576 o0. NM.-l O8 8 lCaeeBluf .1n nareH gip 8.9-2. 6-2-01.2 -251 3. 5 6.0-89 40. 5oa. 1V. 1us ir a .80, 1량자분의료시1 인0 .임과결어 다가이온이 더욱 〈확장된 딱딱한 막대형〉을 갖게 되는 것으로 해 석된다. 그러나, 염의 첨가는 다가이온에 반대이온이 회합되어 이 온화 정도가 감소되어 전체적인 분자 모양에 영향을 준다. HA 와 Ch4 · -S 가 임의 코일형을 갖는 반면에 HP 가 〈딱딱한 막대형〉을 갖 는 것은 이들 다당류간의 전하밀도의 차이로 해석된다. 유사한 전 하밀도를 갖는 Ch4 -S, Ch6-S 와 DS 의 모양 (a 값에서 추정)의 차 이는, 고분자 사슬의 주축에서의 전하 분포의 차이(이온화된 기능 기의 위치 차이)에 의한 것으로 볼 수 있다. 용액의 이 온강도 (µ) 와 [까간의 관계 는 보통 Hermans 의 식 인 [7J] 와 1/VT 의 직선관계로 나타난다. 〔7J]의 이온강도에 대한 의존성 은, 식 (6-20) 과 연관지워, 관성반경 또는 분자의 유제역학적 부피 가 이온강도에 따라 변하는 것으로 설명된다. 용액중의 다전해질 분자의 유체역학적 성질은 용액의 p H 에 따라 서도 변한다. 이는 다당류의 이온화되는 기의 산―염기 평형(해리) 이 용액의 p H 에 따라 변하고, 이에서 다가이온의 전하밀도가 변하 기 때 문이 다. GAG 의 uronic ac id 의 PKa. 는 3~4 이 다. 따라서 GAG 의 점성도나 유체역학적 부피는 중성용액보다는 산성용액에서 적은 값을 가질것이 기대된다· 그러나, 전체 분자의 전하밀도에 대 한 coo_ 기의 기여가 적은 HP 에서는 유체역학적 성질에 대한 pH 의 영향이 거의 관찰되지 않는다. 6. 2. 2 Hy a luron ic Ac id. Hy al uronic acid 는 다른 GAG 들과 마찬가지 로 중성 용액 이 나 조 직 내 에 서 는 이 온화된 다가이 온으로 존재 한다. 따라서 (hya luronate > 라 부르는 것이 화학적으로는 보다 정확하나, 이 다당류를 관습적 으로
과 탯줄에서 분리되며, 탯줄에서 얻어진 HA 는 다른 조직원에서 분 리된 시료에 비해 분자량이 적다. HA 의 수용액에서의 유체역학적 성질은, 이 다당류의 생물학적 기능과 연관지어 오랫동안 큰 관심 의 대상이 되었다. HA 의 가장 큰 유체역학적 독성은 큰 유체역학적 부피를 갖는다 는 것과, 용액이 점 탄성 (vi scoelas ticity)을 보인다는 것이 다· 그림 6·5 는 HA 의 유체역학적 부피를 다른 생물 고분자의 부피와 비교 한 것이다. HA 분자는 수용액에서, 용액조건과 분자량에 따라 차
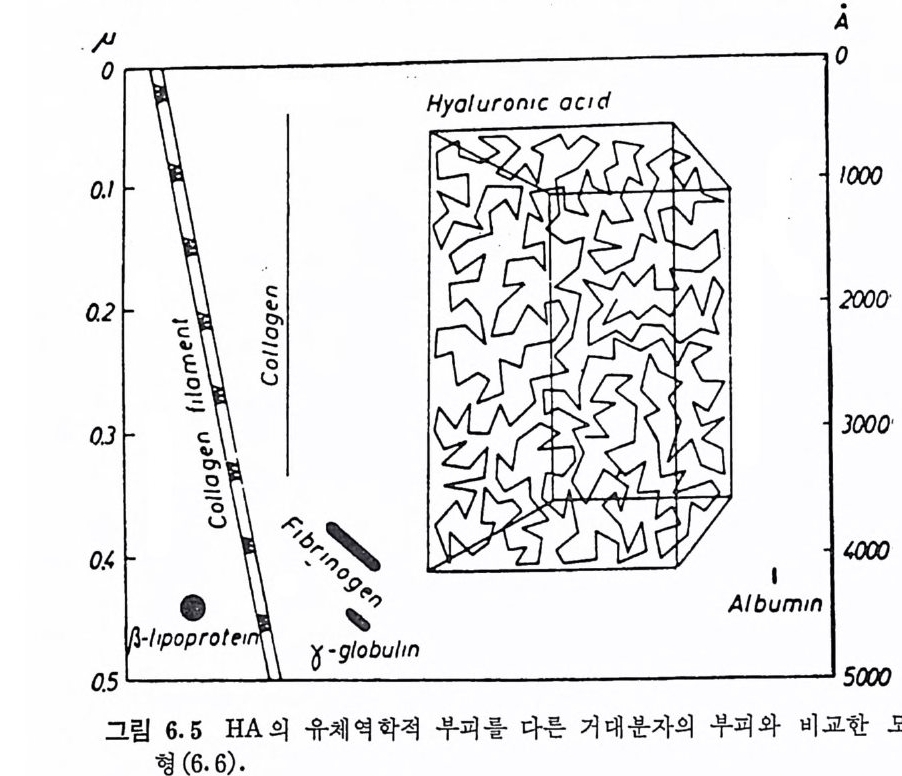 。
。
이 가 있으나, 2000~4000A 의 관성 반경 을 갖는다. 이 값은 건조된 ·1g r 의 HA 가 용액 에 서 는 1000~2000cm3 의 부피 를 차지 하는 것과 마찬가지다. 따라서 HA 는 용액에서 자신이 차지하는 부피에서 다 른 거대분자를 배제시키는 역할을 할 것으로 짐작된다. 다른 GAG 둘은 HA 에 비 해 월등히 적 은 배 제 부피 (excluded volume) 를 갖는다龜
그러 나 pro te o g ly c an 은 조직 내 에 서 HA 와 유사한 배 제 효과물 나 타낸다 . HA 의 큰 유제역학적 부피 때문에, HA 의 사술은 HA 농도가 1~ lOm g /ml(0.1~1% )에서도 서로 엉기기 시작하며, 더욱 높은 농도에 서는 개개의 분자 사슬이 구별되지 않는 연속적인 고분자망을 형성 하며, HA 용액은 점탄성을 보인다 (6.7) . 즉, 낮은 변형주파수 (s t ra i n fr e q uenc y)에서는 HA 용액은 거의 점성의 성질을 보이나, 높은 주 과수에서는 탄성을 나타낸다. HA 용액의 탄성은 농도가 증대할수 록 더욱 증가한다. pH 2.5 부근에서의 HA 용액의 탄성은 중성용액 에서보다 월등히 큰데, 이는 HA 분자가 pH 2.5 부근에서 더욱 강 직해지는 것으로 해석퇴었다 (6 . 8). HA 의 이같은 유동학적 성질이 여러 변형주파수가 작용하는 관절의 기계적인 기능에 중요한 몫을 하는 것으로 설명하고 있다. - 용액중에서 HA 사슬이 서로 엉기는 것은 HA 의 침강속도의 실험 에서도 관찰된다 (6.5). 분자량이 다른 HA 분자들은 움은 용액에서 는 각각 다른 속도로 침 강하나, HA 농도가 2mg /m l 이 상에 서 는 HA 분자의 침강속도는 상대적으로 감소하고 분자량에 무관한 것으 로 관찰되었다. 따라서 높은 HA 농도에서는 전체의 HA 망이 다공 성 마게 (pl u g ) 형태로 초원심분리관을 통해 움직인다고 해석된다 . 움은 HA 용액의 물리화학적 성질에 관한 연구는 많은 연구자들 에 의해 수행되었다. 이들은 HA 분자의 대부분이 약간의 강직성 (s tiff ness) 을 갖는 임의코일형으로 존재한다고 결론지었다. HA 사슬 의 어느 정도의 강직성은, 분자량이 적은 분자에서 더욱 크게 기여 할 것이 예상된다. 이는, 표 6.5 의 토끼피부의 HA 가 분자량이 3.1 Xl05~1.5x106 범위에서는 점성도인자 a=O.76 으로 임의코일형으` 로, 그리고 분자량이 1Xl04~7,2 Xl04 에서는 a= l. 20 으로 확장된 막대형으로 존재한다고 간주될 수 있다는 실험결과와 일치한다. HA 용액 의 낮은 각도 X- 선 산란은 HA 분자가 4~6nm 의 존속길 이 (pe r-sis t e n ce len gt h) 를 갖는 〈 worm li ke 〉사슬로 존재한다는 것으로 해석 되었다 (6.9). 단백질이나 핵산에서 관찰된 나사선 구조와 유사한 〈질서된 상태
(ordered s t a t e) 〉가 GAG 분자에 서 도 존재 하는가에 대 한 해 답은 오랫 동안 이 분야에 관여하는 연구자들의 큰 관심의 대상이 되었다. 더 우기 HA 의 고체상태 (주로 섬유상태)의 X- 선 회절 결과(제 7 장 참 조)가 HA 의 나사선 구조를 지지한다는 보고가 있은후, HA 분자는 용액에서도 나사선 구조를 갖는 것으로 추측되었다. 많은 연구자들 은 HA( 물론 다른 GAG 도 연구대상이 되었음)용액의 pH , 염, 온 도 등의 용액조건의 변화에 따르는 점성도나 광학적 성질(예로, CD 및 ORD) 의 변화를 이 다당류의 〈질서 (order) ―무질서 (d i sorder) 〉형 전이 (tra nsit ion ) 로 해 석 하였 다. GAG 용액의 점성도는 p H 에 따라 민감하게 변한다. 이는 이 온 화된 coo- 기의 양성자 첨가 (COOH 가 됨)에 따른 전하밀도의 감소 로 충분히 설명될 수 있다. HA 용액의 점성도는 p H 가 중성범위 에서 3.5~2.5 로 감소할 때 급격히 감소하며, 이는 GlcUA 의 COOH 기의 PKa 와 거의 일치하는 pH 영역이다· 또한 ' HA 용액의 p H 를 중성에서 12.5 로 중가시킬 때 HA 분자의 분자량은 감소하지 않으 나, 점성도와 관성반경이 크게 감소하는 것이 보고되었다 (6.10). Math e ws 는 이 결과를 glu cosami ne 의 C-OH 의 해 리 에 의 해 중성 용액의 〈질서된〉 구조가 불안정해져 가역적인 구조변화가 일어난다 고 설명하였다. HA 의 용액의 p H 를 7.O 에서 7.5 로 중가시킬 때 낮은 shear 속 에서 측정된 용액의 [r;]가 10 배까지 증가되며, 이를 협동적인 구조 전이로 설명한 연구 결과가 보고되었다 (6.11). 그러나, 이 p H 영역 에서는 침강속도나 분몰부피 (pa rti al molar volume) 의 변화는 관찰되 지 않는다· 또한 다른 방법 으로 측정 된 HA 의 [r;]는 상기 pH 영 역 에 서 아무런 변화가 관찰되 지 않았다. 따라서 pH 7. 0~7. 5 에 서 보고된 협동적 구조전이는 의문의 여지가 크다. 실제로, 순수한 HA 분자는 이 pH 영역에서 구조전이를 유발할 여하한 화학적 변화도 고려할 수 없다. HA 의 수용액에서의 분자 구조에 대한 보다 명확한 실험적 증거 는 Park 과 Chakrabarti 의 연구에 서 볼 수 있 다 (R4 ) . 이 들은 HA 용액의 점성도와 광학적 성질을 pH , 에타놀의 함량과 온도등을 변
화시키면서 관찰하였다. HA 용액의 〔까는 주어진 이온강도에서는, 중성용액에서보다 산성용액 ( 특 히 pH 2.5) 에서 작은 값을 보인다· 그리고 에타놀이 함유된 pH 2.5 인 수용액에서의 [까값은 물에서보 다는 적은 값이나, HA 의 농도가 증가할수록 용액의 점성은 급격 히 중대 되 어 〈 g el 〉 과 같은 상태 에 이 른다. HCONH2 와 같은 〈수소 결합 파괴제 〉를 산성 에타눌-물 혼합용매에 첨가하면 HA 의 [1J] 는 증가하고, 높은 HA 농도에 서 의
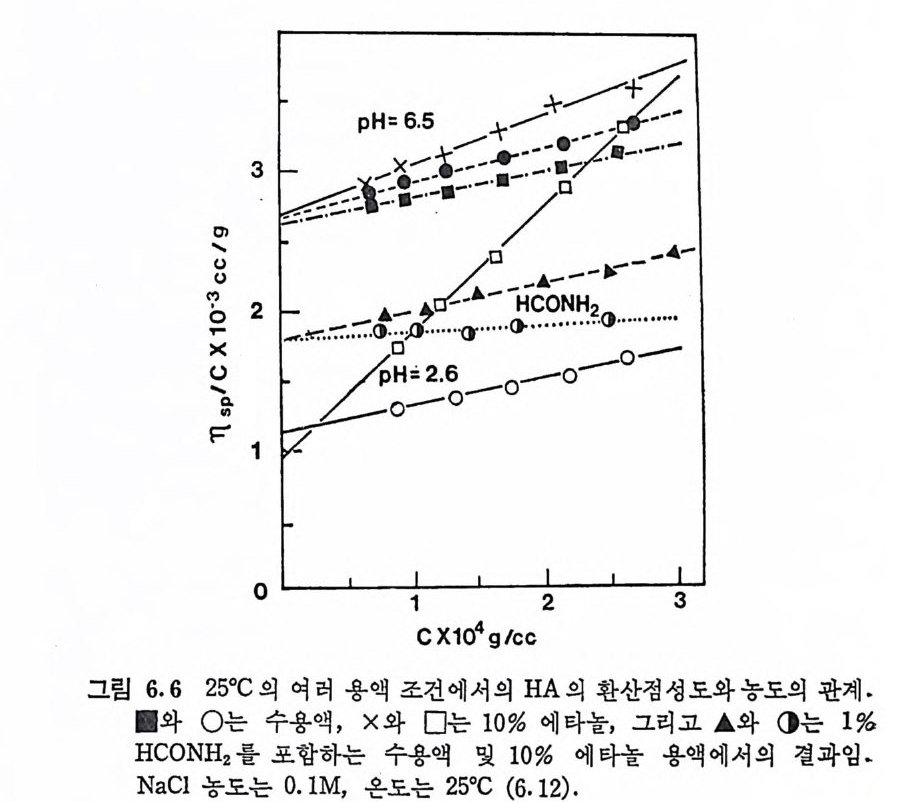 6`uu
6`uu
조는 고제 상태의 X- 선 회절에서 관찰된 것으로 모두 분자내 수소 결합을 동하여 안정화되었다. HA 의 구조는 제 7 장에서 보다 상세 히 언급된다. 6. 2. 3 Chondroit in s ulf ate s HA 의 분자량이 106 단위 인 반면 에 , chondroit in sulfa tes 등 다 른 GAG 들의 분자량은 보동 5Xl04 이하이다. 따라서, 이들 다당류 용액의 점성은 HA 용액에 비해 아주 낮다· 표 6.5 에서 볼 수 있듯 이, 높은 염 용액에서의 Ch4-S 의 본성점성도([까)와 분자량은 [7J] = 3. 2 X 10-4M0 74 의 관계 를 따른다. Ch-4S 와는 달리 Ch6-S 는 [7J] =(0.05~0.065)xM i. 14 의 관계를 보인다. CS 의 [까와 분자량의 상 관관계 는 Ch6-S 가 Ch4 -S 에 비 해 더 욱 확장된 구조를 갖는 것 으로 해석될 수 있는데, 분자량과 전하밀도가 거의 동일한 Ch4-S 와 Ch 6- S 가 어떤 구조적 요인에 의해 이와같은 차이를 나타내는지는 확 실하지 않다. GlcNAc 부분의 0- sul fati on 의 위치의 차이로 인한 단당류간 연결의 회전성이 입체적으로 방해를 받는 정도에 차이가 날 수 있다· 또한 0-sulfa tion 위치의 차이는 다당류 사슬의 2 차 구조의 변화를 초래하고, 이들에서 분자사슬의 유연성이 변화될 가 능성도 있다. Ch 4- S 와 같은 적은 분자량을 갖는 GAG 분자 사술의 강직성은 Cleland(6.13) 의 실험에서도 계시되었다. 평군분자량이 1Xl04~2X 1 어 인 HA, HP, CS 및 Na-CMC (sodiu m carbox ym eth y lc ellulose) 의 점성도 실험에서는 다당류의 종류에 무관하게 모양인자 a 값이 1.0 이 얻어졌으며, 분자량과 본성점성도는, lo g[7J〕.財걀 =2.07+2.Olo g (2n)(n 은 중합도)의 상관관계를 나타내었다. CS 의 침강상수와 분자량은 sO20,.,=2.3X10-2M0 · 44 의 관계가 있 음이 보고되었다 (6.14). 이와는 대조적으로, Tanaka 는 0.2M NaCl 용액에서의 Ch 4- S 와 Ch6-S 의 s 남을 Ml/2 에 대해 도시하 면 직선관계가 얻어지고, 절편은 양의 값을 가짐을 보고하였다 (6. 15). 이 결과는, CS 의 2 차구조가 반유연성 (se mifl e xi ble) 코일을 하 고 있는 것으로 설 명 되 었다. 〈 worm li ke 〉모델에 의 한 Ch4 -S 및 Ch
6-S 의 존속길이는 각각 5,0 럿 4.8nm 로 계산되었다. 6. 2. 4 Hep a rin HP 은 항응고작용과 같은 약리적 특성으로 인하여 많은 물리-화 학 적 연구의 대상이 되었으며, 이 결과는 최근에 Ehr li sh 와 Sti va la 에 의해 정리되었다 (6.16). HP 은 여러 포유동물의 조직에 널리 분포되어 있으며, 동물에 따 른 HP의 분자량 및 유체역학적 파라미터들을 표 6,6 에서 정리하 였 다. 이 표에서 f/fs p는 HP 분자를 타원체로 가정했을 때의 마찰 계수(f)와 이 타원체와 동일부피를 갖는 구형의 마찰계수(f‘p)의 비이다. 이 바를· 표. 6,2 의 분자모양과 마찰계수와의 상관관계와 연관지으면, HP 분자는 용액에서 축간의 비 (b/a) 가 약 20 : 1 인 타
표 6. 6 몇 가지 Hepa rin 시 료의 물리 화학적 상수 (6.17) 동물 죠x . 야lO탑 : ) D02x0,1 w 0 (- C1! I2l/s ec) M.W. f/fsp * o* x l0 -13 Hog 2.10 8.51 12,000 1.93 0.49 Beef 2.1 5 8.21 12,800 1. 95 0.52 Dog 2.38 6.84 16,000 2.16 0.65 Sheep 2.29 7.32 15, 200 2.07 0.56 Human 2.27 6.29 15, 000 2.18 0.54 * f/fsp 밋 6 는 본문 참조
윈체로 존재하는 것으로 간주된다. 이는 HP 사슬이 비교적 크게 확 장되어 상당한 강직성을 보이는 것으로 해석된다. 8 값은 침강계수 의 표준편차로 정의된 값으로 HP 의 분자량이 크게 분산되어 있음 울 보여 준다. HP 분자는 수용액에서 다른 GAG 분자와마찬가지로 다가이온형 태로 존재하며, HP 의 농도에 따른 점성도 변화는 이미 그림 6.2 에서 보여준 바와 같은 전형적인 다전해질의 거동을 보인다. Lib e rt i 와 S ti vala 는 식 6.23 을 이용하여 여러 분자량의 HP 시료에 대한 [1J ]00 를 구했다 (K=0.25). HP 의 점성도의 모양인자 a 는 물에서
1. 59, 0. OIM NaCl 에 서 1, 13, 0. IM NaCl 에 서 1. 00, 그리 고 0. 5M NaCl 에서는 0.90 의 값이 얻어졌다 (6.1). 또 한 식 6.23 의 [1J ]OO 값 은 용매의 유전상수 (d i elec t r i c cons t an t)의 중가에 따라 중가하나, 상 호작용을 나타내는 파라미터인 B 는 유전상수에 무관 함 을 보였다 (6.18). HP 의 점성도 결과는, 이 다당류가 염이 존 재하지 않 을 때 는 확장된 형태도 존재하나, 높은 농도의 염이 존재하여 다당류의 전하가 효과적으로 차폐되면 〈 Gauss i an 〉코일 형 태로 존재하는 것 으로 해석되었다. 용액의 p H .에 따른 HP 용액의 점성도는 pH 2.0~3.3 사이에서는 [1J]값이 크게 변하나, pH 3.3 이상에서는 [1J]값은 p H 에 거의 두 관하다. 이는 음이온 (S03-,coo- )간의 정전기적 반발력에 의한 HP 사슬의 팽창은 대부분 S03- 기에 기인되며, COO- ( COOH 의 PKa::::4) 의 중화는 HP 분자의 전하밀도에 큰 영향을 미치지 않는 것을 나 타낸다· (HP 분자의 S03-/C00-의 비 는 약 3 이 다) . 6. 2. 5 기 타 gly c osam ino g ly c ans HPS, KS 및 DS 의 크기나 유체역학적 성질에 관한 연구는 이들 의 분자량 빛 기본적인 과라미터의 결정 (표 6.4 및 6.5) 등에만 국한 되어 있는 실정이다· R*l .추 C천. R문. 헌C anto r and P. R. Sch imme l, Bi op h y s i c a l Chemi st r y : Part J I ► Techniq u es for the stu d y of biolo g ica l str u ctze r e and fun cti 01z , W. H. Freeman & Comp . San Franc isc o. (1980) (생물 분자의 구조와 기능을 규명하는 방법에 대해 완벽하게 기술하 고 있으나, 내용은 상당히 어렵다). R2. K. E. van Holde, Phys ica l Bi oc hemi st r y, Prenti ce -Hall, Eng le wood,. N.J. (1971) (생물물리화학의 기초을 취급하고 있다.) R3. F. A. Bett elh eim , Phy si c a l chemi st r y of aci di c po lys a ccharid e s, in: . Bio l og ica l Polye lectr o lyt es , ed ited by A. Veis , Marcel Dekker,
N.Y (1970) (Acid i c po lys a ccharid e s 전 반에 대 한 물리 화학을- 취 급) R4. B. Chakrabarti and J. W. Park, Giy co sami no g ly c a ns: Str u ctu re and int e r acti on , CRC Rev. Bi oc hem. 8, 225~312(1980) (유체역학적 성질도 Rev i ew 되었으나, 이보다는 7 장 럿 8 장의 내 용이 주를이룬다) * 인용문헌 6. 1. P. A. Lib e rti and S. S. Sti va la, Phy si o c hemi ca l stu d ie s of frac ti o- nate d bovin e hep a rin . II . Vi sc osit y as a fun cti on of ion ic str e ng th, Arch. Bio c hem. Bi op h y s. , 119, 510(1 9 67) 6. 2. R. M. Fuoss and U. P. Str au ss, The vis c osit y of mi xt u res of po lye l ectr o lyt es and sim p le electr o lyt es , A1111. N. Y. Acad. Sci. , 51, 836 (1949) 6. 3. L. Yuan, T. J. Doug h erty and S. S. Sti va la, A. sem i-em p irica l- ap pro ach to the vis co sit ies of po lye l ectr o lyt e soluti on s, ]. Polym er. Sci. , (A2) , 10, 171 (1972) 6. 4. P. J. Deby e, Analys i s of scatt er in g by fluc tu a ti on the ory : a bit spe ci al iz ed , ]. Phys . Chem., 51, 8(1951) 6. 5. T. L. Laurent, M. Ry a n and A. Pie t r usz kie w i cz , Fracti on ati on of hy al uron ic aci d: The po lyd isp e r sit y of hy a luronic aci d from the bovin e vit reo us humor, Bi oc him . Bi op l zy s. Acta , 42, 476(1960) 6. 6. W. D. Comp e r and T. C. Laurent, Phy si o l og ica l fun cti on of conn- ecti ve tiss ue po lys a ccharid e s, Phys i o . Rev., 58, 255(1978) 6. 7. D. A. Gib b s, E. W. Merril, K. A. Smi th and E. A. Balazs, Rhe . olog y of hy al uronic aci d, Bi op o ! ym ers, 6, 777(1968) 6. 8. E. A. Balazs, The ph y si c a l pro p e rti es of s yn o 쩌 al flui d and the- sp e ci al role of hy a luron ic aci d; in: Di so rders of Knee, edit ed by J. Helf et, Lip pino tt , Phil a delph ia, 1974, p. 63~75 6. 9. R. L. Cleland, The pe rsis t e n ce leng th of hy a luronic aci d: an esti - mate from small ang le X-ray scatt eri n g and int r i n s ic visc osit y, Arch. Bi oc lzem. Bi op h y s. , 180, 57(1977) 6. 10. M. B. Math e ws and L. Decker, Confo r mati on of hy al uronate in neutr al and alkali ne soluti on s, Bi oc lzim . Bio plz y s. Acta , 498, 259(1977) 6. 11. T. W. Barett and R. E. Harrin gton , Low velocit y gra d ien t flow
bir e fr ing e nce and vis c osit y chang e s in hy a luronate soluti on s as fun cti on of pH , Bi op o l ym ers, 16, 2167(1977) ·6. 12. J. W. Park and B. Chakrabarti, Op tica l pr op e rtie s and vis c osit y of hy a luronic aci d in mixed solvents : Evid e nce of con for mati on al tra nsit ion , Bi op o l ym ers, 17, 1323 (1978) ·6. 13. R. L. Cleland, Ion ic po lys acchari dE S. N. Free-rota t i on dim e nsio n s for dis a ccharid e po lym e rs. comp a ri so n wi th exp e rim ent for hy a luron ic acid , Bio p o l ym ers, 9, 811(1970) ·6. 14. A. Waste s on, Prop e rtie s of frac ti on ate d chondroit in sulph ate from ox nasal sep ta, Bi oc hem. ]., 122, 477(1971) ,6. 15. K. Tanaka, Phy s ic o chemi ca l pro p e rtie s of chondroit in sulf at e . JI . Molecular weig h t dep e ndence of int r i n s ic vis c osit y and sedim enta t i on coeff icien t, and analys is as a sem i-flex ib l e coil , ]. Bio c hem. (Toky o ), 83, 655(1978) :6. 16. J. Ehrlis h and S. S. Sti va la, Chemi st r y and ph armacolog y of hepa rin , ]. Plzarm. Sci. , 62, 517(1 9 73) ·6. 17. G. H. Barlow, L. J. Coen and M. M. Mozen, A bio l og ica l, chem- ica l and ph y si c a l comp a riso n of hep a rin from dif fer ent mammali an spe ci es , Bi oc him . Bi op h y s . Acta , 83, 272(1964) '6. 18. L. Yuan and S. S. Sti va la, Vis c osit y of hep a rin as a fun cti on of diel ectr ic consta n t and of desulfa tion , Bi op o l ym ers, 11, 2079 (1972)
제 7 장 Glyc o sami no g ly c a ns 의 구조 및 광학적 성질 고분자의 유체역학적 성질의 연구는 이들의 분자 과라미터들인 분자량이나 거시적인 분자 모양에 관한 정보를 제공함을 제 6 장에 서 언급하였다. 그러나, 유체역학적인 성질의 연구는 보통 아주 ~ 은 용액에서 수행되며, 더우기 대부분의 경우는 무한히 붉은 용액 (C-O) 으로의 의연장에서 얻어진 값들에서 분자 파라미터가 결정된 다. 따라서 실제의 조직내의 생리적 조건인 진한 용액이나
정보와, GAG 의 여러 분광학적 특성을 취급한다. 또한 이들에서 얻 어진 용액 상태의 GAG 분자의 구조에 대해서도 논의한다. 7. 1 X- 선 회 절 (X-ray Dif fra cti on ) X- 선 회절은 결정성 물질의 구조를 규명하는 가장 효과적인 방 법으로 여겨진다. 구체적인 X- 선 회절에 관한 이론을 논하는 것은 이 책의 범주를 벗어나는 것으로 생각되며, 이 책에서는 단지 X- 선 회절의 기본 원리를 간략히 언급하고, GAG 분자들의 구조에 대한 정보를 종합한다. 가장 기본적인 X- 선 회절에 관한 논의는 Brag g 식 (7-1) 의 유도 이다. 결정의 균등한 결정면은 일련의 반사면으로 볼 수 있으며, X- 선이 이 면에 입사각도 O 로 주사되면 동일 각도로 반사된다. 반 사된 X- 선은 과장(-<)' 0 및 면간격 (d) 이 다음의 Bra gg식을 만족 할 때 서로 보강된다. 2d sin O =ni ( 은 정 수) (7-1) 단결정에서 반사된 X- 선을 사진 필립에서 검출하면, 식 (7-1) 을 만족하는 결정면에 대응하는 일련의 점들이 나타난다. 이 점들간의 간격에서 단위세포 (un it cell) 내의 원자간의 거리와 배향이 결정된다. X- 선 회 절 에 의 한 분자구조의 결 정 에 는 단결 정 (sin g le crys t a l ) 뿐 만 아니라, 많은 작은 임의로 배열된 결정들로구성된 분말(p owder) 이 사용되기도 한다. 이 때에는 X- 선 회절 양상은 점들이 아닌 동 심원의 형태로 얻어진다. 분말법에 의한 X- 선 회절에서는 단지 면 간격만 얻을 수 있으며, 원자의 배열은 단결정법에서만 가능하다· GAG 둘은 X- 선 회절에 이용될 수 있는 단결정으로는 아직 얻어 지지 않았다. 따라서, 이들의 X- 선 회절은 주로 섬유상에서 수행 되며, 섬유상의 회절 양상은 단결정과 분말법의 중간 정도이다. 섬 유 상태에서의 X- 선 회절 양상은 섬유의 배향 정도에 따라 크게 차 이가 나며(그립 7.1 참조), 구조에 대한 보다 좋은 정보는 잘 배향된 시료에서 얻어진다. GAG 를 포함한 고분자의 배향된 섭유는 보통
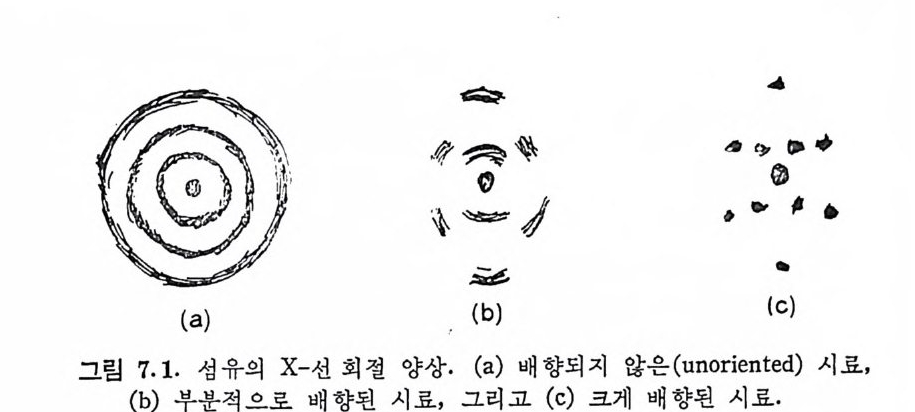 .`f~—‘ 도0 ~ / *m `, 40. , 0 ‘* •
.`f~—‘ 도0 ~ / *m `, 40. , 0 ‘* •
용액에서 실로 뽑을 때 얻어지며, 배향을 향상시키기 위하여 신장 (str e chin g ) 시 키 기 도 한다. X- 선 회절의 결과에서 GAG 등의 다당류의 구조를 결정하는 데의 가장 큰 문제점은, 다당류의 사술부분을 기술하기 위해 필요한 과라 미터들의 수가 회절 양상에서 얻어지는 점보다 월등히 많다는 것이 다. 따라서, 회절 결과에서 바로다당류의 결정 구조를규명하기보다 는, 적당한분자모델을 가정하고 이에서 계산된 회절 양상과실험에 서 얻어진결과를비교하고, 분자모델을개량하여 두가지 회절 양상 (계산된 것과 측정된 것)을 가능한 한 일치시키는 방법이 이용된다. GAG 분자의 X- 선 회절은 1959 년에 Be tt elhe i m(7.1) 에 의하여 처음으로 보고되었으며, 1970 년대에는 대부분의 GAG 에 대한 배 향된 섬유상에서의 X- 선 회절 결과가 발표되었다. 이들 결과의 대 부분은 GAG 분자가 비목 구체적인 구조는 다르나, 어떤 형태의 나 사선 (he li cal) 구조를 갖고 있는 것으로 해석되었다. 표 7.1 는 GAG 들의 나사선 대칭과 이당류 단위제의 평균주기 (h) 를 비교하여 요약 한 것을 보여 준다. GAG 분자들은 고체 상태 에 서 다양한 나사선 구조를 가질 수 있음 울 표 7.1 에서 볼 수 있다. 그리고, GAG 간의 화학적 유사성이 구 조성 유사성으로 반영됨도 알 수 있다. 예로, 반복되는 이당류 단 위체가 1-3 및 1- ► 4 gly c o sid i c 연결로 결합된 I-IA , Ch4 -S, Ch6- S, DS 와 KS 에서는 모두 2 배수 나사선 구조(나사 1 회 전당 2 개 의 이당류 단위체가 반복된다.)를 갖는 것이 관찰되었으며, KS 를
표 7.1 Glyc osami no g ly c ans 의 나사선 대 칭 과 이 당뮤당 평 균주기 (h) (이 표의 Data 에 대 한 참고문헌 은 Rl 참조) h 값 (nm) 나사선 대칭 HA KS Ch6-S Ch4-S DS HP HPS 32 배배 수수 ((ttwhro efeo flod l)d ) 00.. 9958 0—. 945 00.. 9953 00.. 99 68 00.. 9956 0. 80~0. 87 0. 93 0. 91 0. 96 0. 98 0.913 4 배 수 (fou rfo ld ) 0. 85 0.93 8 배 수 (eig h tf old ) 0—.82 一 0. 98 — 0. 93 a. Ch4-S 와 Ch6-S 의 2 배수 구조는 산성에서만 관찰됨.
제외하고는 모두 3 배수 나사선 구조를 가질 수 있다. 단당류제 간 의 연결이 분자 구조를 규정하는 중요한 요인이긴 하나, 당고리에 치환된 기능기도 분자 구조에 큰 영향을 미친다• 이는 앞서 언급된 5 종의 GAG 중 황산기가 포함되지 않은 HA 만이 4 배수 구조를 나타내며, coo- 기가 없는 KS 에서는 2 배수 구조가 관찰되지 않 은 것에서 추정된다. 7. 1. I Hy a luron ic ac id. 전자계산기에 의한 HA 분자 주축 (backbone) 의 구조에 대한 모델 은, 이 다당류는 오른손 (r ig h t -handed) 나사선 구조보다는 왼손 나사 선 구조가 더 우선적이라는 것이 밝혀졌다 (7.2). HA 의 왼손 나사 선 구조는 At k in s 등 (7.3) 에 의해 처음으로 재안되었다. 이들은 HA- 염 (h y alurona t e) 은 이당유당 나사선 축길이 (h)가 0.95nm 인 왼 손 3 배수 나사선 구조를, 그리고 산성형은 h 가 o.. 98nm 인 2 배 수 구조를 갖는다고 보고하였다· 또한, 섬유축 길이가 2.85nm 인 두 가지 육방 결정체 (hexa g onal) 형도 재시되었다. 연이어 이들은 동· 일한 두 개의 왼손 나사선 가닥이 서로 반대 방향으로 꼬아진 2 중 나사선 구조를 HA- 염과 산성형 모두에 대해 제시하였으나, 이 모
형은 적합하지 않음이 밝혀지고 수축된 단일 가닥의 구조로 대제되 었다 (7 . 4). HA 의 X- 선 회절 결과는 이 다량류가 고체상태에서 수축된 (com pr essed) 형과 신장된 (ex t ended) 형의 두 가지로 존재할 수 있음을 보 이고 있다 . 이 두 가지 형은 근본적으로 이당류체당 축길이 (h) 가 크 게 다르다. 죽, 수축된 형에서는 h 값이 대략 0.85nm 인 반면에, 신장된 형에서는 약 0.95nm 을 갖는다. 신장된 형은 여러 가지 나 사선 대칭 구조 를 갖는데, 이들은 이당류체당 회전각도가 -90° (4 배수형), 一 120° (3 배수형) 및 -180° (2 배수형)으로 차이 가 난다. 각 형의 차이는 당고리 (sug a r r i n g)의 구조 변화에서 보다는, 연결 부분의 각도에서 차이가 있는 것으로 여겨진다. 따라서, HA 의 곁 정 구조는 분자내 인력보다는 분자간 상호작용에 의해서 결정된다 고 볼 수 있다. HA 염의 수축된 형에 대한 구체적인 구조가 Guss 등 (7.4) 에 의 해 제 안되 었 다. 한 가지 는 정 방결 정 체 (tet r a go nal fo rm) 으로 단위 세 포의 크기는 a=b=O.987nm, c=3.394nm 이며, 두개의 정상적인 4 배수 나사선 다당류가 각 단위세포를 동과한다 . 따라서, 각 단위 세포는 8 개의 이당류제를 포함하며, 물 (H2 0) 는 포함하지 않는다 (그립 7.2). 이 구조에서는 다당류 사슬은 모두 왼손 나사선 구조를 갖고, 두 사술은 서로 반대 방향을 하고 있다. 높은 상대습도하에 서는, 정 방결정체와 극히 유사한 사방결정체 (orth o rhombic fo rm) 가 관찰되었다. 이 구조에서는 a= l. 153nm 이며, HA 사슬은 2 배수왼 손 나사선 구조로존재한다· 그러나, 수축된 구조인 정방결정체와사 방결정 체는 모두가 분자내 수소결합과, 분자간 수소결합 및 O·••Na ➔ • ···O 다리로 안정화된다. 이들 형의 분자내 수소결합은 1-3 연결 을 동한 GlcNAc 의 C-4 OH 기와 GlcUA 의 당고리 산소, 그리고 1-4 연결을 통한 -NH… O (COO- 기의 산소) 간에 형성된다. 이당류체당 축길 이가 0.95nm 인 HA 염의 신장된 형에 대한 구 조도 같은 연구진에 의하여 제안되었다. 이 구조에서는 HA 사술은 정상적인 왼손 3 배수 나사선 구조를 갖는다. 4 배수와 3 배수 구조 의 중요한 차이는 옆가지의 배향에 있다. 4 배수형은 대략 ga uche-
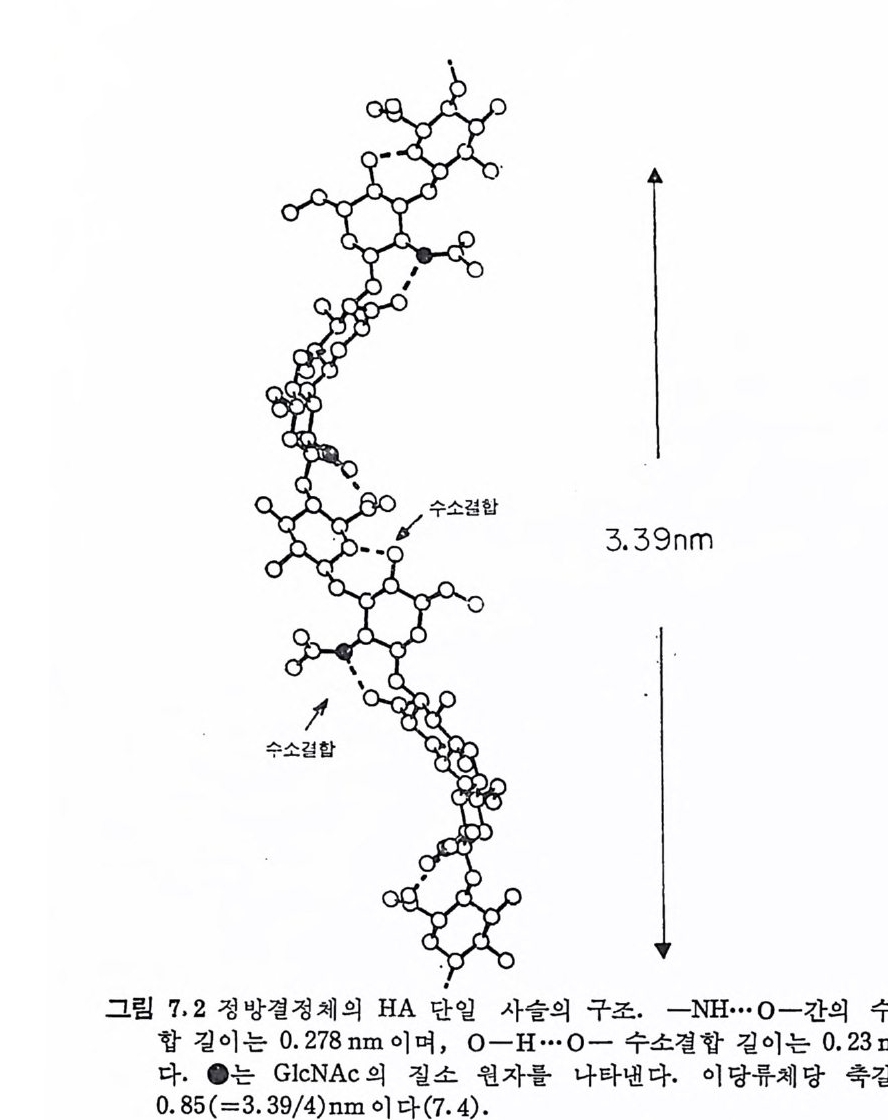 3.39nm
3.39nm
tra ns 구조를 갖는 반면에 , 3 배 수형 은 ga uche-ga uche 구조를 하 고 있다· 그러나, 이들은 모두 분자내 및 분자간 수소결합, 그리고 O·••Na 七 ··O 다리에 의해 안정화되어 있다. 분자내 수소결합은 3 배수형과 4 배수형에서 차이가 난다. 앞서 언급된 바와 같이 4 배 수형은 GlcNAc 의 C-4 OH 와 GlcUA 의 고리 산소 사이, 그리고
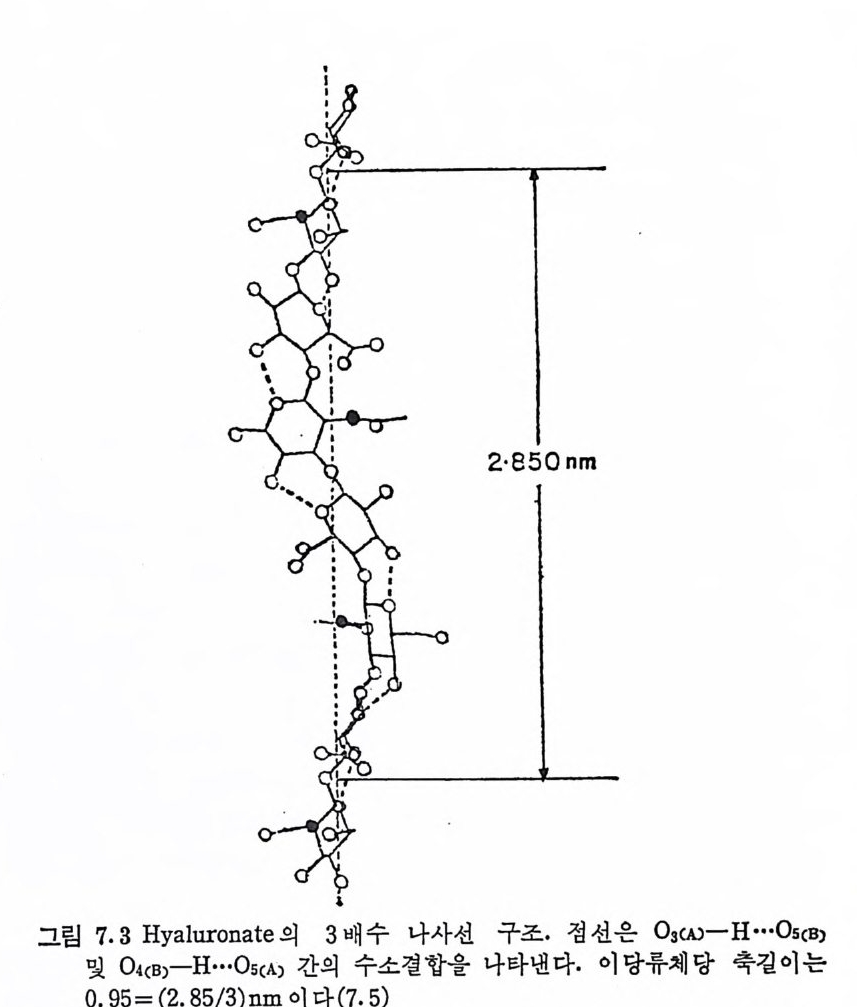 2·850nm
2·850nm
― NH … 0-(COO-) 간의 수소결합을 하는 반면에, 3 배수형은 GlcUA 의 C-3 OH 와 GlcNAc 의 고리 산소간의 수소결합만 하고 있다. HA 염은 반대 금속이온의 종류에 따라 고체 상태의 구조가 달라 지사사슬형는 이 것구 도조co 와o보 -고유…되사C 었 a한2다+ ….구 - 조o Co를ac- h 갖 y다 a는리lu다에ro (n7의.a 6 t해 )e. 는 이연 결앞구서되조 어에언 서있급 는으된며 두,3 개배각의수 C Ha2나A+ 에는 3 쌍의 물 분자가 배위되어 있다. 그러나 수축된 4 배수 구조 에서는 이와 같은 2 가 양이온 결합을 할 수 없다. K+, NH/, Rb+
과 Cs+ 등의 양이온 존재 하에서는 HA 는 왼손의 상호 반대 방향의 이중나사선 구조를 갖는다는 것이 재안되었다 (7.7). K+ 염의 경우 에는 p H<4 에서만 이중나사선 구조를 나타낸다. 이들 이중나사 선 구조는 HA 사슬이 4 배수 구조몰 하고 있으며, 각 사슬은 이웃 사슬과 동일 축을 중심으로 서로 꼬아져 있다고 제안되었다. 7. 1. 2 Chondroit in 4-sulf ate Bett elh eim (7. 8) 은 Ch4-S (이 시 료의 황산기 와 GlcUA 의 비 는 1 : 3 으로 보고) Ca 염의 부분적으로 배향된 시료의 X 一선 회절 결 과를 발표하였다. X- 선 회철상에서 0.98 및 0.327nm 의 간격을 갖 는 경선호 (me ri d i onal arc) 가 얻어졌으며, 이들은 동일한 이 당류체 주기 0.98nm 에 의한 1 차 및 3 차 회절에서 기인된 것으로 간주 하였다. Ch4-S 염 및 산성형의 고체 상태에서의 나사선 구조도 X- 선 회 절 실 험 에 서 재 시 되 었 다 (7. 9, 7. 10). Ch4-S 의 Na 염 은 h 가 0.95nm 인 3 배수 나사선 구조를 보이는 반면에, 산성 에타놀 용 액에서 얻어진 산성형은 h 가 0.98nm 인 2 배수 구조를 갖는 것으 로 제시되었다· 또한 Ca 염에 대한 W int e r 등의 X- 선 회절의 결과 (7. 11) 는 앞서 언급된 Bett el heim 의 h 값 0. 98 nm 와는 다른 0. 913 . nm 을 갖는 것으로 보고되었다. 이와 같은 Ch4 -S Ca 염의 h 값의 차이는 Ch 4- S 의 구조가 시료나 시료 제조 방법에 따라 달라지는 것으로 설명되었다. 3 배수 나사선 구조를 갖는 Ch4-S 의 3 차원적 구조의 해석은, 이 구조가 GlcUA 의 C-3 OH 와 GalNAc 의 고리 산소간의 수소결 합이 1-4 연결을 동해 존재하여, 1-3 연결을 동하는 수소결합은 없는 것으로 제시되었다 (7.12). 또한 3 배수 나사선 구조는 고체상 태 에 서 GlcUA 의 C-2 OH 와 GalNAc 의 07 간의 분자간 수소결 합 으로 안정화된다고 보고되었다(그림 7.4). 이와 같은 Ch4-S 의 분자 간 수소결합은 HA 의 3 배수 나사선 구조에서는 관찰되지 않았다. Prote o g ly c ans 의 탄수화물의 주성 분은 chondroit in s ulf ate 이 다 .. 초거대 분자인 PG 의 구조와 연관지어, Ch 4- S 의 단백질 복합체 등 에 대한 구조의 연구도 보고되었다. A t k i n 등 (7.13) 은 Ch 4- S- 단백
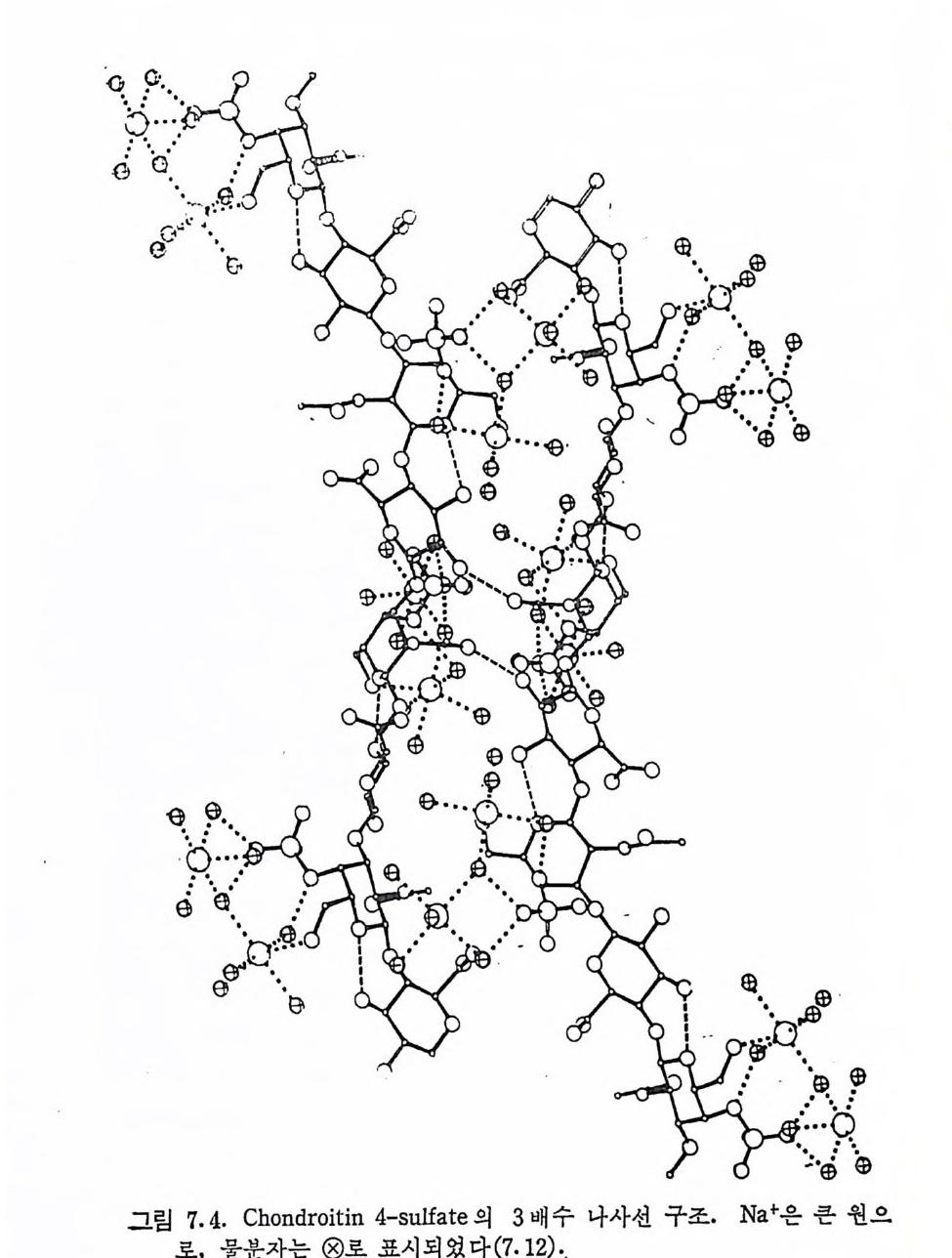 . Ge. .o ....... g . ...5·』. ..ci \·’·i. . o.i. e. .: 0 |e
. Ge. .o ....... g . ...5·』. ..ci \·’·i. . o.i. e. .: 0 |e
질 복합체, 분해된 PG 및 재회합된 PG 의 Ch4-S 부분은 모두가 산성형 Ch4-S 와 유사한 2 배수 나사선 구조를 가집을 보였다. 이 에서, 그들은 PG 의 단백질, KS 및 HA 성분은 Ch4-S 의 구조에 큰 영향을 미치지 않는다고 주장했다. 같은 연구팀은 Swarm rat chondrosarcoma 에 서 분리 된 Ch4-S 가 다 량 포함된 PG 의 Na 및 Ca 염의 구조도 보고했다 (7.14). Na+o] PG 의 유일한 반대 이온일 때는 Ch4-S 는 3 배수 나사선 구조를 가지나, 약간의 Ca+ +가 첨가 될 때는 2 배수 나사선 구조로 전환된다. 이 구조는 3 배수 구조의 분자간 수소결합 이외에도, 분자간 S03-:-··•Ca++… -o oc 다리에 의 해 안정화된다. 7. 1. 3 Chondroit in 6-sulf ate Ch4-S 와 GalNAc 부분의 황산기 의 위 치 만 다른 Ch6-S 는 Na 염 에서는 두 개의 다당류 사슬이 서로 평행하게 나가는 3 배수 및 8 배수 구조가 가능함이 보고되었다 (7.15). 이들 구조는 거의 동등한 이당류제당 축길이 o.96 및 0.98nm 을 보이나, 회전 각도가 이당 류체당 120° 와 45° 로 큰 차이가 난다. 방위에 따른 전하를 띤 옆가 지 (COO- 및 so 디의 분포가 두 구조에서 크게 다르며, 이것이 gly c o sid i c 연결의 각도를 변화시킨다고 해석된다. Ch6-S 의 산성 형은 2 배수 나사선 구조를 갖는 것으로 해석되었다. 7. 1. 4 Dermata n sulf ate DS 의 uronic ac id 성 분은 HA, Ch4-S, Ch6-S 등의 GlcUA 와 는 다른 L-id u ronic a ci d(IdUA) 이다. HP 과 HPS 의 uronic ac id 의 주성 분도 IdUA 이 다. IdUA 와 GlcUA 의 구조적 차이 가 이 들을 포함하는 다당류의 화학적 성질(예로 pK a 럿 이온 결합 특성)과 생물학적 기능의 차이로 나타나는 것으로 여겨진다. 이에서 DS, HP 및 HPS 의 구조에 있 어 서 는, uronic ac id 부분의 구조에 큰 관 심이 주어졌다. DS 의 X- 선 회절의 결과는 이 다당류가 이당류체 당 축길이가 각각 0.97, 0.95 및 0.93nm 인 2 배수, 3 배수럿 8 배수 나사선 구조가 가능함이 보여졌다 (7.10,7.16,7.17).
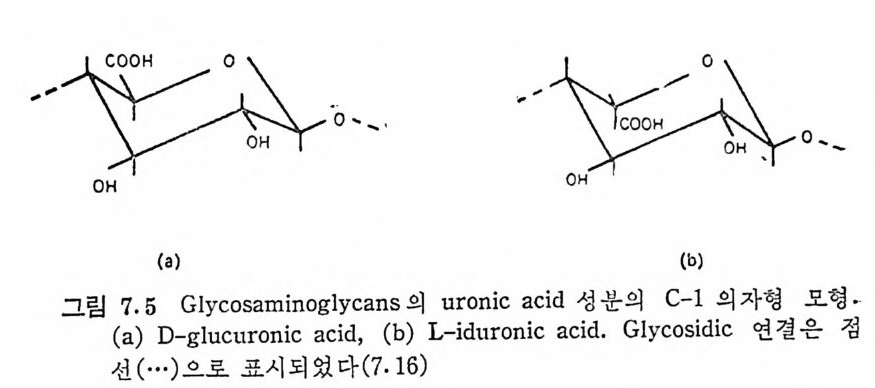 · OH °` .... , 〉三\。`-
· OH °` .... , 〉三\。`-
Uronic ac id 의 의 자형 구조는 C-1 형 과 1-C 형 이 가능하며 , 구 조형에 따라 옆가지의 배향은 물론단당류 길이도변한다. 그립 7.5 는 정 상적 인 C-1 의 자형 의 GlcUA 와 IdUA 의 구조를 보여 준다. C-1 형 에 서 는 GlcUA 의 옆 기 능기 (OH 빛 COOH) 들은 모두 수평 방 향에 위 치 하나, GlcUA 의 C-5 ep im er 인 IdUA 의 COOH 기 는 축 방향에 위 치 한다. IdUA 의 COOH 가 수평 방향에 위 치 하는 1-C 의 자형에서는 다당류의 전체적인 모양이 C-1 형에서보다 크게 변한 구 다. 이를 그림 7.6 에서 가능한 이당류체당 길이와 함께 보이고 ‘ 있다. C-1 의자형에서는 이당류체의 길이가 1. 02nm 까지 가능하나, 1-C 형에서는 단지 0.92nm 까지만 가능하다. 이폴 DS 의 X- 선 회 절에서 얻어진 h 값 o.97(2 배수형), 0.95(3 배수형) 밋 0.93nm (8 배수형)과 비교할 때, 적어도 2 배수와 3 배수형 구조에서는 1-C 형은 가능하지 않음을 결론 지울 수 있다. 8 배수형은 이론값과 0.01nm 차이가 나며, pyra nose 고리가 약간 변형된다면 1-C 형에 서 0.93nm 까지는 가능할 수 있을 것이다 (7.17). 반면에, At ki n s . 와 Lauren t (?.IO) 은 DS 의 IdUA 1-C 구조의 가능성을 완전히 배제 시적켰으다로• 가1능-C한 구 분조자의 모이형당을류 당고 려가하능면한 0축.길90이n m0 가.9 되3n며m, 는 이 입값체은화 학8 배수형의 0.93nm 에 크게 미치지 못한다. 따라서, 고체 상태의 DS 는 나사선 대칭에 무관하게 IdUA 가 C-1 의자형을 하고 있을 것으. 로 짐작된다·
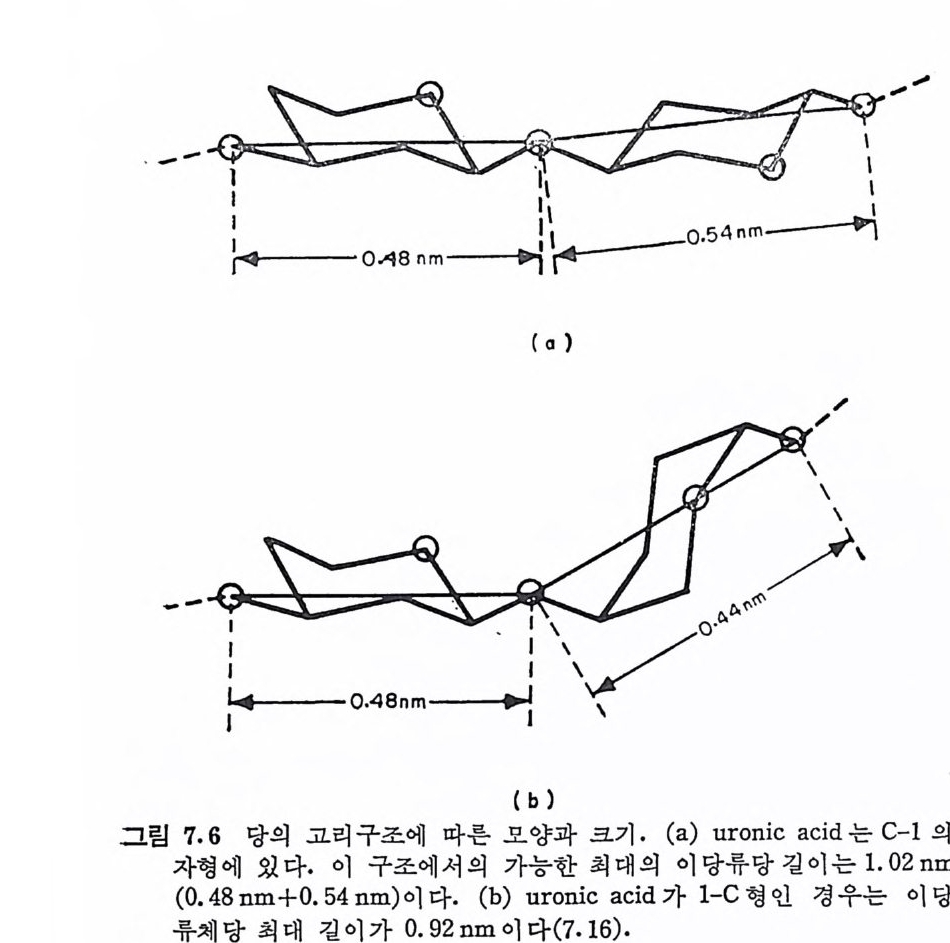 ”
”
7. 1. S Hep a rin 및 Hep a ran sulf ate HP 과 HPS 는 분자 사슬의 uronic ac id 조성 이 나 sulfa te 화 정 도가 크게 불균일하다. 따라서, 이들의 X- 선 회절 결과와 분자 구 조간의 상관 관계의 규명은 아직 예비 단계에 불 과하다· 지금까 지 얻어진 HP 의 X- 선 회절 결과는 분자의 반복 길이가 1.5 9~ 1. 73nm 로 보여지며, 이 값은 시료의 원천이나 상대습도에 따라 변한다 (7.18). 반복 길이 1. 59~ 1. 73nm 는 HP 분자가 이당류체당 축길이가 0.80~0.87nm 인 2 배수 나사선 구조를 하고 있는 것으 로. 해석될 수 있다. HP 의 X- 선 회철 결과는 HP 의 분자량에 따
라서도 차이폴 보인다· 쥐의 피부에서 얻어진 고분자량 HP 은 84% 상대 습도에서는 반복되는 축길이가 1.65nm 룹 , 그리고 78% 상대 습도에서는 반복되는 축길 아가 1. 73nm 로 완전히 구별되는 두 가지 결정구조륭 나타낸다• 그러나 돼지 내장 점막 (mucosa) 에서 분리된 저분자량 시료는 단지 1. 65nm 의 주기성만 보인다. At k in s 등 (7.18) 은 중합도에 따른 분자 구조의 차이가 자연상태와 분해된 쥐 의 피부 HP 간의 현저한 생물학적 활성의 차이로 나타난다고 설명 했다. HP 의 X- 선 질과에 의한 이당류체당 축길이 0.80~0.87nm 는 이 다당류의 IdUA 가 1-C 의 자형 구조로 간주될 만큼 짧은 값이 다 (7.19). HP 의 최대로 가능한 이당류체당 축길이는 IdUA 가 C- 1 형 일 때는 0.99nm 이며, 1-C 형 일 때는 0.89nm 이다· 고체 상태의 HP 의 IdUA 에 서 1-C 형 구조가 더 욱 가능하다는 것 은 IdUA 가 1-C 형과 C-1 형으로 있을 때의 분자사슬의 쌓임 (p ack i n g)의 비교에서도 확인되었다. 1-C 의자형은 GlcNAc(or NSO 디의 C- 3 위치의 OH 와 IdUA 의 고리 산소간의 분자내 수소결합에 의해 안정화될 수 있 으나, C-1 형 에서 는 분자내 수소결합이 가능하지 않는 것으로 나타 났다. HPS 의 Na 염에 대한 X- 선 회절은 이 분자가 h 값이 O.93nm 인 2 배수 나사선 구조를 하고 있는 것으로 나타난다 (7.10). RPS 는 :ur onic a ci d 로 GlcUA 와 IdUA 를 거의 동량으로 포함하고 있다. 따라서 두 uronic ac id 가 모두 C-1 형 , 모두 1-C 형 , 그리 고 GlcUA 는 C-1 형 이 나 IdUA 가 1-C 형 인 3 가지 의 구조가 가능하다. HPS 의 당류가 모두 C-1 구조륭 하고 있을 때는정상적인 결합길이, 결 합각도 및 당고리 구조에서 2 배수 나사선 구조가 가능하다. 더우 기 , 이 구조에 서 는 HPS 사슬이 uronic ac id 의 고리 산소와 hexo- sam i ne 의 C-3 OH 간의 수소결합에 의해 안정화 되는 것으로 나타 났다. 그러나 uronic ac i d 가 모두 1-C 형일 때는 최대의 h 값이 0.85nm, 그리고 IdUA 만 1-C 형일 때는 0.73nm 로 실험적으로 얻은 0.93nm 보다 크게 적은 값이 얻어졌다. 따라서 고체 상태의 .HP S 의 uronic ac id 는 모두 C-1 형 구조를 하고 있는 것으로 여 겨
진다. HPS 의 Ca 염 의 h 값은 Na 염 의 0. 93 nm 보다 훨 씬 작은 0. 84 nm 가 얻어졌다 (7.20). 이 h 값은 HPS-Ca 에서는 GlcUA 와 IdUA 가 모두 1-C 형을 하고 있는 것으로 해석될 수 있다 . 7. 1. 6 Kerata n sulfa te 소의 각막 에서 분리된 KS 의 신장된 필몸 상태의 X- 선 회절은 이 다당류가 2 배수 단일가닥 나사선 구조 를 가질 수 있음을 보인다 (7.21). 이 구조에서는 이당류체당 축길 이는 0.945nm 로, 다당류 사슬이 신장된 상태로 존재함을 보여준다. 이 구조에 대한 구체적 인 모형 은 GlcNAc 의 C-3 OH 기 와 Gal 의 고리 산소간에 수소결 합 이 가능한 것으로 나타났다(그립 7.7).
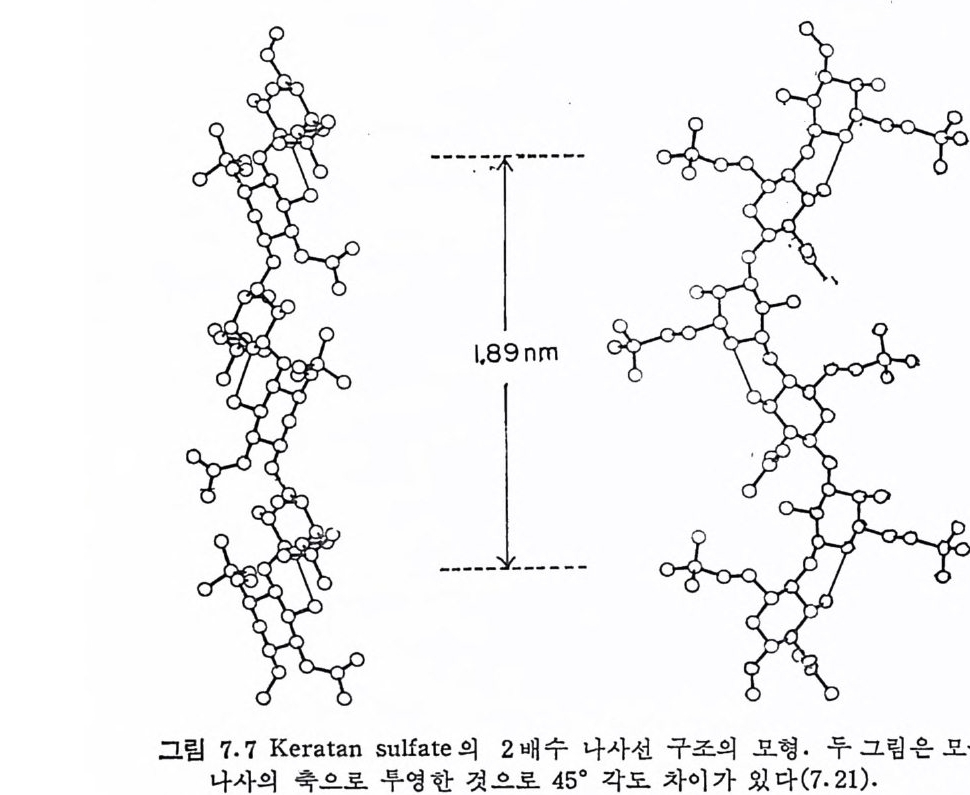 1,89nm
1,89nm
지금까지 GAG 의 배향된 섬유상태 또는 신장된 필름에서의 X- 선 회절 실험의 결과에 따른 이들 다당류의 가능한 구조들을 기술 하었다 . 이들은 모두 어떤 형태든 나사선 구조를 보이는 것으로 보 고되었다· 고제 상태에서의 X- 선 회절에서 나타나는 나사선 구조와 동일한 구조를 이들 다당류가 용액 또는 조직 내에서 하고 있는 것 으로 간주하기는 곤란하다· 고체 상태에서 관찰된 질서된 나사선 구 조를 안정화시키는 에너지는 대부분 아직 규명되지 않았거나, 아니 떤 약한 수소결합으로 설명되고 있다. 이와 같은 안정화 에너지가 용액 중에서도 구조적 질서에 의한 en t ro py의 감소를 보완하는 데 충분한가는 극히 의문이다. 생체조직에서는 GAG 는 PG 과 같은 집합체로 존재하며, 이는 용액과 고체 상태의 중간으로 여길 수 있 다 . 많은 다당류 사슬간의 접촉에 의한 협동적인 안정화로 고제 상 태에서와 유사한 신장된 질서된 구조가 생체 조직 내에서도 가능할 수있다 . 용액 상태와 고체 상태의 다당류의 구조가 크게 차이가 날 것이 라는 것은 DS 와 HP 및 HPS 의 구조의 비교에서도 짐작할 수 있 다. IdUA 를 포함하는 DS,HP 빛 HPS 의 여 러 성질이 GlcUA 를 포함하는 HA, CS 빚 KS 의 성 질 과 차이 가 나는 것 을 uronic ac id 의 구조적 차이로 설명되어 왔다. X- 선 회절의 결과는 DS 와 HPS 의 IdUA 는 C-1 형, 그리고 HP 는 1-C 형을 가짐을 나타낸다 . 그러 나, 용액에서는 DS, HP 및 HPS 의 IdUA 는 오두 유사한 광학적 및 이온결합 특성을 나타내며, 이 성질은 다른 GAG 의 GlcUA 의 특성과는 큰 차이를 보이고 있다 . 따라서 DS, HP 및 HPS 의 IdUA 의 구조는 용액 상태에서는 모두 동일할 가능성아 높다. 7.2 분광학적 성질 : 자외선 영역 극히 최근까지만 해도 GAG 의 전자전이에 따른 분광학적 성질을 이용한 GAG 의 구조에 대한 연구는 극히 미미하였다. 이는 GAG 들은 보통의 UV 및 가시광선 영역에서의 홉광도가 극히 적은 것에 기인된다고 여겨진다 · 최근의 분광학적 기기의 진전에 따라, 이 분·
야에도 많은 연구가 수행되었으며, 이들에 이용된 분광학적 방법은 주로 CD 및 ORD이다. 분자의 진동을 이용하는 적외선 (In fr a-Red: IR) 및 Raman 분광법과 핵 spi n 의 전이를 이용하는 핵자기공명 (Nuclear Mag ne ti c Resonance: NMR) 도 GAG 의 구조 결 정 에 가끔 이 용된다. 이 항에서는 우선 CD 및 ORD 를 취급하며, 다른 방법은 7·3 및 7.4 에서 취급된다. 7.2.1 발색단과 자외선 흡수 스펙트럼 분자의 전자전이 (electr o nic t rans iti on) 에 의 한 흡광은 보통 자외 선 가시 광선 (UV-VIS) 영 역 에 서 일 어 난다. UV-VIS 분광기 의 작동 영 역 은 보동 185 nm 까지 이 나, 200 nm 이 하에 서 는 UV lam p(주로 D2) 의 빛의 강도가 극히 약하고 용액 중의 많은 성분(예로, c1-) 이 강 하게 빛을 흡수하므로 반복성이 좋은 스펙트럼이 얻어지지 않는다. 185nm 이하에서는 공기 중의 산소 등의 전자전이가 일어나므로, 이 파장 영역에서는 보통 N2 기류하, 또는 진공 상태에서 스펙트 럼을 취한다. GAG 를 비롯한 대부분의 탄수화물은 200nm 이상의 과장에서는 거의 빛을 흡수하지 않는다· 그러나 많은 aceta m i do (-NHCOCH3) 또는 카르복실기 (COOH) 를 포함하는 다당류는 190nm 부근에서 강 한 흡수띠를 보인다(그립 7.8). 이는 200nm 이상에서는 빛을 흉 수할 수 있는 발색단이 없거나, 발색단이 존재한다고 하더라도 전 자전이가 거의 금지되어 있음을 의미한다· GAG 의 구조물 보면, 이들 다당류의 전자전이 중 가장 낮은 에 너 지 로 일 어 날 수 있는 것은 aceta mi do (-NHCOCH3) 와 카로복실 기 (COOH) 에 의한 것이라는 것을 쉽게 짐작할 수 있다 (OH 기는 진 공 UV 영 역 인 160nm 부근에서 빛을 흡수한다). 이들 두 기능기의 전자전이는 모두 -CO-기 에 의한 것으로, 이의 전이 유형은 그 립 7.9 와 같이 나타낼 수 있다. 카르보널 (-CO- )기의 전자전이 중에서 가장 낮는 에너지의 전 이 (가장 장파장에서 흡수띠를 보인다.)는 산소의 비결합전자 (non bondin g elec tr on) 가 r- 반결합 (an ti bon di n g) 궤도로 전이되는 n- 군전
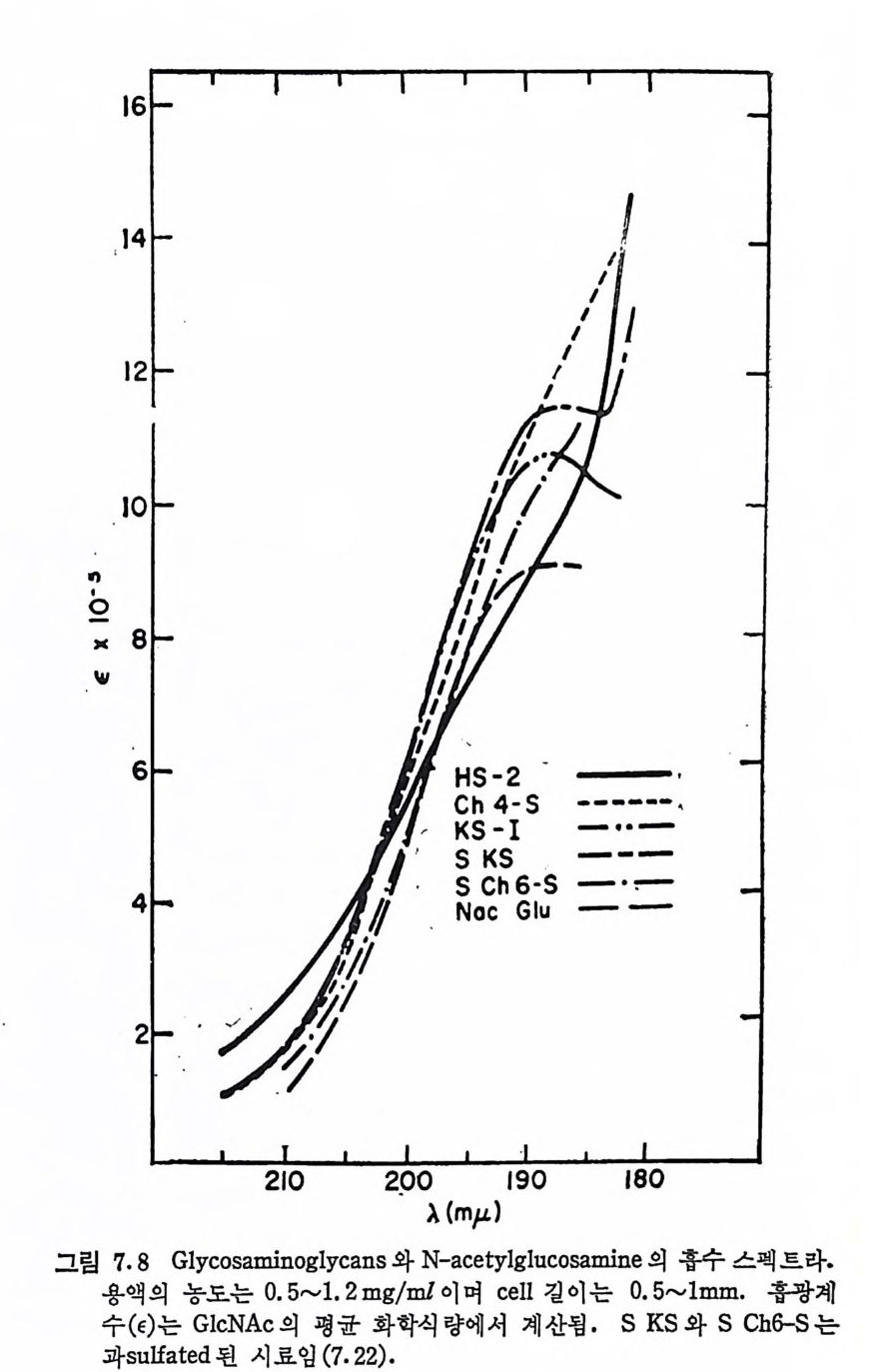 16
16
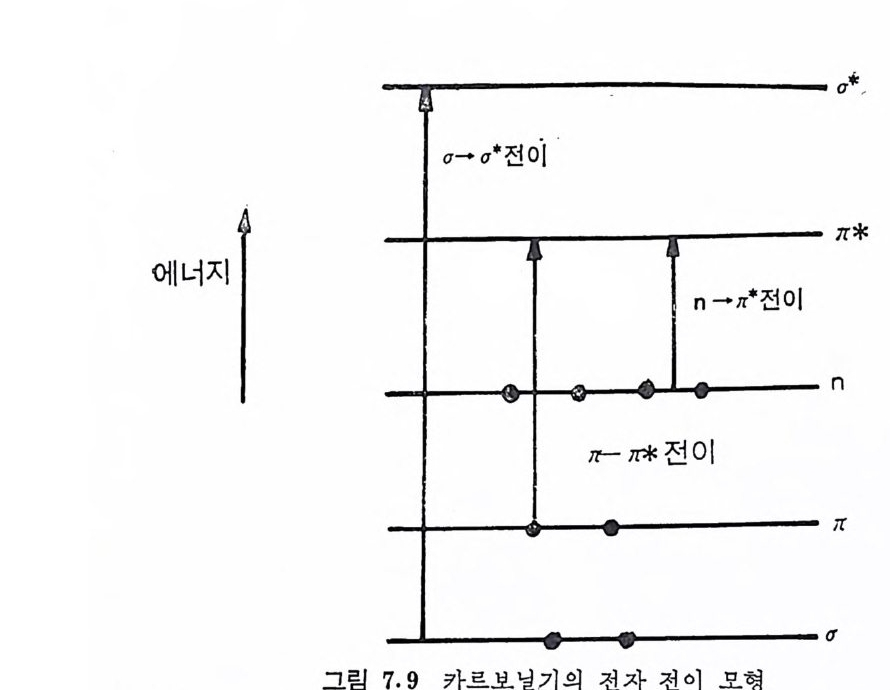 (l* -
(l* -
이이다. T 一군와 (1一군 전이는 이보다 짧은 과장에서 전이가 일어 난다. 많은 연구자들에 의 한 GAG 의 UV 흡수 sp e ctr a 와 CD 결 과 는 n- 군전이는 210nm 부근에서, r 一군전이는 190nm 부근에서 일어남을 보이고 있다. 이 흡수 과장은 단백질의 pep tide 결합 (-NHCO— ) 에 대 응하는 전 이 의 과장과 극히 유사하다. - GAG 의 210nm 부근의 n- 군전이는, 그림 7.8 에서 알 수 있듯 이 , 흡수 sp ec tr a 에 서 는 잘 관찰되 지 않는다. 이 는 ami de 나 COOH 기의 n- 군전이가 모두 아주 약하게 허용되어 있거나, 아니면 파동 함수의 대칭에 의해서 금지되어 있음을의미한다. 일반적으로, n-1r* 전 이 의 몰흡광계 수 (molar exti nc ti on coe ffi c i en t)는 약 100 으로 1r-1r* 전이의 104~105 에 비해 극히 적은 값이다· 또한 GAG 의 UV 홉 수 sp e ctr a 는 190 nm 의 仁一군전 이 는 ― NHCOCH 러 를 함유하는 GAG 및 이의 단위체 (GlcNAc) 에 있어서는 COOH 기의 존재 유무에 거의 무관하게 동등한 홉광계수를 보이고 있다. 즉, COOH 가 없는 KS 와 GlcNAc 는 거의 동일한 크기의 190nm 부근의 홉광 pe ak 을 보이나, -NHCOCH3 의 상당량이 ― NHS03- 로 치환된 HPS 에서
는 p eak 가 관찰되지 않는다. 이는 COOH 기의 T- ► 군전이도 거의 허용되지 않는 것으로 해석될 수 있다. 7. 2. 2 Cir c ular Dich rois m 맞 Op tica l Rota t or y Di sp e rsio n GAG 는 물론 대부분의 생물고분자와 많은 수의 생물 분자들은 비대칭 구조를 가지고 있다. 비대칭 분자는 소위 광학 활성 (op tica l ac ti v ity)을 나타내는데, 이는 이들 분자에 전자과가 편광 방향에 따 라 작용하는 정도에 차이가 있는 것에 기인된다. 광활성 성질은 CD 나 ORD 로 나타나며, 이들은 비대칭 분자의 구조에 대한 좋은 자료를 제공한다. GAG 들 간의 UV 흡수띠는 GAG 종류에 따라 큰 차이룰 보이 지 않는 반면에, CD 및 ORD 는 큰 차아를 보인다. 바록 흡수띠 (absorpt ion band) 와 CD 띠는 이들의 위치가 전이되는 에너지 간격 과 동일하다는 공통점이 있으나, 강도에는 1 : 1 의 대응 관계가 성 립되지 않는다. 전자전이의 흡수띠의 강도는 전기 쌍극자 전이 모 멘트에만 의존하나, CD 띠의 강도는 전기 및 자기 쌍극자 전이 모 멘트에 모두 의존한다. 따라서, 약한 흡수띠를 나타내는 전이가 강 한 CD 띠를 낼 수 있으며, 이의 역도 가능하다. 오른쪽 방향과 왼쪽 방향으로 각각 원형편광된 광(ci rcularl y po• lari ze d lig h t)이 광학 활성인 매체를 동과할 때, 이의 전기벡터가 통 과된 시¢료=에—1 8 r의00해 (두nL께- 庫l 에)l 서 회전한 각도는 다음과 같이 주어(진l-2다). nL 과 nR 은 각 원형편광에 대한 굴철물, A 는 입사광의 과장을 나 타낸다. 매체의 고유광회전도[이는 다음으로 주어지며, 이는 매체 의 온도와 입 사광의 파장의 함수이 다• 印= axllO•CO O (7-3) l 은 보통 dm 로, C 는 g r/dl 로 나타낸다. 매체의 굴절률 n 은 과 장에 따라 변하며, 이는 n=l+ -A,- (K 와 Ao 는 주어진 매체에 서상 수이며 Ao 는 흡수 파장과 같다)로 주어진다. 따라서 〔¢〕는 i。
부근에서는 무한대가 된다. 한 분자에 여러 개의 흡수전이가 있을 시 [¢]는 다음의 Drude 식으로 보통 표시된다. [¢] =~ }A- 泥j~ (7-4) 이 식은매체의 여러 광활성인 흡수띠의 기여의 합을 나타낸 것 이다. 입사파장이 어떤 흡수띠의 파장에 가까우면, 이 과장에서의 印값은 대부분 그 흡수띠에 대응하는 흡수만을 반영한다( A2_1 記 가 커지므로). 그러나, 여하한 흡수 파장보다 멀리 떨어진 과장에 서의 [¢]값에는 모든 흡수띠의 기여가 대략 A i 紅에 비례하여 냐 타난다. 광회전성을 과장의 함수로 나타내는 것을 ORD 라 부른다. 원형편광된 빛이 광활성인 물질에 의해 홉수될 때, 편광의 방향 에 따라 홉광도의 차이가 난다. 따라서, 평면편광된 빛이 광활성 물· 질에 의해 흡수되면, 통과한 빛은 왼쪽 및 오른쪽으로 원형편광된 빛의 전기벡터의 크기에 차이가 난다. 이는 타원형으로 편광된 벗 으로 나타나며, 원형이색성 (CD) 는 타원윤 (e llipticity : e) 와 동등하다. (} =2 . 303 (AL-AR) 180/411: (7-5) AL 과 AR 는 각각 왼쪽 및 오른쪽 원형편광된 빛의 홉광도 (ab- 드 sorbance) 를 나타낸다. CD 는 보통 몰타원융([(}〕)로 나타내며, 이는 몰홉광계수와 다음의 식으로 연관지어진다. [(}] = 3, 300 (eL -e 파 (7-6) 고유광회 전도([¢])와 몰타원율([(}〕)는 Kronig -K ramers 전환이 라 불리는 일련의 적분에 의해 서로 연관지어진다. 따라서 모든 파 장에서의 ORD 가 알려지면, CD 믈 계산할 수 있으며, 이의 역도 성립한다. [江) ] =추\: 앙부 1 『' dl' [O (l)] = -우 : 멋詐 dl' (7-7) 그림 7.10 은 하나의 허용된 전이에 대한 흡수, ORD 및 CD 의 관계를 보여 준다. CD 와 ORD 현상을보통
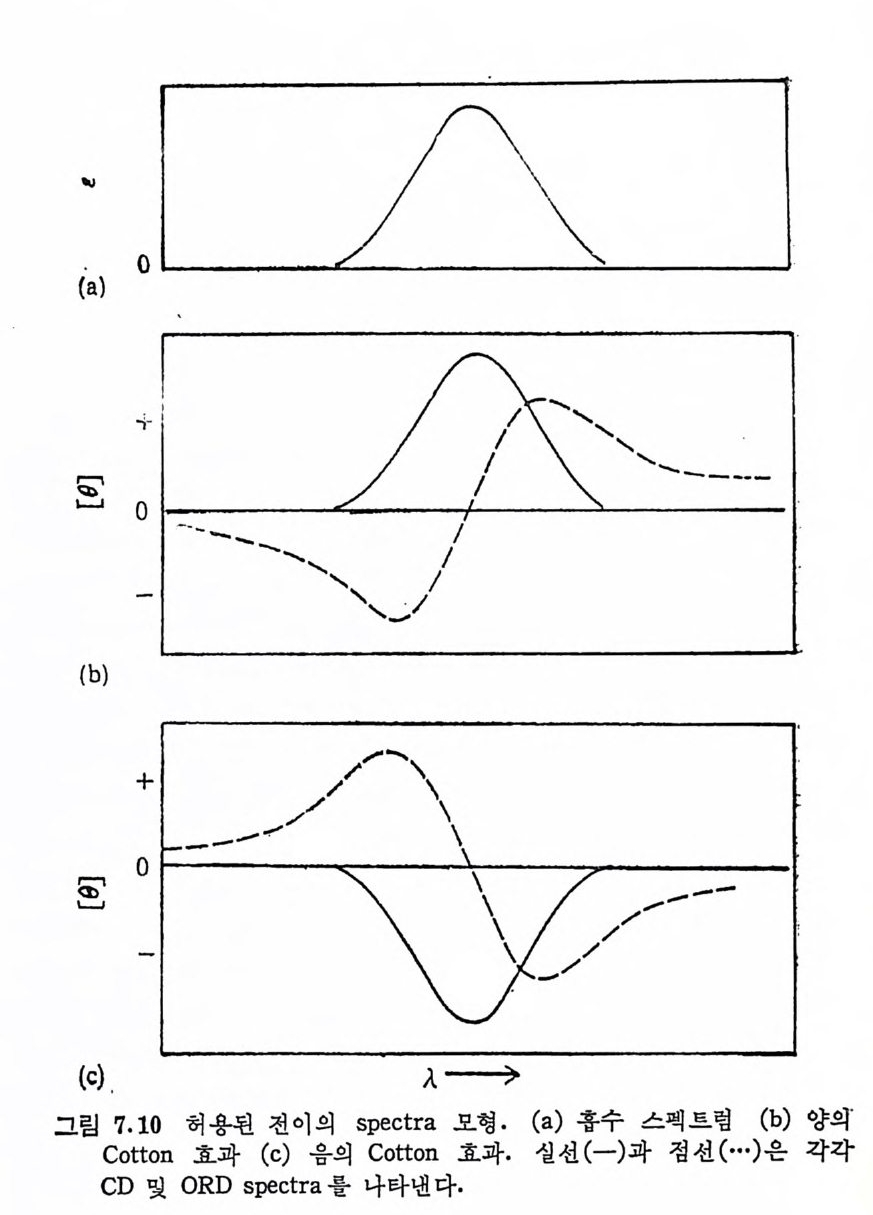 `
`
양(+)이면
7. 2. 3 Glyc osami n og l yc ans 의 Cot ton 효과-일 반적 성 질 Glyc osami no g ly c ans 의 180 nm 이 상에 서 의 Cott on 효과는 대 부분 hexosami ne 의 aceto ami do (CH3CONH 一) 기 의 전 이 에 의 한 것 이 라는 것 이 Bey c hok 과 Kabat ( 7. 23) 에 의 해 제 안되 었 다. 이 는 aceto a mi do 기(c <가 t >없J 는=- jm§>alt )o s 을e 와이 용am하y 여lo se분 의석 하OR면D 결i 。과값를이 <1on 5e0-ntem r m가 D얻ru어de지 식는 > 반면에, 2-ace t oam i do 기를 갖는 혈액형 물질의 gly c op ro te i n (약 75% 가 탄수화물)의 ORD 에서는 220nm 부근에서 ORD p eak 를 보 이 는 것 에 서 추정 되 었 다· 또한 2-aceto a mi do hexose 의 CD 는 200 ~210nm 부근에서 흡수띠를 보이는데, 이는 a-p ol yp e pti des 의 233nm 부근의 ORD 띠로 알려진 am i de 의 n- 군 전이에 대응하는 aceto ami do 기 의 n- 군 전 이 로 설 명 된 다. a-po lyp e p tide s 의 ami de 의 n- 군 전 이 는 약 222 nm 에 서 일 어 난다. 이 값과 aceto ami do 당 류의 210 nm 값과의 차이 는 po lyp e p tide s 의 ami de 기 가 당류의 am i de 에 비해 보다 소수성인 환경에 있는 것으로 설명된다. 일반적 으로 n-1r* 전이는 매체의 극성이 감소할수록 blue sh ift 를 보인다. Sto ne (7. 22) 은 대 부분의 GAG 및 GalNAc 등의 CD spe ctr a 에 서 210 nm 의 부근의 pe ak 이 외 에 도 190 nm 부근에 서 aceto ami do 기 의 T 一군전이로 간주될 수 있는 또 다른 p eak 가 관찰된다고 보고 하였다. 이와 같은 ace t oam i do 기의 n- 군 (~210mm) 및 1r-1r* (~190nm) 전이의 지정은 아직도 그대로 받아지고 있다· 그림 7.11 은 S t one 에 의해 보고된 GAG 의 CD s p ec t ra 둘이다. 이 그림에서 DS 의 spe ctr u m 은 240 nm 에 서 양의 pe ak 가, 그리 고 215 nm 부근에 서는 음의 pe ak 가 190 nm 에 위 치한 큰 음의 pe ak [〔。〕 n 。:::: 16, 000°] 의 꼬리 부분과 겹쳐서 나타남을 보인다· 또한 Ch4-S 와 Ch6-S 는 CD 띠의 모양은 비슷하나 [O 〕값이 큰 차이를 보이고 있다· 그러나 다른 연구팀에 의한 DS 의 CD 에서는 240 및 215nm 의 peak 가 관 찰되지 않았으며, Ch 4- S 와 Ch6-S 의 〔 O 〕값의 차이도 관찰되지 않 았다 (R3) . 이 에 서 , Sto ne 의 spe ctr a (그림 7• 1l) 에 사용된 DS 와 €S 시료의 순수성에 의심의 여지가 있다.
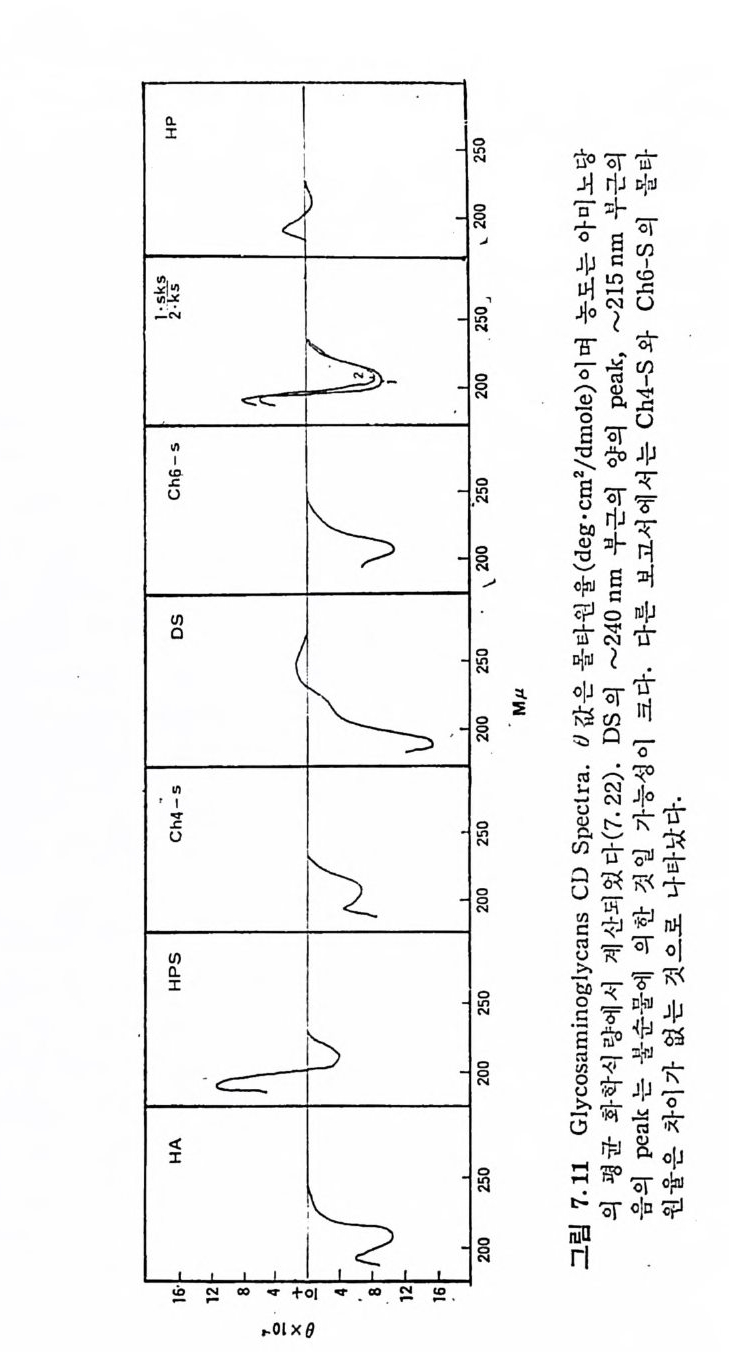
GAG 의 ORD curve 는 CD 의 결과를 반영하다. CD 에서 190nm 부근에서 강한 양의 p eak 를 보이는 HPS, HP 밋 KS 에서는 장 파 장(예로, Sodiu m D li ne) 에서 양의 광회전을 보이나, 다른 다당류에 서는 음의 광회전을 나타낸다(표 3.2 참조). 그리고, 모든 GAG 는 220 nm 부근에 서 210 nm 의 CD pe ak 를 반영 하는 ORD tro ug h (음의 peak)가 관찰된다. GAG 분자의 화학적 구조와 CD 의 비 교에 서 , 210 nm 부근의 CD p eak 는 ace t oam i do 기의 n-+ 군전이에 의한 것으로 설명되었으며, 많은 보고는 C00H 기에 의한 이 파장영역에서의 CD 기여 를 고려하 지 않았다. 이 는 COOH 기 를 포함하지 않은 KS 가 210 nm 부근에 서 다른 GAG 와 유사한 크기의 CD 값을 보아며, N-ace ty l 화 정도 가 낮은 HP 와 HPS 에서는 210nm 의 CD 값이 아주 적은 것에서 얻은 결론이다• 그러나, GAG 의 CD 는 p H 에 따라 민감하게 변하 는 것이 관찰된다. 이는 p H 에 따른 GAG 의 구조변화에 의한것이 라기보다는, uronic ac i d 의 산―염기 평형에 의한 것이며, 따라서 210nm 부근의 GAG 의 CD 에는 COOH 기도 상당히 기여하고 있음 이 밝혀 졌 다 (7. 24) . 또한, IdUA 에 연 결 된 hexosami ne 의 ami de 의 n-+ 군 전이는 CD 에서도 거의 관찰되지 않으며, HP 과 DS 의 210nm 부근의 CD 는 대부분 uronic acid 에 의한 것으로 설명되 었다. GAG 의 CD 에서 T- 군 전이 영 역 (~190nm) 의 부호는 gly c osid i c 연결의 위치에 따라 다르다. 1-+4(uronic a ci d-.hexosam i ne) 로 연결된 HP, HPS 빚 KS 는 강한 양의 T 一군전 이 pe ak 를 보이 나, 1-+3 로 연결된 HA, Ch4 -S, Ch6-S 및 DS 는 이 영역에서 양의 CD 값이 적거나 아니면 음의 값을 갖는다. 이와 같은 당류간의 연결 위치와 T 一군 전이의 CD 부호와의 상관 관계는 N-ace ty l 화된 아미노당의 o lig omer 에서도 관찰된다. S t one(R4) 는 ~190nm 에서 양의 CD 를 보이 는 GAG 에 서 는 질 소원 자와 uronic ac id C-3 ( KS 에 서 C-2) OH 사이에 수소결합을 하는 반면에, 음의 CD 를 보이는 GAG 는 질소원자와 C-2 위치의 OH 간에 수소결합을 하고 있다고제안하였 다· 그러나 이와 같은 수소결합을 한 분자 모델은 앞에서 검토된
고체상태의 X- 선 회절 결과 에서는 제시되지 않았으며, 또한 다른 물리화학적 실험에서 도 확인되지 않았다. 7. 2. 4 Glyc osami n og l y c an 의 단당류 성분의 sp e ctr a 180nm 이상의 파장에서의 GAG 의 CD 는 앞서 언급된 바와 같 이 aceto ami do ( 一 NHCOCH3) 기 의 n-+1r* 및 T 一군 전 이 로 해 석 되 어 왔다. 그러 나 COOH( 또는 -c oo 기기의 7r->7r* 및 n- ► 군 전이도 ace t oam i do 기의 전이와 유사한 파장 영역에서 일어난다. 따라서, GAG 의 s p ec t ra 의 설명은 일차적으로, 이를 구성하는 단당류 성분 둘의 sp e ctr a 와의 비 교에 서 비 롯된 다. GAG 의 hexosami ne 부분인 GlcNAc 와 GaINAc 는 바 록 크기 에 는 약간의 차이가 있으나, 모두 ace t oam i do 기의 n-+ 군 전이는 210 nm 부근에서 그리고 1r-+1r* 전이는 ~190nm 에서 관찰된다. n-+ 군 전이는 anomer 구조 (a 또는 8 연결)에는 거의 무관하며, 1-+4 릿 1-► 6 이 당류 연결도 11-► 군 전이 에는 큰 차이를 보이지 않는다. 반 면에, T-> 군 전이는 anomor 구조, 치환기의 위치 및 연결 위치에 따라 큰 차이가 난다. 특히 C-3 위치가 치환된 경우는 190nm 에 서 음의 CD 를 보아나, C-4 위치가 치환되면 반대로 양의 CD 값이 중대 된 다 (그립 7. 12). 이 는 앞서 언급된 1-+4 로 연결된 GAG 가 T-+ 군 영역에서 강한 양의 CD p eak 를 나타내나, 1-+3 로 연결된 GAG 는 약하거나, 아니면 음의 CD p eak 를 보인다는 S t one 의 일반론 을 뒷받침하는 것으로 볼 수 있다. GAG 의 또 다른 성 분인 uronic ac id 의 카르복실 기 의 n-+1r* 및 T_ >군 전이도 ace t oarn i do 기의 전이와 유사한 영역에서 . 일어난다. uronic a ci d 의 CD 는 C-4 위치의 OH 기의 배향에 다라 크게 차이 가 난다· 그리고 COOH 기의 이온화 정도에 따라서도 전반적인 CD 의 양상이 민감하게 변한다 (7.26). uronic ac i d 의 전형적인 CD sp e ctr a 를 그립 7. 13 에 서 보여 주며 , GlcUA 와 IdUA 의 meth y l gl yc osid e s 의 몰타원융 값을 표 7. 2 에 정 리 하였 다. 정 상적 인 C-1 의 자형 구조에 서 , C-4 위 치 의 OH 가 수평 (eq uit ori a l ) 방향 인 uronic ac id gl yc osid e 는 gl ucuronosid e 와 mannuronosid e
 (A) ~ )
(A) ~ )
몰 둘 수 있으며 , 축 (a xi al) 방향인 것 으로는 idu ronosid e , gu lu- ronosid e 와 ga lactu r onosid e 를 들 수 있 다· 따라서 GAG 의 GlcUA 부분은 그림 7.13 의 ®와 유사한 CD 를, 그리 고 IdUA 는 ®의 거 울상과 같은 CD 를 보일 것으로 예상된다. IdUA 와 같은 04 가 축방향인 uronic acid 의 CD 는 pH 에 따라 210nm 부근의 CD 는 pe ak 위치의 변화가 없이 크기만 변한다. 반면에, 04 가 수평방향인 경우에는 n- 군 전이의 CD p eak 가 두 곳에서 관찰되며, 이들의 상대적 크기나 위치는 p H(COOH 의 산 一염기 평형)에 민감하게 변한다. 이를 GlcUA 의 p H 에 따른 CD spe ctr a 를 예 로 들어 그림 7. 14 에 서 보여 준다. GlcUA 와 같이 04 가 수평방향인 uronic a ci d 에서 관찰되는 COOH 기 의 n- 군 전 이 (205~240 nm) 의 두 개 의 CD pea k 을 초기 에 는 이 발색단의 salvati on 여부에서 기인되는 것으로 설명하였다.
표 7. 2 Meth y lg l y c osid e s 의 CD spe ctr a 의 [O] 값 (7. 26) D-G iu c uronosid e D-Iduronosid e 파장 a p a: nP (nm) 산 염 산 염 산 염 산염
190 -6270 -5170 -4780 3220 -17500 5600 195 -480 -980 -1020 -940 920 2480 -2 240 5040 200 1520 0 2120 1410 4140 2810 5220 3730 205 2450 -610 3450 1020 6160 4420 9330 5600 210 2440 -1340 3530 -470 7270 5430 11600 8020 215 1840 -1550 2670 -1020 7220 4880 11900 7090 220 870 -990 1490 -780 5930 2940 9700 4480 225 0 -440 310 -550 4230 1290 7090 2050 230 -570 -150 -430 -240 2350 460 3730 560 235 -630 -40 -630 • -80 1010 90 1680 0 240 -500 0 -240 0 370 0 0 0 245 -270 0 -80 0 140 0 0 0 250 -90 0 0 0 0 0 0 0그러나, 현재에는 이들은 각각 다른 COOH 기의 회전이성체를 반영 하는 것으로 설명되고 있다 (7.26). 표 7.2 의 IdUA 와 GlcUA 의 CD 타원울 ([O J) 비교에서, 우리는 IdUA 가 210nm 부근에서는 GlcUA 에 비해 3~5 배의 강한 CD 값 을 나타냄을 볼 수 있다. 또한, IdUA 의 210nm 부근의 CD 값은 N-acety lh exosami ne 의 같은 과장 범 위 의 CD 값과 비 슷한 값을 나 타낸다. 이 는 GlcUA 를 포함하는 GAG (Hs , cs) 의 210 nm 부근의 CD 는 대부분 hexosami ne 에 기 인된다고 간주될 수 있으나, IdUA 를 포함하는 GAG(HP, HPS 및 DS) 의 CD 에는 IdUA 의 기여가 아 주 큰 비중을 차지할 것이라는 것을 짐작하게 한다. 더우기, HP 과 HPS 의 hexosa mi ne 의 상당량이 N-sul fat e 된 점을 고려한다 면, 이들 다당류에서는 IdUA 의 전체 CD 에의 기여가 더욱 큘 것 으로Ur o여n겨ic 진 a다ci.d 의 COOH (또는 coo-) 기 의 n-n* 전이 의 정 확한 위
 30
30
치는 아직 확인되지 않았다. GlcUA 수용액의 진공 UV 에서의 CD 는 185nm 이상에서는 r 一군 전이로 해석될 수 있는 CD p eak 가 보이지 않으나, 고체 상태의 fi lm 에서는 182nm 에서 약한 양의 p eak(Na 염의 경우,) 또는 음의 p eak( 산성형의 경우)가 관찰되었다 (7. 27). 이들 p eak 는 COOH 기의 T 一군 전이에 의한 것으로 해석될 수 있으나, 당의 고리산소에 의한 것이라는 가능성도 배제시킬 수 없다.
7. 2. 5 pH 에 따른 Glyc osami no g ly c ans 의 CD 변 화 다가이온(p ol yi ons : 예로 GAG, 단백질, 핵산)의 구조는 흔히 pH 에’ 따르는 이들의 광학적 성질의 변화에서 규명된다. 이의 좋은 예가 po lyp e p tide s 의 a-helix 정 도와 CD 와의 상관관계 이 다• 보다 확실 한 구조적 정보를 얻기 위해서는 제 6 장에서 취급된 유체역학적 성 질도 광학적 성질과 병행하여 연구된다. GAG 의 pH 에 따르는 Cott on 효과의 변화를 가장 잘 보여 주는 것으로 그립 7. 15 의 HP 의 ORD 를 들 수 있 다. HP 의 CD 도 ORD· 에서 예측되듯이 pH 에 따라 크게 변한다. 죽, 중성의 HP 용액을 산성화시키면, pH 5 부근에서 210nm 의 CD 의 음의 peak 가 2 배 정도 중대된다. 이를 DS 와 같이 보여 주는 것이 그립 7.16 이 다· 초기에는 그립 7.15 및 7.16 에서 보는 바와 같은 p H 에 따르 는 큰 HP 의 광학적 성질의 변화를 HP 의 구조전이 (confo r mati on al 독t r립ans 적 iti 인on )전 를위 반 차영 적하 정는 법 것(po으 te로 n t i o간m 주et하r i였c 다tit·ra ti 그on러 ) 에나 ,의 해C D계 의 산 변된 화c율oo은- 기의 COOH 화 정도에 비례하는 것으로 밝혀졌다. 즉, HP 의 pH 에 따른 CD 빚 ORD 변화는 coo- 기의 산-염기 평형 (p Ka) 으로 잘 설명된다 (7.29). HP 이외의 다른 GAG 의 pH 에 따른 CD 변화도 대부분 GAG 의 uronic ac id 성분의 산-염기 평형으로 설명되며 p H 에 따른 CD 변화의 측정은 -COOH 기의 p Ka 를 결정하는 데 이 용될 수 있다 (7.24). 다음은 p H 에 따른 GAG 의 CD 변화의 일반적인 양상을 정리한 · 것이다· (1) IdUA 를 포함하는 DS 와 HP 의 CD 는 p H 가 중성에서 산성 이 됨에 따라 220nm 부근의 음의 타원울이 중대된다(그립 7.16, 참조). 210nm 부근의 CD 변화량은 COOH 기의 중화량에 비례 한다. 그러나 230nm 부근의 HPS 의 CD 는 단일의 p Ka 를 갖 는 COOH 의 중화도에 비 례 하지 않는다. (2) GlcUA 물 포함하는 HA,CS 의 CD 는 산성화에 따라 230nm 부근의 음의 타원울은 COOH 의 양에 바례하여 증대한다· 그러 나, 210 nm 부근의 읍의 CD 값은 오히 려 감소하고, COOH 0J= -
4.0 +. 0)2 I 1·111.”mrlIIIII. 3.5 N'OL 4 X 11·_·1_:H_·laI,1©,6_ 11II1 . `.,.`.\` 8 `,.,.I 3.0 1·1220 ·'2 30 240 . 250 260 mµ ’ c'OL __ X0 2.5 I | \ \ f、. “.\t\.-.-- 2.0 ·!' l` ..-. 츠5.4-- I-.. .. 6•. .. .. . .. 홋견·I 1.5 1.0 220 230 240 ?50 260 270 280 Waveleng th (m 피 그립 7.15 Hepa rin 의 pH 에 따르는 ORD 변화. 1~7 곡선은 각각 pH 7. 0, 6. 1, 5. 5, 5. 0, 4. 4, 3.1 및 2. 7 에 서 측정 된 것 이 다. 삽입 그립 은 1 과 7 의 차이 문 나타낸다 (7,28),
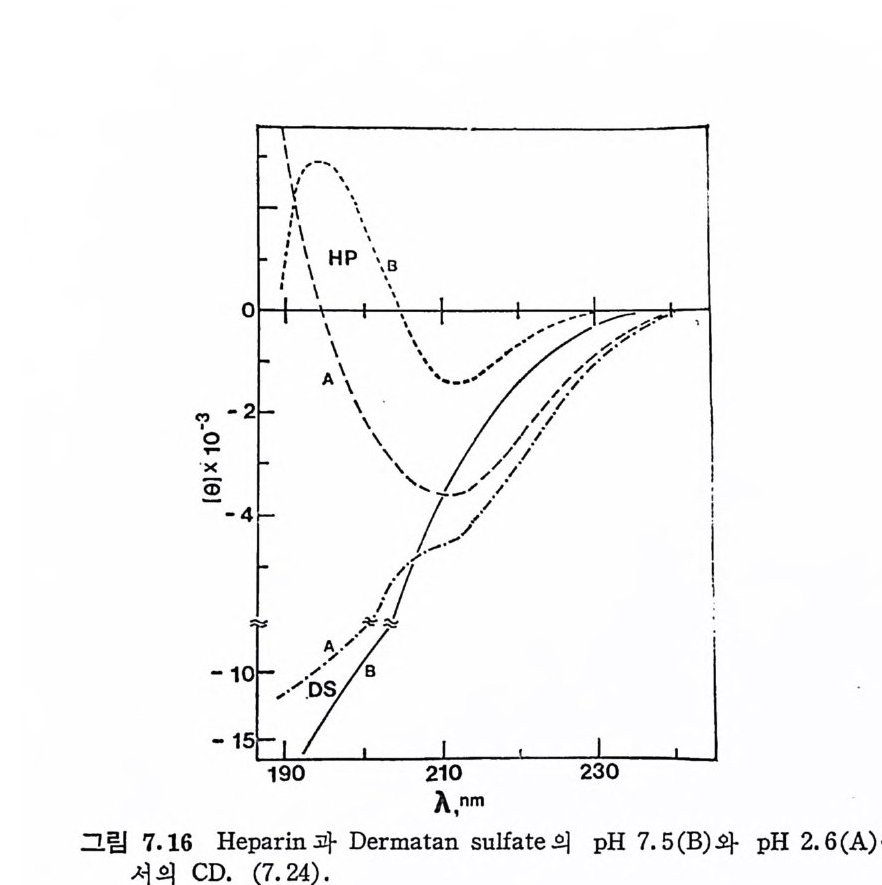 7
7
과 CD 감소량은 정비례하지 않는다. HPS 의 230nm 부근의 CD 변화가 단일 p Ka 값을 갖는 COOH 의 중화도와 비례하지 않는 것은 이 다당류에 존재하는 GlcUA 와 IdUA 의 p Ka 가 서로 다른 것으로 설명된다. GlcUA 를 포함하는 다당류의 210 nm 부근의 CD 변화가 GlcUA 의 중화도와 정 비 례 하 지 않는 것은, 비록 p H 에 따른 GAG 의 CD 변화가 C00H 기의 중 화를 크게 반영하는 것이긴 하나, am i de 의 CD 도 p H 에 따라 약 간 변함을 의미한다. p H 와 GAG 의 210 및 230nm 의 CD 변화의 상관관계를 그림 7.17 에서 보여 준다· GAG 들의 중성용액에서의 210 및 230nm 에서의 [8] 값과, 산성 화에 따른 이들 값을 표 7.3 에 요약하였다· 이 표는 GlcUA 몰 포 함하는 다당류의 210nm CD 값은 p H 에 따라 크게 변하지 않는 반
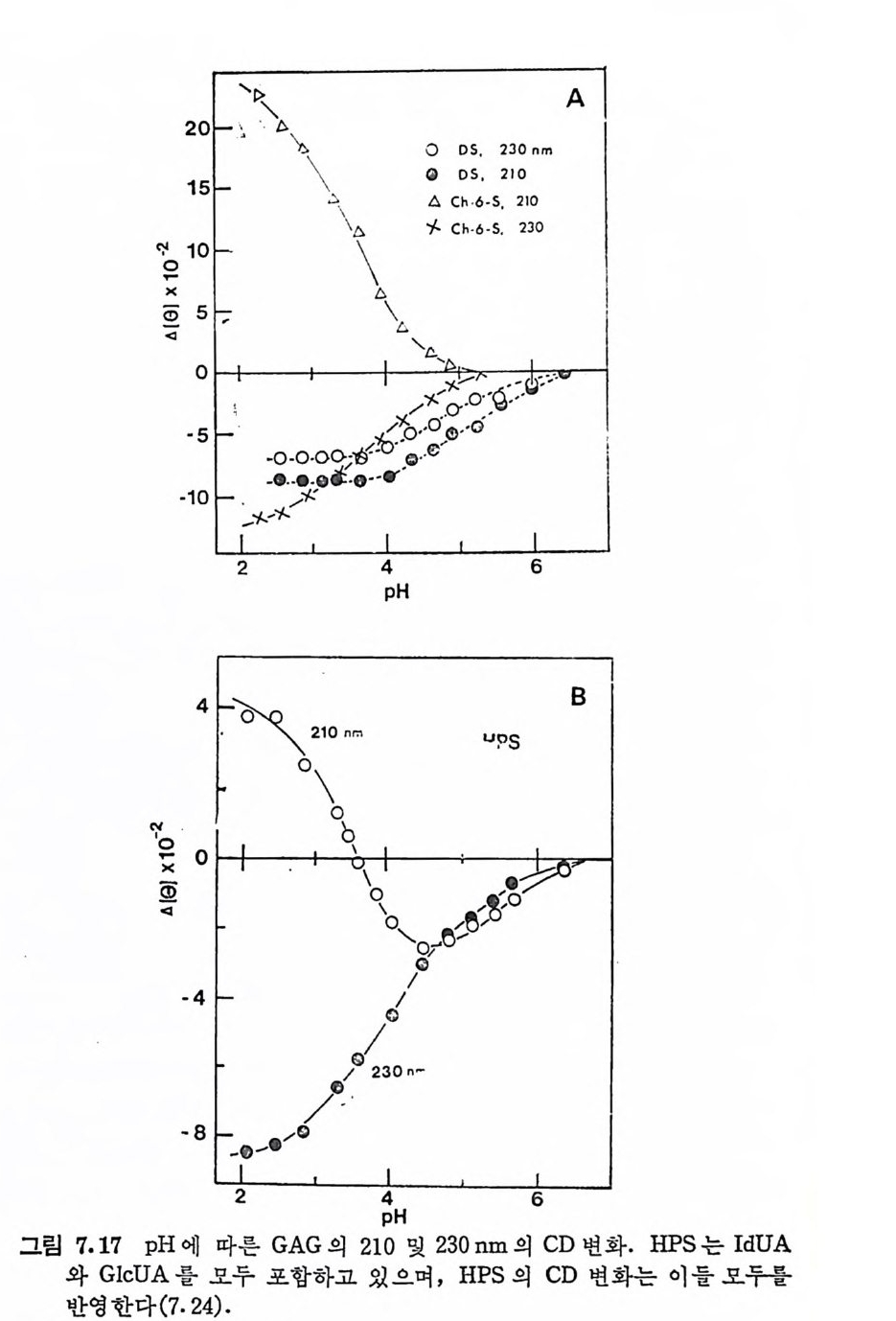 여~ 2100[} -`’』 \ \ \^\ +소 CChh .•6 S· 5 ., 2?m3 0 A
여~ 2100[} -`’』 \ \ \^\ +소 CChh .•6 S· 5 ., 2?m3 0 A
표 7. 3 Glyc osami no g ly c ans 와 이 의 uronic aci d 단위 제 의 CD 값 띠는 deg /c m2dmole X 10-3 으로 표시 (7. 24) . 210nm 230nm 시 료. Uronic aci d ( %) * [8] ** 』〔 O 〕 * * 切** Ll[O]** hy a luronic ac id Glu (100) -16.1 +1.5 -1.3 -1.5 -ch ondroit in G!u (IOO) -6. 8 +1. 6 -0. 52 -0. 62 chondroit in 4-sulfa te . Glu (IOO) -6. 3 +1. 7 -0. 56 -0. 93 chondroit in 6-sulfa te Glu (IOO ) -5.9 +1.8 -0.55-0.89 -cb ondroit in m eth y l este r Glu-meth y l este r -5. 5 +o. 7 -1. 97 +o. 04 dermata n sulfa te IdU (10 0) -3. 72 -0. 84 -0. 28 -1. 1 hepa rin Idu(m ajo r ) Glu(mi no r) -2. 74 -1. 84 -0. 28 -1. 1 hep a rin -2 Idu(84)Glu(l6) -1. 45 -2. 35 -0. 21 -0. 79 N-desulf at e d hep a rin ldu(majo r )Glu(mi no r) -2. 09 一1. 94 -0. 23 -0. 77 N-acety la te d hep a rin ldu(majo r )Glu(mi no r) -1. 76 -2. 38 -0. 21 一 0. 96 hep a ran sulfa te ldu(33)Glu(67) -4. 55 +o. 41 -0. 28 -0. 84 11e -G lu* ** • Glu(lOO) -0. 47 +4. 00 -0. 24 -0.19 Me -ld u** * ldu (lOO) -5 . 43 -1. 83 -0. 46 -1. 89 * Glc 와 ldu 는 D-gl u curonic ac id 와 L-id u ronic aci d 을 의 미 한다. ** [O] 는 pH 7.5 에서 측정된 값이며 4[ 町 는 [8)p H2,6-[8] p H7,6 이다. *** Me -G lu. 와 Me -ld u 는 각각 P-m eth y l- g lu curonosid e 와 a-meth y l- idu ronosid e 을 나타내 며 표 7. 2 에 서 취 했 다.
면에, IdUA 를 포함하는 다당류의 CD 값은 아주 크게 변함을 보여 준다. 따라서, GAG의 GlcUA 는 210nm 부근의 CD 값에 큰 기여 를 하지 않으나, IdUA 는 크게 기여한다고 말할 수 있다. IdUA 울 포함하는 다당류 (DS,HP,HPS) 들의 210nm 부근의 CD 값은 hexosa- m ine 의 N-acety l 화 정 도에 거 의 무관함을 표 7. 3 에 서 알 수 있 다. (he p ar i n 과 N-acety la te d he p ar in을 비교). 반면에, 이들 다당류의 CD 값은 GlcUA 의 함량에 따라 크게 변한다. 이에서 Park 등 (7.24) 은 IdUA 와 연결된 hexosami ne 의 ami de 의 n- 군 전 이 는 CD 에 서 도 거의 관찰되지 않는다는 일반론을 제시하였다. DS 와 HP 의 CD sp e ctr a 및 이 의 pH 의 존성 은, 이 들의 uronic ac i d 의 주성분인 IdUA 부분의 CD 성질을 나타낸다. IdUA 부분의
CD 특성 (그립 7. 15) 이 DS 와 HP 에 서 크게 차이 가 나는 것 은, 이 들 이 각각 다론 구조를 하고 있는 것으로 해석될 수 있다. 앞서 보아 온 X- 선 회절 결과는 DS 의 ldUA 는 C- 1 구조를, 그리고 HP의 ldUA 는 1-C 구조를 하고 있는 것으로 해석되었다. X- 선 결과와는 대조적으로 용액 상태에서의 NMR 스펙트라의 분석은 HP 과 DS 의 IdUA 간의 구조적 차이가 없음이 보고되었다 (7.30). 따라서, DS 와 HP의 CD 차이는 단지 당류간 연결의 차이 (ldUA-hexosami ne 연 결은 DS 에서 1->3 이나 HP 에서는 1->4 이다.)에서 연유될 가능성 도 배제시킬 수는 없다. 7. 3 Glyc osami no g ly c a ns 의 구조전 이 수용액에서의 GAG 의 광학적 및 유체역학적 성질이 pH , 용액 조성, 온도 등에 따라 변하는 것을 GAG 의 구조전이 (confo r mati on :-, · t rans iti on) 에 의한 것으로 해석하는 것이 많이 보고되었다. 이들 브 고의 대 부분은, 보다 정 밀 한 실 험 에 서 단순한 uronic ac id 부분의 산-영기 평형이나, coo- 기의 이온결합에 의한 용액 성질의 변화로 수정되었다· 그러나 HA 용액에 대한 용액상태의 구조전이는 보다 확실한 실험적 중거로 뒷받침되고 있으며, 이를 여기서 중점적으로 기술한다. HA 의 구조전 이 는 낮은 pH 의 e t hanol- 물 혼합용매 에 서 의 CD 에 서 관찰된다. 앞 절에서 보았듯이, HA 수용액의 CD 는 p H 에 따 라 크게 변하지 않는다· 그러나, 산성 조건에서 약간의 e t hanol 을 첨가하면 HA 의 CD 는 그립 7.18 에서 보여 주는 바와 같은 큰 변 화를 나타낸다. 산성 혼합용매에서의 HA 의 CD 특성은, CD 226nm 부근에 약한 양의 타원율을 보이며, @ am i de 의 n- 군 전이는 관 찰되지 않고, ® 1r:-군 전이는 아주큰음의 타원울을 보이는 것 등 이 다. 이 와 같은 eth a nol 에 의 한 HA 의 CD 변화는 pH 가 -COOH 기의 p Ka( ::: 3.2) 보다 높을 때는 관찰되지 않는다. HA 의 구조전이에 따른 CD 의 변화량은 중화된 GlcUA 부분의 €00H 양에 비례하며, 전이는 좁은 pH , 온도 및 알콜함량의 범위
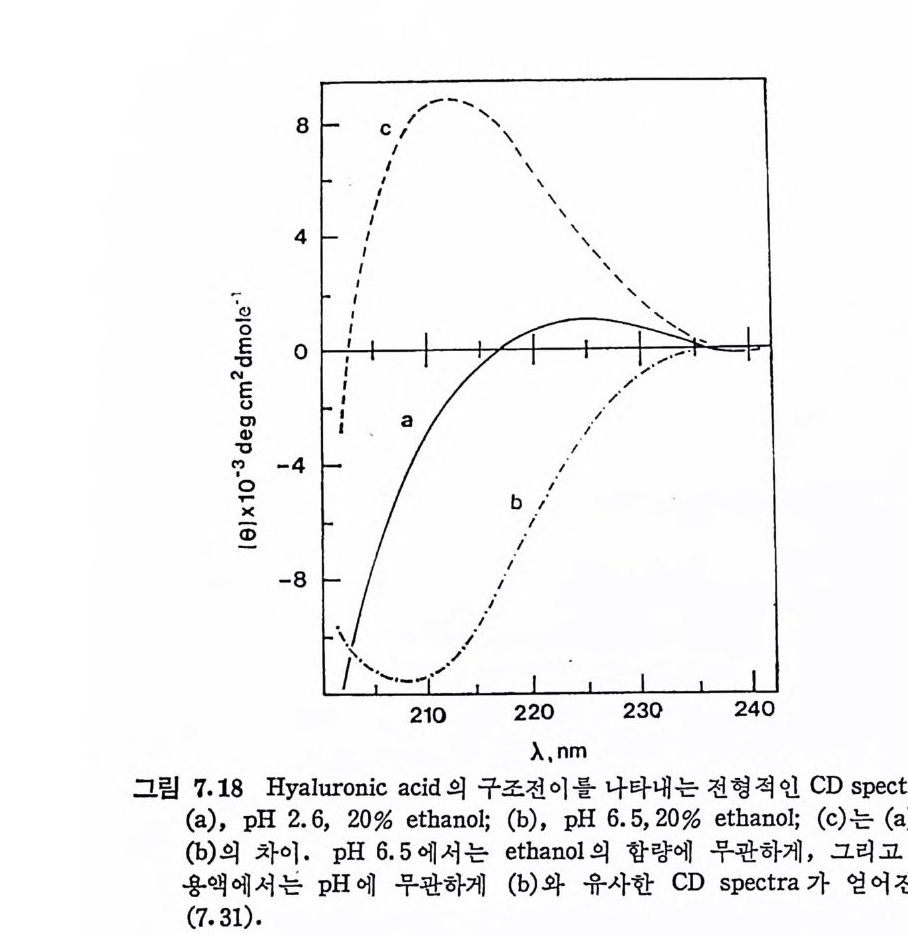 48 .’’,I I ’c’’ I // --` \ \ \ ’ `-\ \ \\\
48 .’’,I I ’c’’ I // --` \ \ \ ’ `-\ \ \\\
에서 협동적 (coo p era ti ve) 으로 일어 난다. 그림 7.19 는 HA 의 산성 eth anol 군 혼합용액 에 서 의 CD, 광회 전 (op tica l rota t i on ) 및 점 성 ~ 륭 온도에 따라 도시한 것으로, HA 의 구조전이가 좁은 온도법위 에서 일어남을 보이고 있다. HA 의 구조전이는 HA 의 COOH 기 를 에 스테 르화시 킨 HA-meth y l este r 나 HA 와는 hexosami ne 의 C-4 OH 의 배 향이 다른 chondroit in 에 서 는 관찰되 지 않는다 (7. 31). 또 한, HCONH2 와 같은 〈수소결합과괴제〉가 약간 첨가될 때도, HA 의 구조전이는 일어나지 않는다. 이들의 결과물 종합하여 Park 과 Chakraba rti(7. 32) 는 용액 에서 의 HA 의 구조 및 구조전이 를 X- 선 회절에서 얻어진 HA 의 구조모형 (7.1.1 참조)과 연결시켜 다음과같
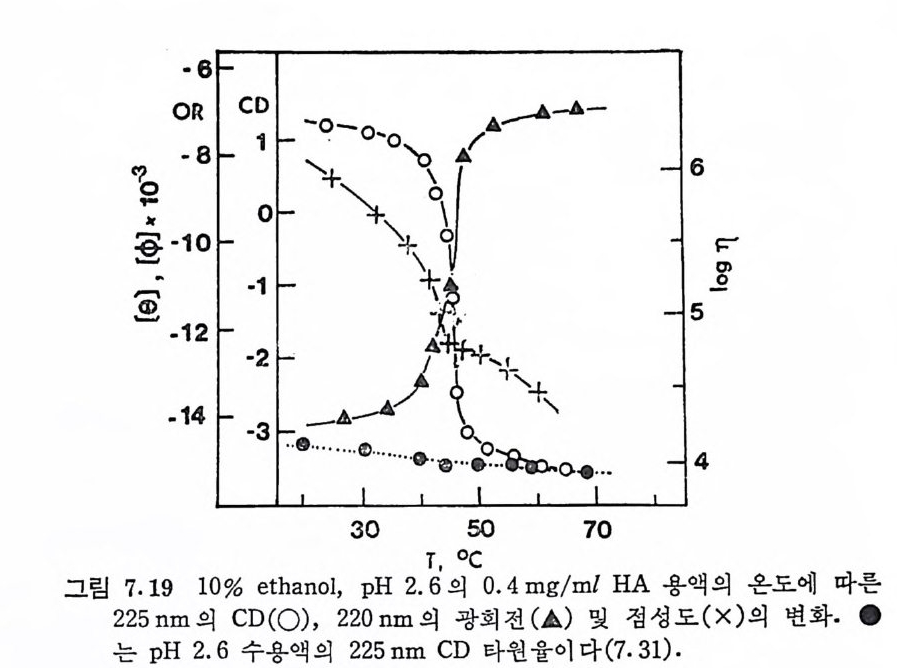 -6
-6
이 해석하였다. 1. 산성 의 eth anol 또는 다른 유기 용매 와 물의 혼합용매 에서 는 HA 는 X- 선 회절에서 제시된 4 배수 나사선 구조를 갖는다. 이 구조는 GlcNAc 의 C-4 위 치 의 OH 와 GlcUA 의 고리 산소, 그리 고 -COOH 와 -NHCOCH3 기 간에 수소결 합을 하므로 얀 정 화된 다. Chondroit in 과 HA-meth y l este r 는 위 의 수소결 합 되이 지가 않능는하다지. 않-C으O며O,H 기따 라와서 — NHHAC 에OC서H와3 기같 는은 수 구소조결 전합이에 가직 관접 찰관 여 하므로, 이 들의 T 一군 전 이 의 회 전 강도 (rota t i on al str en g th) 가 크게 중대된다. HA 의 구조전이는 아주 좁은 pH , 온도 영 역에서 일어나는 것으로 보아, 단일 HA 사술은 사슬전체를 동 하여 한 가지 구조만 가능한 것으로 여겨진다(단백질에서는 사 술의 일부만 나사선 구조를 하고, 나머지는 임의 코일형을 취 할 수 있다.) 2. 유기용매가 침가되지 않은 산성용액에서는 HA 분자는 3 배수 나사선 구조를 갖는다. 이 구조는 GlcUA 의 C-3 0H 와 GlcNAc
의 고리산소간에 수소결합을 하여 안정화된다. 이 구조는 산성 수용액의 HA 의 본성 접 성도([TJ])가 중성 수용액에서의 값보다 는 적 으나, 산성 e t hanol- 물 혼합용액 에 서 의 값보다는 크며 , H설C 명O 한N다H. 려 C O첨O가H에 와 의—해N H〔C TOJC]값H이3 는중 대모되두는 수 것소(결그 합립 에6 .5직 참 접조 )관를 여하지 않 으므로, 이들의 광학적 특성에는 큰 변화가 없다. 3. p H> p Ka 에서는 HA 는 분자내 수소결합을 하지 않은 임의 코 일 형으로 존재한다. 이는 HA 의 중성용액의 점성도가 HCONH2 에 무관하며, 용매의 조성이 CD 에 영향을 주지 않는 것을 설 명한다. 이 상에 서 , HA 는 생 리 적 조건 (pH : ::7 . 2' [N aCl]= 0.15M 펴 용액 에 서 임의코일형으로 존재합을 결론지을 수 있다. 제 6 장에서 언급 된 용액에서의 HA 분자사슬의 부분적 강직성은 HA 사슬의 당류간 의 수소결합에 의한 나사선 구조와 같은 〈질서된 구조〉의 형성에 의 해서라기보다는, 단순한 전하간 반발력에서 초래되는 것으로 여겨 진다. 그러나, 이 결론을 〈조직내에서 HA 분자가 임의코일형으로 존재한다.〉로 확대 해석할 수 없다. HA 는 조직내에서 부분적으로 는 높은 농도로 존재하며, 많은 양이온돌이 이 분자에 결합될 수 있고, 동시에 단백질이나 지질(세포막의 주성분)이 HA 를 비롯한 GAG 와 용이하게 회합한다. 조직내에서 HA 분자가 앞서 보아온 4 배수 나사선 구조와 유사한 구조를 가질 가능성이 고체 fi lm 과 HA-Cu 표 착물의 CD 결 과에 서 제 시 되 었 다. HA- 염 의 고체 film 의 CD 는, 산성 e t hanol- 물 용액 의 HA 의 CD 와 유사한 경 향, · 죽 210nm 의 n- 군 전이 p eak 가 관찰되지 않으며 190nm 부근의 서T-는> 군 a m전i이 d e —p eCauk+ 가+ c중he대la됨 ti o을n 을보 인나다타 (내7.는27) .2 5또0n한m H부A근-C의u 표양 의착 물C에D p eak 를 보이는 반면에, am i de 의 n- 군 전이는 관찰되지 않는다 (7. 33) . 이 는 Cu++ 가 coo-및 -NHCOCH3 기 와 분자내 chelati on 을 하여 4 배수 나사선 구조에서의 분자내 수소결합 (COOH 와 NHCOCH3 간)과 유사한 구조적 안정성을 나타낸다고 해석된다· 그림
7.20 @� HA ©���X� CD @� , 4 0�� ���� � l �p\�� t����� ��fi lm, �1� X� HA-Cu ++ ��a� � ��1� e t hanol m�t ��a� �� � X� HA X� CD |� D�P�\ � ��t��. ��a�������� 4 0�� ���� � l�p�|� ��� ��<�\� �Ũ��ɔ� HA �� -Cu \� � ��1� e t h anol- <� <�iթ�� �� � X� HA ��a� @� ��P� HA X� ��ij� ��D� L��� 0g el 0D� �1�
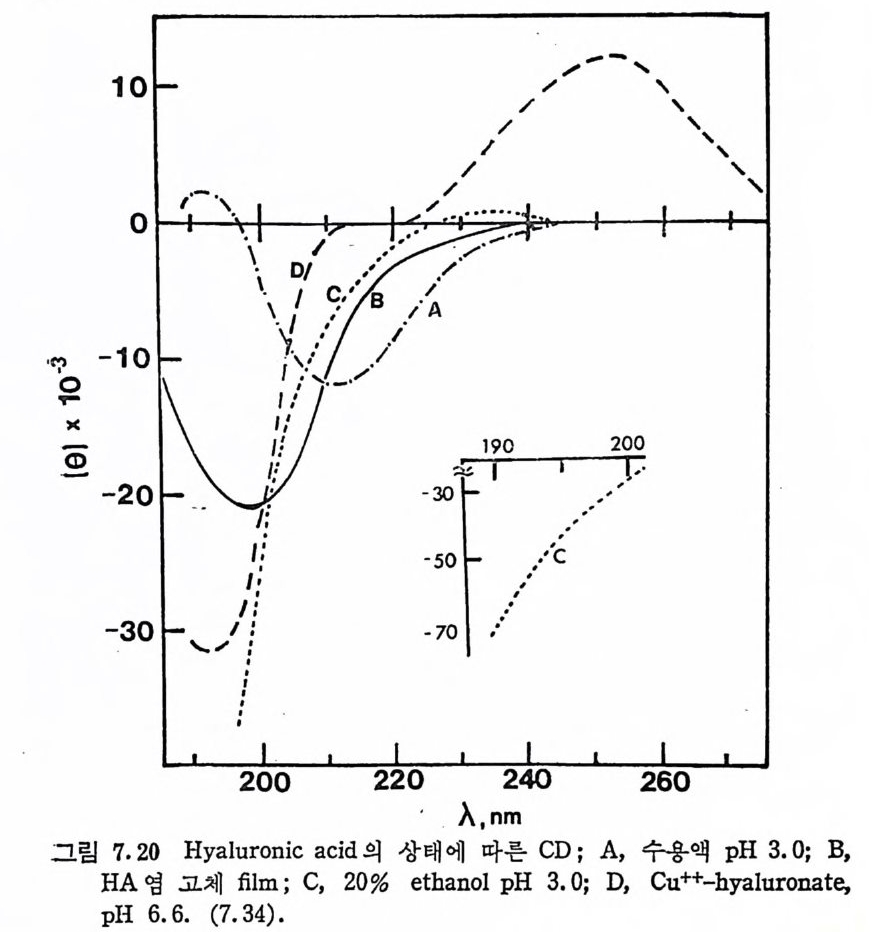 \��
\��
7. 4 적 외 선 및 Raman Sp e ctr a 분자의 진동에너지는 광에너지로 적외선(I R) 영역에 해당되며, IR sp e ctr a 의 분석 은 분자의 구조적 목성 을 규명 하는 데 유용하게 이 용된 다· 최 근에 는 Raman 분광법 에 서 Laser 를 광원으로 사용하 므로, 이 분광법의 효용성이 더욱 증대되었으며, Raman sp e ctr a 는 IR spe ctr a 와 상호 보완적 으로 분자의 진동에 너 지 분석 에 의 한 분자구조의 규명 에 활용되고 있다. IR 은 cellulose, chit in 등 많은 다당류는 물론 GAG 의 구 조 규 평에 이용되었다· 그러나 대부분의 다당류에 있어서 IR s p ec t ra 의 흡수띠의 지정이 명확하지 않은데, 이는 순수한 시료를 얻기가 힘 돌고, IR 띠의 폭이 보통 20cm-1 정도로 넓은 것에 기인한다고 여 겨진다. Laser Raman 분광법은 IR 에 비해 보다 좋은 분리능을 보 여 흡수띠의 지정이 IR 에서보다는 용이하다(그립 7.21 참조)· 표 7. 4 는 Bansil 등 (7. 36) 이 종합한 GAG 와 이 의 단당류체 의 Raman 주파수와 이의 지정을 보여 준다. IR 에서 얻을 수 있는 당 류의 구조에 관한 중요한 한 가지 정보는 당류간의 연결구조이다. 탄수화물의 a-anomer 의 Cl-H 변형 은 보통 840cm-1 부근에 서 관 찰되는 반면에, {3 -anomer 의 C1-H 변형은 890cm-1 부근에서 일어 난다. 이는 표 7.3 에서도 명확히 볼 수 있다. GAG 의 S03- 기의 -S-0 진동은 1200cm-1 부근에서, 그리고 -C-0-S 연결의 진동은
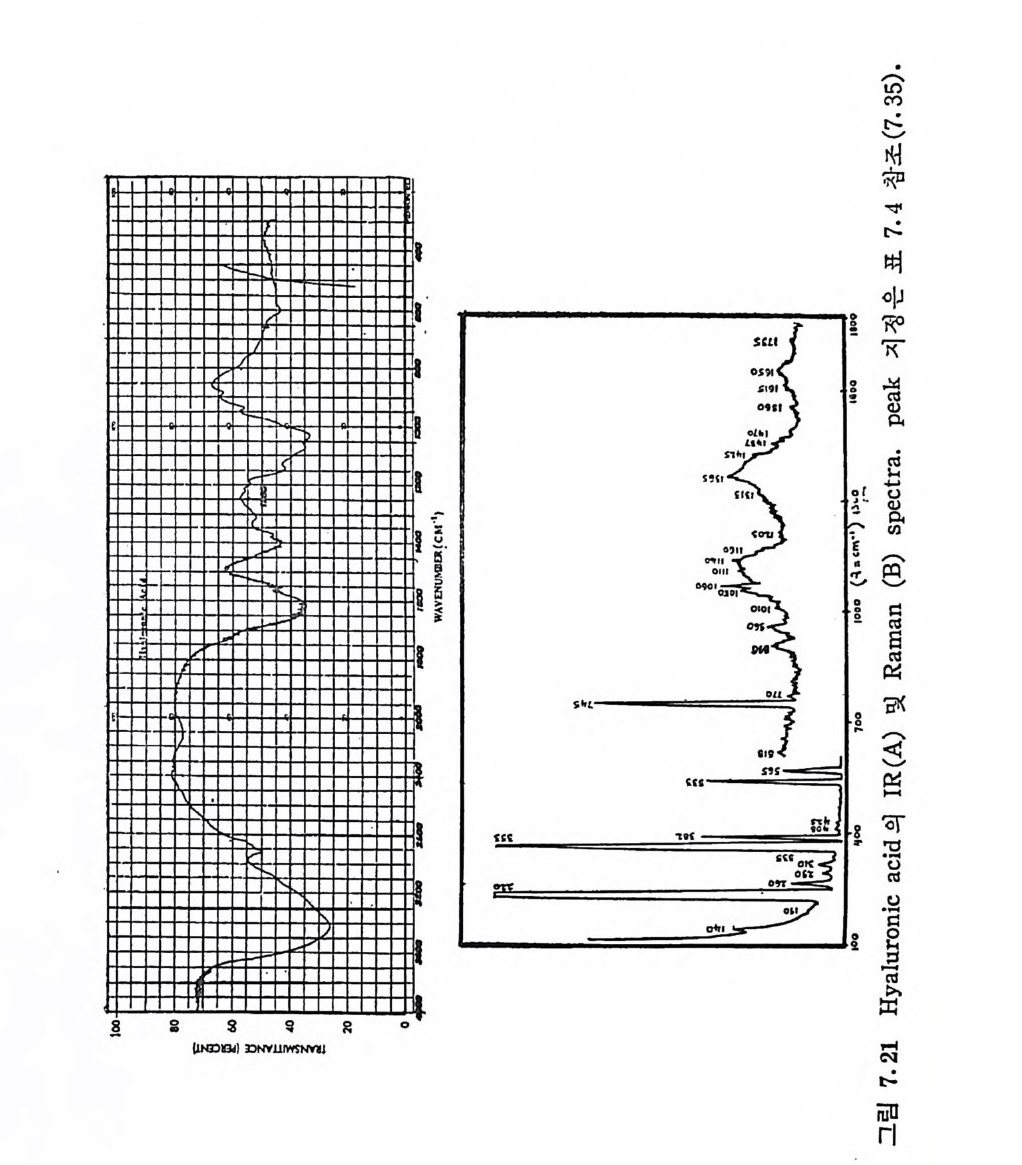 (
(
mnaaR당류. 주의e수7( )의단 3과 GA u-uNoecnl-rc-clDyt-t-eliAcyN da csaleas ommanlun aeocgstinmigeAcins itg 7()271saoOC bnv ro=f tii O HOCs)61)911 2 33s ((h wsesdI moA i l nIRan mi yi (95001 )(5w51w) dem IAIi (m624 1)(m6741 )C d2r emnHaoitof - cooesmrc myti (s83)13) s (1381 mmes 3cHC ryti mnroeda itof ,61) br s(33sI2 13)) eds (3113 m7IIA( i 1(w6612 (s5712)) w(327) hs(232)1yrame-3m ss0cit h(snorrecs gt tt R) In i ) w(5021s(6021 )hs(6ll5) m()5h15l hs8(41)1 ysaca와igmnol이n duSmo i ayal reonuht 41(0s 2(0 h61s))6 )(5165m b, )r85 {41ws) 2141((s) 5731m() 1331m() 862121m() 60 ll5m()3 7.4ycosl표G rn doonChiti au- 4setfl 63)1 (5s1(0m 55)4br51(6 ,) w1(1) s 14 (6)1s734 s)311 (h31s1) 4(1 (7)7w2b1 (9), 6rm2312 (w2)12 (w0)1IJ (w7)5 nord6 nhoC-tii ls uetaf 0161 4 )s)(h5s16(m(6 )051,) 951br4 (w3(s) 411(s) 77133(s) 04113(s b)021(w2 )8912(mb) r,1 712(w 7)3612(w) 0ll5(m)9
Q억φ럭k」li능{·“Q]l능,잉 i “벼B다이”’며김ω<야I”〔m。•ω섭u여。잉%u5‘@i여다뼈다 >∞ZN(엄Ql‘‘법l?(다。쩌Q업)m ) @·i。g}(ul;。〕엽깅φ。 (E)•S(∞∞@”ωu섭|R。im빌。kEgum ) 〕〔띠{Q」μφ m]i)컴((N}엽QS여。Zμ(| m mm ) (gm £ω()} N ()…(a)∞。( m),l。Q( (띠엉{}h(m()@m ) ) 4Q-。여},lω강mQ ·@t」〉벼。u여』;@iI: hia 이。∞ (E•∞)h}다E;。검〕(여·깅【 { lS ωsμ。E」mzm。}QX N(m∞ Q」응〔a움。l〕(ζ;-E))E )。Z·iωi:i。L;}g }。(;”a。야¢)l띠ζ·t,υ (t{h∞>) a。·다‘I잉QQlQi I iQ연m 。({>]N[m ) )([ @(띠{(] ” ) (∞m R g) {(@띠되) @ @(a∞{) @(E*) )∞n‘E(g i(E‘nh ) (a•g> ) ∞ 검.m걷s- .당1. 다ω 딩c〉~;:、;: 섭(*mN) g(B)g (Sg)g S)되(m g )‘RS。( ){。@<@(m )i。<(& { ” N(RN()} ∞)(∞∞m p∞h su디μ,킹;z。。 }}iiim”φv. , )h{잉ε( 피)∞mg∞( 띠‘∞[()S )({띠。@ (] )되(<”띠m a g(i되)띠s @日(h∞) {()되m@ @ h어。(m E) 딩∞(5 ) 않∞(m E∞m(;←)m ) @암(ε) l@ 。C。【;김〕{』i언 μφ【}m띠걷- [。[(Na ) g)。(ia >(N m) 되(a)”gm (<)。m”m되 )(되{ω ∞()잃 ” m‘£ m(& h )a (m) 되ω() ∞∞*(m ) 、,。0o.-e0. I “ 0、r0- -~ 。 ‘
15SU.8!SSV AtWJU? ! alIe oSw;)p I
a'IA13;}3U>llllIENS 0 (s) 쓰S ggz' L v(9 (s)60 ::m y )日 '1IA8 V2.! U! WBSOPE(EII1)1lg>OO -Y ,M』A -N g(E9 )C9U'9 :6(9A )900V w日() (A)suc !'(A)xp -q e o . 1 J:l!nUO g '.q(r ) :Q> nrDp-p-e )(tAl Z 9( s)Z늄S l9 (f,S )89 (E)LL6C(혼IV )>V술 8Cll1euomIeAqaleHnS1> aIl!POS ((A)NF!C:ir -ea 늠A)OKS 0J,6 LLV CW CIF A\ .. 9 umo.1puoqu ' (E)lv9'v69 . (A)Z>9 (A)I(6v (sq)6£ (lSi )N(AIV) 9(Al£) NVC )日 Z9-g ‘1 v umolpU1o 요 q:) n sHe(A)l£g)kO 9O L (s q)£00 g(VA> )6s(q)L E s(vq )m (s) IOO용(혼C7. 5 NMR Sp e ct ra 핵 자기 공명 (nuclear mag ne ti c resonance: NMR) 을 이 용한 GAG 의 구조에 대한 연구는 주로 캐나다의 Perlin 팀 (7.37 참조)에 의하여 수행되었다. 그림 7.22 는 D20 용매에서 얻은 몇 가지 GAG 의 양성 자 nmr spe ctr a 를 보여 준다. GAG 의 anomer 양성 자 (C1-H) 는 다른 양성 자에 비 하여 낮은 자 장영 역 에 서 공명 한다. hep a rin 밋 hep a ran sulf ate 의 hexosami n e 의 anomer 양성 자 (그립 에 서 AI 또는 a) 는 uronic ac id 의 anome:r 양성자 (Il 또는 b) 와 구분되어 5.2p pm 부근에서 관찰된다. 반면에, DS 와 Ch4 -S 의 anomer 양성 자는 이 보다 높은 4. 5~5. 0 ppm 에 서 공명한다. HP 와 HPS 의 Cl-H 가 보다 낮은 자장에서 공명하는 것 온 이 들 다당류의 hexosami n e (glu cosami ne ) 과 idu ronic acid 의 sulfa te 화에 의 한 shie l din g 효과로 설 명 된 다. Hexosami ne 의 N- ace ty l 기는 2.2p pm 부근에서 관찰되며, HP 에서 이 p eak 가 아 주 작게 관찰되는 것은 HP의 아민기의 대부분이 N-sul fati on 되어 있다는 것과 잘 일치한다. 따라서 다당류의 N-ace ty l 화 정도를 nmr sp e ctr a 에 서 추정 할 수 있 다. IdUA 을 포함하는 GAG(HP, DS 릿 HPS) 의 IdUA 의 구조에 대해 서 큰 관심이 주어졌음은 이미 언급되었다. Per li n(7.37) 은 이들 다당류의 nmr spe ctr a 에 서 HP 와 DS 의 IdUA 는 1-C 의 자형 구조 를 하고 있을 가능성이 크다는 것을 주장하고 있다 (7.37). 이의 이 유로 그는 @ I H-1 과 I H-2 의 coup ling 이 적 다, @ 13C nmr 에 서 C-1, H-1 의 coup ling 상수가 C-1 의 축방향 배 향과 일 치 한다. 그리 고 ® HP 의 uronic acid 의 C-1 및 C-6 pe ak 가 Gd (N0 3) 3 에 의해 크게 relaxati on 된다는 것을 들고 있다(1 3C nmr 은 7,37 참조). 그러나 이들 다당류가 정상적인 1-C 형을 하지 않고
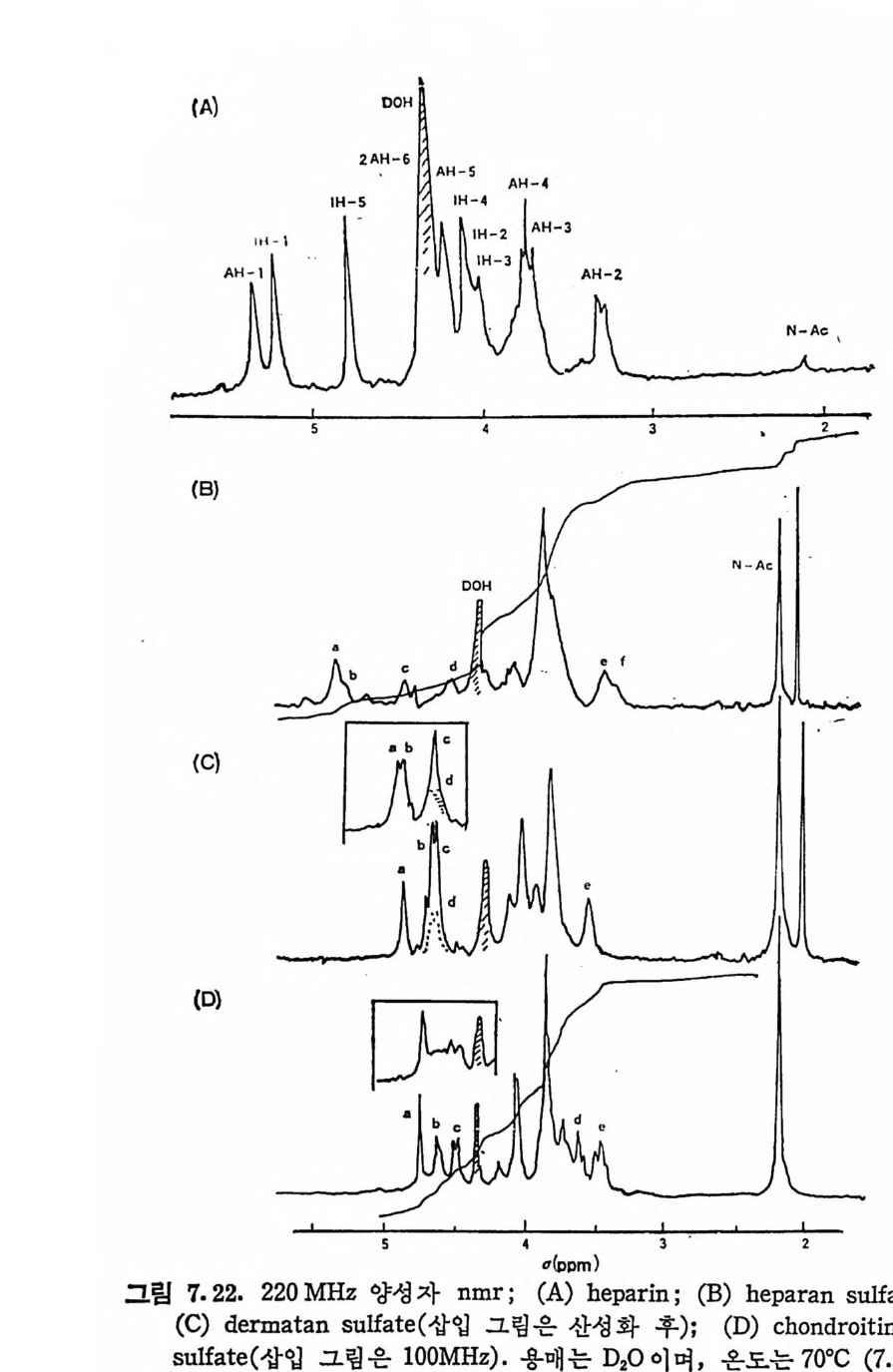 (A)
(A)
은 유동적임을 보였다 (7.39). 강직한 부 분 은 HA 사 슬 이 접 히거나 꼬리 를 형 성하여 분자 간 회합을 하고 있 는 것으로 설 명된다. 연골 PG 집 합체 와 Ch4-S 의 “C nmr sp e ctr a 비 교는, PG 의 GAG 탄소 의 80% 이상이 nmr s p ec t ra 에 기여하고 있 는 것 으로 나타났는데, 이 결과는 PG 집합제의 단백 질 부 분 은, GAG 와는 달리, 주 축 (back bone) 의 유동 성 이 계한되어 있 음 을 의미한다. 죽, PG 집합체의 주 축구조는 중심단백질에 의하여 규정된다고 볼 수 있다 (7. 4 0). * 추천문현 Rl 및 R2. 이 장의 실험방법에 관한 구 체 적인 내용은 6 장의 Rl 및 R2 인 Phy s ic a l Bio c hemi st r y 에 관한 책 을 참조. R3. B. Chakrabarti and J. W. Park, G!yc osami no g ly c ans: Str u ctu re and in te r acti on , CRC Re v, Bi oc hem., 8, 225~312 (1980). (이 장의 많은 내용이 Revie w 되 어 있 다. ) R4. A. L. Sto n e, Cir c ular dic h rois m and opt ica l rota t o ry dis p e rsio n in po lys a ccharid e str uc tu ral analys i s : in tr i n s ic and extr i n s ic Cott on effe c ts ; in Meth o ds in Carbohy d rate Chemi st r y , Vol. 7 R. L. Whi- stl e r and J. N. Bemi ller Eds, Academi c Press, New Yerk, (1976) pp.1 20. (초기의 GAG 에 대한 광학적 연구 결 과 를 기록하고 있으 나, 구조적 해석은 비평적으로 받아들이는 것이 요구된다.) * 인용문현 7. 1. F. A. Bett elh eim , An X-ray dif fra cti on inv esti ga ti on of sodiu m hy al uronate , ]. Phys . Chem., 63, 2069 (1959) . 7. 2. D. A. Rees, Con for mati on al analys is of po lys accharid e s. Part Il . Al ter nati ng cop o lym e rs of the ag a r-carrag e enan-chondroit in type by model buil din g in the comp u te r wi th calculati on of heli ca l pa ramete r s, ]. Chem. Soc. (B) , 217 (1969) . 7. 3. E. D. T. At ki n s and K. Sheehan, Str uc tu re of hy a luronic acid , Natu r e (New Bi ol .) , 235, 253 (1972) . 7. 4. J. M. Guss, D. W. L. Hukin s , P. J. C. Smi th, W. T. Wi nter , S. Arnott , R. Moorhouse, and D. A. Rees, Hy a luronic aci d: molec-ular confo r mati on s and int e r acti on in tw o sodiu m salt s, ]. Mot. Bi ol ., 93, 359 (1975) .
7. 5. W. T. Wi nt e r , P. J. C. Smi th, and S. Arnott , Hy a luronic aci d: Str u ctu re of a full y exte n ded 3-fo ld heli ca l sodiu m salt and com- pa ris o n wi th the less exte n ded '1-fold heli ca l for ms, J. Mal. Bio l ., 99, 219 (1975) . 7. 6. W. T. Wi nt e r and S. Arnott , Hy a luronic aci d: the role of div a lent cati on s in confo r mati on and pa ckin g , J. Mal. Bi el . , 117, 761 (1977). 7. 7. J. K. Sheehan, K. H. Gardner and E. D. T. At ki n s , Hy al uronic aci d: a double-heli ca l str u ctu r e in the pr esence of po ta s siu m at low pH and fou nd also wi th the cati on s, ammoniu m , rubid i u m and cesiu m , J. Mal. Bi ol . , 117, 113 (1977) . 7. 8. F. A. Be tt elhe i따 An X-ray dif fra cti on stu d y of calci um chondr-oit in sulfa te A, Bio cl zim . Bi op l zy s. Acta , 83, 350 (1964) . 7. 9. D. H. Isaac and E. D. T. At k in s , Molecular confo r mati on s of chondroit in 4-sulph ate , Natu re (New Bi ol .), 244, 252(1973). 7. 10. E. D. T. At kins and T. C. Laurent, X-ray- dif fra cti on pa tt er ns from chondroit in 4-sulph ate , dermata n sulph ate and hep a ran sulph ate , Bi oc hem. ]., 133, 605 (1973) . 7. 11. K. Tanaka, X-ray analyi s of the confo r mati on of chondroit in- 4-sulfa te calciu m salt, J. Bi oc hem. , 83, 325 (1978) . 7. 12. W. T. Wi nt e r , S. Arnott , D. H. Isaac and E. D. T. At k in s , chondroit in 4-sulfa te: the str u ctu re of a sulfa ted gl yc osami no - gly c a n, J. Mal Bi ol . , 125, 1 (1978) . 7. 13. E. D. T At ki n s , T. E. Hardin g h am, D. H. Isaac and H. Muir s X-ray fibe r dif fra cti on of carti lag e pro te o g !yc an ag gr eg a te s conta i n i n g hy a luronic aci d, Bi oc lzem ]., 141, 919 (1974) . 7. 14. J. J. Cael, W. T. Wi nt e r and S. Arnott , Calciu m chondroit in 4-sulf ate : molecular con for mati on and orga niz a ti on of po lys acc- harid e chain s in a pr ote o g ly c an, ]. Mal. Bi ol ., 125, 21 (1978) . 7. 15. S. Amott , J. M. Guss, D. W. L. Hukin s and M. B. Math e ws, Mucop ol ys accharid e s: comp a ris o n of chondroit in sulf ate con for ma- tion s wi th tho se of sulf ate d po lya nio n s, Sdence, 180, 743 (1973) . 7. 16. E. D. T. At k in s and D. H. Isaac, X-ray dif fra cti on stu dies on th e connecti ve tiss ue po lys accharid e s: molecular con for mati on s of dermata n s 따p ha te, J. Mo/. Bi ol ., 80, 773 (1973) . 7. 17. S. Amott , J. M. Guss, D. W. L. Hukin s and M. B. Math e ws,
Dermata n sulf at e and chondroit in 6-sulf at e con for mati on s, Bi oc - hem. Bio p hy s . Re s. Commun., 54, 1377(1 9 73). 7. 18. E. D. T. At k in s , I. A. Nie d uszyn s ki and A. A. Horner, Cr ys ta l l- iza ti on of macromolecular hep a rin , Bi oc hem. ]., 143, 251(1974). 7. 19. E. D. T. At k in s and I. A. Nie d uszyn s ki, Eff ec t of a-L-id u ronate confo r mati on on the molecular shap e of hep a rin , Fed. Proc., 36, 73 (1977) . 7. 20. S. Arnott and W. T. Wi nt e r , Deta i l s of gly c osami no g ly c an confo r mati on s and int e r molecular inter acti on , Fed. Proc. , 36, 73(1977). 7. 21. S. Arnott , J. M. Guss, D. W. L. Hukin s, I. C. M. Dea and D. A. Rees, Con for mati on of kerata n sulf ate , ]. Mo!. Bi ol ., 88, 175 (1974) . 7. 22. A. L. Sto n e, Op tica l rota tor y disp e rsio n of mucop oly s a ccharid e s. ill. Ultr a vio l et circ ular dich rois m and con for mati on al spe cif icity in ami de gr oup s , Bi op o l ym ers, 10, 739 (1971) 7. 23. S. Beyc h ok and E. A. Kabat, Op tica l acti vit y and con for mati on of carbohy d rate s . I. Op tica l rota tor y dis p e rsio n stu dies on im munochem ica lly reacti ve am ino sug a rs and th eir gly c osid e s, mi lk olig o saccharid e s, olig o saccharid e s of glu cose, and blood grou p ing substa n ces, Bi oc hemi stry , 4, 2565 (1965) . 7. 24. J. W. Park and B. C. Chakrabasti , Op tica l characte ris t i cs of carboxy l gr oup in relati on to the circ ular dic h roic pr op e rt ies and dis s oc iat i on consta n ts of gly c osami no g ly c ans, Bi oc him . Bi op hy s . Acta , 544. 667 (1978) . 7. 25. P. L. Coduti , E. C. Gordon and C. A. Bush, Cir cu lar dich rois m of olig o saccharid e s conta i n i n g N-acety la m ino sug a rs, Anal. Bi oc hem. , 78, 9 (1977) . 7. 26. E. R. Morris , D. A. Rees, G. R. Sanderson and D. Thom, Confo r mati on and circ ular dic h rois m of uronic aci d resid u es in gly c osid e s and po lys accharid e s, J. Chem. Soc. Perkin Il , 1418 (1975). 7. 27. . L. A. Buff ing ton , E. S. Py s h, B. chakrabarti. and E. A. Balazs, Far-ultr a vio le t circ ular dich rois m of N-acety lg l u cosam ine , gl ue-uron ic aci d, and hy a luronic acid , J. Amer. Chem. Soc., 99,. 1730(1977).
·7. 28. A. L. Sto n e, Ami de Cott on eff ec ts of hep a rin , Natu re (Lo ndon) , 216, 551(1967) 7. 29. J. W. Park and B. Chakrabarti, Ac id- base and op tica l pro p e rtie s of hep a rin , Bio c hem. Bi op l z y s. Res. Commun. , 78, 604 (1977) . 7. 30. A. S. Perlin , N!vIR spe ctr o scop y of hep a rin , Fed. Proc., 36, 106(1977) . 7. 31. J. W. Park and B. Chakrabarti, Op tica l pro p e rti es and vis c osit y of hy a luronic aci d in mi xe d solvents : evid e nce of confo r mati on al tran sit ion , Bi op o l ym ers, 17, 1323 (1978) . 7. 32. J. W. Park and B. Chakrabart i, Confo r mati on al tra nsit ion of hy alu ronic aci d: carboxy lic gro up pa rti cip a ti on and the rmal eff ec t, Bi oc him . Bi op h y s. Ac ta, 541, 263 (1978) ·7, 33. N. Fig ue roa and B. Chakrabarti, Cir c ular dic h rois m stu d ie s of cop pe r ( II )-hy a luronic acid comp le x in relati on to confo r mati on of the pol ym e r, Bi op o lym ers, 17, 2415 (1978) . 7. 34. B. Chakrabarti, N. Fig u eroa and J. W. Park, Can hy a luronic acid exi st s heli x in soluti on ?, Proc. 4th Int. Sy m p . Glyc oconju - ga te s , Vol I, Academi c pr ess, New York (1979) , p. 119. 7. 35. A. T. Tu, N. D. Din h , C. Y. She and J. Maxwell, Laser Raman scatt er in g of a-and {3- meth y l- D-gl u cosid e s and hy a luronic acid , Stu d ia bio p h ys ic a , 63, 115(1977) 7. 36. R. Bansil, I. V. Yannas and H. E. Sta n ley, Raman spe ctr o scop y: a str u ctu ral pro be of g!yc osami no g !yc ans, Bi oc lzim . Bi op h y s. Acta , 541, 535 (1978) 7. 37. A. S. Perlin , NMR spe c tr o scop y of hep a rin , Fed. Proc. , 36, 106(1 9 77) 7. 38. A. S. Perlin , B. Casu and G. R. Sanderson, 220MHz spe ctr a of hep a rin , chondroit ins , and oth er mucop o lys accharid e s, Can. J. Chem., 48, 2266(1970) 7. 39. A. Darke, E. G. Fin e r, R. Moorhouse and D. A. Recs, Stu d ie s of hy a luronate soluti on s by nuclear mag n eti c relaxati on measu-rements . Dete c ti on of covalentl y - d efin ed sti ff seg m ents wi thin the flex ib l e chain s , J. Mal. Bi ol ., 99, 477(1975) 7. 40. D. A. Torchia , M. A. Hasson and V. C. Hascall, Investi ga ti on of molecular moti on of pro te o g ly c ans in carti lag e by 13C mag n eti c resonance, J. Bi ol . Chem., 252, 3617(1977)
제 8 장 이온 및 작은 분자와의 상호작용 생물분자의 많은 목성적인 기능은 이들 분자가 생체 내에서 다른 분자와 상호작용을 하는 것 으로 설 명 된 다. Glyc o sami no g ly c ans 는 생리적 p H 에서 이온화된 다가이온으로 존재하므로 여러 가지 양이 • 온 빛 분자의 양전하를 띤 영역과 정전기적 상호작용을 할 것이 예 상된다. GAG 의 다가음이온적 성질은 GAG 를조직 내에서 분리하고 특 성화시키는 것은 물론, GAG 의 분자구조의 규명 (7 장 3 절 참조) 과 생물학적 기능을 설명하는 것의 기본이 된다. GAG 와 양이온간 의 상호작용, 양이온 결합은 GAG 의 음이온기의 산-염기 평형과 밀접한 관계가 있다. 따라서 이 장에서는 GAG 의 산-염기 평형을 먼처 취급하고 다음에 금속이온, 양이온성 염료, 4 가 암모늄염 등 의 결 합을 기 술한다. 그리 고 GAG 의 수화 (hy d rati on ) 에 대 한 내 용 도 이 장에서 취급한다. GAG 와 단백질 등 거대분자와의 상호작용 은 제 9 장에서 취급된다. 8. 1 산-염 기 평 형 : H+ 결 합 생리적 p H 에서 GAG 는 이온화된 coo-및 S03- 기를 포함하고 있다. 이들 이온화된 기는 GAG 이 양이온과 결합할 때의 결합자리 가 된다. 따라서 이들의 pK a 값이 큰 관심의 대상이 된다. 다전해질의 중화는 일염기산의 중화와는 약간 다른 거등을 보인다.
이 는 중화과정 에 서 정 전 기 적 (electr o sta t ic ) po te n ti al
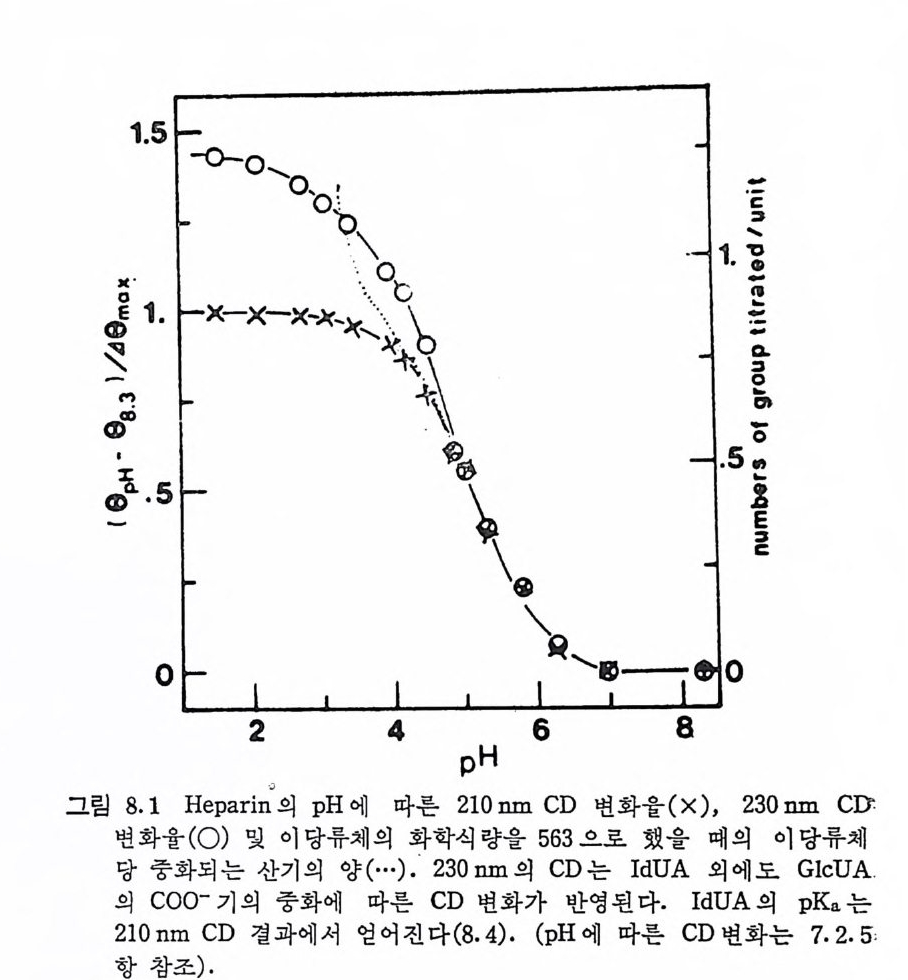 1.5 수0I0`-x,o.px* -lun`
1.5 수0I0`-x,o.px* -lun`
pH 에 따른 HP 의 230 nm CD 변화는 p K,. 가 5. 2 인 유기 산의 전형 적인 적정곡선과 일치함을 알 수 있다. 여 러가지 GAG 의 p H 와 lo g a/(1-a) 의 관계를 도시한 것이 그 림 8.2 이다. 여기서 구한 p K,. 와 n 값을 표 8,1 에서 요약하였다. GAG 의 카르복실기의 PKa 는 GAG 의 전하밀도와 용액의 이온 강도 (NaCl 농도) 에 따라 변 함은 물론, uronic ac id 의 종류에 따라 크게 차이 가 난다. GlcUA 를 포함하는 CS 와 HA 의 pK ,. 차이 는 다당류의 전하밀도를 반영하다. 죽, coo- 기 이외에 -0S03- 를 갖·
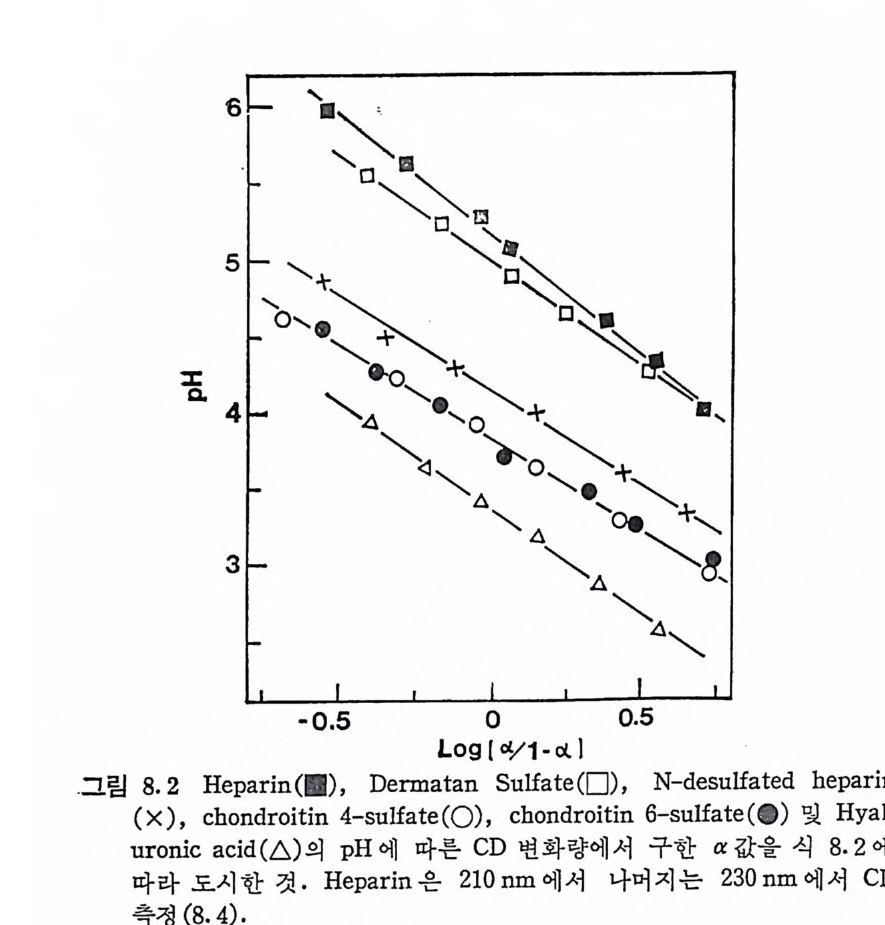 6 」 `1\+\0\ i\
6 」 `1\+\0\ i\
는 CS 의 COOH 기는 HA 의 COOH 기에 비해 높은 p H 에서 적정 된 다. 그러 나, CS 의 -0S03-기 를 분해 시 킨 desulf ate d chondroit in · su lf a t e(chondro ti n) 은 HA 와 유사한 pH 영 역 에 서 적 정 된다. 다가이 온의 전하밀도와 COOH 기의 PKa 의 관계는 hep a rin 릿 이의 변형 화합물에서도 볼 수 있다. 아민기가 N-ace ty la ti on 된 N-acety la te d he p ar i n 의 IdUA 부분의 COOH 기의 PKa(4.68) 는 아민기의 대부 분이 N-su lf a t ed 된, 죽 음의 전하를 띤, hep ar i n 의 PKa(5.2) 보 다는 낮고, 아민기 가 양의 전 하를 띤 N-desulf at e d hep a ri n 의 PKa (4.20) 보다는 높다. 높은 이온강도에서는 다가이온의 전하간 상호 작용이 감소하여, COOH 는 보다 낮은 p H 에서 중화됨을 표 8.1 은
표 8.1 G!yc osami no g ly c ans 카르복실 기 의 적 정 과라미 터 Comp o und N(amCol lacro)n e pK a n pK o Hy a luron ic aci d 0. o:g 3.36 1. 40 0.1 3.10 1. 06 2. 93~3. 04 Chondroit in sulfa te& 0.0 4.37 1. 35 0.0* 3.84 1. 25 0.01 3.97 1. 21 0.1 3.02 1. 08 3. 08~3. 13 'De sulfa ted chondroit in 0.1 3.39 1.1 4 2.90 Desrumlfaat ta en sulfa te o00... oo0 :l졌a!( 435...840340 111... 332726 0.01 4.46 1. 23 0.1 3.93 1.1 4 3.63 Desulf at e d dermata n sulfa te 0.1 3.40 1.1 7 3.30 Hep a rin c 0. 0 ; 꾹 5. 2 1. 27 N-desulfa ted hep a rin c 0.0 벅 4.20 1. 26 N-acety la te d bep a rin ° 0.0 沼 4.68 1. 24 a. 여러 시료의 평균값 b. Ch4-S 와 Ch6-S 는 극히 유사한 값웅 보임 c. IdUA 부분의 값임 ※ CD 방법 (8.4) 으로 측정한 것이며, 나머지는 전위차 적정 (8.1 및 이의 참고문헌 참조)에 의한 것임
보여 주고 있다. 표 8. 1 는 GAG 의 GlcUA(HA 빛 CS 의 uronic a ci d) 는 IdUA(HP 및 DS) 보다는 근원적으로 강산임을 보이고 있다. uronic a ci d 의 C-5 ep im er 간의 pK a, 차이 는 D-mannuronic ac id( PKa=3. 38) 과 L-gu- luronic a ci d(PKa=3.65) 에서도 관찰된다. 이 러한 pK a , 차이의 원인 에 대한 두 가지 가능성이 Sco tt (8.6) 에 의해 제시되었다. 1. D-mannuronic ac id 의 COOH 기 와 C-2 또는 C-3 0H 기 간 에 수소결합을 한다. 2. 카르복실기의 배향의 차이이다. 죽 COOH 가 수평방향인 경우 에는 이의 p Ka ,가 낮고, 축방향에서는p Ka ,가 높다(약산이다).
처음의 가능성에 대한 X- 선회철 빛 편광 IR 결과는p ol y -(L- g uluron i c ac i d) 의 C-2 OH 와 COOH 간에 분자내 수소결 합을 보이 냐, po ly - (D-mannuronic aci d) 에서는 유사한 수소결합이 나타나지 않았다. ldUA 와 GlcUA 의 COOH 기의 PKa. 차이는 이들을 포함하는 다 당류의 여러 가지 물리화학적 성질, 독히 양이온과의 결합성질등에 바로 반영 되 어 나타난다. 즉 ldUA 를 포함하는 DS 나 HP 는 다몬 GAG 에 비해 높은 양이온 천화력을 나타낸다. -C00H 기와 -0S03H 기를 모두 포함하는 다당류의 -COOH 의 PKa. 값과 적정결과는 이들 다당류의 COOH 밋 -0S03H 의 함량을 결정하는 데 이용될 수 있다. 다당류의 염을 산성화된 양이온 교환 수지를 통과시키면, -coo-및 -0S03- 의 반대이온이 모두 H+ 과 치환된다. 치환된 H+ 의 적정과 높은 p H 에서의 coo- 기의 적정값 의 비 교에 서 -COOH 및 -0S03H 의 개 별 적 정 량이 가능하다. 8.2 양이온 결합 GAG 의 양이은과의 결합은 GAG 가조직 내의 삼두압 및 조직간 의 금속이온의 전달을 조절하는 것과 결부지어진다. 득히 GAG 와 Ca2+ 과의 상호작용은 연골 pr ote o g yc ans 의 Ch4 -S 가 조적 의 회 화 (calc ifi ca ti on) 시에 Ca2+ 축적자리가 된다는 점에서 많은 연구가 수 행되었다. 최근에는 세포막에 존재하는 GAG 의 생물학적 기능이 이 다당류의 Ca2+ 결합력과 밀접하게 연관되어 있다고 주장되기~ 한다. GAG 와 금속이온간의 결합을 연구하는 데는 결합된 금속이온 또 는 결합되지 않은 금속이온의 농도결정이 필요하다. 이를 위해서 EDTA 적정법, 원자홉광법 (A.A ), po larog r ap h y , 이온선택성 전 극, 결합된 금속착물의 홉광성질 등 다양한 물리화학적 기법이 동 원된다. 다전해질에 의한 이온결합은 크게 3 가지 유형으로 구분된다 : ® 비 해 리 성 (undis s oc iat e d ) 결 합 ® 이 온쌍 형 성 ® 비 국재 화 (non-loca- lize d) 결합이 이들이다. 처음의 비해리성 결합의 좋은 예는 산-엽
기 평형으로, 이는 이미 8, 1 에서 취급되었다. 이온쌍 형성은 하나 또는 몇 개의 전하를 떤 영역에 결합되는 이온이 위치하고 있는 경 우이며, 비국재형 결합은 다전해질의 전기장내에 이온이 단순히 머 물고 있는 경우이다. 대부분의 경우에는 상기 3 가지 유형의 결합 이 동시에 일어난다. 다가이 온에 의 결 합은
에 서 는 Mg 2+
표 8. 2 Glyc o sam ino g ly c a ns 의 금속이 온 결 합상수 NaCl Meta l ion (mcoonlea.r ) Kcs Kvs/Kcs KHPIKcs Kp G /Kcs Ca2+ 0.15 16. 3 1. 5 8.3 0.94 Ca2+ 0.1 55 2.2 6.7 Ca2+ 0.Ia 65 I. Ob Cu2+ 0.1 57 4.0 16.5 Co(NH3)6'+ O.lc 1500 6.0 11 a. 6°C 에서 측정 b. ag greg at e d PG 에 서 는 1. 7 c. CS data 는 O. IM NaCIO‘ 용액 에 서 얻 었 다.
와 CS 의 차이는 uronic ac id 의 조성의 차이로 설명된다 (8.11). 여러 금속이온과 GAG 간의 상호작용은 용액의 이온강도에 크게 의존한다. 이의 한 예를 그립 8.3 에서 보여 준다. 그러나 CS 와 양 이온간의 상호작용에 대한 전기전도도 측정은 이 돌 상호작용을 정 전기적 힘만으로는 설명할 수 없음이 보고되었다. 금속이온과 GAG 간의 특성 적 결 합은 표 8. 4 의 Cu2+ 릿 Co (NH3) s3+ 가 Ca2+ 에 비 해 DS 와 HP 에 월등히 높은 결합력을 보이는 것에서도 나타난다. HP 의 Cu2+ 과의 결 합은 이 들간의 결 합상수와 HP 의 항응고작용 과의 상관관계 를 찾으려 는 Sti va la 팀 의 시 도에 서 많이 연구되 었 다 (8.11). 이 팀은 HP 의 항응고작용이 Cu2+ 빚 Co(NH3)s3+ 의 결합력
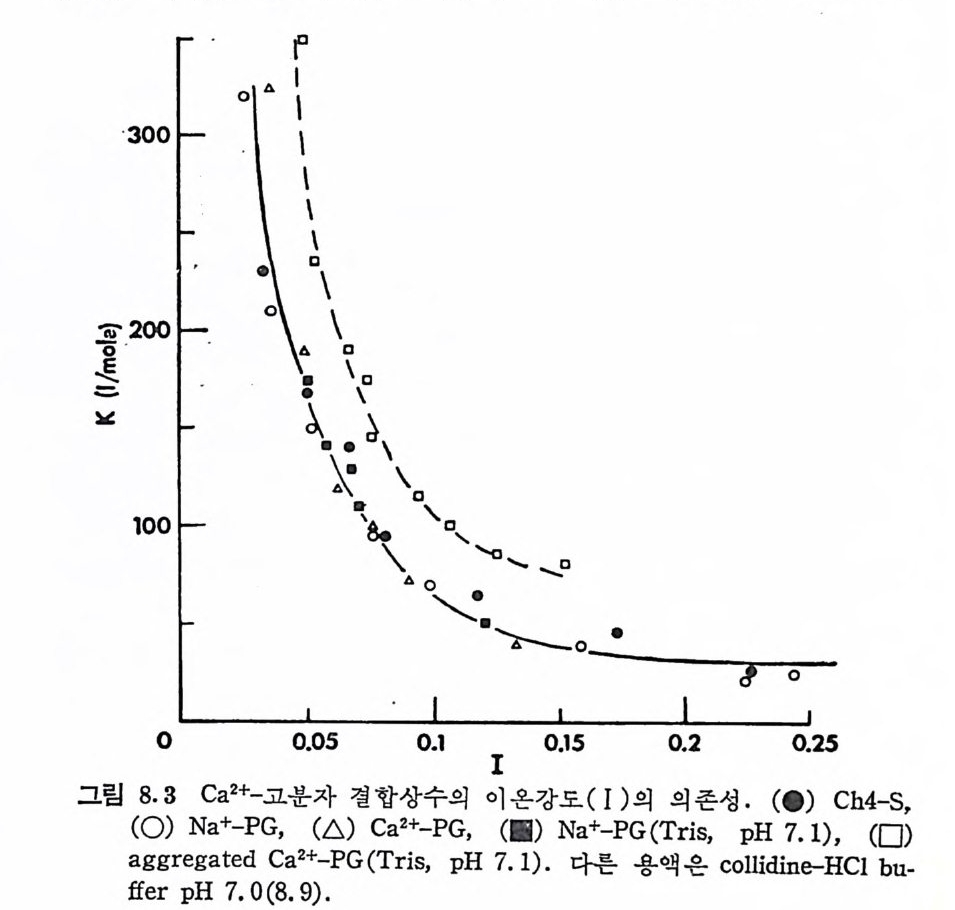 P111\
P111\
과 밀접한 관계를 갖고 있다고 주장했다. 죽 금속결합력이 쿨수록 항응고작용이 크며 , N-desulfa tion 은 항응고작용과 금속결 합력 을 모두 크게 감소시킨다. 그러나, 아직도 HP 의 항응고력과 금속결합 력간의 직접적인 상관관계가실제로 존재하는지는 규명되지 않았다. GAG 의 양이온, 특히 Cu2+ 의 결합자리는 이온화된 coo- 기라 는 것이 밝혀졌다 (8.13). 이는 p H 에 따른 HP-Cu+ +의 UV 홉광 성 질의 변화에서 나타난다(그림 8.4). p H 에 따른 Cu2+ 착물의 홉광도 변화를, GAG 의 -COOH 기 의 PKa 와 연관시 키 면 Cu2+ 와 GAG 간 f의a te결d 합H상P수 (D가S H얻P )어 의 진 다-.c oHo+- 기와 에C u경++ 쟁 가 적 으모로두 H결P 합 하또며는 , N.c-odoes-u와l- Cu2+ 의 결합비는 1 : 1 이고 결합상수는 각각 1X104 M-1(HP) 및 2x l02M-1(DSHP) 으로 나타났다. 이 실험에서의 coo- 와 Cu2+ 의 1 : 1 의 결합비는 Cu2+ 가 단독으로 -OS03- 에 결합되어 있는 것은 배제 시킬 수 있다. 반면에, coo- 와 -0S03-가 동일한 Cu2+ 에 chela- ti on 되어 있을 가능성은 다음에서 보듯이 아주 크다. Cu2+ 와 GAG 간의 결 합은 앞서 보여 준 UV sp ec tr a 이 외 에 도 CD sp ec tr a 에서도 관찰된다· 그러 나, pH 에 따른 Cu2+-GAG 착물의 CD 타원율과 UV 홉광도간에는 직접적인 1 : 1 의 대응관계가 관찰 되 지 않는다. Cu 표 결 합에 따른 CD 변화는 HP, RPS, DS, DSHP (p H>5 에서) 및 HA( p H>6) 에서 관찰된다. 반면에, CS, chondroi- tin, p H<5 에서의 DSHP 와 p H>6 에서의 HA 에서는 관찰되지 않 는다· 이 결 과는 CD 변화가 COO--Cu2+ 이 온쌍(또는 착물) 에 -OS03- (HP, HPS, DS 의 경 우) , -NH2 (DSHP 의 경 우) 또는 -NHCOCH3 (HA 의 경우)가 다시 chela t e 되어 Cu2+ -착물의 비대칭성이 중대되어 일어난 이다 는하에 것 서으 는로 C설u2명+ 된에다 c.o o따-라기서 만, cHheAla 와te 되D 어S HUPV 는 s p각 e c각tr a p만H 보6 여및 주5 나, 이 이상의 p H 에서는 또다른 기가 chela t e 되어 CD 에서도 착 물이 관측된다고 볼 수 있 다. (초기의 연구논문은 HP-Cu2+ 착물의 CD 변화를 HP 의 분자구조 전이로 해석하기도 했다.) Cu2+-GAG 의 착물형성에 따른 목성적인 UV sp e ctr a 변화는, 다 른 이온과 GAG 의 결합 연구에도 응용된다. Park 과 Mukherje e
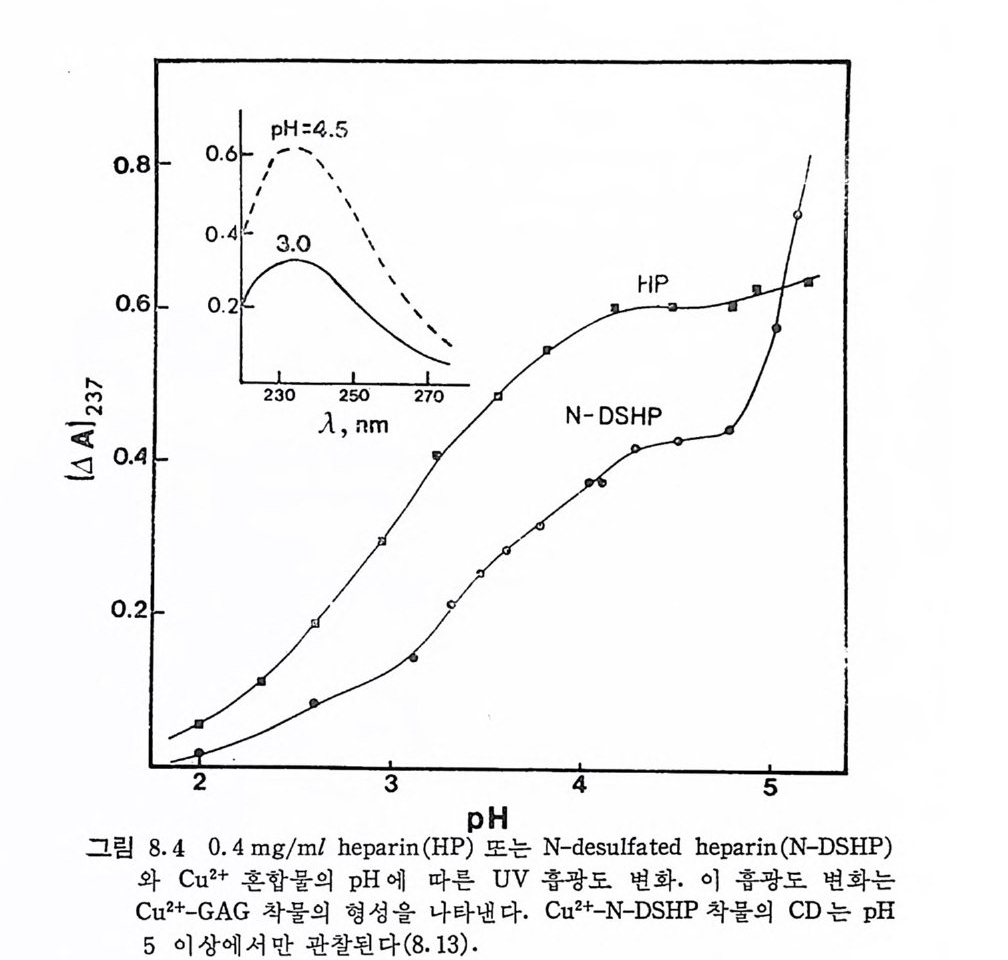 pH =4.5
pH =4.5
{8.11) 는 Cu2+-GAG 착물에 Ca2+ 을 첨 가하여 , Cu2+-GAG 착물의 부 분 적인 해리를 관찰하고, 이에서 표 8.2 에 수록된 Ca2+-GAG 의 결합상수를 구했다. 8. 3 양이 온성 염 료 결 합 및 meta c hromacy 음이온성인 GAG 와 양이온성 염료와의 상호작용은 두 가지 측떤 에서 연구된다. 한 가지는 세포나 조직 내에서 GAG 의 위치를 결정 하는 조직 염색 (his t o l og ica l s t a i n i n g)인데, 이는 다가음이온성 분자에
양이온성 염료가 결합할 때 염료의 분 광 학적 독성이 크게 변하는 〈 me t achromac y〉의 성질을 이용한다· 또다른 염료의 GAG 분자간 의 결합에 대한 연구의 초점은 GAG 분자구조의 규명과 연관된다. 이 방법은 처음 p ol yp e ti des 의 구조규명에 도입되었는데, 염료의 유도된
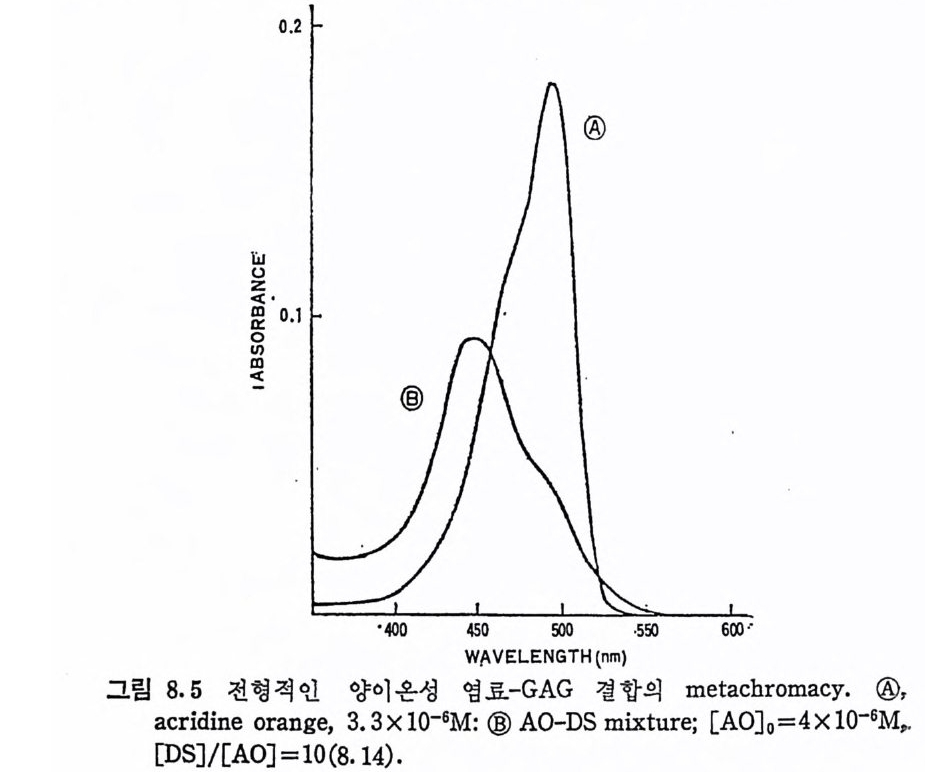 0.2
0.2
정된다. H yp ochrom i sm 에 의한 GAG 의 염료 결 합자리수는 GAG 의 이온 화 된 기의 수와 잘 일치 한다 . 이는 양아온성 염료가 0s03- 나 coo-기 에 모두 잘 결합 되 어 동일한 hy po chromi sm 을 나타내 는 것으로 해석된다. GAG 에 결합된 염료의 홉 수 s p ec t ra 가 단과장 영역에서 관찰되 는 것 과는 대 조적 으로, 형 광 spe ctr a 는 장파장에 서 보 통 나타난다. 그림 8. 6 은 acrid i n e orang e -DS 의 형 광 sp e ctr a 를 보여 주는 것 으로, 660nm 의 형광 peak 는 DS 에 결합된 AO 에 의한 것으로 판
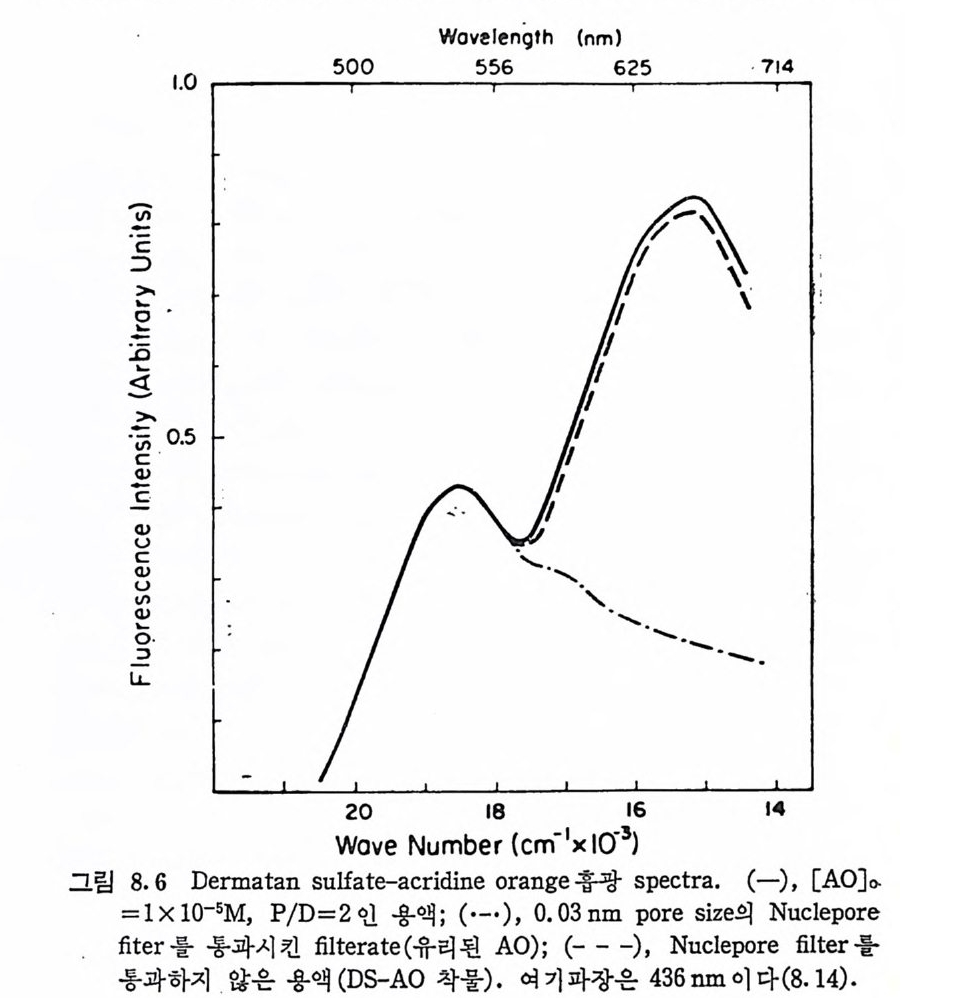 Waveleng th (nm)
Waveleng th (nm)
명되었다. DS-AO 결합에 대한 열역학적 연구는 협동적 결합상수가 4. 9~6. Ox l05M -1 로 계 산되 었으며 , 이 는 7. 74~7. 84 kcal/ mo le 의 자유에너지에 해당된다. Lag u noff 는 비 만세 포 과립 (mast cell gr anule : 생 체 내 에 서 HP 이 주로 촌재 하는 세 포) 과 HP 의 meth y le ne blue 결 합의 바 교에 서, HP 온 과립 내에서 단백질과 0-sul fat e 기가 관여된 착물을 형 성함을 보였다. 이와 같이 GAG- 염료 결합은 GAG 의 음아온의 수, GAG 가 관련된 착물의 구조, 음이온의 PKa( p H 에 따른 meta c hr- omac y의 변화에서)등의 연구에 이용된다 (8.15). 비대칭 분자에 결합된 염료는 CD 빛 ORD(7 장 2 참조)를 보인다. 염료의 유도된 Cott on 효과는 염 료가 결합된 어 미 분자의 구조에 대 한 정 보를 제공한다. T i noco(8.16) 는 고분자의 나사선 방향과 유도 된 Cott on 효과의 CD 부호간의 상관관계를 제안하였다 : 왼손 나사 선 고분자에 결합된 염료는 장파장에서 음의 p eak 를, 그리고 단파 장에서 같은 크기의 양의 p eak 를 보이며 (음의 2 중 CD 디), 오른 손 나사선 ' 고분자에서는 이의 반대가 성립된다. St on e (R3) 은 GAG 와 meth y le ne blue 착물의 가시 광선 영 역 의 CD spe c tr a 을 얻 었 다. HP, HPS 및 KS 는 음의 2 중 (doublet) CD 띠를 보이나, CS 와 DS 는 양의 2 중 CD 띠를 나타낸다. 이 질과 는, 단백 질의 유도된 Cott on 효과와 동일한 방법 으로, GAG 의 나 사선 구조에 의한것으로 해석되었다· 그러나, 염료의 종류, 고분자 와 염 료의 비 (P/D ) 등에 따라 유도된 Cott on 효과의 부호와 크기 가 변하는 것이 관찰된다. 이들의 몇 가지 예를 보이면 다음과 같다. CD Meth y le ne blue (MB ) 와는 대 조적 으로, acrid i n e orang e (AO) 는 HP 과 Ch6-S 에서 유도된 ORD 의 크기와 부호가동일하다 : 이 결과는 AO 가 여러 GAG 에 결합하는 것이 비목성적 (non s p ec ifi c) 인 것으로 설명되었다. ® MB 와 여 러 GAG 와의 착물의 Cott on 효과는 고분자의 sulf a- tion 정도에 따라 변한다 (8.17). @ AO -H A 착물의 유도된 CD 는 AO 농도가 2. 5x 10-5M 일 때는 이중띠를 보이나, l0-4M 에서는 단일띠를 보인다 .
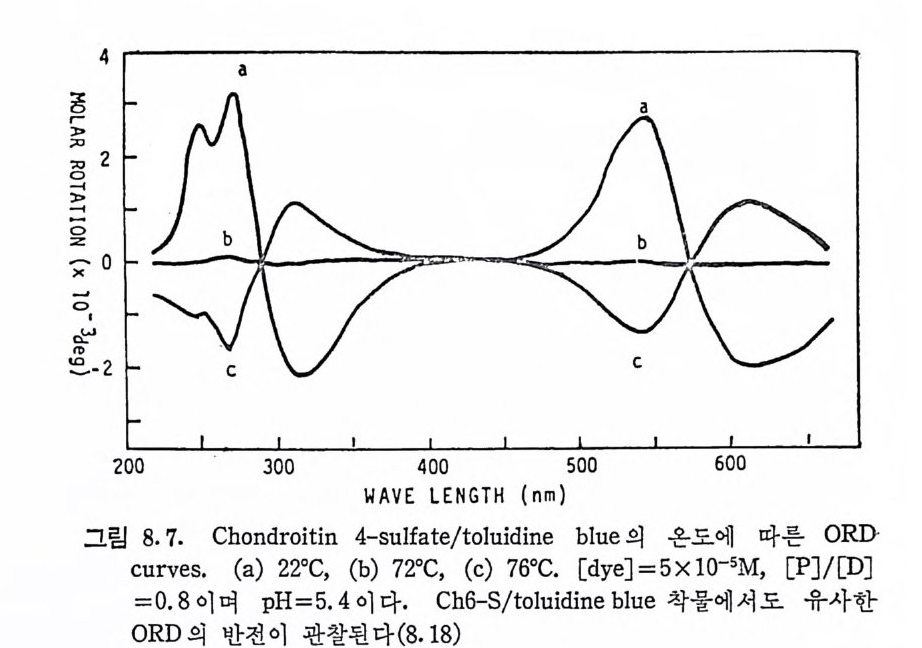 420a
420a
GAG- 염료의 유도된 Cott on 효과는 온도에 따라서도 민감하게 변 한다. 예로, HA 와 CS 의 p H7 에서의 MB 착물은 실온에서는 서 로 반대 부호의 Cott on 효과를 보이 나, 온도가 중가할수록 흡수 및 ORD 에 서 의 meta c hromati c 이 동은 감소한다. CS 의 tol uid i n e blue 의 Cott on 효과는 높은 온도에 서 부호가 반대 로 된 다 (그립 8. 7) . CS 의 용액 조건에 따른 Cott on 효과의 부호의 반전은 p H 의 변화 에 서 도 관찰된다. 죽 Ch6-S-TB 착물의 유도된 Cott on 효과는 pH 3 부근에서 부호가 반대가 된다. 그러나 HA 에서는 단지 pH 3 부근 에서 Co tt on 효과가 감소할 뿐이다. 이들 결과를 종합하면, GAG- 염 료의 유도된 Cott on 효과가 GAG 의 분자구조에 의 해 결정 된다 고 간주하기는 어렵다· 고분자의 나사선 구조(만약 존재한다면) 이외에도 염료간 상호작용, 염료가 결합된 음이온기의 독성 등이 결 합된 염 료의 유도된 Cott on 효과에 모두 복합적 으로 반영 된다고. 여겨진다.
8.4 4 가 암모늄염 및 아민유 결합 GAG 는 다가음이온적 목성의 한 가지인 여러 가지 4 가암모늄염과 물에 불용성인 착물을 형성하는 성질을 보인다. 이 착물은 높은 무 기염 (NaCl 등)의 농도에서는 분해되어 다시 용해된다. GAG-4 가암 모늄염 착물의 용해에 필요한 염의 임계농도 (cr itic al concentr a ti on ) 는 GAG 의 전하밀도가 클수록 높다 (8.19). 일반적으로 많은 거대 음이온의 암모늄염과의 결합의 세기는 -coo-<-P04-<-0s03- 의 순으로 나타난다. GAG 와 4 가암모늄염 , 특히 cety lp y r id i n i u m · Chlor i de(CPC) 과의 착물형성은 GAG 을 조직에서 회수하고, 정 량하 며 GAG 를 종류에 따라 분별시키는 데 많이 이용되어 왔다. Jen nin g s 와 Hurst( 8 . 20) 는 GAG-CPC 착물이 무기 염 이 포함된 수용액층과 bu t anol 층에 분배될 수 있으며, 분배계수는 염의 농도, CPC 의 농도 등에 민감하게 의존하여 아주 좁은 염의 농도변화로 GAG 를 수용액층에서 유기용매층으로 거의 정량적으로 전이시킬 수 있음을 보였다. 염의 농도에 따른 GAG 의 분배를 그림 8.8 에 서 보여 준다. 분자량 및 황산기의 함량이 다른 분별된 cs 도 CPC 을 이용하여 물층과 bu t anol 층에서 분배되어 분리되었다 (8.20). cs 의 분배에는 황산기의 함량이 중요 결정요인이며, 분자량 12,000 이상에서는 분 자량의 차이는 큰 영향을 주지 않음이 밝혀졌다. 따라서 염의 임계 농도보다는 용매一용질간의 상호작용이 분배현상에서 나타난다고 주장되기도 했다 (8.21), GAG 는 많은 양이온과 정전기적으로 결합하는데, 이 중에서 큰 관심의 대상이 HP-his t a m i ne ( I )간의 결합이다. 비만세포 과립 (mast cell g ranule) 은 HP 과 his t a m i ne 을 모두 포함하고 있 으며 , 세포 내에서 HP 이 h i s t am i ne 의 결합제로 작용하고 있다고 여겨진 다. Keller (S. 22) 는 pH 5. 0~5. 5 에 서 his t a m i ne 과 seroto n in ( ]1 ) 이 HP 과 약하게 결합함을 보였다. 높은 p H 나 염농도에서는 이들의 HP 착물은 분해된다. 비만세포 과립을 분해시키면 단백질 성분이
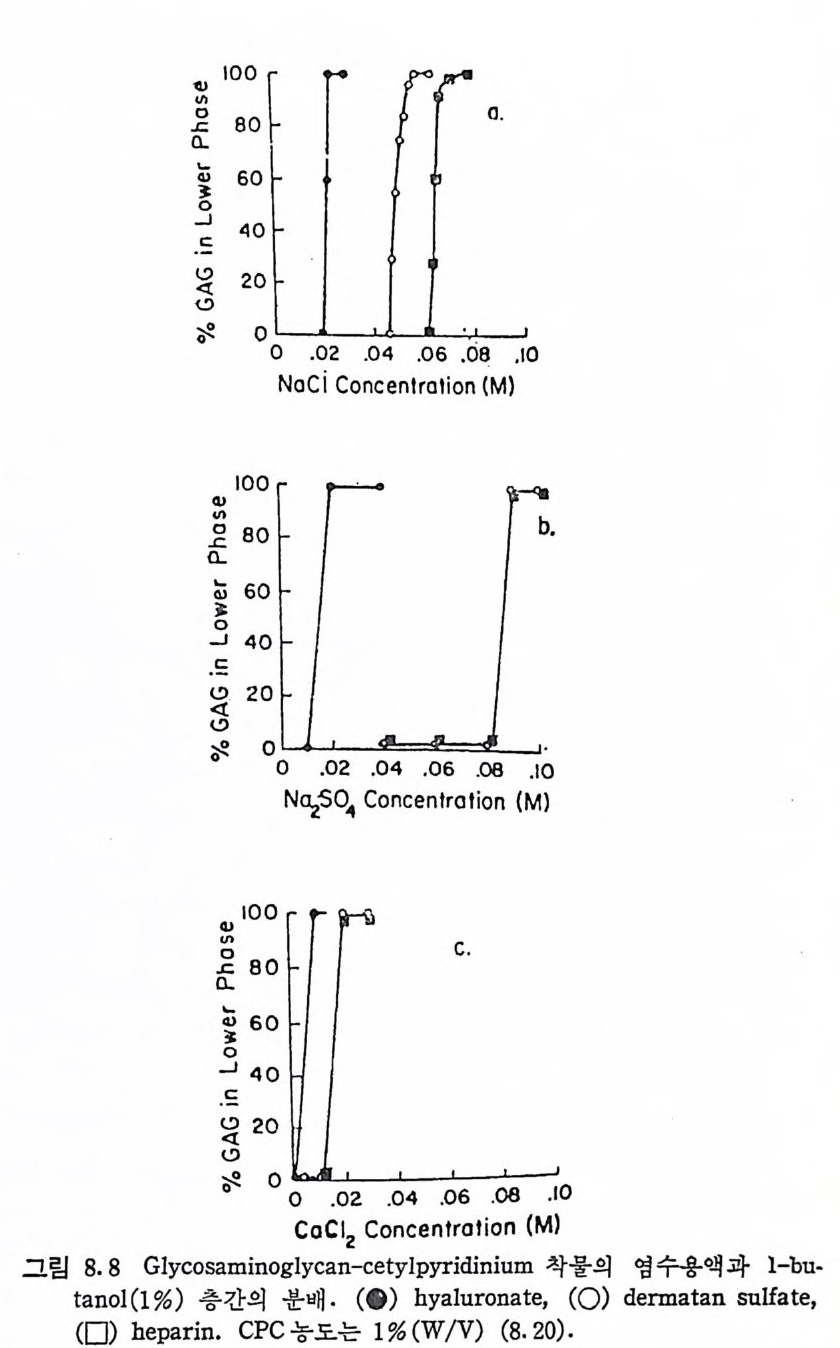 o} 100-80- t
o} 100-80- t
 Ill 曰C H,CH,NH,·2HCI CH, C ~,N H, • Her
Ill 曰C H,CH,NH,·2HCI CH, C ~,N H, • Her
분해되고 HP 은 방출된다. 따라서, 과립에서는 HP 은 단백질과 복 · 합체로 존재하며, h i s t am i ne 은 HP 부분에 정전기적으로 결합되어 있는 것으로 여겨진다. Sto n e(8. 24) 은 HP 에 his t a m i ne 이 나 seroto n in 이 결 합될 때 , 이 다당류의 ORD 가 크게 변함을 보고하였다. 이 결과는 초기에는 his t a mi ne 결 합에 의 한 HP 분자의 구조전 이 로 해 석 되 었으나, hi- sta m i ne 이 HP 의 coo- 기에 결합되어 coo- 의 양성자 첨가시와 유사한 CD 변화를 보이는 것으로도 해석할 수 있다. Uvnas 등 (8. 24) 은 h i s t am i ne 은 과립 단백질의 coo- 기에 결 합되며, HP 의 음 이온은 단백질의 양이온성기와 상호작용을 한다고 제시하였다. 반 던에 Lag uno ff (8.15) 는 HP 과 염료와의 결합 실험에서 HP 의 N_ sulf ate , coo-및 0-sulfa te 기 모두가 염 료나 his t a m i ne 과 같은 양이온성 분자들의 결합자리가 될 수 있음을 보였다. 지금까지 언급된 4 가 암모늄이나 아민류 외에도, 많은 양이온성 물질이 GAG 와 정전기적으로 결합한다. 그러나 이들 상호작용은 대부분은 아직도 GAG 의 구조나 기능을 규명하는 데 큰 관심을 끌 지 않으며, 따라서 이들에 대해서는 취급하지 않는다. 8.5 물과의 상호작용 GAG 는 연결조직 내의 물의 유지에도 관여하고 있는 것으로 여겨 진다. 물은 다당류 사술의 OH 기와 전하를 띤 기능기에 수소 및 국 · 성결합으로 연결되어 있다. (O g s t on 은 〈물의 결합 (wa t er bin ding)> 이란 용어는 임의적이고 애매모호하여 사용하지 않음이 좋다고 지 적했다.)
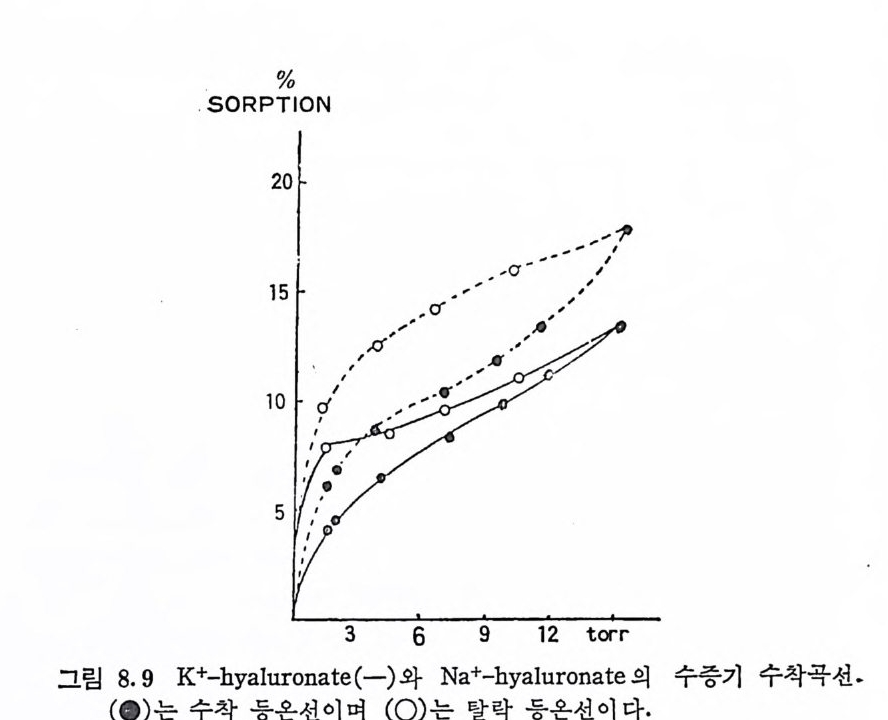 %
%
고분자에 결합되는 물의 양은 상대습도에 따른 건조된 시료에 수 착 (sor pti on) 된 수중기 (va p or) 의 양에서 얻어진다. 이 연구는 주로 Be tt elhe i m 등(예로 8.25 참조)에 의해 수행되었으며, 이의 한 예를 그림 8.9 에서 보여 준다. GAG 간의 수착력은 낮은 중기압하에서 는 Ch4 -S
로 여 겨 진다· 소 각막 (bov i ne cornea) GAG 의 주성 분은 KS 인데 , KS 와, KS 을 포함하는 PG 는 Ch4-S 보다 물 의 수착력이 큰 반면에 쉽 게 탈착도 된다. 소 각막의 g lucosam i ne( 주로 KS) 과 ga lacto s ami ne (주로 Ch4-S) 의 비 는 상피 (ep ithe liu m ) 에 서 내 피 (endoth eli um ) 으로 갈 수록 중대된다. 상피에는 많은 양의 KS 가 존재하여 각막의 탈수에 의한 물의 손실이 KS 의 큰 물의 수착력에 의해 방지되는 것 으로 설명되었다 (8.26). 상어 연골은 소나 철갑상어 (stu r ge o n) 연골에 비 해 높은 팽창 (swe lli n g)성을 보이는데, 이는 상어 연골이 높은 GAG/ colla g en 값을 갖는 것으로 설명된다. Swee t등 (8.27) 은 관절은, 미 숙한 연골의 대응되는 성장하는 영역에 비해 많은 물을 함유하며, 최대의 접촉을 갖는 부분에서는 이들보다 물의 양이 적음을 보였다. 그러나, 최대로 접촉하는 관절부분은 최소로 접촉하는 부분에 비해 많은 양의 HA 와 훨씬 많은 양의 KS 가 존재한다. U 자형 관에 HA- 염 용액을 넣고 한쪽 끝에 약한 압력을 가하면 관 의 양끝 간에 전위차가 형성되는 HA 용액의 기계-전기 (mechanoelec trica l) 전환 현상이 보고되었다. 이 현상은 주어진 압력에 의해 HA 에 결합된 물이 방출되는 entr o p y 변화에 의한 것으로 설명되었다 (8. 28). HA 등 다당류는 수용액 상태에서 물의 구조를 변화시키며, 이러 한 구조변화는 고분자 표면에서 먼거리까지 확장되어 용액의 상당 히 많은 물이 구조변화에 관여되어 있을 것으로 제안되었다 (8.30). 그러나 고농도 HA 용액의 X- 선 회절 및 양성자 nmr 연구에서는 다당류 주위의 물이
* 추천문현 Rl . W. D. Comp e r and T. C. Laurent, Phy si o l og ica l fun cti on of conn-
ecti ve po lys accharid e s, Phys io . Rev., 58, 255~315(1 9 78) (GAG-이 온의 상호작응을 화학적 인 면보다는 생 리 적 측면에 서 쥐 궁) R2. B. Chakrabarti and J. W. Park, Glyc osami no g ly c ans: Str u ctu r e and fun cti on , CRC. Re v. Bio c hem. , 8, 225~313(1980) (이 장의 많은 내용이 Rev i ew 되어 있다. 화학적인 면에서 기술했다.) R3. A. L. Sto n e, Confo r mati on s of hexose po lys a cchari de s in soluti on , in Str n ctu r e a11d Sta b il i ty of Bio lo g ica l Macromolecules, Bio l og ica l Macromolecular Serie s Vol 2. S. Tim asheff and G. Fasman, Marcel Dekker, New York, (1969) Chap 5. (pp. 353~415) 밋 6 장의 R4. (CD, ORD 밋 염 료 결 합 에 의 한 다당류의 구조규명 을 기 술한다. Me- tac hromacy 에 대 해 상 세 히 취 급하고 있 다. 다당류의 구조에 관한 해 석은 비판적으로 받아들이는 것 이 요구된다). * 인용문현 8. 1. M. B. Math e ws, Ac id str e ng th of carboxy l gro up s in iso meri c chondroit in sulfa tes , Bi oc him . Bi op h y s . Acta , 48, 402 (1964) 8. 2. I. G. Gil be rt and N. A. My e rs, Meta l bin d ing pro p e rtie s of chon-droit in sulph ate , Bio c him . Bi op l zy s. Acta , 42, 469 (1960) -8. 3. A. Katc h alsky and P. Sp itinik, Pote n ti om etr ic titrat i on s of po ly- meth acryl ic acid , ]. pol ym er Sci. , 2, 432(1947) -8. 4. J. W. Park and B. Chakrabarti, Ac id- base and op tica l pro p e rti es of hep a rin , Bi oc lzim . Bi op h y s . Res. Commun., 78, 604(1977) -8. 5. J. W. Park and B. Chakrabarti, Op tica l characte r i st i cs of carbox yl gro up in relati on to the circ ular dich roic pro p e rtie s and diss oc ia- tion consta n ts of gly c osam ino g ly c ans, Bi oc lzim . Bio plz y s. Acta , 544, 667 (1978) .8. 6. M. B. Math e ws, Str u ctu r al fac to r s in cati on bin d ing to an ion ic po lys a cchari de s of connecti ve tiss ue, Arch. Bi oc hem. Bi op h y s ., 104, 394 (1964) 8. 7. J. R. Dunsto n e, Ion exchang e reacti on s betw een aci d mucop o ly- saccharid e s and vario u s cati on s, Bi oc lzem. ]., 85, 336(1962) 8. 8. W. D. Comp e r and B. N. Presto n , Model connecti ve tiss ue sys te m s: Membrane ph enomena of ge l membranes conta ining po lye lectr ol y-tes , ]. Colloid Inte 1 f ac e Sc i., 53, 391 (1975) 8. 9. E. A. Mac}reg o r and J. M . Bowness, Inte r acti on of pro te o g ly c ans and chondroit in sulfa tes wi th calciu m and ph osph ate ion s, Cau. ]. Bio c lzcm., 49, 417(1971) 8.10. K. Tanaka, Phy s ic o chemi ca l pr op e rti es of chondroit in sulfa te. I. Ion bin d in g and secondary str u ctu re, ]. Bi oc lzem. (Tollyo ), 83, 647 (1978) 8.11 . J. W. Park and D. C. Mukherje e , Sp e ctr o scop ic stu d ie s on Cu2+ and Ca2+ bin d ;ng wit h gly c o sami no g ly c a ns, Bull. Kor. Chem. Soc., 1, 83(1980) 8. 12. S. S. Sti va la, Phy si c o chemi ca l pr op e rti es of hep a rin , and its in te r acti on wi th Cu (Il ) and Calciu m in relati on to anti co ag u la- tion , Fed. Proc., 36, 83 (1977) 8. 13. D. C. Mukherje e , J. W. Park and B. Chakrabarti, Op tica l pro - pe rtie s of Cu ( Il ) comp le xes wi th hep a rin and relate d gly c o sa-mi no g ly c a ns, Arclz. Bio c hem. Bi op h y s , 191, 393(1978) 8. 14. S. S. West, R. E. Hurst and J. M. Mento r , Thermody n ami cs of mucop o lys a ccharid e s-dy e bin d in g , Bi op o ! y1 1 1ers, 16, 685, 695- (1977) 8. 15. D. Lang u noff , Analys i s of dy e bin d in g sit es in mast cell gra nules, Bi oc lzemi st r y , 13, 3982 (1974) 8.16. I. Tin o co, Jr. , Cir c ular dic h rois m and rota t o r y dis p e rsio n curve of heli ce s, ]. Amer. Chem. Soc. , 86, 297 (1964) 8. 17. M. Nemeth - Cs6ka, M. Kajt ar and J. Kajt ar , The role of sulph a- tion of gly c osami no g ly c ans in the ir str u ctu ral and fun cti on al characte r is t i cs , C01meti ve Tis s ue Res., 5, 1 (19 77) 8. 18. K. Nakaji m a and G. Mats u mura, Eff ec t of trm p e ratu re on th e ind uced Cot ton eff ec ts of aci di c po lys a cchari de -basic dy e comp !- exes, Bi op o l ym ers, 12, 2539 (1973) 8. 19. J. E. Scott , Al iph ati c ammon ium salts in assay of aci dic po ly- sacchari de s from tiss ues, in Meth o ds of Bi oc hemi ca l A11alys i s , Vol. 8, D. Glic k E~. Joh n Wi ley & Sons, New York, 1960, p.1 45. 8. 20. R. E. Hurst and J. Y. Sheng , The pa rti tion of gly c osami no g ly c an- tqiuo an t,e r Bnia orc yh iam m . mBotn' oipu hm y s c. omAcp tlae x, . 44I.4 , T7h5e ( 1e9f7f e6c) t of ph ase comp o si-
S. 21. R. E. Hurst and J. Y. Sheng , The pa rti tion of gly c o sami no g ly c an -qu ate r nary ammoniu m comp le xes. II . The eff ec ts of po lym er molecular weig h t and sulfa tion , Bio c him , Bi op h y s. Acta , 497, 539(1 9 77) 8. 22. R. Keller, zur Bind ung von his t a m i n und seroto n in in den Mastz e llen, Arweim . Forsch., 8, 390(1958) 8. 23. A. L. Sto n e, Ami de Cott on eff ec t of hep a rin , Natu re (London) , 216, 551(1967) 8. 24. B. Uvn 걸 s, C. H. Aborg and A. Berge ndorff, Sto rage of his t a m i ne in mast cells. Evid e nce for an ion ic bin d in g of hist a m i ne to pr ote i n carboxy ls in the gr anule hep a rin - pr ote i n comp le x, Acta , Phy si o l . Scand. Sup pl. 336, 1 (19 70) 8. 25. F. A. Bett elb eim and B. Pressy. The hy d rati on of pr ote o g ly c ans of bovin e cornea, Bio c him . Bio ph ys . Acta , 381, 203 (1975) 밋 이의 참고문헌 참조. 8. 26. F. A. Bett elb eim and D. Goetz , Dist r i b u ti on of hexosam ine s in bov ine cornea, Invest. Op tha l. , 15, 301 (19 76) 8. 27. M. B. Sweet, E. J. Tbonar and A. R. Immelman, Reg ion al dis- tri b u ti on of wate r and gly c o sami no g ly c ans in im matu re arti cu l-ate carti lag e , Bi oc him . Bi op hy s . Acta , 500, 173 (1977) ·s. 2 8. T. W. Barett , Mecbanoelectr i c a l tra nsducti on in by aluro 떠 c aci d salt soluti on is an entr o p y driv e n pr ocess, Plzys io l . Chem. Phys . , 8, 125(1976) 8. 29. B. Jac obson, On the int e r pr P. ta ti on of diel ectr ic consta n ts of aqu eous macromolecular soluti on s. Hy d rati on of macromolecules, J. Amer. Chem. Soc., 77, 2919(1 9 55)
제 9 장 거대분자와의 상호작용 GAG 는 보통 조직 내에서 다른 거대분자 (특히 단백질)와 함께 존재한다. GAG 의 생물학적 역할은 이들의 거대분자적 성질은 물 론, 다른 분자와의 상호작용과도 밀접한 관계가 있을 것으로 믿어 진다. 아 장에서는 GAG 와 다른 거대분자와의 상호작용을 취급한 다. 9. I 단백질과의 상호작용 GAG- 단백질의 상호작용은 크게 4 가지 유형으로 구분된다 : ® 공유결합, ® 특유한 비공유결합, ® 비특유의 정전기적 상호작용, ® 공간적 배제 등이다. 이 중에서 공간적 배제는 9.5 에서 별도로 . 취급하고 여기서는 ®~®먄 기술한다. GAG- 단백질의 공유결합은 이미 제 2 장에서 취급된 PG 의 구조 에서 보았다. PG 에서는 GAG 가 단백질과 연결부분을 통해 공유 결합을 하고 있다. 특유한 비공유결합은 PG 의 집합체 형성시의 HA 와 PG 단위제간의 상호작용을 예로 들 수 있다. GAG 사슬이 공유 결합된 PG 단위제의 중심단백질의 끝 부분은 소수성이며, HA 와 상호작용을 하여 PG 집합체를 형성한다. 이 상호작용은 정전기적 상호작용과는 달리 높은 이온강도에서도 안정하다· 그러나 높은 농· 도의 g uan i d i ne-H(?l 과 같은 단백질 변성제의 존재하에서는 이 연
결 은 분해된다 . 세포막의 GAG 는 대부 분 목유한 비공 유결합의 형태로 수용 체 (rec e pt or) 에 결합 되어 있는 것 으 로 여겨진다. 이 와 같은 수 용체와 GAG 상 호작용은 조직 의 구성 , GAG 의 분 해 등 에 중요한 역 할 을 하는 것 으로 여겨진다. HP 와 혈 액응고인자와 의 결합도 독유한 비 공유결합 으로 믿어지며, 이 는 이 항 의 마지막 부분에서 취급 된다. GAG 과 단 백 질간의 정전 기 적 상 호작용은 가장 흔히 관찰 되는 것 이다. 정전기 적 인 인 력에 의 한 결합 은, 결 합 의 정도 가 용액 의 이온 강 도와 p H( 고분 자 의 이온 화 정도)에 크 게 의촌 하는 것에서 다른 결 합 과 구분지 어 진 다. Gelman 등 은 여 러 GAG 와 양이 온성 po lyp e - J)tide 인 po ly- L-argi ni n e (PLA) 와 po ly- L-lys in e (PLL) 간 의 상호작 용을 CD 을 이용하여 연구하였다. PLA 와 PLL 은 모두 중성 용액에 서는 임의코일형태로 존재하나, GAG 의 존재시에는 a- 나사 선 구조 를 가짐이 관찰되었다• 그림 9.1 은 CS 에 의한 PLL 의 구조변화를 예 를 들어 보여 준다. GAG 에 의한 PLL 및 PLA 의 a- 나사선 구조로의 전 이는 높은은 도.에 서 는 일 어 나지 않으며 , 이 때 의 GAG 와 po lyp e p tide 혼 합용액 의 CD 값은 각 성분의 CD 값 의 합 (그립 9.1 의 B) 과 같 다. 온도에 따 른 po lyp e p tide -GAG 의 구 조전 이 는 아주 좁은 온도범 위 에 서 일 어 나며 , 이 온도를 용융온도 (meltin g tem p e ratu r e : 226nm CD 값과 온도 의 도시에서의 중간점)으로 정의할 수 있다· 표 9.1 은 GAG-po lyp e - ptide 의 착물의 화학양론과 용융온도를 보여 준다. 이 표에서 GAG 종 류에 따른 GAG 와 양이 온 성 po lyp ep tide 의 상호작용의 세 기 (착뭉 의 안정도)는 HA< C h4 -S( HP S< C h6-S( KS ( DS ( HP 임 을 볼 수 있다. 양이 온성 po lyp e p tide s 와 GAG 간의 착물형 성 은, 정 전기 적 목성 에서 기대되듯이, 용액의 p H 와 이온강도에 큰 영향을 받는다. 예 로, 주어 진 pH 에 서 GAG-po lyp e p tide 용액 의 이 온강도 를 높이 면, J) Ol yp e pti de 의 a- 나사선 구조가 파괴되는데, a- 나사선 구조가 파 괴되는데 필요한 이온강도의 크기 서열은 Ch6-S( HA < C h4-S(H P 〈 DS 로 나타났다 (9 . 3) . 그러나, PLA 은 GAG 와의 인력이 아주 강 하여 높은 이온강도의 용액에서도 PLA 의 a- 나사선 구조가 파괴되지
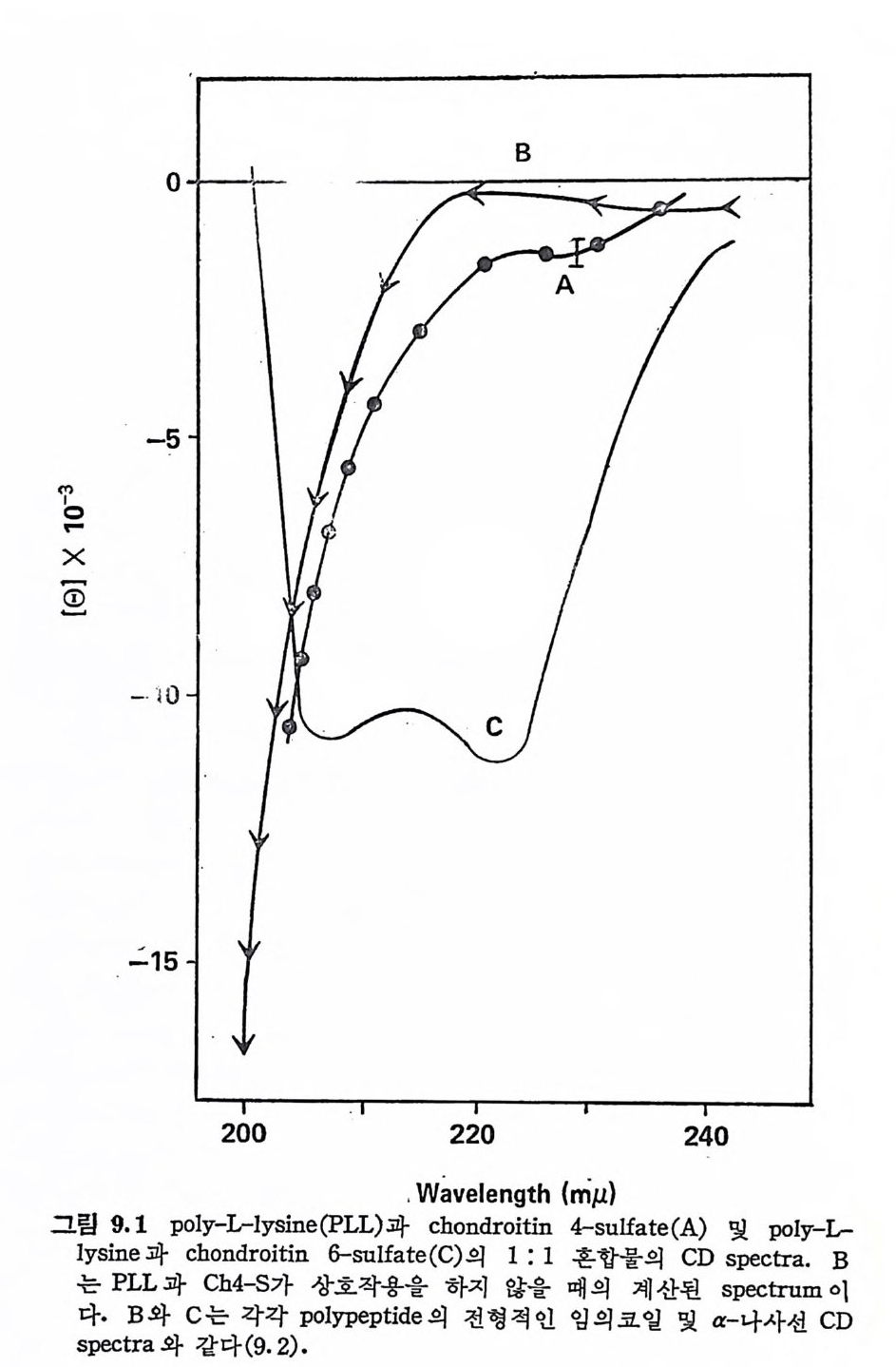 B
B
표 9. 1 pol yp e p tide -gly c o sami no g ly c ans 상 호 작 용 에 의 한 착물의 용융온 도 ( Tm) 와 초 ] 대 작용 시의 아미 노산 / 아 당유체 의 비 (9.1) Glyc o sami no g ly c ans Polyp ep tide s HA KS2 Ch4-S HS Ch6-S KSI DS HPS PLA 바 1:1 1,4 :1 2 : 1 1 : 1 2 : 1 1. 2 : 1 1. 4 : 1 34. 3 : 1 구조 a a a’ a: a! a’ a a a Tm(°C) 35. 0 46.0 54.5 65.0 76.0 >90 >90 >90 PLL 비 1:1 1,4 :1 1 : 1 2 : 1 1 : 1 L 2 : 1 1, 4 : 1 2. 3 : 1 구조 a R R R R R R R R Tm 23.0 - 47,0 72.o >90 ’ PLOb 비 2. 3 : 1 구조 a’ Tm 56.0 a. a 는 a-heli x, R 은 임의코일 b. PLO 는 Poly- L -Ornit hi n e 이 며 , 다몬 약어 는 본문에 적 은 것 과 동 - 일하다.
않는다• p H 에 따른 po lyp e p tide -GAG 착물의 po lyp e ti de 부분의 구 조전이는 pH 2.4~3.8 및 pH 11 부근에서 일어나며, 이는 GAG 의 coo- 기 의 양성 자 첨 가 및 po lyp e p tide 의 아미 노기 의 탈양성 자 반 응과 관련지어진다. 양이온성 p ol yp e pti de 의 구조전이를 유발하는 음이 온성 고분자는 GAG 에 국한되 지 는 않으며 , po lyg a lactu ronate , carrage enan, po lyp h osph ate 등 많은 음이 온성 다가이 온은 모누 양이 온성 po lyp e p tide 에 유사한 영 향을 미 친 다. 많은 천연의 양이온성 단백질도 GAG 과 강한상호작용을보인다. 산성 HA 매체 내에서의 혈청알부민의 침전, 식초산의 첨가에 의한 · 관절활액의 응결이나 낮은 염의 용액에서 CS 에 의한 l y soz y me 의 분리 등은 모두 GAG 와 양이온성 단백질의 상호작용의 예로 들 수 있 다 (9. 4). 연골의 한 성 분인 lys ozy m e 은 KCl 의 농도가 O.lM 이하일 때는 CS 와 침전한다. 연골 PG 과 l y soz ym e 간에 형성된 침전을 용해시키기 위해서는 KCl 의 농도가 0.2~0.4M 이 요구되 는데, 이는 생체 내에서 l y soz ym e 의 PG 과 염연결을 하고 있음을-
나타낸다 (9.5). (L y soz y me 은 PG 을 분해시키지는 않으며, 이 효 소의 연골에서의 기능은 잘 알려 지지 않 았다.) 시 험 관에 서 많은 종 류의 lys osomal 효소는 활 성 이 HP 과 CS 에 의해 억제받는 것으로 알려져 있다 (9.6). 이는 lys o somal 효소들이 GAG 와 가역적인 정전기적 상호작용을 함 을 의미하며, GAG 가 백혈구성 lys o somal 효소 활 성을 조절한다고 볼 수 있다. 여 러 가지 다가음이 온 ( 특 히 HP) 은 세 포핵 의 염 색 질 (chromati n) 복사과정을 자극시키는 것으로 알려져 있다 (9.7). 이 현상온 다가음 이온이 h i s t one( 염 색질의 단백질 부분)과 착물을 형성하여 DNA 형판 (tem p la te ) 활성에 대한 제한을 제거시키고 RNA 합성을 허용하는 것 으로 설 명 된 다. 다가음이 온은 유리 된 RNA po lym e rase 의 활성 은 억제하나, eucaryo ti c 핵내의 RNA 합성속도는 중대시칸다. 이는 다가음이 온이 B 형 RNA po lym erase 가 개 제된 po lyr ibo nucleoti de 의 신장속도를 중대시키는 데서 기인된다고 설명되었다 (9.8). 그림 9.2 는 염색질에서의 RNA 합성속도에 대한 HP 의 영향을 보여 주 틀 는 것이다. Hi s t one 과 다가음이온 (HP 포함)의 결합은 acryl a mi de ge l 전기 영동에서도 확인되었다. 낮은 이온강도에서는 h i s t one 의 f2« 및 f2b 부분이 우선적으로 HP 에 결합하는 것이 관찰되었다. 이와 유사 하게 , po lys ty re ne sulfo n ate 의 경 우에 는 argi ni n e 이 많은 f2a l 과 會 f3 부분이 가장 쉽게, 그리고 l y s i ne 이 많은 A 부분은 가장 어렵게 결합하는 것으로 보고되었다. 다가음이온에 의해 염색질에서 his t o n e- 을 DNA 에서 분리시키는 것에는 음이온의 전하밀도와, 핵단백질 (nucleop ro te i n ) 표면에 있는 전하를 띤 영역에의 접근과 관련된 다 가음이온의 입체적 장애가 중요인자로 작용한다고 여겨진다 (9.7). HP 의 독득한 생물학적 역할인 항응고 (an ti coa gu lan t) 작용의 기 구를 규명하기 위하여, 혈액 단백질과 HP 과의 상호작용에 대한 많 은 연구가 수행되었다. HP 의 항응고 작용은 이 다당류가 anti th- rombin ill (AT- ill)의 pro te i n a se 억제 작용을 중대시키는 것으로 알 려져 있다. HP 은 AT- ill에 강하게 결합하여 AT- ill의 구조룬 p- 나사선에서 임의코일형으로 변화시키는 것이 CD 에서 확인되었t:l--
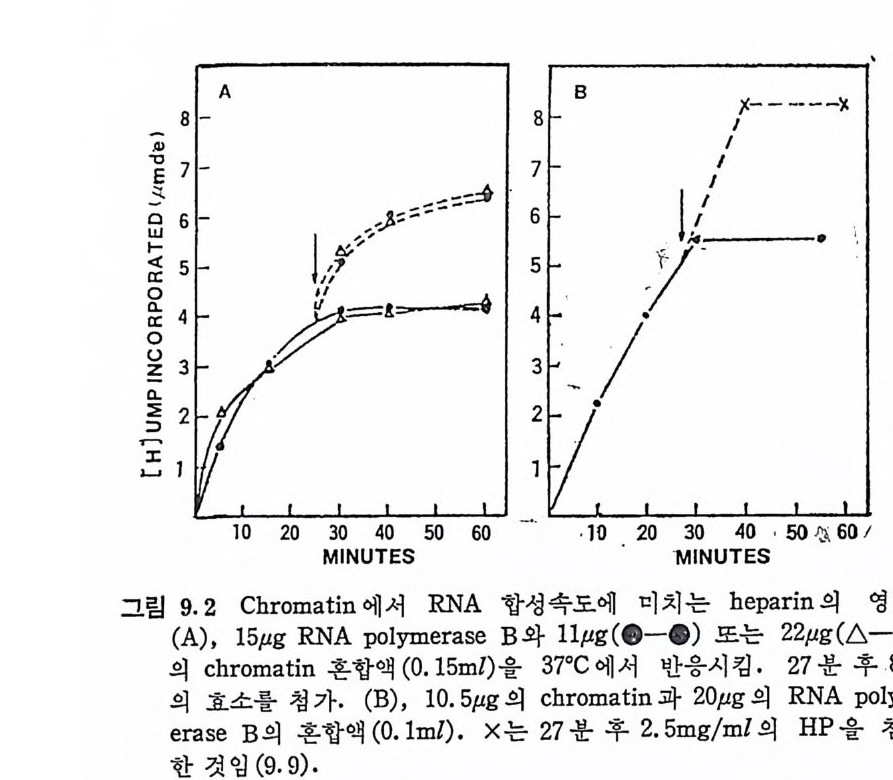 (Ea7z 80’3 l1/_7VA l:l 06d-l.J :l005Z 4= 23 一21 8-7B .6I 〉543x二- ----X
(Ea7z 80’3 l1/_7VA l:l 06d-l.J :l005Z 4= 23 一21 8-7B .6I 〉543x二- ----X
·( 그림 9. 3) , 그러 나, HP 은 thr ombin 과도 결합상수가 101 M-1 이 나 되는 강한 결합을 하는 것이 보고되었다 (9.11). 따라서 HP 은 thr om- bin 에 결합하여, 이 효소의 구조를 변화시키고, 나아가 AT-III 와 의 착물 형성에 관련되어 항응고작용을 나타낼 가능성도 있다. HP 과 AT-III 의 상호작용에는 HP 시료 중 단지 일부분만이 관여 할 수 있는 것으로 보인다. 이는 HP 분자의 화학 구조의 불균일성 에 기인하는 것으로 간주된다. HP 과 AT-III 와의 결합에는 10 당 류제가 관련되며, 이 10 당류체는 명확하게 주어진 당류간 서열이 필요한 것으로 여겨진다· 보통 상품용 HP 의 가능한 여러 10 당류 체 서 열 중에서 단지 2. 5% 만이 AT-III 와 결합될 수 있는 바론 서 열을 갖고 있다. 이는 여러 HP 시료들이 비록 전체적인 화학적 조 성온 유사함에도 불구하고, 항응고작용에는 큰 차이가 있음을 설명 한다· 또한, 동계적으로 HP 의 분자량이 중대할수목 AT-III 와 결합
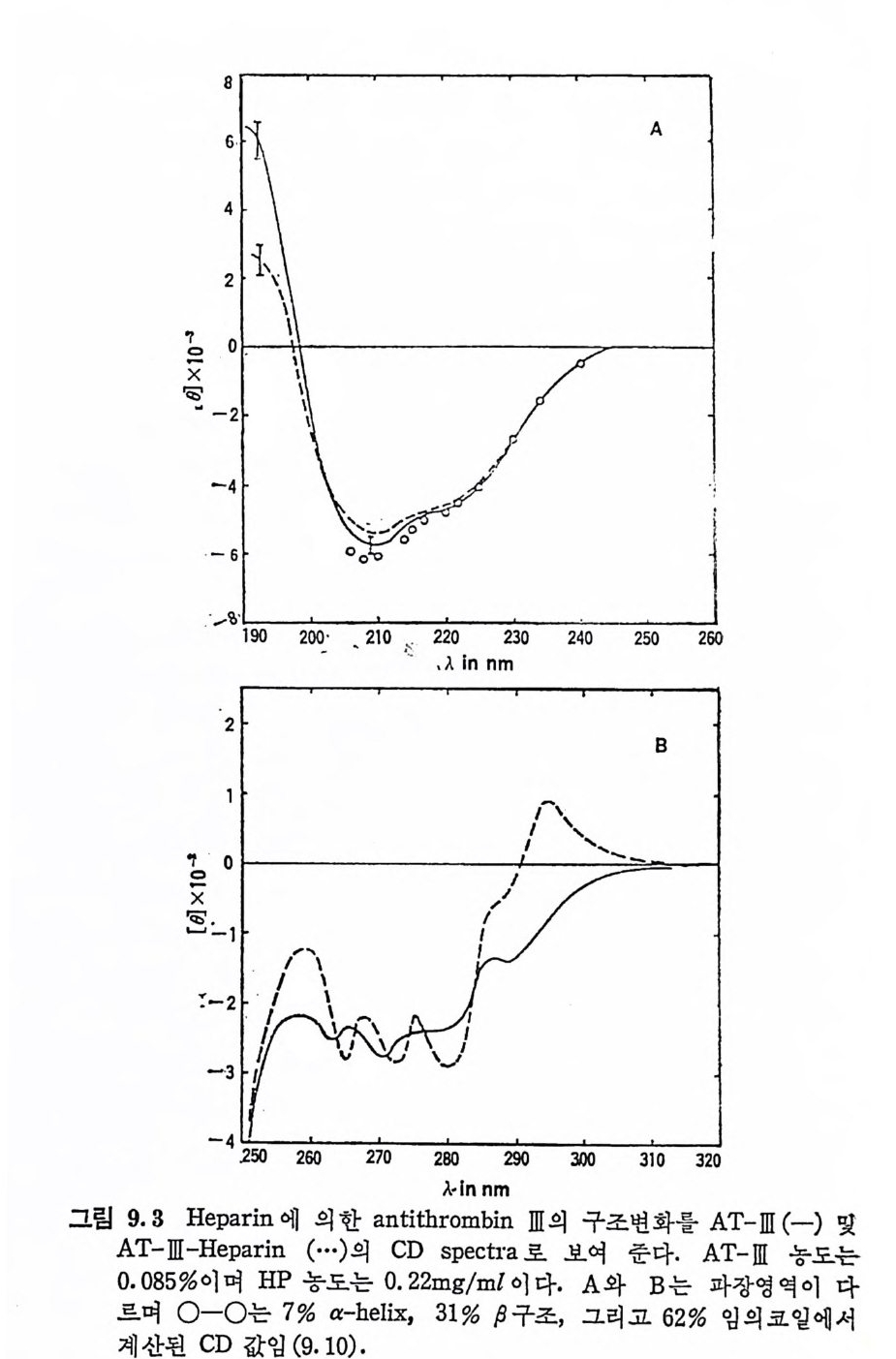 8
8
될 수 있는 바 른 10 당류- 서 열의 확률 이 중가하는 것에서 HP 의 분 자량과 항 응고 작용의 상관관계가 설명된 다. HP 은 지 질 단백 질 (li po p ro te i n ) 지 방분해 효소 (lip ase) 와도 정 전기 적 으로 결합힌다 (0 .17 ) . 여 러 GA G 중 ldUA 를 포 함하 는 DS, HP 및 HPS 는 li p a se 와 보 다 효과적으로 결합하나 , GlcUA 륭 갖 는 CS 는 단 지 약 하게 철합 한다. ( 많은 GAG 의 이 온 성 결 합 에는 IdUA 를 포 함하 는 다당 류 가 보다 강 한 결 합을 보인다. 이는 IdUA 와 GlcUA 의 -COOH 기의 p Ka 의 차이에서 설명된 -coo- 기의 배 향 의 차이 에 의 한 것으로 여 겨 진다. ) Lip a se 와 HP 의 강 한 결 합은 HP 이 조 직에서 지방단백질 lip ase -문 분리시켜 혈액으로 방 출 시키므로 지방 질 혈 장에서 지방의 제거둘 촉 진한다. 따라서, lip ase 와 HP 간의 이온성 상호작용이 HP 의 또 다론 중요한 약리작용인 지방제거작용 의 메카니즘이 될 수 있다. HP 시료에 따른 AT-III 에의 활 성과 지질 단백질 lip ase 와의 결 합력은 큰 상관관계가 없다. 이는 AT 一 III 와 l ip ase 가 각각 HP 의 다른 결 합자리에 결합하는 것으로 간주된다. GAG 와 단백 질 의 상호작용 중 collag e n-GAG 결 합은 이 의 생 물 학적 의미나 결합의 유형에서 다른 것과 큰 차이가 있다. 따라서 이는 별도로 다음 항 에서 취급된다. 9. 2 Colla g en 과의 상호작용 Collag e n 은 많은 동물조직 에 서 GAG 및 PG 과 결합되 어 존재 한 다. Collag e n 구조의 형성과 안정화에 GAG 가 필요불가결한가에 대해서는 아직도 의문의 여지가 있으나, 많은 시험관에서의 연구는 -co llag e n 과 GAG 가 강하게 결합하고, GAG 는 collag e n 섬 유의 형 성에 조절 역할을 한다는 것을 보였다. Colla g en 과 GAG 상호작용에 대한 각종물리화학적 연구는 이 두 종류의 생물고분자가 정전기적으로 결합함을 보여 주고 있다. 죽, KS 를 제외한 모든 GAG 는 colla g en 과 생리적 pH 빛 이온강도에 서 결합하며, 결합세기는 매제의 이온강도, 다당류의 전하밀도 및
분자 량 에 크게 의존한 다. PG 은 이의 조 성 인 개별적인 GAG 에 미 해 보다 강하게 colla g en 과 절합한다 . Gelman 과 Blackw e ll(9 . 12 ) 는 4 가지 GAG (C h4-S, DS, HA 및 KS) 이 산성 pH 에 서 collag e n 과 다양 한 강 도 로 결 합 하여 collag e n 의 3 중 나사선 구조의 용융온 도 를 38°C 에서 46°c 로 중대시키는 것 을 보여 주 었 다. collag e n 의 3 중 나사선 구조를 안정 화시 키 는 GAG 간 의 서 열 은 Ch6-S 〉 DS 〉 HA 〉 KS 〉 Ch4-S 로 나 타 났다. 이 서열은 GAG 와 양이 온 성 po lyp e p tide s 의 결 합 의 세 기 나, collag e n 섬 유 형 성 에 미치는 GAG 의 영 향 의 서 열과는 약 간 의 차 이가 있다. GAG 및 PG 과 collag e n 간의 상호작용은 collag e n 유형 과는 거 의 무관하다. 연골 PG 과 l 및 訓 형 collag e n, chic k embry o PG 과 I, II 및 冊 형 collag e n 과의 상호작용은 큰 차이 플 보이 지 않 는다. 다당 류 와 collag e n 의 상호작용은 collag e n 섬 유형 성 과정 에 서 중 요 한 역 할 을 하는 것으로 여겨진다. 이에 관한 연구는 크게 두가지 방법으로 수 행 되는데, 한 가지는 전자현미경에 의한 섭유형성의 직 접 적 인 관 찰이 며 , 다른 한 가지 는 수용 성 collage n 을 37°c 로 가열 하고 섬유상으로 응결되는 속도 를 혼탁도로 측정하는 것이다. 그 립 9.4 는 후자의 방법에 의 한 실험결과를 도시한 것이다. 시간에 따른 용해된 colla g en 의 옹결에 의한 혼탁도의 변화는, 초기단계 에서 지연과정을보이는데, 이는 핵 (nucle i)의 생성단계로 여겨진다. 그림 9,4 의 결과는 DS 와 CS 는 colla gen 의 핵생성 단계를 가속 시키는 것으로 해석된다· 그러나, CS 와 HPS 및 PG 을 핵생성 이 후 에 주입시키면 collag e n 섬유형성은 오히려 지연되는 것으로 관 찰되 었다 (9.13). Collage n 섬 유형 성 에 미 치 는 GAG 의 영 향은 많이 보고되 었으나, 이들의 결과는 일관성이 결여되어 있다. 처자에 따라 GAG 는 〈영 향을 주지 않는다〉, 〈가속시킨다〉 또는 〈지연시킨다〉로 다양하게 · 보고되었는데, 이는 아직도 이를 연구하기 위한 명확하고 반복적인 실험방법이 없다는 것으로 볼 수 있다. 대부분의 collag e n 용액은 핵으로 작용하는 약간의 집합체를 포함하고 있고, 따라서 GAG 는
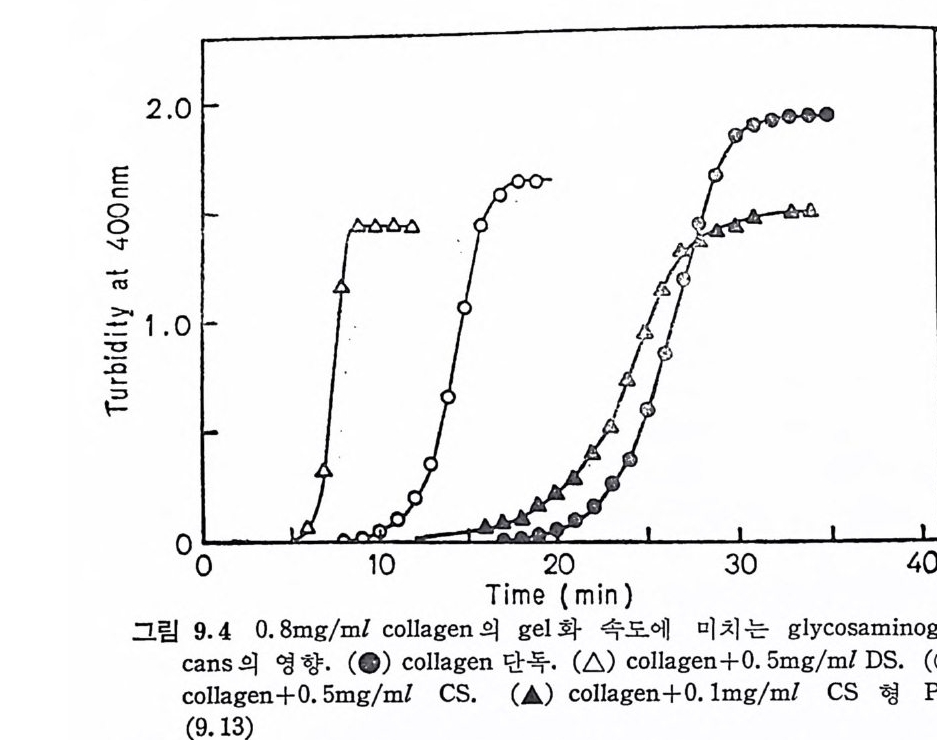 2.0
2.0
핵생성과 섬유성장단계에 아주 다르게 작용하는 것으로 여겨진다. 그러나 GAG 는 collag e n 섬유형성에 어떤 영향을 미친다는 것만은 확실하다. 생리적 조건에서 collag e n 섭유형성에 대한 GAG 의 영향이 다양 한 것과는 대조적으로, 0.5M 이온강도에서는 모든 GAG 가 섬유형 성을 가속화시키는 것으로 보고되었다. Collag e n 섬유형성에는 여 러 가지 음이 온들도 영 향을 미 치는데 , SOi -, P043-및 능금산이 온은 、 섬유형성을 지연시키며, N03- 와 S032- 는 영향을 미치지 않고, . SCN-, CI-, F-및 C022- 는 가속화시 키 는 것으로 보고되 었다다. 9. 3 Lip o p r ote i n 과의 상호작용 황산기 가 있는 GAG 와 혈장 지 질 단백 질 (lipo p r ote i n s) 간의 정 전기 적 결 합은 Iveriu s (9. 14) 가 행 한 pH 7. 4 에 서 의 ag a rose ge l chro-
mato g r ap h y 실험에서 제시되었다. 생 리적 이온 강도에서는 HP 와 DS(DS 는 HP 보다는 약하게 )만이 작은 밀도 지질단백질(l ow
 三A _〉_ ..... \ \ \B`. f/,; i 一l ------_--_ -,_ -_- ---------치\I\ _ /
三A _〉_ ..... \ \ \B`. f/,; i 一l ------_--_ -,_ -_- ---------치\I\ _ /
이 그림에서 볼 수 있듯이, 구형인 입자는 그 입자가 차지하는 부피의 8 배(반경 r 인 경우, 입자의 부피는 랑군이나 배제 부피 는 송짜 2r)3 이다)의 배제부괴를 나타낸다. 또한 막대형 입자(길이 l, 반경 다가 구형인 입자(반경 m) 웅 배계시키는 부피는 l•n(rs+re)2 가 된다. O g s t on(9.18) 은 긴 막대로 구성된 임의의 망 (ne t work) 에서 구 형인 입자에 대한 배제된 부피의 분율은 (1-e-l•(r,+r, ) ?임을 보였 다. 따라서, 임의로 분산된 막대의 망에서 구형인 입자가차지할수 있는 부K피a. 의u = e평-L균· r 분(T'율+T은.,,; (9-1) 가 된다· 여기서 L 은 단위부피당 모든 막대의 길이의 합이다. 공
간적 배제는 분자단위에서 일어나며, 이는 단지 en t ro py적 상호작 용으로 봅 수 있다. 입체적 배제작용은 모든 용액에서 예측될 수 있으나, 수화된 부 피가 큰 고분자에서 더욱 현처하게 나타날 것이 기대된다. GAG 용 액 중에서 가장 심한 배제부피 효과를 보이는 것은 HA 용액이다. 이는 HA 의 큰 분자량 (~106) 과, 다른 고분자에 비해 월등히 큰 수 화된 부피 (그립 6.4) 에 기인된다. 다른 GAG 들은 HA 에 비해 훨싼 적은 분자량 (~104) 을 갖고 있고, 따라서 큰 배제부피를 나타내지 않 는다. 그러나, 조직 내에서 이들은 아주 거대한 PG 분자의 조성으 로 존재하며, PG 및 이들의 집합체는 큰 배제부피를 나타낸다. 공간적 배 제 작용은 침 강 (sedim enta t i on ) , 삼두압 동 여 러 가지 방 법으로 연구된다. GAG 의 배제현상은 O g s t on 과 Phel p s(9.19) 에 의 해 처음으로 제시되었다. 이들은 혈청 알부민 (BSA) 등이 HA 상과 완충°석상 사이에서 분배될 때 완충액상에서 높은농도를 유지함을보 였다. HA 에 의한 배제 실험의 결과는 HA 의 이당유당 길이(l) 을 1. 0nm, 반경 을 0. 3nm 로 간주하면 식 9. 1 을 잘 만족시 킨다• 즉, 0,5% HA 용액은 BSA 에는 25% 그리고 I g G 에는 40% 의 공 간을 배제시킨다· 또한 1.5% HA 용액은 각각 75%(BSA) 와 85% (I gG) 의 부피를 배제시킨다. 연골 PG 도 HA 와 비슷한 크기의 배 제부피를 나타내는 것으로 관찰되었다. 고분자망의 배제부피는 이 망을 동해 이동하는 입자의 속도에 영 향을 미치며, 이는 침강속도의 변화로 연구된다. 많은 연구자들은 .HA 용액에서의 한 입자의 침강속도는 입자의 크기가 클수록, 그 리고 HA 의 농도가 중가할수록 식 9.2 의 실험식을 만족시키면서 감소함을 보였다 (9.20). s/s0=A•ck • d 효 (9-2) S 는 직경 d 인 구형입자의 농도가 C 인 HA 용액에서의 침강계수이 며, k 와 A 는 상수이다. GAG 는 주로 세포 밖 매체에서 존재하여 이 매체에서 다른 고분자의 이동을 조절하는 데 큰 몫을 하고 있을 것으로 여겨진다. 거 대 분자의 병 진 확산 (tra nslati on al dif fus io n : 침 강속도로 표시 될
수 있다. )이 HA 의 농도에 크게 영향을 받는 것파는 대조적으로 γ 입자의 희전운동은 거의 영향을 받지 않는다. 이는 바록 농축된 다 당류 용액이 높은 체적 (bulk) 점성도를 보이나, 업자 주위의 미세정 성도 (microviscosity) 는 용매의 점성도외- 거의 같음을 의미힌다. 따 라서, 병진확산의 장애는 점성도에 의해서가 아니라, 고분자간의 입 체적 장애로 간주된다. 비대칭 입자(예로 선행의 입자)의 확산은 동일한 유치 l 역학적 부 피플 갖는 구형업자에 비해 장애를 적게 받는 것£로 관찰되었다. 이는 비대칭 업자는 고분자망 속을 무작위하게 이동하기보다는 특 정한 방향으로 이동할 수 있음을 의미한다. GAG 을포함하는 조직의 배제성질에 대한 생체내 실험도 부분적 £로 수행되었다. 그림 9.6 은 몇 가지 조직에 대한 mannitol 이 차 지할 수 있는 부피와 polyethyleneglycol(PEG) 이 차지할 수 있는 부피의 비를 조직의 다당류 비에 대해 도시한 것이다. 이 그림은
 잉 1. 。
잉 1. 。
PEG 에 대한 배제부피는 조직의 다당류 농 도에서 계산된 이론적 배제부피와 잘 일치합을 보여 준다 (mann it ol 공간은 조직의 물의 양과 거의 일치한다). 그러나, 건(t endon) 과 대동맥 (aor t a) 에서는 예측된 값보다 적은 값을 보이는데, 이는 이들 조직 내의 섬유 (colla gen 과 elas ti n) 에 의한 배제도 무시할 수 없음을 의미한다. 많은 조직은 GAG 와 colla g en 으로 구성되어 있으며, 이들 각각 에 대한 배제부피가 조직 전체의 배제부피로 나타난다· 그립 9.7 은 HA 와 피부 colla g en 의 BSA 에 대한 배제부피를 비교한 것이다. 이 그림은 colla g en 의 BSA 에 대한 배제부피는 약 4cm3/gr 임을 보이고 있다. colla g en 의 dex t ran( 분자량 150,000) 에 대한 배재부 피도 거의 같은 값을 보임도 다른 독립된 연구에서 밝혀졌다. coll- a g en 과 다당류의 배제부피에 대한 상대적 기여는 다당류가 많은 조직과 다당류가 적은 조직의 바교에서 추정될 수 있다. l g r 의 돼 지 연골은 680mg 의 물, 190mg 의 collag e n 과 22mg 의 다당류로 구
EEqn一L」esaEn 0 1O.. g 0 8,’, '' / ’ //H -Y- A·· ·L··U···R--O一: . -N···A· TE J I1 uqo 06-0II-I'4' -0,2, ' ~J;eI- II/II COL.-L. .A GEN OE nJO / \ ,' 덩 크~g Con0c en t「 a ti ~5n0 of 'c·ol l a1g0 e0n or· h y a1l5 u0r onat e /m20g 0 cm- 3 그립 9. 7 Dextr a n 에 대 한 hya luronate 와 피 부 collag e n 의 배 제 성 질 의 비교(R 1, p 295 에서).
u
성 되 어 있 다 (9. 21) . 이 조직 에 서 collag e n 만은 BSA 에 대 해 조작 l gr당 0.4~0.8cm3 의 배제효과 를 가쳐야 한다. 다당류가 전체 부 피의 50% 운 차지한다면 농도가 50m g /cm3 이고, 이는 나머지 공 간에서 BSA 을 완전히 배제시키기에 충분한 농도가 된다. 실제로 hemog lo bin 보다 큰 분자는 연골에 들어갈 수 없음이 관찰되었다. 사람의 진피 (dermi s) lg r 은 650mg 의 물, 300mg 의 collag e n, 그리 고 0.6m g의 다당류로 되어 있다. 아 경우, 조직 l g r 당 BSA 에 대 한 colla g en 의 배재효과는 0.6~1. 0 cm3 정도이며, 다당류는 단지 0. 02cm3 정 도만이 기 여 한다. 따라서 진피 에 서 는 collag e n 이 배 제 효과에 대한 큰 몫을 하고 있다고 볼 수 있다. * 추천문현 Rl. W. D. Comp e r and T. C. Laurent, Phy si o l og ica l fun cti on of connec- tive po lys a ccharid e s, Phys i o l . Rev., 58, 255~315(1978) (Polys a ccharid e -po lym e r 상호작용 및 po lys a ccharid e 용액 내 의 전 달 현상을 결합조직의 생리적 성질과 결부시켜 기술) R2. J. Ehrlic h and S. S. Sti va la, Chemi st r y and ph armacolog y of hep a rin , ]. Phann. Sc i., 62, 517(1 9 73) (He p ar i n 의 약리적 작용에 관여되는 상호작용에 대한 초기 연구결 과를 수록하고 있다.) R3. J. M. Schubert, Inte r cellular macromolecules conta i n i n g po lys a cc-ba ride s, Bi op l zy s. ]. Sup pl. , 4, 119(1964) * 인용문현 9. 1. J. Blackwell, K. P. Schodt and R. A. Gelman, Po!ys a ccharid e - po lyp e p tide sys t e m s as model for hep a rin in te r acti on s, Fed. Proc., 36, 98(1977) 및 이 의 인용문헌. 9. 2. R. A. Gelman and J. Blackwell, Inte r acti on betw een mucop o lys a c· charid e s and cati on ic po lyp e p tide s in aq u ous soluti on : Chondroit in· 4-sulfa te and dermata n sulfa te, Bi op o ! ym ers, 12, 1959, (1973) S. 3. K. P. Schodt, R. A. Gelman and J. Blackwell, The eff ec t of chang e s in salt concentr a ti on and pH on the in te r acti on betw een gly c o sami no g ly c a ns and cati on ic po lyp e p tide s, Bi op o ! ym ers, 15~
1965 (1S 76 ) 9. 4. M. Schube rt, Inte r cel l ular macromolecules conta i n i n g po lys a c char- ide s, Bi op l z y s . ]. Sup/ JI. , 4, 119 (19 64) 9. 5. M. Schubert and E. C. Franklin , Inte r acti on in soluti on of lys - ozy m e wi th chondroit in sulph ate and its pa rent pro te i n p o lys a cc- harid e , ]. Amer. Chem . Soc., 83, 2920(1961) 9. 6. J. L. Avil a and J. Convit , Phy s ic o chemi ca l characte r is t i cs of the · gly c o sami no g ly c an-lys o somal enzy me int e r acti on in vit ro , Bio c - !:em . ]., 160, 129 (19 76) 9. 7. A. T. An se vin , K. K. MacDonald, C. E. Smi th and L. S. Hnil ica , Mechanis m of chromati n tem p la te acti vi t y: ph y s ic a l eYi de nce for desta b il iza ti on of nucleop ro te i n s by anio n s, ]. Bi ol . Chem., 250, 281 (19 75) 9. 8. B. E. Coup a r and C. J. Cheste r to n , The mechanis m of whic r, hep a rin sti mu late s tra nscrip tion in iso late d rat live r nuclei, Eur. J. Bi oc lzem., 79, 525 (1977) 9. 9. Y. Groner, G. Monroy , M. Jac q u et and J. Hurwi tz, Chromati n as a tem p la te for RNA syn th e sis in vitro , Proc. Natl . Acad. Sci. U. S. A., 72, 194( 19 75) 9. 10. G. B. Vil lan ueva and I. Danis h efs k y, Evid e nce for a hep a ri n in- duced confo r mati on al chang e on anti thro mbin I[ , Bio c hem. Bi op hy s . Res. Commun., 74, 803(1977) 9. 11. E. H. Li, C. Orto n and R. D. Fein m an, The int e r acti on of thr ombin and hepa rin . Profl av in e dy e bin d ing stu d ies , Bio c he-mi st r y , 13, 5012 (1973) 9. 12. R. A. Gelman and J. Blackwell, Colla g en一m uco p ol y sacchar i des . int e r acti on at acid i c pH , Bi oc him . Bio p h y s . Acta , 342, 254 (1974) 9. 13. B. Obri nk , The inf l ue nce of gly c o sam ino g ly c a ns on the for mati on of fibe rs from monomeric tro p o collag e n i?/ 껴fr o, Eur. ]. Bi o c-hem . , 34, 129 (1973) 9. 14. P. -H. Iveriu s , The int e r acti on betw een human pla sma lipo p ro - tei n and connecti ve tiss ue gly c osami no g ly c ans, J. Bi ol . Chem. 247, 2607(1972) 9. 15. S. R . Srin i v a san, B. Radhahris h namu rthy and G. S. Berenson, Stu dies on the int e r acti on of hepa ri n wit h serum lip o pr o te i n s in
the pre sence of Ca2+ , Mg 2+ and Mn2+, Arclz. Bi oc lze m . Bi op lzy s . , 170, 33•! (1 9 75) ·9. 1 6. C. E. Day , J. R. Powell an d R. S. Levy , Sulfa ted po lys accharid e inh ib i t ion of aorti c up tak e of low de n sit y lipo pr o te i n , Arte r y, I, 126( 19 75 ) ·9. 17. T. Oli ve crona, G. Beng tss on, G. Marklund, U. Lin d ahl and M. Hook, Hep a rin - lip o pr o te i n lipa se int e r acti on , Fe d. Proc. , 36, 60(1977) ·9. 18. A. G. Og s to n , The spa ce in a unif or m random suspe nsio n of fibe rs, Trans. Faraday Soc. , 54, 1754 (1958) 9. 19. A. G. Og s to n and C. F. Phelps , The pa rti tion of solute s betw een buff er soluti on s conta i n i n g hy a luronic aci d, Bi oc hem. ]. , 78, 827 (1961) -9. 20. B. N. Presto n and J. M. Snowden, Measurement of dif fus io n and sed im enta t i on of ovalbumi n, serum albumi n and r-gl o buli n in soluti on s of connecti ve of tiss ue po lys accharid e s, Proc. R. Soc. Lo11do11, Math . Phys . Sc i. Ser. A, 333 331 (1973) ·9. 21. K. A. Brandt and H. Mu ir, Characte r i za ti on of pr ote i n po lys a c-charid e s of artic u lar cart ilag e from im matu re pigs , Bio c hem. ]., 114, 871 (1969) .9. 22. R. H. Pearce and B. J. Grim mer, The natu re of the gr ound substa n ce. In: Aavances in Bi ol og y of Skin , Eds. W. Monta g n a, J. P. Bentl ey , and R. L. Dobson, Ap pe lto n , New York, Vol. X. (1970) p. 89~101 .
색인
* 편의 상 주계는 알파벳 順 으로, 세부사항은 가나다 럿 알파벳웅 혼용 하여 정리했다.
A N-Acety lg a lacto s ami ne -6- sulf ate sulf ata s e 103 N-Acety lg a lacto s ami nyl- tra nsfe r ase 71 N-Acety lg l u cosami ne-6- sulfa te sulf at a s e 104 a-D- N -Acety lg l u cosa minida selOO N-Acety lg l u cosa minyl- tra nsfe r ase 78 ~D-N-Acety lh exosam inida se 99 Acety lt r an sfe r ase 106 Ac id- base eq uilibr i um 201 Ac idi c po lys a cchari de s 12 Acrid ine orang e-G AG int e r acti on 213 Algi nic aci d 13, 84 Anio n ic po lys accharid e s 12 Anomeric config ur ati on 190, 195 Anti co agu la nt acti vit y 229 Anti thr ombin -I II 229 Aryl s ulf ata s e 102 B Bio s yn the sis 63 당류간전환 65 조절 69 종료 66 Glyc osami no g ly c an 변형 64, 78 lipid 중간제 65, 76
C Carbohy d rate - pr o te i n link ag e 14, 38, 69 Carrag e enan 13 Cata b oli sm 95 一 enz ym es 96 Cati on ic dy e bin d ing 211 Cati on bin d in g 206 Cell gro wt h- GAG 조성 89 CPC 216 Chondroit in 54 Chondroit in sulf ate s , 구조 53 구분 22 기능 55 분해 108 생합성 67,74 A,B,C,D,E,K 54 nmr 197 pro te o g ly c a ns 39 sulf ate 함량 55 x- 선 회절 158 H 55 Chromati n 229 Cir c ular dich rois m 169 염료결합 212 ORD 와의 관계 171 Glyc o sami no g ly c ans 의 _단당류 175 ―p H 영향 180, 184 -C 硏결합 188,210 -pKa 측정 180,202
Collag e n, CD 변 화, GAG 와 결합, 성유 형성 232 Connecti ve tiss ue po lys accharid e s 13 Cott on eff ec ts , ex trins ic 212 int r ins ic 172 D N-Deacety la ti on 80,83 Dermata n su lfat e , 구조 55 분해 109 생합성 76 L-id u ronic aci d 구조 56 pr ote o g ly c ans 36 X- 선 회절 160 D,H 57 Di ffus io n -sed ime nta tion 125 Doli ch ol pa th w ay 76,88 Donnan eq uilibr i um 123 Drude equ ati on 170 E Electr on ic tra nsit ion 166 End- t o 국 md dist a n ce 135 Endog ly c osid a ses 97 Ep ime rase 81,85 Ep ime riz a ti on 64,83 Eucary o ti c 229 Exclusio n , model 235 volume 238 collag e n 효과 239 Exog ly c osid a ses 99 F Fr icti on al coeff icien t 126
G GAG: Glyc osami no g ly c an 참조 Galacto s ami ny lt r an sfe r ase 70 fi-D -Galacto s id a se 101 Galacto s yl t r a nsfe r ase 70 /3-D -Glucosami ni d a se 100 a-Glucosami ni d e -N - acety l t r a nsfe r ase 106 fi-D -Glucuronid a se 99 Glucuronosy It r a nsfe r ase 71,77 Gly co p ro te i n 13 당-단백 질 연 결 14 탄수 화문 성분, 함량 17 혈장 - 13 Glyc osami no g ly c an 12,43 구조적 목성 19,47 구조전이 180 금속이온 결합 206 단백질 결합 225 분리, 분석 43,211 분자량 137 분해효소 96 생합성 63 성장에 따른 변화 89 염료결합 211 조성 20,47 CD spe ctr a 173 Hy d rody na m ic pa ramete r 140 pK a 205 Glyc osid ic link ag e 14 Glyc osy ltra nsfe r ase 66 Gua nidi n e -H CI, PG 추출 25 H Heli ca l sym m etr y 154
Hexose, numberin g 21 Hep a ran sulfa te, 구조 57 분해 110 생합성 77,87 nmr 195 pro te o g ly c an 37 x- 선 회절 162 Hep a rin , 구조 58 금속이온 결합 209 기능 229,235 변형 59 분자모양 147 분해 110 생합성 67,77 항응고작용 59,210,229 CD, p H 의 영향 180 his t a m i ne 결합 216 Hy d rody n am ic pa ramete r 147 L-id u ron ic aci d 구조 21, 195 lipa se 결합 230 Lip id clearin g acti on 230 nmr 195 pK a 180 pr ote o g yc an 36 uron ic aci d 분석 49 p-H ep a rin 55 Hepa rin a se 98 Hepa rin sulf am ida se 105 Hi st a m i ne 218 Hi £ton e-GAG 결 합 227 Hug gin' s equ ati on 128 Hy a lobiu r on ic aci d 51 Hy a luronid a se 39,97 Hy a hrronic aci d, 관성 반경 51
구조 52 구조전이 185 나사선 구조 187 배제작용 52,235 분리 25 분해 108 생합성 64,75 이차구조 187 점성도 145 점탄성 142 hy d rody na mi c 성 질 52,141 IR 및 Raman spe ctr a 190 pr ote o g ly e ans 12 X- 선 회절 154 Hy d rody na mi c pa ramete r s 140,212 Hy po chrom ism 211 I Iduronate su lfnt a s e 105 a-L-Iduron ida se 100 In fra -red spe ctr a 190 Intr ins ic visc osit y 128,140 K Ka t chalsk y웁 S pitini k equ ati on 202 Kerata n sulf at e , 구조 12,60 분해 110 생합성 87 corneal 36,60 skeleta l-, PG 36,60 pro te o g ly c an 36 연결구조 40,60,88
L Lig h t scatt er in g 131 Lin k pr ote i n 29 Lip o pr ote i n 232,234 Low ang le X-ray scatt er in g 136 Ly s oz ym e, CS 와 결 합 228 ]\{ Meta c hromacy 211 Meta l ion bin d ing 206 Molecular shap e 139 Molecular weig h t 122,137 광산란에서 133 GAG 137 Monomer, 구조 22 CD 175 Mucop o lys acchari de 11,20 Mucop o lys accharid o se 23, 95, 112 Multi en zy me comp le x 72 N n-+rr* 전이 166 Nuclear mag ne ti c resonance 195 Nucleop r ote i n 230 。 Op tical rota t o r y disp e rsio n 169 • CD 와의 관계 171 Osmoti c pr essure, 분자량측정 122 P -PA PS 73 Pecti c aci d 13 Persis t e n ce leng th, CS 147
HA 143 Polye lectr o lyt es , 금속이온 접합 206 적정 202 Polyp e p tide s, GAG 와 결 합 225 Prote a se 28,107 Prote o g ly c ans, 구조(목성) 13,19,25 기눙 23 단백질 성분 35 단위체 32 반감기 95 분리 25 분포 20,23 생합성 25,63 연골-· 19,33 중심단백질 34 집합인자 28,53 집합체 28 탄수화물-단백질 연결 38, 69 Ca* 결합 23,208 collag e n 과 상호작용 26,233 cs 33 DS 36 HA 12,36 HP 36 HPS 37 KS 36 X- 선회절 160 Puromy cin 63,75 Py 3 T3 89 T 一군 전이 168 Q Qu ate r nary ammon inu m
salt , GAG 와 결 합 216 R Radiu s of gyra ti on , lig h t scatt er in g 에 서 132 분자 모양과 관계 135 Raman sp e ctr a 190 s Scatc h ard plo t 207 Scheraga -Mandelkern equ ati on 131 Sedim e nta t i on , 분자량 측정 123 eq u il ibr iu m 127 Seroto n in 218 Shap e fac to r 129 Sulf am i da se 105 Sulf ata s e 102 ary ls ulfa tas es 102 N-sauclefat yt el- g— a lact o s ami ne -6- 1 03 Nid-us aurcolefnata y tteleg — l —u cosa m ine -6- 110054 N-Sulf ati on 83 0-Sulfa tion 72 Ste r le exclusio n 237 Sto k es law 126 Svedberg eg u ati on 125 SV3T3 cell 76,89 T 3T3 cell 89
Thrombin 230 Tumor cell, GAG 함량 90 u Ultr a centr i f uga ti on , 분자량측정 123 Uronic ac id, 구조 22 분석 49 CD 175 epi m eriz a ti on 64,83 pK a 205 UV absorp tion 166 V Vi sc oelasti cit y, HA soluti on 142 Vi sc osit y, 128 shape fac to r 129 분자량과 관계 128 ion ic str e ng th 의 영 향 141 po lye l ectr o lyt es 129 w Wate r bin d ing 218 X X-ray dif fra cti on 152 ori en te d fibe r 153- {3- D-Xy lo sid a se 10l Xy lo sy ltra nsfe r ase 68 z Zim m Plot 133
박준우 서 운 대학교 화학과 졸업 Tem p le 대 학교 대 학 원 화학과 이 학박사 Ey e Research Insti tut e of Reti na Foundati on 연구원 한국 화학연구소 선임 연구원 논문 「액 정 , pol ys a ccharid e s, 계 면 활 성제」 등에 관 해 서 20 여편 현재 이화여자대학교 화학과 부교수- 炤\ Muco p ol y sacchar i des 의 生化學 빛 生物理學 1984 년 2 월 .•5 일 인쇄 1984 년 2 월 20 일 발행 著 者 박 준 우 發行人朴孟浩 發行處民音社 우편대 체 계 좌번호 oroo4r-3r-52328z 于no 서울 종로구 관철동 섞의 I 724-2000 • 724 가 234 • 725-85 끽 출판등록 1966. 5. 19 r-142 값 3,800 원 파본은 교환해 드립니다
대_우학 술총서 자연과학 1 소립자와게이지 상호작용 김진의 2 動力學特論 이병호 3 室素固定 송승달 4 面굽 B 와臨界現象 김두칠 5 觸媒作用 진종식 6 뫼스바우어分光學 옥향남 ` 7 극미량원소의 영양 승정자 8 水素化湖素와 有機湖素化合物 윤능민 9 抗生物質의 全合成 강석구 10 국소적 형태의 At iya h-Sin g e r 지표이론 지동표 11 Mucop ol ys a ccharid e s 의 生化學 및 生物理學 박l-준우 12 Astr o p hy s ic s 홍승수 13 우天원然식 物 化學硏究法